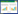文章信息
- 高曦, 盛月慧, 高彦征
- GAO Xi, SHENG Yue-hui, GAO Yan-zheng
- 菲、芘对蚕豆的氧化胁迫和DNA损伤
- Oxidative Stresses and DNA Damages in Cells of Vicia faba Exposed to Phenanthrene and Pyrene
- 农业环境科学学报, 2014, 33(10): 1873-1881
- Journal of Agro-Environment Science, 2014, 33(10): 1873-1881
- http://dx.doi.org/10.11654/jaes.2014.10.001
-
文章历史
- 收稿日期:2014-3-6
多环芳烃(PAHs)是环境中广泛存在并优先控制 的一类持久性有机污染物[1,2],主要来源为人类生产和 生活,如化石燃料的燃烧、化工生产、垃圾焚烧等[1,3]。 PAHs可通过污水排放、干湿沉降、石油泄露等多途径进 入土壤中,土壤承载了90%以上PAHs的环境负荷[4,5]。 曹云者等[6]报道,我国土壤PAHs污染严重,其含量最高 达151.60 mg·kg-1,其中以3 环和4 环PAHs 含量较 高,菲、荧蒽和芘含量分别占总量的17.59%、16.22% 和10.41%[6]。杨国义等[7]分析了珠江三角洲典型区域 农业土壤中PAHs的含量及分布特征,农田土壤中16 种PAHs含量范围在3.30伊10-3~4.08 mg·kg-1,平均含 量为0.24 mg·kg-1,以3 环和4 环的PAHs为主。土壤 PAHs污染问题已受到各界普遍关注。
PAHs难以降解,易在土壤中残留,对作物等造成 持续毒害。Flocco 等[8]通过水培实验研究发现,菲明显 降低了紫花苜蓿生物量、叶绿素含量和根系过氧化物 酶(POD)活性;Pakova 等[9]研究了菲、蒽和芴对白芥、 小麦、菜豆的毒性作用,PAHs触发植物抗氧化反应, 可提高抗氧化酶的活性;Song 等[10]将蚕豆次生根暴露 在3 组生物修复前和修复后的PAHs 污染土壤中,采 用根尖微核发生率(每1000 个细胞中微核数量,译) 指示PAHs 遗传毒性,研究表明PAHs 浓度过高会阻 碍细胞有丝分裂,从而影响微核体的形成。针对PAHs 具有潜在或已被确认的“三致”效应,评价其遗传毒性 显得十分重要[11]。从已有的资料来看,国内外大量文 献详述了PAHs 对人和动物遗传毒性的影响,但关于 PAHs 对高等植物遗传毒性的研究则很少[12,13]。作为 快速、灵敏、可靠的基因毒性研究方法,彗星实验 (Comet assay)应用十分广泛[14,15,16],但有关PAHs 基因 毒性的植物细胞彗星实验国内外则鲜有报道[17]。超氧 化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶 (CAT)是植物体内主要的活性氧清除酶[18],MDA 含量 高低是膜脂过氧化作用强弱的一个重要指标[19],根据 其活性或含量变化,可以分析PAHs 对植物的氧化胁 迫。国内外至今有关氧化胁迫与DNA 损伤关系的研 究仍很少,而探究PAHs对植物的氧化胁迫、DNA 损 伤效应以及两者间的关系,可为PAHs 植物毒性机制 的研究提供理论±据。
本研究以菲和芘作为PAHs 代表物[20],采用广泛 用于有毒化学物质致突变试验的蚕豆作为供试植 物[21],通过对蚕豆抗氧化酶(SOD、POD、CAT)活性和 MDA 含量等的响应,探讨PAHs 对蚕豆的氧化胁迫 作用;利用蚕豆根尖细胞彗星实验,分析PAHs 对 DNA 的损伤效应;将蚕豆幼苗根经抗氧化剂维生素 E 预处理后,暴露于菲、芘污染,研究DNA 损伤与氧 化胁迫间的关系。旨在为土壤PAHs污染的农业生态 风险评估、PAHs早期监测和预警等提供理论±据。 1 材料与方法 1.1 实验材料
菲、芘购自Fluka,纯度>97%;低熔点琼脂糖 (LMP)购自Solarbio,生物技术级。供试植物为大白皮 蚕豆(Vicia faba),购自南京市明天种业有限公司。 1.2 实验设计
选取无污染的沙子,过30 目筛并清洗干净后烘 干。配置一定浓度的菲、芘单一PAHs 的丙酮(分析 纯)溶液,分别加入到供试沙子中混匀,使其中菲、芘 的初始浓度(单一PAHs)分别为0、5、10、20、30、50 mg·kg-1(根据文献[11,22]设置,有改动)。0 mg·kg-1为 阴性对照组(NC)仅添加等量丙酮。各处理组沙子均 放入通风橱中,待丙酮挥发干净后使用。挑选大小一 致、饱满无虫的蚕豆种子,用5%的次氯酸钠浸泡10 min 进行表面消毒。用自来水冲洗干净,再以去离子 水充分清洗。室温下用去离子水浸泡24 h使种子充 分吸胀,其间换水2~3次。浸泡后将种子种于沙子中, 在人工气候箱中(20±2 ℃,80%湿度,14 h光照,光照 强度4000 lx)培养4 d,此时蚕豆幼苗根长为3~5 cm。
选取根长一致的蚕豆幼苗,种于盛有以上各浓度 (0、5、10、20、30、50 mg·kg-1)菲或芘污染的沙子的烧 杯中,每个烧杯8 颗。将烧杯用黑色塑料袋包裹,在人 工气候箱中染毒48 h,染毒之后小心取出蚕豆幼苗, 用去离子水清洗干净。
取染毒48 h后洗净的蚕豆幼苗的茎叶测定SOD 活性,取蚕豆幼苗的根测定POD、CAT活性以及MDA 含量。对于彗星实验的直接污染组(不经维生素E 预 处理),取染毒48 h后洗净的蚕豆幼苗根尖进行彗星 实验。同时,增设浓度为20 mg·kg-1 的CdCl2作为阳 性对照,即蚕豆幼苗经CdCl2沙培染毒处理48 h后, 取蚕豆幼苗根尖进行彗星实验,其结果为阳性对照。 对于彗星实验维生素E 预处理组,用少量无水乙醇 溶解维生素E,然后加1/2 浓度霍格兰营养液,配制 浓度分别为2、4 mg·L-1的维生素E 溶液(控制无水乙 醇的体积分数小于1译)。将无污染条件下培养的(未 染毒处理)根长一致(3~5 cm)的蚕豆幼苗浸于上述维 生素E 溶液并在人工气候箱中(黑暗条件下)培养8 h,之后用去离子水将根冲洗干净,进行48 h染毒处 理,然后洗净蚕豆幼苗的根部,取蚕豆幼苗根尖进行 彗星实验。 1.3 指标测定 1.3.1 SOD 活性测定
称取0.5 g 蚕豆幼苗茎叶放入预冷研钵中,加1 mL预冷的磷酸缓冲液,冰浴研磨,加缓冲液使终体积 为5 mL。匀浆倒入离心管中,4 ℃10 000 r·min-1离心 20 min,上清液即为粗提液。SOD 活性的测定采用氮 蓝四唑法测定[23],NBT 光还原50%为一个酶活单位, 测定560 nm 下的吸光度值。 1.3.2 POD 活性测定
POD 的提取及测定采用龚帅帅等[24]的方法,并略 做改进。称取蚕豆幼苗根0.2 g左右,加聚乙烯吡咯烷 酮(PVP)0.05 g,pH 7.8 磷酸缓冲溶液(PBS)10 mL, 冰浴研磨,4 ℃10 000 r·min-1离心10 min,取上清液 即为粗酶提取液。POD活性的测定采用愈创木酚法, 以每分钟内A470增加0.01为1个酶活性单位。 1.3.3 CAT活性和MDA 含量测定
CAT 活性的测定采用可见光法,H2O2 与钼酸铵 作用产生一种淡黄色的络合物,在405 nm 处测定其 生成量,每毫克样品每秒钟分解1 μmol 的H2O2为一 个活力单位。MDA 含量的测定采用TBA 法。CAT活 性及MDA 含量的测定均以蚕豆幼苗根为材料,采用 南京建成生物工程研究所相应的试剂盒,按照说明书 所述步骤进行操作。 1.3.4 彗星实验
细胞核的分离参照Gichner[25]的方法,并略做改 进。蚕豆幼苗染毒处理后用刀片切下1 cm 长的根尖 并用去离子水清洗,将根尖放入置冰浴上的培养皿中 (直径7 cm),加入500 μL 冷PBS 缓冲液,使根尖伸 展开,用新刀片将根尖轻轻地切成薄片。培养皿在冰 上保持倾斜,使分离的细胞核容易进入缓冲液。
彗星实验采用最常用的三层凝胶结构,具体步骤 参照Gichner[25]的方法。三层凝胶制备好后,将载玻片 放置在4 ℃冰箱中(不少于5 min)。移去盖玻片,将 载玻片放在盛有新配制的4 ℃的电泳缓冲液(1 mmol·L-1 Na2EDTA 和300 mmol·L-1 NaOH,pH>13)的 水平电泳槽中。细胞核先在缓冲液中裂解5 min,使 DNA 解旋。之后在1 V·cm-1(26 V)、300 mA 条件下电 泳15 min(溶液仍保持4 ℃[26])。电泳结束后,载玻片 用冷的400 mmol·L-1 Tris(pH 7.5)浸泡5 min,用80 μL(20 μg·mL-1)溴化乙锭(EB)染色5 min,然后浸入 冰水中,去除过量的EB,盖上盖玻片。染色后尽快用 荧光显微镜(ZEISS Axion Imager A1)观察彗星图像。 荧光显微镜的激发波长选用546/12 nm,发射波长为 575~640 nm。对每一个载玻片,在200 倍荧光显微镜 下随机选取50 个清晰细胞核图像进行观察并用 CCD 拍摄。用Komet Version 6.0 软件(Andor Tech原 nology)分析彗星图像,选用常用参数尾矩(Tail Mo原 ment,TM)即尾部DNA 含量和彗尾长度的乘积来评 价DNA 的损伤程度。
实验中每个处理进行3 次重复,每次重复观察一 个载玻片,每个载玻片取50个细胞核数据的中位数 作为其数值。对于每个处理,取3 次重复的平均数,并 计算标准差[27]。对于抗氧化酶(SOD、POD、CAT)活性 及MDA 含量的测定,每个处理重复6 次,去除6 次 重复中最大值和最小值,剩下数值取平均值,并计算 标准差。 1.4 数据分析
采用SPSS 19.0 对实验数据进行统计分析。对不 同处理与阴性对照间的测定指标进行单因素方差分 析(one-way ANOVA)和Tukey’s-b多重比较。 2 结果与分析 2.1 菲、芘对蚕豆SOD 活性的影响
由图 1A 可知,菲暴露能显著地提高蚕豆茎叶细 胞SOD 活性。20 mg·kg-1菲暴露下SOD 活性达到本 实验菲处理的最高值(262.18±14.44)U·min-1·g-1FW, 比对照组高37.06%(P<0.01)。当菲的浓度低于20 mg·kg-1时,SOD 活性随菲浓度的升高呈增大趋势,当 菲的浓度高于20 mg·kg-1时,SOD 活性随菲浓度升高 而降低。同样,从图 1B 可以看出,芘暴露使根细胞 SOD活性增加,但没有达到显著水平。同样20 mg·kg-1 暴露下,SOD 活性亦达到本实验芘处理的最高值 (242.19±26.98)U·min-1·g-1FW,与对照相比SOD 活性 未发生明显变化。
|
| Significant differences from the control are indicated as follows: *P<0.05,**P<0.01. The same as below 图 1 菲、芘对蚕豆幼苗茎叶中SOD 活性的影响 Figure 1 Effectsof phenanthrene(A)and pyrene(B)on SOD activity in shoots of Vicia faba |
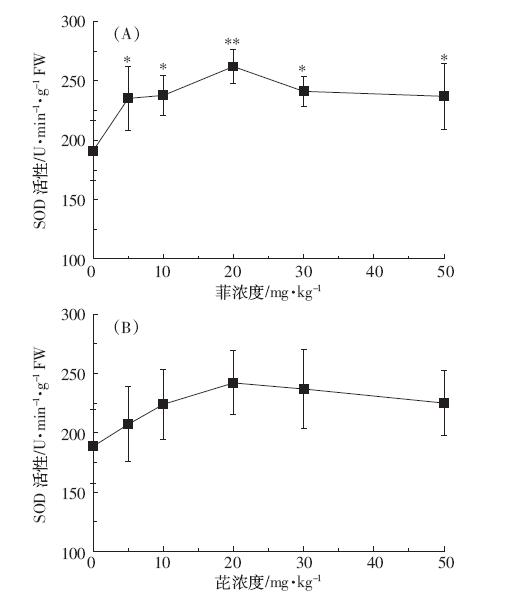
菲、芘均可显著提高POD活性(图 2)。菲暴露下 除浓度30 mg·kg-1 处POD 活性小于浓度20 mg·kg-1 处活性,其他浓度下,随菲浓度的增大POD 活性逐渐 增大。最高(50 mg·kg-1)比对照增加了89.75%,存在 极显著差异(P<0.01)。芘暴露下POD 活性随浓度增 高(0~30 mg·kg-1)而增大,在30 mg·kg-1浓度达到最 高(33.56±2.78)U·min-1·g-1FW,P<0.05。之后POD 活 性降低,50 mg·kg-1污染下POD活性与对照相比仍有 显著差异(P<0.05)。
|
| 图 2 菲、芘对蚕豆幼苗根中POD活性的影响 Figure 2 Effects of phenanthrene(A)and pyrene(B)on POD activity in roots of Vicia faba |
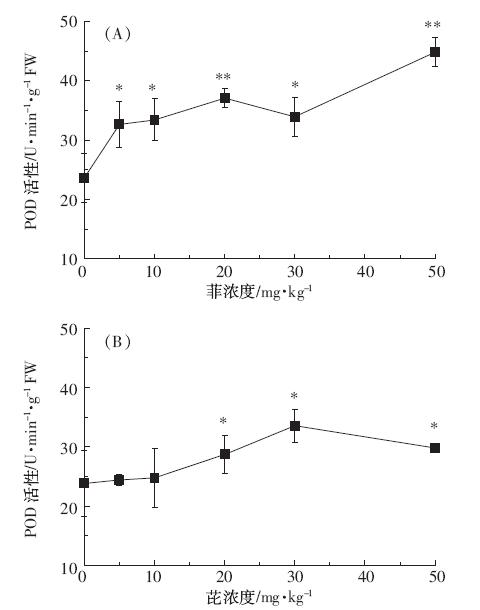
比较图 3 与图 1 可以看出,CAT活性变化与SOD 活性变化趋势相似。经菲、芘污染处理,CAT活性均较 对照显著增强(5 mg·kg-1 菲污染除外)。菲、芘暴露 下,CAT 活性均在0~20 mg·kg-1 随浓度的增加而增 大,浓度大于20 mg·kg-1 CAT活性受到抑制。菲、芘浓 度为20 mg·kg-1条件下CAT 活性达到最大,分别为 (6.37±0.44)、(6.83±0.28)U·min-1·mg-1FW,分别比对 照显著增加53.43%和75.75%(P<0.01)。
|
| 图 3 菲、芘对蚕豆幼苗根中CAT活性的影响 Figure 3 Effects of phenanthrene(A)and pyrene(B)on CAT activity in roots of Vicia faba |
由图 4A 可知,菲暴露下MDA 含量随浓度的增 加呈增大的趋势,浓度为50 mg·kg-1时达到最大,为 (265.78±28.64)nmol·g-1,与对照相比存在极显著差异 (P<0.01)。芘暴露下(图 4B)MDA含量随芘浓度的增 加逐渐增大,从对照的(148.13±5.47)nmol·g-1 增加到 50 mg·kg-1 的(221.90±30.28)nmol·g-1,增加了 49.80%,与对照相比存在极显著差异(P<0.01)。分析表 明,MDA 含量(C)与菲(Cphe)和芘(Cpyr)浓度的线性拟 合方程分别为
C=1.838 4Cphe+145.088 4,R2=0.744 4
C=1.447 5Cpyr+149.092 4,R2=0.993 0
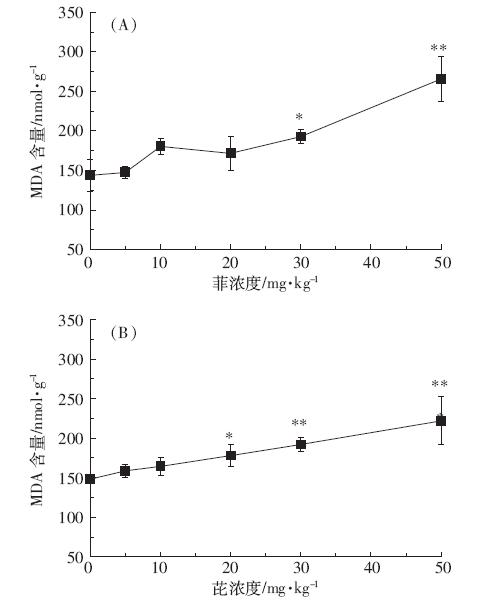
|
| 图 4 菲、芘对蚕豆幼苗根中MDA含量的影响 Figure 4 Effects of phenanthrene(A)and pyrene(B)on MDA concentration in roots of Vicia faba |
这说明MDA 含量与菲(P<0.05)和芘(P<0.01)浓 度分别呈显著和极显著的线性关系。 2.5 菲、芘对蚕豆的DNA 损伤及维生素E 对DNA 损 伤的抑制
图 5 为菲诱导蚕豆DNA损伤的彗星图像。对比 图片可以看出,随着菲浓度的升高,彗星拖尾长度逐 渐增长,表明DNA损伤程度不断增大。从图 6 和图 7 可以看出,在培养48 h后,蚕豆根尖细胞DNA 损伤 程度随菲、芘浓度的提高不断增大。菲暴露下TM 值 从阴性对照的(46.4±9.2)μm 增加到50 mg·kg-1 的 (122.0±2.9)μm,与阴性对照相比存在极显著差异(P< 0.01)。芘对蚕豆根尖细胞DNA 的损伤程度同样随着 芘浓度的升高而增大。芘暴露下TM 值从阴性对照的 (44.3±10.8)μm 增加到50 mg·kg-1 的(110.4±6.4)μm, 与阴性对照相比增加了149.21%,存在极显著差异 (P<0.01)。由此可以得出,菲、芘对蚕豆根尖细胞存在 基因毒性效应,而且存在剂量-效应关系。在相同条件 下,阳性对照20 mg·kg-1 CdCl2造成的DNA 损伤为 (74.10±2.73)μm,与阴性对照相比存在极显著差异(P< 0.01)。

|
| A:阴性对照(NC); B:5 mg·kg-1菲; C:10 mg·kg-1菲; D:20 mg·kg-1菲; E:30 mg·kg-1菲; F:50 mg·kg-1菲 A:negative control; B:5 mg·kg-1 phenanthrene; C:10 mg·kg-1 phenanthrene; D:20 mg·kg-1 phenanthrene; E:30 mg·kg-1 phenanthrene; F:50 mg·kg-1 phenanthrene 图 5 蚕豆细胞DNA 损伤的彗星图像 Figure 5 Images of DNA damages in Vicia faba detected by comet assay |
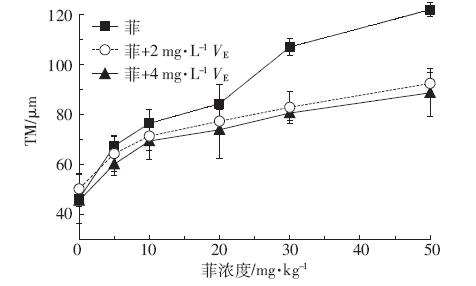
|
| 图 6 菲对蚕豆DNA损伤效应及维生素E 对DNA损伤的影响 Figure 6 Effects of vitamin E on DNA damages of Vicia faba induced by phenanthrene |
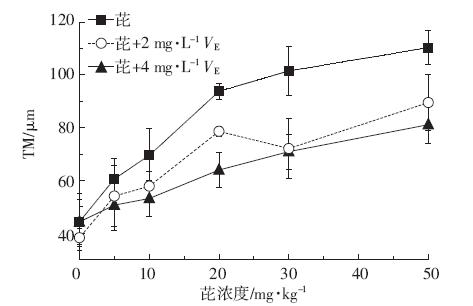
|
| 图 7 芘对蚕豆DNA 损伤效应及维生素E 对DNA 损伤的影响 Figure 7 Effects of vitamin E on DNA damages of Vicia faba induced by pyrene |
由图 6 和图 7 可知,经过2 mg·L-1维生素E预处 理8 h,DNA 损伤程度小于菲、芘直接污染造成的损 伤(5~50 mg·kg-1)。图 6 显示,菲污染组经过2 mg·L-1 维生素E 预处理,DNA 损伤减小量在50 mg·kg-1 浓 度下最大,为29.49 μm,与50 mg·kg-1 菲直接污染相 比减小了24.16%,存在极显著差异(P<0.01)。芘污染 组经过2 mg·L-1 维生素E 预处理,DNA 损伤减小量 在30 mg·kg-1 浓度下最大,为28.42 μm(图 7),与 30 mg·kg-1 芘直接污染相比,减小了28.98%,存在显 著性差异(P<0.05)。同样对于菲、芘污染(5 ~50 mg· kg-1),4 mg·L-1 维生素E 预处理组DNA 损伤程度小 于2 mg·L-1维生素E 预处理组,维生素E 对菲、芘造 成的DNA 损伤的抑制作用随维生素E 浓度的增大 而增强。实验结果表明一定浓度的维生素E 能够抑 制菲、芘造成的DNA 损伤,即菲、芘造成的DNA 损伤 与氧化胁迫存在一定关系。 2.6 菲、芘浓度与抗氧化酶活性、MDA 含量以及DNA 损伤之间的相关性分析
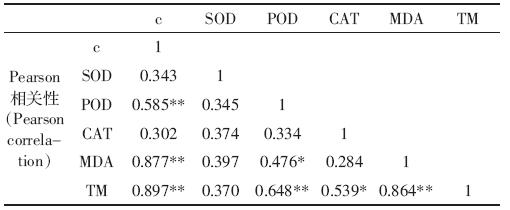
由表 1 可知,在菲暴露下,POD、MDA 与菲浓度 三者之间具有极显著的相关性(P<0.01);由表 2 可 知,MDA 与芘浓度之间具有极显著的相关性(P< 0.01)。由于MDA含量与菲、芘浓度均具有极显著的 相关性,在研究PAHs 对植物的氧化胁迫时应加强对 MDA 含量的关注。在芘暴露条件下SOD、POD、CAT 和MDA 四项指标之间没有显著的相关性,在菲暴露 下,仅POD 与MDA 之间具有极显著相关性,因此在 研究PAHs 对植物的氧化胁迫时还应兼顾多种指标。 同时,在菲暴露下,TM 值与POD 和MDA之间具有极 显著相关性,在芘暴露下,TM 值与MDA 之间具有极 显著相关性。在菲、芘暴露下DNA 损伤程度(TM 值) 均与MDA 之间具有极显著相关性,一定程度上印证 了菲、芘诱导的DNA 损伤与氧化胁迫有关。
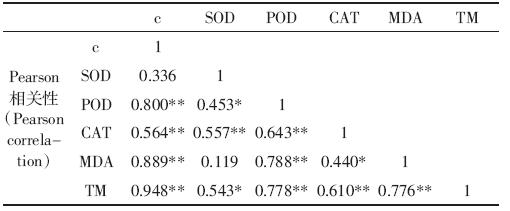 |
 |
当植物遭遇环境胁迫时ROS 迅速积累,并引起 植物体一系列的应激反应。为抵御和清除ROS,植物 体合成并激活一系列抗氧化酶,如SOD 酶能够将O-2· 转化为H2O2 和O2,POD 和CAT 酶能将H2O2 转化为 H2O和O2[28]。目前关于植物SOD 的研究大多以植物 叶片为材料[18,23,29,30],为便于与其他研究分析比较,本 研究选取蚕豆幼苗茎叶进行SOD 活性的测定。彗星 实验采用蚕豆幼苗根尖细胞进行,为保持一致,POD 和CAT 活性以及MDA 含量的测定均采用蚕豆幼苗 的根进行。
当植物受到轻度环境胁迫时,SOD 和POD 活性 有所升高,以增强植物对ROS 的清除能力。受到重度 逆境胁迫时,SOD 和POD 活性又会大幅度降低,造成 ROS 的积累和细胞的伤害[14],以上规律在本实验中得 到证实。正常情况下植物体内SOD、POD 和CAT活性 维持在一定的水平,从而去除不断产生的自由基,使 植物体内SOD、POD 和CAT活性以及ROS 含量达到 一定的平衡。在本实验中,SOD、POD 和CAT 的活性 变化是被诱导的,但随着菲、芘浓度的升高,SOD、 POD 和CAT活性在升高后又有所下降。这可能是随 着菲、芘富集量的增加,机体被活性物质攻击,细胞结 构受到损伤,抗氧化酶蛋白受到一定程度的消耗和破 坏导致的。活性降低意味着抗氧化酶对ROS 的去除 可能存在延缓,进而带来脂质过氧化作用的增强。 MDA是膜脂过氧化过程中的分解产物,作为膜脂过氧 化指标,表示膜脂过氧化程度和对逆境反应的强弱, 其含量越高表明损伤越大[31]。本研究中随着菲、芘浓度 的升高,MDA 含量有增大的趋势,表明蚕豆脂质过氧 化作用增强。高雯欣等[32]研究海水中添加菲、芘两种 PAHs对孔石莼的氧化胁迫,发现暴露6 h和72 h,经 过处理的样品中MDA 含量均有升高,与本实验结果 相似。从图 2 可以看出,POD活性对菲、芘胁迫的响应 存在较大差异,这可能由于菲、芘溶解度、辛醇-水分 配系数等理化性质不同造成的。有报道指出,污染物 种类、浓度与抗氧化酶之间的胁迫响应具有差异性[18]。
菲、芘在引起蚕豆体内ROS 积累造成氧化胁迫 的同时,还抑制了抗氧化系统相关酶的活性,引起蚕 豆膜脂过氧化。这些PAHs 诱导产生的ROS 或者膜 脂过氧化过程中产生的ROS 基团由于不能及时清 除,可能直接或间接作用于DNA 或者DNA 修复系 统,从而引起DNA 损伤。Arya 等[33]也表示,过量的 ROS 可诱导蛋白质分解,膜的脂质过氧化,并引起 DNA 损伤。
彗星实验是一种灵敏性高的遗传毒性研究方法,常 被用作检测诸如DNA单链和双链断裂、碱性位点、不完 全修复位点、DNA 交联等多种类型的DNA 损伤[34]。 1996 年Koppen 和Verschaeve[21]第一次报道了利用植 物材料进行彗星实验,观察到甲基磺酸乙酯(EMS)、 丝裂霉素C(MMC)、氯化镉(CdCl2)等都能引起显著 的DNA 损伤。Pourrut 等[27]用彗星实验研究铅对蚕豆 根的DNA损伤效应,结果表明,随着铅浓度的增加 (1~20 μmol·L-1)DNA损伤显著增大,表明铅能够引 发蚕豆DNA 损伤,并且存在剂量-效应关系。本研究 中蚕豆DNA 损伤程度(TM 值)随菲、芘浓度的提高 (5~50 mg·kg-1)不断增大,表明菲、芘对蚕豆具有基因 毒性效应。阳性对照20 mg·kg-1 CdCl2 造成显著的 DNA损伤,重金属对植物DNA 造成损伤的一个重要 原因是诱导体内氧化胁迫[16],菲、芘对蚕豆DNA 造成 损伤的原因可能与之相同。PAHs对植物DNA 损伤的 彗星实验研究鲜见报道[17],对动物细胞造成DNA损伤 的报道较多。韩雪等[35]研究发现PAHs 暴露和精子 DNA 损伤之间存在关联,通过彗星实验发现尿中2- OHNa含量与彗星实验各项指标具有正相关关系。崔 昕毅等[36]用彗星实验研究了芘对蚯蚓的DNA损伤,发 现50、100、200 μg·kg-1芘可诱导极显著的DNA 损伤 (P<0.01)。从表 1 和表 2可以看出DNA损伤程度(TM 值)与菲、芘的浓度以及MDA 含量均具有极显著的相 关性(P<0.01),可见DNA 损伤与氧化胁迫存在一定 的关系。植物细胞有细胞壁,PAHs经植物吸收后主要 存在于细胞壁中[37,38],由于细胞壁的阻隔效应,PAHs 对植物的毒性效应以及致毒机理可能不同于动物细 胞,PAHs在植物体内造成DNA 损伤的机制有待进一 步研究。
维生素E 具有抗氧化的性质,是植物体内防御 自由基的非酶系统的重要组成部分[39]。维生素E能够 保护细胞抵抗ROS的影响。Collin 等[40]研究证明维生 素E 对于拟南芥耐受金属诱导的氧化胁迫至关重 要。在Pourrut等[27]的研究中,蚕豆根在铅染毒之前用 维生素E 预培养1 h,使用1 μmol·L-1 维生素E 预处 理,观察到DNA 损伤减小90豫,10 μmol·L-1维生素 E 预处理则完全消除DNA 损伤,表明铅基因毒性 可能由ROS 的产生起中间作用。本研究中经过2 mg· L-1 维生素E 预处理8 h,DNA 损伤程度小于菲、芘直 接污染造成的损伤(5~50 mg·kg-1);对于菲、芘污染 (5~50 mg·kg-1),4 mg·L-1 维生素E 预处理组DNA 损 伤程度小于相应菲、芘浓度胁迫下2 mg·L-1维生素E 预处理组。蚕豆DNA 损伤的可能原因之一是由于菲、 芘引起的ROS 的积累,而经过抗氧化剂维生素E 的 预处理,DNA 损伤程度减小。由此可以证实菲、芘造 成的DNA 损伤与氧化胁迫有关,而且维生素E 能够 抑制菲、芘造成的DNA 损伤。 4 结论
(1)菲、芘能够触发蚕豆抗氧化反应,提高SOD、 POD、CAT等抗氧化酶的活性。随着菲、芘污染强度提 高,蚕豆体内ROS 积累,导致脂质过氧化产物MDA 含量增加,表明经48 h 污染暴露后,菲、芘对蚕豆产 生了氧化胁迫。
(2)经过48 h 污染暴露处理,菲、芘造成蚕豆 DNA 的损伤,且损伤程度随菲、芘污染强度的提高而 加重,表明菲、芘对蚕豆根尖细胞具有明显的DNA 损伤作用。
(3)通过抗氧化剂维生素E(2 mg·L-1和4 mg·L-1) 预处理,菲、芘对蚕豆DNA 损伤的程度减小,且4 mg·L-1维生素E 预处理组DNA 损伤程度小于2 mg· L-1维生素E预处理组,表明维生素E能抑制菲、芘对 蚕豆的DNA 损伤,菲、芘对蚕豆造成的DNA 损伤与 氧化胁迫有关。
| [1] | Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons(PAHs):A review[J]. Journal of Hazardous Materials, 2009, 169(1-3) :1-15. |
| [2] | GAO Yan-zheng, REN Li-li, LING Wan-ting, et al. Desorption of phenanthrene and pyrene in soils by root exudates[J]. Bioresource Technology, 2010, 101 (4):1159-1165. |
| [3] | 马英歌. 多环芳烃物理化学性质的确定及其在逸度模型和上海典型环境研究中的应用[D]. 上海:上海交通大学, 2009. MA Ying-ge. Evaluation physical chemical properties of 16 PAHs and their application in fugacity model and typical area in Shanghai[D]. Shanghai:Shanghai Jiaotong University, 2009. |
| [4] | Wild S R, Jones K C. Polynuclear aromatic hydrocarbons in the United Kingdom environment:A preliminary source in inventory and budget[J]. Environment Pollution, 1995, 88(1):91-108. |
| [5] | 王学彤, 贾 英, 孙阳昭, 等. 典型污染区农业土壤中PAHs的分布、来源及生态风险[J]. 环境科学学报, 2009, 29(11):2433-2439. WANG Xue-tong, JIA Ying, SUN Yang-zhao, et al. Distribution, sources and ecological risk assessment of polycyclic aromatic hydrocarbons in agricultural soils from a typical contaminated area[J]. Acta Scientiae Circumstantiae, 2009, 29(11):2433-2439. |
| [6] | 曹云者, 柳晓娟, 谢云峰, 等. 我国主要地区表层土壤中多环芳烃组成及含量特征分析[J]. 环境科学学报, 2012, 32(1):197-203. CAO Yun-zhe, LIU Xiao-juan, XIE Yun-feng, et al. Patterns of PAHs concentrations and components in surface soils of main areas in China[J]. Acta Scientiae Circumstantiae, 2012, 32(1):197-203. |
| [7] | 杨国义, 张天彬, 高淑涛, 等. 珠江三角洲典型区域农业土壤中多环芳烃的含量分布特征及其污染来源[J]. 环境科学, 2007, 28(10):2350-2354. YANG Guo-yi, ZHANG Tian-bin, GAO Shu-tao, et al. Source and distribution characteristics of polycyclic aromatic hydrocarbons in agricultural soils in the Pearl River Delta[J]. Environmental Science, 2007, 28(10):2350-2354. |
| [8] | Flocco C G, Lobalbo A, Carranza M P, et al. Some physiological, microbial, and toxicological aspects of the removal of phenanthrene by hydroponic cultures of Alfalfa(Medicago sativa L.)[J]. International Journal of Phytoremediation, 2002, 4(3):169-186. |
| [9] | Paskova V, Hilscherova K, Feldmannova M, et al. Toxic effects and oxidative stress in higher plants exposed to polycyclic aromatic hydrocarbons and their N-heterocyclic derivatives[J]. Environmental Toxicology and Chemistry, 2006, 25(12):3238-3245. |
| [10] | Song Y F, Gong P, Wilke B M, et al. Genotoxicity assessment of soils from wastewater irrigation areas and bioremediation sites using the Viciafaba root tip micronucleus assay[J]. Journal of Environmental Monitoring, 2007, 9(2):182-186. |
| [11] | 邓 欢, 郭光霞, 乔 敏. 多环芳烃污染土壤毒性评价指标的研究进展[J]. 生态毒理学报, 2009, 1(4):1-13. DENG Huan, GUO Guang-xia, QIAO Min. Advances in the biological indicators for toxicity assessment of polycyclic aromatic hydrocarbons contaminated soil:A review[J]. Asian Journal of Ecotoxicology, 2009, 1(4):1-13. |
| [12] | Aina R, Palin L, Citterio S, et al. Molecular evidence for benzo[a]pyrene and naphthalene genotoxicity in Trifolium repens L.[J]. Chemosphere, 2006, 65(4 ):666-673. |
| [13] | Alkio M, Tabuchi T M, Wang X C, et al. Stress responses to polycyclic aromatic hydrocarbons in Arabidopsis include growth inhibition and hypersensitive response-like symptoms[J]. Journal of Experimental Botany, 2005, 56(421):2983-2994. |
| [14] | 张 琼, 伍 琴, 高香玉, 等. 二溴联苯醚对纤细裸藻的生态遗传毒性效应[J]. 中国环境科学, 2010, 30(6):833-838. ZHANG Qiong, WU Qin, GAO Xiang-yu, et al. Ecogenotoxicological effects of BDE-15 on the Microalga Euglena gracilis[J]. China Environmental Science, 2010, 30(6 ):833-838. |
| [15] | Bandyopadhyay A, Mukherjee A. Sensitivity of allium and nicotiana in cellular and acellular comet assays to assess differential genotoxicity of direct and indirect acting mutagens[J]. Ecotoxicology and Environmental Safety, 2011, 74(4):860-865. |
| [16] | 张旭红, 林爱军, 苏玉红, 等. 镉引起蚕豆(Vicia faba)叶片DNA损伤和细胞凋亡研究[J]. 环境科学, 2006, 27(4):787-793. ZHANG Xu-hong, LIN Ai-jun, SU Yu-hong, et al. DNA damage and apoptosis induced by Cd in the leaves of horsebean Vicia faba[J]. Environmental Science, 2006, 27 (4):787-793. |
| [17] | Ventura L, Giovannini A, Savio M, et al. Single Cell Gel Electrophoresis(Comet) assay with plants:Research on DNA repair and ecogenotoxicity testing[J]. Chemosphere, 2013, 92(1):1-9. |
| [18] | 宋玉芳, 李昕馨, 张 薇, 等. 植物CytP450和抗氧化酶对土壤低浓度菲、芘胁迫的响应[J]. 生态学报, 2009, 29(7):3768-3773. SONG Yu-fang, LI Xin-xin, ZHANG Wei, et al. The response of CytP450 and antioxidant enzymes in plants to phenanthrene and pyrene exposure in soil at lower concentrations[J]. Acta Ecologica Sinica, 2009, 29(7):3768-3773. |
| [19] | 汪月霞, 孙国荣, 王建波, 等. NaCl胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系[J]. 生态学报, 2006, 26(1):122-129. WANG Yue-xia, SUN Guo-rong, WANG Jian-bo, et al. Relationships among MDA content, plasma membrane permeability and the Chlorophyll fluorescence parameters of Puccinellia tenuif lora seedlings under NaCl stress[J]. Acta Ecologica Sinica, 2006, 26(1):122-129. |
| [20] | 宋玉芳, 周启星, 许华夏, 等. 菲、芘、1, 2, 4-三氯苯对土壤高等植物根伸长抑制的生态毒性效应[J]. 生态学报, 2002, 22(11):1945-1950. SONG Yu-fang, ZHOU Qi-xing, XU Hua-xia, et al. Eco-toxicological effects of phenanthrene, pyrene and 1, 2, 4-trichlorobenzene in soils on the inhibition of root elongation of higher plants[J]. Acta Ecologica Sinica, 2002, 22(11):1945-1950. |
| [21] | Koppen G, Verschaeve L. The alkaline Comet test on plant cells:A new genotoxicity test for DNA strand breaks in Vicia faba root cells[J]. Mutation Research, 1996, 360(3):193-200. |
| [22] | Sverdrup L E, Kelley A E, Krogh P H, et al. Effects of eight polycyclic aromatic compounds on the survival and reproduction of the springtail Folsomia fimetaria L. (Collembola, Isotomidae)[J]. Environmental Toxicology and Chemistry, 2001, 20(6):1332-1338. |
| [23] | 李关荣, 李天俊, 冯建成. 生物化学实验教程[M]. 北京:中国农业大学出版社, 2011. LI Guan-rong, LI Tian-jun, FENG Jian-cheng. Biochemical experiments tutorial[M]. Beijing:China Agricultural University Press, 2011. |
| [24] | 龚帅帅, 韩 进, 高彦征, 等. 抑制剂和安全剂对高羊茅根中酶活性和菲代谢的影响[J]. 生态学报, 2011, 31(14):4027-4033. GONG Shuai-shuai, HAN Jin, GAO Yan-zhang, et al. Effects of inhibitor and safener on enzyme activity and phenanthrene metabolism in root of tall fescue[J]. Acta Ecologica Sinica, 2011, 31(14):4027-4033. |
| [25] | Gichner T. DNA damage induced by indirect and direct acting mutagens in catalase-deficient transgenic tobacco cellular and acellular comet assay[J]. Mutation Research, 2003, 535(2):187-193. |
| [26] | Gichner T, Patkova Z, Szakova J, et al. Toxicity and DNA damage in tobacco and potato plants growing on soil polluted with heavy metals[J]. Ecotoxicology and Environmental Safety, 2006, 65(3):420-426. |
| [27] | Pourrut B, Jean S, Silvestre J, et al. Lead-induced DNA damage in Vicia faba root cells:Potential involvement of oxidative stress[J]. Mutation Research, 2011, 726(2):123-128. |
| [28] | 汪承润, 王晓蓉, 于红霞, 等. 运用蚕豆幼苗叶片生物标志物评价铅污染土壤[J]. 环境科学, 2008, 29(11):3246-3251. WANG Cheng-run, WANG Xiao-rong, YU Hong-xia, et al. Evaluation of soil lead contamination by biomarkers in leaves of Vicia faba L. seedlings[J]. Environmental Science, 2008, 29(11):3246-3251. |
| [29] | 侯新东, 盛桂莲, 葛台明, 等. 生物化学实验指导书[M]. 武汉:中国地质大学出版社, 2011. HOU Xin-dong, SHENG Gui-lian, GE Tai-ming, et al. Biochemical experiments instructions[M]. Wuhan:China University of Geosciences Press Company Limited, 2011. |
| [30] | 宋玉芳, 王 磊, 李昕馨, 等. 植物CytP450和抗氧化酶对土壤菲、芘暴露的生态毒理响应[J]. 环境科学学报, 2009, 29(2):381-388. SONG Yu-fang, WANG Lei, LI Xin-xin, et al. Ecotoxic responses of CytP450 and antioxidant enzymes in maize due to exposures to phenanthrene and pyrene in soil[J]. Acta Scientiae Circumstantiae, 2009, 29(2):381-388. |
| [31] | 吴尔苗, 王军良, 赵士良, 等. 菲和芘单一及复合污染对蚯蚓抗氧化酶活性和丙二醛含量的影响[J]. 环境科学学报, 2011, 31(5):1077-1085. WU Er-miao, WANG Jun-liang, ZHAO Shi-liang, et al. Effect of single and combined pollution of Phe, Pyr on SOD, CAT activities and MDA content of Eisenia Foetida in soils[J]. Acta Scientiae Circumstantiae, 2011, 31(5):1077-1085. |
| [32] | 高雯欣. 两种多环芳烃对孔石莼的生物毒性及氧化胁迫研究[D]. 哈尔滨:哈尔滨工业大学, 2010. GAO Wen-xin. Biologicle toxicity and oxidative stress of two kinds of polycyclic aromatic hydrocarbons on Ulva pertusa[D]. Harbin:Harbin Institute of Technology, 2010. |
| [33] | Arya S K, Basu A, Mukherjee A. Lead induced genotoxicity and cytotoxicity in root cells of Allium cepa and Vicia faba[J]. The Nucleus, 2013, 56(3):183-189. |
| [34] | Cenkci S, Yildiz M, Ciğxerci I H, et al. Evaluation of 2, 4-D and Dicamba genotoxicity in bean seedlings using comet and RAPD assays[J]. Ecotoxicology and Environmental Safety, 2010, 73(7):1558-1564. |
| [35] | 韩 雪. 重庆及三峡库区多环芳烃和邻苯二甲酸酯类物质环境暴露对男性生殖器损害的研究[D]. 重庆:第三军医大学, 2011. HAN Xue. Male reproductive toxicities of environmental exposure to polycyclic aromatic hydrocarbons and phthalates[D]. Chongqing:Third Military Medical University of Chinese P. L. A, 2011. |
| [36] | 崔昕毅. 黑炭对沉积物中疏水性有机物的生物富集、降解与基因毒性的作用机制[D]. 杭州:浙江大学, 2010. CUI Xin-yi. Effect of black carbon on the bioaccumulation, biodegradation, and genotoxicity of hydrophobic organic compounds in sediment[D]. Hangzhou:Zhejiang University, 2010. |
| [37] | Zhang M, Zhu L. Sorption of polycyclic aromatic hydrocarbons to carbohydrates and lipids of ryegrass root and implications for a sorption prediction model[J]. Environmental Science & Technology, 2009, 43(8):2740-2745. |
| [38] | Chen L, Zhang S, Huang H, et al. Partitioning of phenanthrene by root cell walls and cell wall fractions of wheat(Triticum aestivum L.)[J]. Environmental Science & Technology, 2009, 43(24):9136-9141. |
| [39] | 李 殷. 植物维生素E生物合成途径及调控[D]. 上海:复旦大学, 2009. LI Yin. Engineering and regulating plant tocopherol biosynthetic pathway[D]. Shanghai:Fudan University, 2009. |
| [40] | Collin V C, Eymery F, Genty B, et al. Vitamin E is essential for the tolerance of Arabidopsis thaliana to metal-induced oxidative stress[J]. Plant, Cell and Environment, 2008, 31(2):244-257. |
 2014, Vol. 33
2014, Vol. 33