文章信息
- 马涛, 易能, 张振华, 王岩, 高岩, 严少华
- MA Tao, YI Neng, ZHANG Zhen-hua, WANG Yan, GAO Yan, YAN Shao-hua
- 凤眼莲根系分泌氧和有机碳规律及其对水体氮转化影响的研究
- Oxygen and Organic Carbon Releases from Roots of Eichhornia Crassipes and Their Influence on Transformation of Nitrogen in Water
- 农业环境科学学报, 2014, 33(10): 2003-2013
- Journal of Agro-Environment Science, 2014, 33(10): 2003-2013
- http://dx.doi.org/10.11654/jaes.2014.10.018
-
文章历史
- 收稿日期:2014-3-31
2. 江苏省农业科学研究院农业资源与环境研究所, 南京 210014
2. Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
近年来,以水生植物为核心的污水或富营养化水体修复技术,因净化效果好,且同时具有环境友好、易管理、成本低廉等特点,已成为国内外生态环境科学领域研究热点之一[1,2,3].漂浮植物凤眼莲(Eichhonia-crassipes)是研究最早的水生植物之一,被公认为是去除氮、磷效果最佳的一种水生植物类型[4],已被广泛应用于生活污水[5]、养殖废水、富营养化湖泊、河道[6]等水体处理中。氮(N)是水体生态系统中循环最活跃的元素之一,与水体富营养化关系密切。凤眼莲净化富营养化水体过量氮负荷途径主要有:凤眼莲吸收作用;凤眼莲通过促进水体反硝化、硝化-反硝化脱氮释放N2过程,降低水体氮负荷。近期利用N-15示踪技术研究凤眼莲对水体中氮去除途径的影响发现,种植凤眼莲的富营养化水体释放15N2原子百分超显着高于未种植凤眼莲对照水体释放15N2原子百分超,凤眼莲表现出了促进水体反硝化脱氮过程的显着效果[7].
大型水生植物影响水体反硝化脱氮过程的有关机理主要是建立在湿地污水净化系统中挺水植物对该过程产生影响的基础上。普遍认为水生植物主要通过以下方面调节硝化、反硝化过程,包括:①水生植物根系为硝化、反硝化微生物提供良好附着和繁殖界面,形成水生植物根际微生物非特异结合的根际微生态系统,从而为同步硝化-反硝化过程提供良好根际微域环境[8,9,10],在种养凤眼莲与水芹的人工湿地系统研究发现,种养凤眼莲和水芹水体硝化、反硝化细菌数量显着高于相应条件下未种植水生植物处理[11].②水生植物通过光合作用将空气中O2传输到根部,促进硝化反应过程[12],对几种湿地植物(水芹、马蹄莲、美人蕉、茭草、菖蒲、香蒲、芦竹)根系分泌氧气与水体总氮(TN)去除率的研究发现,湿地植物根系分泌氧气速率与水体TN去除率存在正相关关系,分泌氧气速率越高,水体TN去除率越大[13];③水生植物通过根系分泌作用向介质中提供有机碳源[9];④调节介质环境pH、氧化还原电位(Eh)、微生物活性变化等[8],研究表明,种养凤眼莲能够稳定水体pH[14].从根本上讲,这都是通过水生植物自身特性影响并改变所处介质环境中物理、化学条件,从而形成与其相适应的生物学环境条件,最终影响介质硝化、反硝化脱氮过程。虽然以上机理被广泛接受,而对漂浮植物凤眼莲分泌物对富营养化水体净化的研究多局限于根系分泌物抑制藻类生长方面。研究认为凤眼莲根系能够分泌化感物质或克藻物质消除藻类,是凤眼莲净化富营养化水体一个重要机制[15].然而,目前对凤眼莲分泌氧气、有机碳规律掌握得并不深入和全面,其分泌氧气和有机碳过程对水体溶解氧(DO)、可溶性有机碳(DOC)以及富营养化水体中氮转化过程的影响也不清楚。
国内外对陆生植物和水生植物研究均表明,不同类型植物,甚至同一植物在不同生长阶段其根系分泌溶解氧、有机碳都具有一定差异[16,17].因此,本文拟研究不同生长阶段(以不同生物量区分不同苗龄大小,代表凤眼莲不同生长阶段)凤眼莲根系分泌氧气及有机碳规律,在此基础上,分析凤眼莲根系泌氧、分泌有机碳对富营养化水体溶解氧、有机碳及不同浓度、形态无机氮转化的影响。 1 材料与方法 1.1 供试植物
凤眼莲(Eichhonia crassipes),俗称水葫芦,属雨久花科,为大型漂浮水生植物。试验开始前,于江苏省农业科学院2号蓄水塘凤眼莲种养区中选取长势一致的三个苗龄凤眼莲,由于凤眼莲是分蘖繁殖,不同苗龄凤眼莲以根长、生物量划分后进行移栽。苗龄1:根长(10.93±1.21)cm,生物量(60.32±10.28)g;苗龄2:根长(13.76±1.15)cm,生物量(111.54±23.03)g;苗龄3:根长(19.43±2.89)cm,生物量(184.21±37.56)g. 1.2 供试富营养化水体
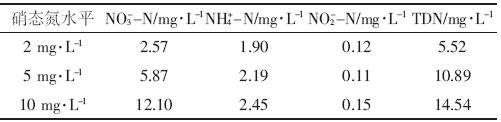
富营养化水体来源为江苏省农业科学研究院2号蓄水塘污水。该水体主要来源于生活污水和雨水,铵态氮(NH4+-N)变化范围1.04~5.56 mg·L-1,硝态氮(NO3--N)浓度大部分时间维持在2 mg·L-1左右,主要用于灌溉水稻田。2013年,蓄水塘水体pH变化范围6.9~8.2、DO变化范围7.4~13.7 mg·L-1、TN变化范围5.0~10.2 mg·L-1、总磷(TP)变化范围0.2~0.7 mg·L-1.在本实验中,根据实验需要分别以KNO3或NH4Cl形式向其中加入一定浓度NO3--N或NH4+-N.实验开始前,分别测得不同处理水体中NO3--N、NH4+-N、亚硝态氮(NO2--N)、可溶性总氮(TDN)浓度,见表 1、表 2.
 |
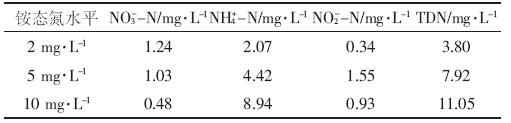 |
实验处理设为三种不同苗龄,两种不同氮形态富营养化水体(NH4+-N、NO3--N),同时设有三种不同浓度处理(NO3--N为2、5、10 mg·L-1;NH4+-N为2、5、10 mg·L-1).每个处理重复3次,参见表 3.
实验分别于2013年5月25日至5月31日和2013年12月4日至12月10日在江苏省农业科学研究院模拟实验基地智能温棚中进行,温棚中温度维持在25~30 ℃。实验开始时向1 L烧杯中加入配制好具有2、5、10 mg·L-1 NO3--N或NH4+-N的2号塘富营养化水800 mL,取各处理初始水样,测定水体中NO3--N、NH4+-N、NO2--N、TDN浓度,同时向烧杯中放置三种不同苗龄凤眼莲,每个烧杯中放置一株凤眼莲。为了尽量减少植物生长速率不一致对不同苗龄根系分泌特征差异性影响,每个苗龄培养实验均持续一周,代表各个苗龄凤眼莲根系分泌规律。实验期间,采用破坏性取样方式,每个处理每天取出3株凤眼莲,在实验室内测定整株凤眼莲植株鲜重,以及根鲜重和干重,并测定凤眼莲根系分泌氧气速率、分泌有机碳速率,以一周测定结果代表各苗龄凤眼莲根系分泌氧气和分泌有机碳情况;同时,每天测定水体pH、DO、Eh、水温;每天采集50 mL烧杯内水样,测定水体内NO3--N、NH4+-N、NO2--N、TDN浓度。实验期内,每天向各处理烧杯中补加蒸馏水弥补蒸发和蒸腾损失量。 1.3.3 水温、pH、DO、Eh测定
使用YSI多功能水质测定仪(YSI ProPlus)测定水体常见理化指标,主要包括水温、pH、DO、Eh. 1.3.4 水样NO3-、NH4+、NO2-及TDN浓度测定[18]
水样采回经过滤后,NO3--N含量使用紫外分光光度法测定;NH4+-N含量使用纳氏试剂光度法测定;NO2--N含量使用N-(1-萘基)-乙二胺光度法测定;TDN含量使用过硫酸钾氧化-紫外分光光度法测定。 1.3.5 凤眼莲根系分泌DOC及氧气量的测定
凤眼莲根系分泌DOC测定:将凤眼莲置于加入800 mL超纯水的1 L烧杯中,放入恒温培养箱培养2 h,收集凤眼莲根系分泌物[19].为了模拟温棚环境条件,调节恒温培养箱参数,温度设定为30 ℃,光照条件100 000 lx(夏天阳光光照强度).取2 h内收集到的根系分泌物水溶液,用0.45 μm滤膜过滤,使用TOC仪测定DOC浓度(C凤眼莲),同时使用TOC仪测定超纯水DOC浓度(C超纯水),两者之差(C凤眼莲-C超纯水)即为凤眼莲根系分泌DOC含量。
凤眼莲根系分泌氧气量用柠檬酸钛比色法测定:测定根系泌氧过程在充满N2的厌氧培养箱内进行。每天采集整株凤眼莲鲜样放入含800 mL培养液的烧杯中,培养液为1/4霍格兰仕营养液,使用前以N2通入30 min,以驱除水体内氧气。培养液表层以液体石蜡覆盖5 cm,烧杯表层用锡纸包裹以减少光照对根的影响,将放入凤眼莲的烧杯置于恒温培养箱培养6 h.为了模拟温棚环境条件,恒温培养箱温度设定为30 ℃,光照条件为100 000 lx.到达时间后取出凤眼莲,将培养液混匀,之后在紫外分光光度计527 nm波长下比色测定含有凤眼莲的培养液及不含凤眼莲的空白溶液。以上除了在恒温培养箱培养6 h过程,其他测定步骤均在充满N2的厌氧培养箱内进行[20]. 1.4 统计方法
各处理凤眼莲在不同培养时间、不同形态氮、不同氮浓度、不同生长阶段凤眼莲分泌氧气速率、有机碳速率使用单因素方差分析(One-way ANOVA)进行比较检验,显着水平为5%,极显着水平为1%(SPSS 13.0).不同生长阶段凤眼莲分泌氧气速率、DOC速率箱体图使用Sigmaplot12.5绘制,箱体内实线为每个苗龄阶段7 d测定数据中值,箱体上下边缘分别为75%、25%数据分散范围,上下误差限分别为90%、10%范围。 2 结果 2.1 富营养化水体的NO3--N、NH4+-N、NO2--N、TDN变化规律
由图 1可知,在以硝态氮为主要无机氮源条件下,未种植凤眼莲对照水体NO3--N浓度呈现持续下降趋势;对照水体NO2--N浓度呈现持续上升趋势,对照水体NH4+-N浓度呈现持续下降趋势。
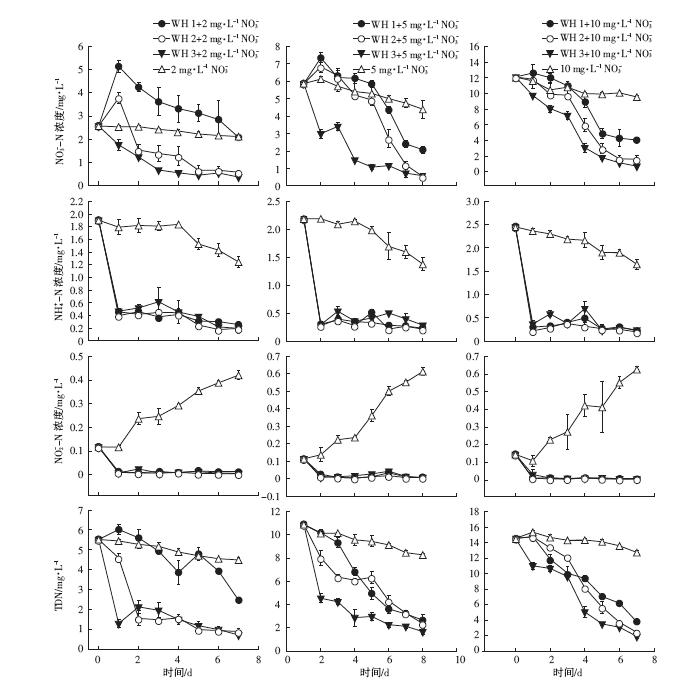
|
| 图 1 不同浓度硝态氮富营养化水体NO3--N、NH4+-N、NO2--N、TDN浓度随培养时间变化规律 Figure 1 Changes of NO3--N,NH4+-N,NO2--N and TDN concentrations in eutrophic water with different initial NO3--N concentrations |
小、中苗龄(苗龄1、苗龄2)凤眼莲处理中,初始硝态氮浓度为2、5 mg·L-1富营养化水体,NO3--N浓度在试验期内呈现先上升后下降趋势。在10 mg·L-1高硝态氮浓度水平下,生长小苗龄凤眼莲水体NO3--N浓度也呈现先上升后下降趋势。大苗龄凤眼莲(苗龄3)处理中,不同浓度NO3--N呈现持续下降趋势。种植凤眼莲富营养化水体NO2--N浓度呈现细微波动变化。生长各苗龄凤眼莲的富营养化水体NH4+-N浓度在实验第1 d陡然降低,之后呈现细微波动变化。
由图 2可知,在以铵态氮为主要无机氮源条件下,未种植凤眼莲对照水体NH4+-N浓度呈现持续下降趋势。2 mg·L-1铵态氮浓度水平下,对照水体NO3--N浓度呈现先上升后下降趋势;5、10 mg·L-1铵态氮浓度水平下,对照水体NO3--N浓度呈现持续上升趋势;2、5 mg·L-1铵态氮浓度水平下,对照水体NO2--N浓度呈现先下降后略微上升再下降趋势;10 mg·L-1铵态氮浓度水平下,对照水体NO2--N浓度呈现先上升后下降趋势。
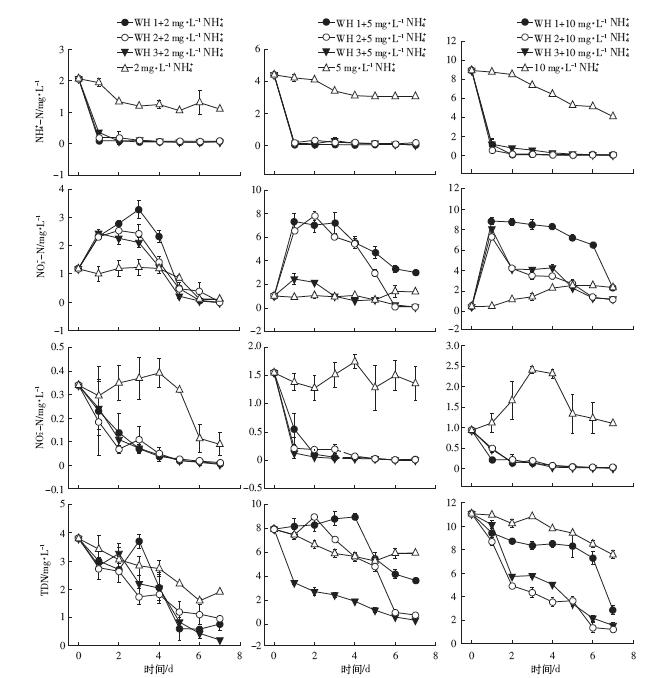
|
| 图 2 不同浓度铵态氮富营养化水体NH4+-N、NO3--N、NO2--N、TDN 浓度随培养时间变化规律 Figure 2 Changes of NH4+-N,NO3--N,NO2--N and TDN concentrations in eutrophic water with different initial NH4+-N concentrations |
不同苗龄凤眼莲处理中,不同浓度铵态氮水平富营养化水体的NH4+-N浓度在试验期内开始第1 d陡然下降,之后呈现细微波动;不同苗龄凤眼莲水体NO3--N浓度在实验周期内呈现先上升后下降趋势;NO2--N在实验开始时先降低后细微变化。
在一个星期培养时间内,种植凤眼莲的不同浓度硝态氮、铵态氮水体中TND浓度相比对照水体均显着降低。 2.2 凤眼莲根系泌氧速率及富营养化水体DO变化规律
由图 3、图 4可知,在一周培养期内,不同生长阶段凤眼莲根系分泌氧气速率随凤眼莲苗龄增加呈现极显着差异(P<0.01).对每个苗龄凤眼莲而言,不同浓度硝态氮或不同浓度铵态氮水平下,根系分泌氧气速率没有显着性差异。一周培养期内,各苗龄凤眼莲泌氧速率在初期1~3 d下降,后期稳定。凤眼莲根系泌氧速率随着苗龄期增加而增加,表现为:苗龄1<苗龄2<苗龄3.用不同苗龄根系泌氧速率7 d监测值代表各阶段凤眼莲根系分泌氧气规律:苗龄1泌氧速率56.19 μmol O2·h-1(范围:48.99~64.54 μmol O2·h-1)、苗龄2凤眼莲泌氧速率93.15 μmol O2·h-1(范围:83.54~100.47 μmol O2·h-1)、苗龄3泌氧速率106.32 μmol O2·h-1(范围:101.19~116.02 μmol O2·h-1).
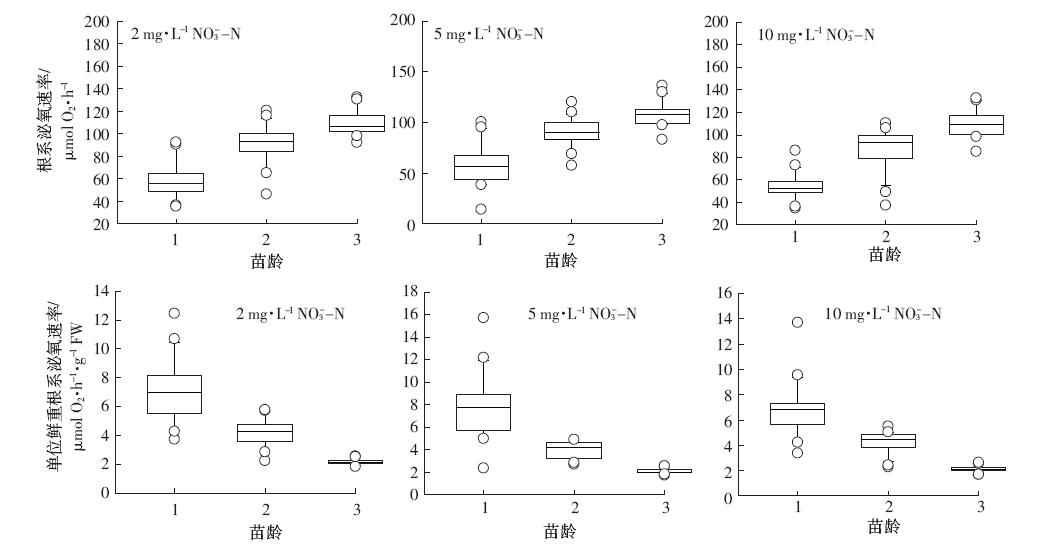
|
| 图 3 不同硝态氮水平下凤眼莲根系泌氧速率 Figure 3 Rates of oxygen release from Eichhornia crassipes roots under different initial NO3--N concentrations |
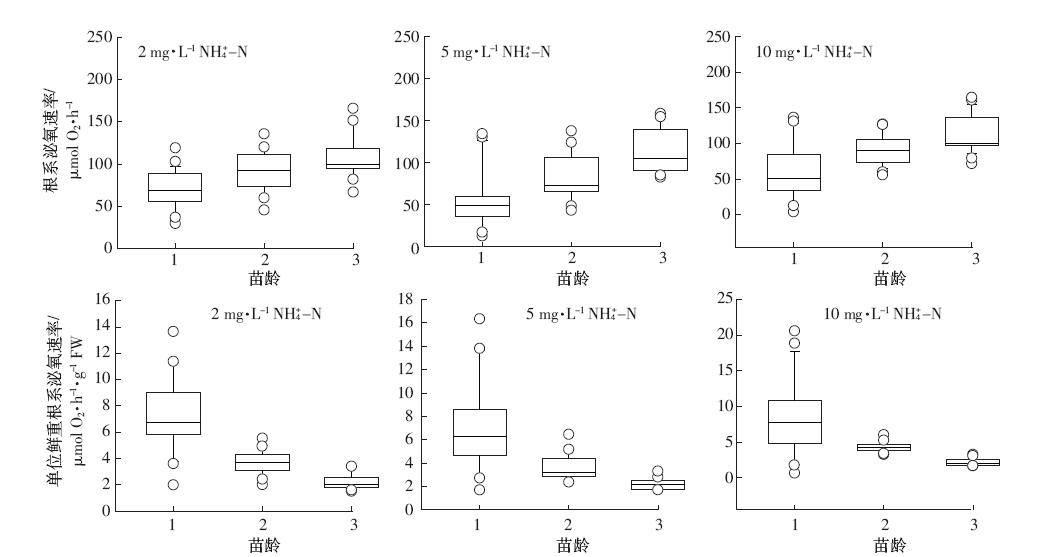
|
| 图 4 不同铵态氮水平下凤眼莲根系泌氧速率 Figure 4 Rates of oxygen release from Eichhornia crassipes roots under different initial NH4+-N concentrations |
凤眼莲根系泌氧能力以单位鲜重根系泌氧速率计算,不同苗龄凤眼莲单位鲜重根系分泌氧气速率随苗龄增加呈现极显着差异(P<0.01),不同浓度硝态氮或不同浓度铵态氮水平下,凤眼莲单位根系泌氧速率也无显着性差异。凤眼莲单位根系分泌氧气能力随着苗龄期增加而降低,表现为:苗龄1>苗龄2>苗龄3.用不同生长阶段单位根系泌氧速率中值代表各阶段凤眼莲根系分泌氧气规律:苗龄1单位根系泌氧速率6.92 μmol O2·h-1·g-1 FW(范围:5.44~8.16 μmol O2·h-1·g-1 FW)、苗龄2单位根系泌氧速率4.29 μmol O2·h-1·g-1 FW(范围:3.46~4.78 μmol O2·h-1·g-1 FW)、苗龄3单位根系泌氧速率2.14 μmol O2·h-1·g-1 FW(范围:2.06~2.31 μmol O2·h-1·g-1 FW).
由图 5可知,在不同浓度硝态氮和铵态氮水平下,对照水体DO呈现平缓变化趋势。种植凤眼莲水体中,随着苗龄增加,水体DO具有持续降低趋势。中、大苗龄凤眼莲处理中,不同氮形态、不同浓度水平富营养化水体DO浓度均显着低于未种植凤眼莲的对照水体,中、大苗龄阶段凤眼莲水体DO范围分别为3.02~3.46 mg·L-1、0.98~1.52 mg·L-1.在小苗龄凤眼莲处理中,以硝态氮为主要初始外源氮的水体中,DO浓度范围为3.51~4.54 mg·L-1,也显着低于对照水体,但高于中、大苗龄凤眼莲处理水体DO浓度;以铵态氮为主要初始外源氮的水体中,DO浓度与对照水体相近,也高于中、大苗龄阶段凤眼莲处理水体DO浓度。
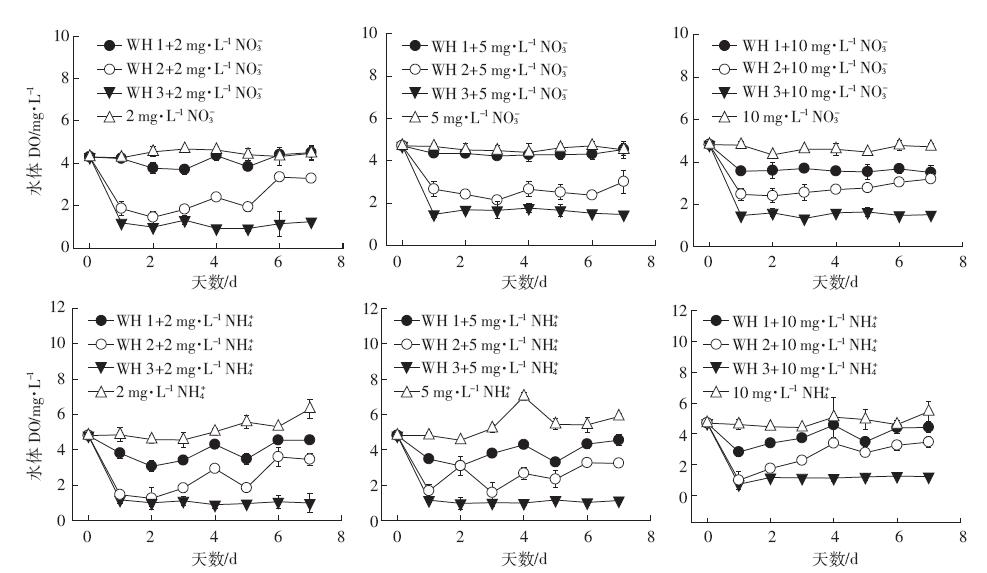
|
| 图 5 各处理中富营养化水体DO 浓度变化规律 Figure 5 Changes of DO concentrations in different treatments |
由图 6、图 7可知,在一周培养期内,不同苗龄凤眼莲根系分泌DOC速率随凤眼莲苗龄增加呈现极显着差异(P<0.01).不同浓度硝态氮或不同浓度铵态氮水平下,凤眼莲根系分泌DOC速率没有显着性差异。凤眼莲根系分泌DOC速率随着苗龄期增加而增加,表现为:苗龄1<苗龄2<苗龄3.用不同苗龄阶段凤眼莲根系分泌有机碳速率中值代表各生长阶段凤眼莲根系分泌DOC规律:苗龄1凤眼莲根系分泌DOC速率0.25 mg·L-1·h-1(范围:0.07~0.44 mg·L-1·h-1)、苗龄2根系分泌DOC速率0.60 mg·L-1·h-1(范围:0.78~0.45 mg·L-1·h-1)、苗龄3根系分泌DOC速率0.92 mg·L-1·h-1(范围:0.84~1.17 mg·L-1·h-1).
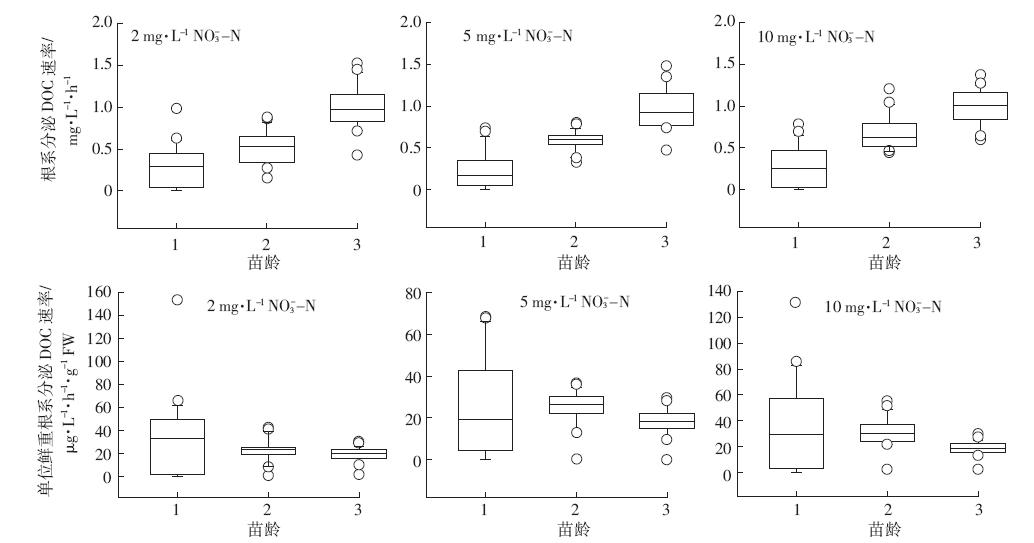
|
| 图 6 不同硝态氮水平下凤眼莲根系分泌有机碳速率 Figure 6 Ratesoforganic carbon release from Eichhornia crassipes roots under differentinitialNO3--N concentrations |
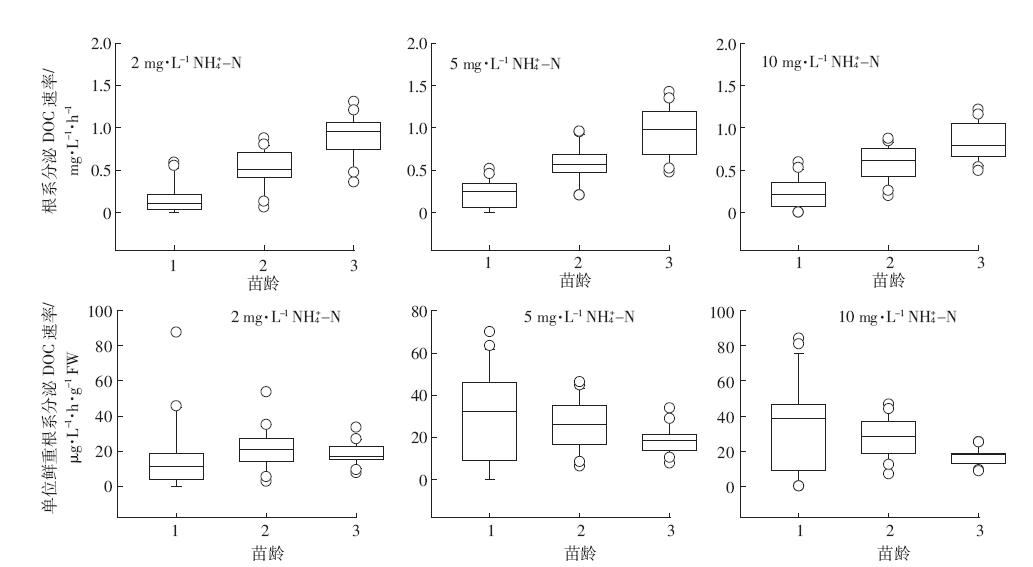
|
| 图 7 不同铵态氮水平下凤眼莲根系分泌有机碳速率 Figure 7 Rates of organic carbon release from Eichhornia crassipes roots under differentinitialNH4+-N concentrations |
凤眼莲根系分泌DOC能力以单位鲜重根系分泌DOC速率计算,凤眼莲单位鲜重根系分泌DOC速率随苗龄增加呈现极显着差异(P<0.01),不同浓度硝态氮或不同浓度铵态氮水平下,单位鲜重根系分泌DOC速率也无显着性差异。凤眼莲单位鲜重根系分泌DOC能力随着苗龄增加而降低,表现为:苗龄1>苗龄2>苗龄3.不同苗龄单位根系分泌DOC速率中值代表各阶段凤眼莲根系分泌DOC规律:苗龄1单位根系分泌速率28.82 μg·L-1·h-1·g-1 FW(范围:3.74~47.97 μg·L-1·h-1·g-1 FW)、苗龄2单位根系分泌DOC速率25.65 μg·L-1·h-1·g-1 FW(范围:22.19~29.69 μg·L-1·h-1·g-1 FW)、苗龄3单位根系分泌DOC速率18.61 μg·L-1·h-1·g-1 FW(范围:14.51~21.61 μg·L-1·h-1·g-1 FW). 3 讨论
本研究明确了凤眼莲具有较强泌氧能力,不同苗龄凤眼莲根系分泌氧气速率随苗龄增加显着(P<0.01)升高(图 3、图 4).刘志宽[13]利用柠檬酸钛比色法研究湿地植物根系泌氧规律,菖蒲根系泌氧速率6.839 μmol O2·h-1·g-1 DW,芦竹根系泌氧速率1.154 μmol O2·h-1·g-1 DW、美人蕉根系泌氧速率3 μmol O2·h-1·g-1 DW,马蹄莲根系泌氧速率4 μmol O2·h-1·g-1 DW[13].将本研究中凤眼莲根系泌氧速率换算为相同单位,得出单位干重根系泌氧速率平均值为26.59 μmol O2·h-1·g-1 DW,凤眼莲根系泌氧速率显着高于其他湿地植物。但以前关于利用凤眼莲净化污水的研究都认为种植凤眼莲降低了水体DO,其实这主要是由于在模拟实验条件下高密度凤眼莲茎叶覆盖水面,而根系泌氧一部分被强烈的根际微生物活动所消耗,未能弥补由于茎叶覆盖所降低的大气复氧过程。另外,随着苗龄增加,水体DO具有持续降低趋势;生长小苗龄凤眼莲水体DO浓度明显高于中、大苗龄凤眼莲生长水体,且在以铵态氮为主要初始外源氮的水体中,DO浓度与对照水体相近。在实际应用凤眼莲净化富营养化湖泊、河流等开放水体时,如果在水域中控制水葫芦覆盖面积,可有效避免大幅度降低水体溶解氧[21].
随凤眼莲苗龄增加,根系泌氧速率增幅减小。这可能是由于凤眼莲在生长前期新根增加,根活性升高,但生长后期,凤眼莲部分根系老化以及根系长度增加,都导致凤眼莲根系泌氧速率趋于平缓。随着根系老化,根细胞壁中产生的蜡和脂肪都会导致根系泌氧能力减弱[22],且随着植物根系长度增加,植物通过光合作用将O2传输到根系的距离增加,导致植物根系泌氧速率降低[23,24].这也相应表现为凤眼莲单位鲜重根系泌氧速率下降,主要是由于凤眼莲根系泌氧增量趋于平缓,但根系生物量持续增加,从而导致单位根系凤眼莲分泌氧气速率减小。Moorhead等[25]使用氧气电极法测定凤眼莲根系泌氧能力同样发现,当凤眼莲根系干重小于0.1 g时,其泌氧能力为3.73 g O2·h-1·kg-1 DW;而当凤眼莲根系干重大于1 g时,其泌氧能力为0.11 g O2·h-1·kg-1 DW,同样说明随着生物量增加凤眼莲根系泌氧能力减小[25].
凤眼莲也具有较强分泌有机碳能力,其根系分泌有机碳速率随苗龄增加显着升高(P<0.01),而单位根系分泌有机碳量却是下降的。由于微生物活动,水体中有机碳分解速率较快,且本实验中容器较小,水体可以视为根际水,水体有机碳含量主要来源于根系分泌的有机碳。植物生长初期生理活动旺盛,根系分泌物量不断增大;随着植物不断成熟,生长速度放慢,但植株生物量仍在不断增长,根系分泌物量仍然呈增长趋势,但增长速度趋于缓慢;随着植物生长,部分根系老化,根系分泌物量呈下降趋势[19].
水生植物可以通过根系泌氧、分泌有机碳调节水体氮生物转化过程。水体中氮生物转化过程主要包括硝化、反硝化反应过程。根据本研究对水体NH4+、NO3--N、NO2--N转化规律分析,富营养化水体发生了硝化、反硝化过程,大量研究表明,模拟实验条件下水体或自然水体均发生硝化、反硝化过程[26].在以不同浓度硝态氮为主要无机氮源条件下,未种植凤眼莲的对照水体呈现NO3--N浓度持续下降、NO2--N浓度持续上升趋势,因为NO2--N是反硝化脱氮过程重要中间产物,表明本研究所用富营养化水体发生着反硝化过程(图 1);以不同浓度铵态氮为主要无机氮源条件下,对照水体呈现NH4+-N浓度持续下降、NO3--N浓度持续上升趋势,在没外界因素影响条件下,说明本研究所用富营养化水体发生硝化过程(图 2).
反硝化反应过程本质是微生物利用水体硝态氮为电子受体分解有机碳的过程,同时硝态氮还原为亚硝态氮再进一步还原为N2O或N2,所以反硝化过程需要适量有机碳[27,28].硝化反应是在氧气适量供应条件下微生物将水体铵态氮氧化为硝态氮的过程[29];在生长水生植物情况下,水生植物根系分泌氧气和有机碳能力对水体硝化-反硝化脱氮过程起着极为重要的作用。
本实验中,不同浓度硝态氮水平下种养中、小苗龄凤眼莲的水体以及不同浓度铵态氮水平水体的铵态氮在实验开始第1 d显着下降而硝态氮明显上升(图 1、图 2).这可能是由于实验容器为一个1 L烧杯,容量较小,而凤眼莲根系占水体大部分空间,水体可视为根际水,这就为硝化作用提供了良好环境,故实验开始时水体铵态氮几乎全部转换为硝态氮,在没有外界氮来源情况下,说明水体发生了明显硝化作用。硝化过程中,氧化1 mg NH4+-N需要消耗4.3 mg O2[30],所以高的根系泌氧能力有利于硝化过程进行,不同浓度硝态氮、铵态氮水平条件下,实验第1 d水体铵态氮几乎全部转换为硝态氮,但是水体硝态氮累计量却随着苗龄增加而减少。这可能是由于凤眼莲对水体氮吸收导致。
根系分泌有机碳为反硝化过程提供碳源,所以凤眼莲根系分泌有机碳量对反硝化过程有着极其重要的作用。随着苗龄增加根系分泌有机碳量增加而水体中亚硝态氮含量减少,说明高的有机碳分泌量会促进反硝化过程进行。Reddy等[31] 实验表明在富营养化水体溶解氧充足条件下,水体铵态氮不断减少而硝态氮含量持续增加。而种植大苗龄凤眼莲富营养化水体氨氮浓度持续降低,并没有发生中、小苗龄硝态氮累积,且随着苗龄增加硝态氮累积量减少,可能是由于随着苗龄增加凤眼莲根系分泌氧气、有机碳速率增加,为水体耦合硝化-反硝化作用提供了很好条件,且大苗龄阶段凤眼莲对水体氮吸收能力升高。因此,旺盛生长期凤眼莲通过促进硝化-反硝化过程及植物体主动吸收氮高效净化污水。近期研究也发现,大型水生植物Potamogeton perfoliatus根系可以通过分泌氧气和有机碳在根际的微域环境为耦合硝化-反硝化过程提供良好环境[32,33],且凤眼莲对水体氮、磷去除速率受凤眼莲自身生物量影响,富营养化水体氮损失率与凤眼莲苗龄呈现显着正相关关系[34],大苗龄凤眼莲对水体氮去除率更高。 4 结论
凤眼莲根系具有较强泌氧及分泌有机碳能力,不同苗龄凤眼莲根系分泌氧气和有机碳的速率随苗龄增加显着升高,而单位根系分泌氧气和有机碳的能力随苗龄增加呈现降低趋势。小、中、大三个苗龄凤眼莲根系分泌氧气速率分别达56.19、93.15、106.32 μmol O2·h-1,分泌有机碳速率分别达0.25、0.60、0.92 mg·L-1·h-1.凤眼莲根系泌氧过程虽然能够增加水体溶解氧,但随着苗龄增加,凤眼莲茎叶覆盖水面抑制大气复氧过程,同时根际微生物活动强烈消耗溶解氧,因此表现出随苗龄增加水体溶解氧浓度下降的趋势。水体氮去除率随着凤眼莲苗龄增加而增加,这除了与凤眼莲吸收作用有关外,还因为其泌氧和分泌有机碳总量增加促进了硝化、硝化-反硝化过程,从而高效地净化水体外源氮负荷。
| [1] | Willian J J. The role of water plant in water treatment[J]. Agricultural Engineering, 1986, 57(6):9-10. |
| [2] | 袁东海, 高士祥, 任全进, 等. 几种挺水植物净化生活污水总氮和总磷效果的研究[J]. 水土保持学报, 2004, 18(4):77-80. YUAN Dong-hai, GAO Shi-xing, REN Quan-jin, et al. Study on purified efficiency of phosphorus and nitrogen from domestic sewage by several macrophytes in vertical flow constructed wetlands[J]. Soil and Water Conservation, 2004, 18(4):77-80. |
| [3] | 章志琴, 方弟安, 徐卫红, 等. 荷花和睡莲对景观水净化的效果研究[J]. 江苏农业科学学报, 2009(5):320-322. ZHANG Zhi-qin, FANG Di-an, XU Wei-hong, et al. Study on effect of lotus and lily on landscape water purification[J]. Jiangsu Journal of Agricultural Sciences, 2009(5):320-322. |
| [4] | 李文朝. 富营养水体中常绿水生植被组建及净化效果研究[J]. 中国环境科学, 1997, 17(1):43-57. LI Wen-chao. Construction and purification efficiency test of an ever-green aquatic vegetation in an eutrophic lake[J]. China Environment Science, 1997, 17(1 ):43-57. |
| [5] | 朱夕珍, 肖 乡, 刘 怡, 等. 植物在城市生活污水人工土快滤处理床的作用[J]. 农业环境科学学报, 2003, 22(5):582-584. ZHU Xi-zhen, XIAO Xiang, LIU Yi, et al. Role of plants in a rapid infiltration filter made of artificial soil for treating municipal sewage[J]. Journal of Agro-Environment Science, 2003, 22(5):582-584. |
| [6] | 窦鸿身, 濮培民, 张圣照, 等. 太湖开阔水域凤眼莲的放养实验[J]. 植物资源与环境学报, 1995, 4(1):54-60. DOU Hong-shen, PU Pei-min, ZHANG Sheng-zhao, et al. An experimental study on culture of Eichhornia crassipes(Mart.) Solms on open area of Taihu Lake[J]. Journal of Plant Resources and Environment, 1995, 4(1):54-60. |
| [7] | Gao Y, Yi N, Wang Y, et al. Effect of Eichhornia crassipes on production of N2 by denitrification in eutrophic water[J]. Ecological Engineering, 2014, 68:14-24. |
| [8] | Eriksson P G, Weisner S E B. An experimental study on effects of submersed macrophytes on nitrification and denitrification in ammonium rich aquatic systems[J]. Limnology and Oceanography, 1999, 44:1993-1999. |
| [9] | Eriksson P G, Weisner S E B. Functional differences in epiphytic microbial communities in nutrient rich fresh water ecosystems:An assay of denitrifying capacity[J]. Freshwater Biology, 1996, 36(3):555-562. |
| [10] | Körner S. Nitrifying and denitrifying bacteria in epiphytic communities of submerged macrophytes in a treated sewage channel[J]. Acta Hydro-chimicaet Hydrobiol, 1999, 27:27-31. |
| [11] | 张 鸿, 陈光荣, 吴振斌, 等. 两种人工湿地中氮、磷净化率与细菌分布关系的初步研究[J]. 华中师范大学学报(自然科学版), 1999, 33(4):575-578. ZHANG Hong, CHEN Guang-rong, WU Zhen-bin, et al. The study on the relationship between N, P removing rates and the distribution of bacteria in two artificial wetlands[J]. Journal of Central China Normal University(Natural Science), 1999, 33(4):575-578. |
| [12] | 吴小慧, 张 勇, 何 岩, 等. 污染水体净化与生态修复中水生植物光合、呼吸特性研究进展[J]. 净水技术. 2009, 28(6):5-7. WU Xiao-hui, ZHANG Yong, HE Yan, et al. Progress on photosynthesis/respiratory characteristics of aquatic plants for polluted water-body purification and ecological remediation[J]. Water Purification Technology, 2009, 28(6):5-7. |
| [13] | 刘志宽. 湿地植物根系泌氧及其对滇池N、P营养物去除的影响研究[D]. 太原:太原理工大学, 2010:41-42. LIU Zhi-kuan. Research on ROL of wetland plants and its impact on removal of N, P nutrient in Dianchi[D]. Taiyuan:Taiyuan University of Technology, 2010:41-42. |
| [14] | Giraldo E, Garzon A. The potential for water hyacinth to improve the quality of bogota river water in the muna reservoir:Comparison with the performance of waste stabilization ponds[J]. Water Science and Technology, 2002, 42(1):103-110. |
| [15] | 杨善元, 俞子文, 孙文浩. 凤眼莲根系中抑藻物质分离与鉴定[J]. 植物生理学报, 1992, 18(4):399-402. YANG Shan-yuan, YU Zi-wen, SUN Wen-hao. Isolation and identification of antialgal compounds from root system of water hyacinth[J]. Acta Phytophysiologica Sinica, 1992, 18(4):399-402. |
| [16] | Ofosu-budu K G, Fuita K. Excretion of ureide and other nitrogenous compounds by the root of soybean at different growth stage[J]. Plant and Soil, 1990, 128(2):135-142. |
| [17] | Francisco J. Root exudates of wild oats:Allelopathic effect on spring wheat[J]. Phytochemistry, 1991, 30(7):2199-2202. |
| [18] | 国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京:中国环境科学出版社, 2002. State Environmental Protection Administration. Methods for the monitoring and analysis of water and wastewater[M]. 4th Edition. Beijing:China Environmental Science Press, 2002. |
| [19] | 陆松柳, 张 辰, 徐俊伟. 植物根系分泌物分析及对湿地微生物群落的影响研究[J]. 生态环境学报, 2011, 20(4):676-680. LU Song-liu, ZHANG Chen, XU Jun-wei. Root exudates of wetland plants and the influence on the microbial community in constructed wetlands[J]. Ecology and Environmental Sciences, 2011, 20(4):676-680. |
| [20] | Kludze H K, Delaune R D, Patrick W H. Aerenchyma formation and methane and oxygen exchange in rice[J]. Soil Science Society of America Journal, 1993, 51:368-391. |
| [21] | 吴富勤, 申仕康, 王跃华, 等. 凤眼莲种植对滇池水体环境质量的影响[J]. 生态科学, 2013, 32(1):110-114. WU Fu-qin, SHEN Shi-kang, WANG Yue-hua, et al. Effect of Eichhornia crassipes plantation on water quality in the Dianchi Lake[J]. Ecological Science, 2013, 32 (1):110-114. |
| [22] | Armstrong W. The use of polarography in the assay of oxygen diffusing from roots in anaerobic media[J]. Physiologia Plant, 1967, 20(3):540-553. |
| [23] | Armstrong W. Radial oxygen loses from intact rice roots as affected by distance from the apex, respiration and water logging[J]. Physiologia Plant, 1971, 25(2):192-197. |
| [24] | Luxmoore R J, Stolzy L H. Oxygen diffusion in the soil-plant system Ⅵ. A synopsis with commentary[J]. Agronomy Journal, 1972, 64(6):725-729. |
| [25] | Moorhead K K, Reddy K R. Oxygen transport through selected aquatic macrophytes[J]. Journal of Environmental Quality, 1988, 17(1):138-142. |
| [26] | 吴雅丽, 许 海, 杨桂军, 等. 太湖水体氮素污染状况研究进展[J]. 湖泊科学, 2014, 26(1):19-28. WU Ya-li, XU Hai, YANG Gui-jun. Progress in nitrogen pollution research in Lake Taihu[J]. Journal of Lake Science, 2014, 26(1):19-28. |
| [27] | Seitzinger S P, Harrison J A, Bohlke J K, et al. Denitrification across landscapes and waterscapes:A synthesis[J]. Ecological, 2006, 16(6):2064-2090. |
| [28] | Knowles R. Denitrification[J]. Microbiological Reviews, 1982, 46(1):43-70. |
| [29] | Focht D D, Chang A C. Nitrification and denitrification processes related to wastewater treatment[J]. Advances in Applied Microbiology, 1975, 19:53-86. |
| [30] | Barnes D, Bliss P J. Theory of nitrification:In Biological control of nitrogen in wastewater treatment[J]. Chemical Technology and Biotechnology, 1983, 29-47. |
| [31] | Reddy K R, Dangelo E M, DeBusk T A. Oxygen transport through aquatic macrophytes:The role in wastewater treatment[J]. Environmental Quality, 1989, 19(2) :261-267. |
| [32] | Caffrey J M, Kemp W M. Influence of the submerged plant, Potamogeton perfoliatus, on nitrogen cycling in estuarine sediments[J]. Limnology and Oceanography, 1992, 37(7):1483-1495. |
| [33] | Weisner S E B, Eriksson P G, Graneli W, et al. Influence of macrophytes on nitrate removal in wetlands[J]. Ambio, 1994. 23(6):363-366. |
| [34] | DeBusk T A, Peterson J E, Ramesh Reddy K. Use of aquatic and terrestrial plants for removing phosphorus from dairy wastewaters[J]. Ecological Engineering, 1995, 5(2):371-390. |
 2014, Vol. 33
2014, Vol. 33