文章信息
- 张苗苗, 沈菊培, 贺纪正, 张丽梅
- ZHANG Miao-miao, SHEN Ju-pei, HE Ji-zheng, ZHANG Li-mei
- 硝化抑制剂的微生物抑制机理及其应用
- Microbial Mechanisms of Nitrification Inhibitors and Their Application
- 农业环境科学学报, 2014, 33(11): 2077-2083
- Journal of Agro-Environment Science, 2014, 33(11): 2077-2083
- http://dx.doi.org/10.11654/jaes.2014.11.001
-
文章历史
- 收稿日期:2014-4-8
2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
土壤氮循环是生命元素生物地球化学循环的重要组成部分,主要由固氮作用、氨化作用、硝化作用和反硝化作用组成,其中硝化作用是铵态氮在微生物的作用下经氨氧化和亚硝酸盐氧化两步反应转化为硝酸盐的过程,在土壤生态系统中普遍发生。硝化作用的产物硝酸盐(NO3-)在土壤中易迁移和淋溶,是导致我国农业氮肥利用率低下以及地表水和地下水污染的主要原因[1]。此外,硝化作用与温室气体如氧化亚氮(N2O)等的排放、土壤酸化及次生盐渍化等问题也都密切相关。
硝化抑制剂通过选择性抑制土壤硝化微生物的活动,可有效减缓土壤中铵态氮向硝态氮的转化,是农业生产中常用的提高氮肥利用率和减少硝化作用负面效应的一种有效的管理方式。硝化抑制剂种类多样,主要有氰胺类、含氮杂环化合物、含硫化合物、烃类及其衍生物四大类,其中农业生产中常用的包括双氰胺(Dicyandiamide,DCD)、3,4-甲基吡唑磷酸盐(3,4-dimethylpyrazole phosphate,DMPP)、2-氯-6-三氯甲基吡啶(Nitrapyrin)和乙炔(C2H2)等。有关硝化抑制剂的种类、筛选和应用效果等已有较多的综述[2,3,4]。近年来,随着分子生态学技术的发展及其在农业科学研究中的应用,使得人们可以从分子水平认识和研究硝化过程及其抑制机理。本文对常用硝化抑制剂的特征及其在农业和科学研究中的应用进行了简要综述,并重点论述了不同硝化抑制剂对氨氧化细菌和氨氧化古菌的作用效果及其机理,以期为深刻理解和认识硝化抑制剂的作用机理,并为硝化抑制剂的开发、筛选和应用提供指导依据。 1 参与硝化作用的主要微生物
硝化作用的第一个反应步骤——氨氧化作用,是硝化作用的限速反应步骤,也是硝化抑制剂作用的靶向环节。过去研究一直认为氨氧化作用主要由化能自养的细菌(Ammonia-oxidizing bacteria,AOB)所催化。但自2004年以来,通过宏基因组学和富集培养等的研究发现,古菌域中的微生物也具有催化氨氧化作用的能力,是一些土壤中硝化作用的主要驱动者,这类微生物被称为氨氧化古菌(Ammonia-oxidizing archaea,AOA)[5,6,7]。AOB和AOA都含有催化氨氧化进行的关键酶——氨单加氧酶(Ammonia monooxygenase,AMO)。AMO是一种活性位点上含有Cu的单加氧酶,底物范围非常广泛,除氨外,甲烷、苯、甲硫醚等40多种化合物均可作为AMO的氧化底物[2]。AOA和AOB的AMO并不完全相同,AOB的AMO是由amoC、amoA和amoB 3个亚基组成的三聚体膜结合蛋白[8],其中amoA亚基含有该酶的活性位点,可催化氨(NH3)氧化成羟胺(NH2OH),羟胺再经由羟胺氧化还原酶(Hydroxylamine oxidoreductase,HAO)作用生成NO2-;而AOA的AMO基因中并不一定同时含有编码amoA、amoB和amoC 3个亚基的基因,但含有编码amoA亚基的基因[5],说明AOA和AOB二者的AMO氨基酸序列可能不同,此外,在AOA中检测不到HAO基因,同时AOA也缺少编码细胞色素c的基因[9,10],而细胞色素c对AOB氨氧化过程中的电子传递具有重要意义,表明AOA与AOB的氨氧化过程可能存在着差异。这些分子水平上的差异可能是导致两类氨氧化微生物对不同类型的硝化抑制剂出现不同响应的主要原因。
除了上述专性化能自养型氨氧化细菌和古菌外,许多异养微生物如微藻类、放线菌、真菌和细菌等也可进行异养硝化作用。如在纯培养条件下,异氧硝化微生物Thiosphaera pantotropha的硝化速率最高可达93.9 nmol NH3·min-1·mg-1 蛋白 [11]。但在自然生态系统中,仅发现在一些硝化作用较弱的酸性森林土壤或含水率较高的土壤中硝酸盐主要来自异养微生物对无机氮的转化[12,13,14],因此一般认为异养微生物对硝化作用的贡献较少。目前也发现氨氧化古菌Nitrososphaera viennensis在富积培养条件下能够进行自养和异养混合型生长[15],但目前对生态系统中氨氧化古菌的异养硝化潜能如何仍不清楚。
因此,目前对硝化抑制剂的筛选主要是依据其对氨氧化细菌和氨氧化古菌AMO的影响和作用来进行的。 2 常用硝化抑制剂在农业生产中的应用及其微生物抑制机理
目前农业中常用的硝化抑制剂包括双氰胺(DCD)、3,4-甲基吡唑磷酸盐(DMPP)、2-氯-6-三氯甲基吡啶(Nitrapyrin)、乙炔等,均具有成本低、效率高、安全方便和对环境影响小的特点。农业中通常将硝化抑制剂与肥料混包生产或与氮肥(如尿素、硫酸铵等)同时施用,对提高土壤氮肥肥效、减少硝酸盐淋溶损失、降低温室气体尤其是氮氧化物的排放、提高作用产量等方面具有显著成效。 2.1 DCD
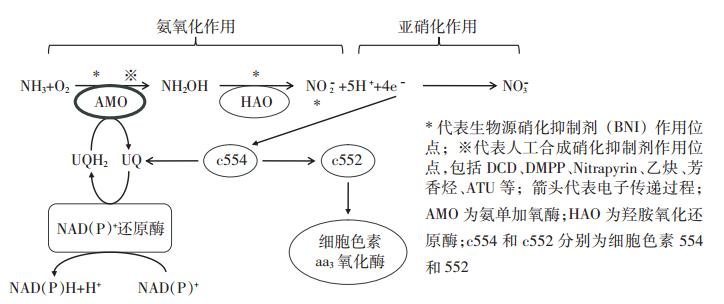
DCD是氰胺类硝化抑制剂的典型代表,其硝化抑制效果显著,价格低廉,不易挥发,且容易加入肥料生产线,因此在国内外农业生产中得到广泛应用。早期研究认为,DCD结构中的功能团C≡N可与细菌呼吸酶中的巯基或重金属基团发生反应,抑制氨氧化细菌呼吸作用中的电子转移和干扰细胞色素氧化酶功能,从而抑制硝化作用[16]。但进一步研究发现,DCD对细胞色素氧化酶和微生物呼吸作用没有显著影响,其对硝化作用的抑制作用主要是因为DCD结构中含有与NH3结构相似的氨基(-NH2)和亚氨基(=NH),可使DCD以底物竞争的形式干扰氨氧化微生物对底物的利用,从而抑制硝化作用(图 1)[17,18]。
大量田间应用研究表明,DCD可显著抑制土壤硝化作用,减少NO3-的淋溶及N2O的排放。如Zaman等[19]研究发现,施用7~10 kg·hm-2 DCD后,春季和秋季土壤中NO3-的淋溶损失分别降低10%~26%和55%~57%,N2O排放量降低47%和37%~53%。此外,Linquist等[20]发现,施用10~30 kg·hm-2 DCD不仅使土壤N2O释放量减少了20%~40%,土壤CH4释放量也减少了12%~25%。对土壤微宇宙培养进行的研究发现,施用50 mg·kg-1的DCD可显著抑制不同类型土壤,包括我国南方酸性红壤、新西兰高氮草地土壤等的硝化作用,并显著抑制氨氧化古菌或氨氧化细菌的数量[7,21]。但Monaghan等[22]却发现10 kg·hm-2 DCD对新西兰冬季牧场土壤中NO3-的淋溶没有显著影响,他们认为这可能是因为DCD施用时间不当或大量矿化氮素滞留在更深层土壤而未随排水系统排出。Dai等[23]也发现,向放牧农场土壤中同时施入尿素(50 kg N·hm-2)和DCD 10 kg·hm-2并不能抑制土壤硝化作用,且DCD对氨氧化古菌和细菌的数量和群落组成也无显著影响。导致这些案例中DCD抑制效果出现差异的原因,除了土壤含水量、有机质含量、土壤pH和土壤类型等理化因素的影响外,更重要的原因可能在于不同土壤中优势氨氧化菌群对DCD的敏感性和要求的剂量不一致。如对实验室富集培养菌株的研究发现,当培养液中DCD浓度为100 μmol·L-1时,氨氧化细菌Nitrosospira multiformis的硝化作用即被完全抑制[16];而1 mmol·L-1 DCD对氨氧化古菌Nitrosotalea devanaterra培养体系中NO2-累积的抑制效率仅为33%,当DCD浓度为5 mmol·L-1时才可完全抑制其中NO2-的累积[24]。这些结果表明,不同氨氧化微生物对DCD的抗性和耐性存在明显差异,由于不同土壤中氨氧化微生物的优势类群不同,DCD在不同土壤中表现出的作用效果也不同。 2.2 DMPP
DMPP迁移性较低,不易与土壤NH+4分离,通常与氮肥或粪肥同时施用。目前关于DMPP对硝化作用抑制机理的研究较少,尚无定论。有学者认为,DMPP仅抑制氨氧化过程中NH3向羟胺(NH2OH)的转化过程,并不影响后续的羟胺氧化为亚硝酸盐(NO2-)的过程(图 1)[25]。
DMPP价格较DCD高,但其抑制效率要远高于DCD,1 kg·hm-2 DMPP的用量即可获得相当10 kg·hm-2 DCD用量的抑制效果,且前者一次施入的抑制效果可持续4~10周[26,27]。如Di等[26]研究发现,施加牛尿土壤中,1 kg·hm-2 DMPP和10 kg·hm-2 DCD可使土壤NO3-淋溶从628.6 kg NO3--N·hm-2分别降低至400.6、451.5 kg NO3--N·hm-2,5 kg·hm-2 DMPP和10 kg·hm-2 DCD可使土壤N2O释放量从1.14 kg N2O-N·hm-2分别降低至0.43、0.39 kg N2O-N·hm-2。同时,施加DMPP可显著抑制AOB的生长,改变其群落结构,但对AOA无显著影响[28]。这可能与土壤中起主导作用的氨氧化微生物类群有关。DMPP对作物质量提高和产量增加也有一定作用,例如,1.8 kg·hm-2 DMPP可分别提高水稻及油菜产量5.3%和7.4%[29]。但和其他的抑制剂一样,DMPP的抑制效率也受到很多因素如土壤孔隙充水率(WFPS)[30]和土壤温度[31]等的影响。Barth等[32]采用多元回归分析也发现,土壤质地、pH和土壤微生物学参数(如过氧化氢酶活性)等均可影响DMPP在土壤中的吸附和抑制效率。 2.3 Nitrapyrin
Nitrapyrin也是AMO的一种催化底物,但由于Nitrapyrin对AMO的亲和能力并不强,底物竞争并不是其抑制硝化作用的直接原因。有研究认为Nitrapyrin可能是通过氧化产物6-氯嘧啶羧酸螯合AMO活性位点上的Cu来抑制硝化作用(图 1)[2,33]。
Nitrapyrin是一种白色晶状固体物质,难溶于水,在农业应用中有乳油剂和水乳剂两种剂型。在美国,Nitrapyrin被广泛应用于中西部玉米种植区,表现出明显的增产效果。大量研究报道表明,除显著减少地表径流中氮素流失和抑制N2O释放外,施用Nitrapyrin还可提高蔬菜产量,降低蔬菜中硝酸盐含量[34]。同样,Nitrapyrin的抑制效果也受多种因子包括土壤水分、温度、降雨量和土壤铵态氮浓度的影响,且其对硝化作用的抑制效果还与土壤类型有关。例如,当Nitrapyrin浓度为土壤纯氮量的0.1%~0.4%时,对砂土硝化抑制效率为55.6%~91.4%,而对粘土的硝化抑制效率则仅为18.5%~50.9%[35]。
Nitrapyrin对不同氨氧化微生物的抑制效果也不同。Shen等[36]对氨氧化古菌N. viennensis和氨氧化细菌N. multiformis的富集培养物进行的研究发现,即使培养液中Nitrapyrin浓度达最大溶解度(173 μmol·L-1)时,对N. multiformis仍无显著抑制效果,但当其浓度为118 μmol·L-1时对N. viennensis硝化活性的抑制效率可达50%。但也有研究发现,10 μmol·L-1的Nitrapyrin即可显著甚至完全地抑制另一株氨氧化古菌N. devanaterra的生长及活性[24];1~40 μmol·L-1的Nitrapyrin即可完全抑制多株亚硝化单胞菌属和亚硝化螺菌属氨氧化细菌的硝化作用,且不同菌株对Nitrapyrin的响应不同[37]。不同的氨氧化微生物菌株对Nitrapyrin的敏感程度差异较大,可能是导致该抑制剂在不同土壤中抑制效果差别较大的原因之一。
由于Nitrapyrin易挥发和光解,且具有较高的蒸汽压,在施用和储存上具有一定的不便;而且Nitrapyrin是一种有机氯化合物,施用量过大时,易对环境和作物造成一定的负面影响,在应用时应考虑到这些问题。 2.4 乙炔
乙炔(C2H2)是一种非常高效的硝化抑制剂。当分压为0.1 Pa时,乙炔即可显著抑制硝化作用;当分压为10 Pa时,则可完全抑制硝化作用[38]。乙炔对于硝化作用的抑制是一种非竞争性且不可逆的抑制,它作为AMO的底物,参与催化氧化,生成不饱和环氧化物。由于该环氧化物具有高活性,可与催化氧化反应的蛋白质发生共价结合使其失活,从而抑制硝化作用(图 1)[39]。研究发现,乙炔仅破坏单一蛋白质,当去除乙炔抑制之后,土壤硝化作用可迅速恢复[40]。
乙炔的高效抑制作用可能与两类主要的氨氧化微生物AOA和AOB均对其非常敏感有关。在微宇宙培养条件下,10 Pa及100 Pa乙炔均可完全抑制土壤硝化作用及AOA和AOB的生长[41,42]。尽管乙炔抑制硝化作用的活性较高,但因其在常温常压下是气体,难以直接应用于实际生产。故此,农业中通常用石蜡或其他材料包被碳化钙(CaC2)制得ECC(包被碳化钙,Encapsulated calcium carbide),ECC可在土壤中水解缓慢释放乙炔,抑制硝化作用。已有研究报道,施用ECC可显著提高作物对土壤氮素的利用率(61.1%)并增加作物产量[43]。同时,ECC水解释放出的乙炔可在微生物作用下还原生成植物激素乙烯(C2H4),而乙烯是一种作物生长调节激素,对作物的各个生长阶段均有重要意义[44]。但ECC抑制作用的有效性受土壤条件影响很大,在粘粒和有机质含量较高的土壤中,施用效果较差;当土壤水分含量较高时,也会影响乙炔在土壤中的扩散,从而影响其硝化抑制作用[45]。
除乙炔外,其他的炔烃及其衍生物也具有硝化抑制作用,但不同的碳(C)链长度对AOA和AOB的抑制效果是不同的,属于选择性抑制。Taylor等[46]研究发现,C链长度为3~4、浓度为5 μmol·L-1炔烃可部分抑制AOB(N. europaea和N. multiformis)的生长及硝化活性,而同样浓度下,C链长度小于2和大于5的炔烃则可完全抑制这两株纯培养AOB的生长。对AOA纯培养菌株的研究则得出不同的结论:C链长度为2~5、浓度为20 μmol·L-1的炔烃均可显著甚至完全抑制AOA(Nitrosopumilus maritimus)的生长,但随C链长度增加,同样浓度的炔烃对该菌株硝化作用的抑制效果显著降低甚至丧失,土壤培养实验也得出与此相似的结果。 2.5 芳香烃及其衍生物
由于芳香族化合物难降解,可在微生物作用强烈的热带地区持续稳定发挥抑制作用,曾有建议将芳香族化合物作为硝化抑制剂应用于热带地区的农业生产[47]。芳香族化合物对硝化作用的抑制是一种竞争性抑制,其可与NH3竞争AMO的活性位点,并作为底物参与催化氧化,从而抑制硝化作用。例如,苯可被AMO催化氧化生成苯酚,从而抑制AOB N. europaea的硝化活性[48]。不同化学结构的芳香族化合物对硝化作用的抑制效果不同。Zhang等[49]对近50种代表了硝基、氨基和羟基芳香化合物的研究发现,大多数芳香族化合物均可抑制土壤硝化作用,且抑制效果与抑制剂的化学结构有关。间位上为硝基(-NO2)、氨基(-NH2)或羟基(-OH)基团的硝基芳香化合物,以及苯环上带有硝基基团或氯原子(-Cl)、或对位上为羟基基团的氨基芳香化合物对硝化作用的抑制效率最高,可能与基团种类及其位置可导致抑制剂结构上的电荷分布及电离常数(pKa)发生变化有关。他们还发现,芳香族硝化抑制剂在草甸棕壤中的抑制效果要优于在棕壤和褐土中的抑制效果,只有当芳香族抑制剂浓度大于0.5 mg·kg-1时方可在棕壤及褐土中表现出硝化抑制效果。Puttanna等[47]通过模拟热带条件在30 ℃下进行室内微宇宙培养实验发现,间硝基苯胺、邻硝基苯酚和苯并三唑均可显著抑制沙壤土中的硝化作用,抑制效率分别为95%、89.4%和77.8%。但是由于多数芳香族化合物具有毒性、致癌、致突变等问题,在将其作为硝化抑制剂应用之前还需进行严格的生态毒理研究和风险评价。 2.6 其他
除了上述人工合成硝化抑制剂在农业生产中具有重要意义以外,农业生态系统中也发现有生物硝化抑制作用(Biological nitrification inhibition,BNI)。这是植物根系与土壤间的一种交互作用,植物根系通过分泌特殊的化合物,抑制土壤硝化作用[50]。这种抑制作用在热带放牧草场中十分普遍,在高粱根系也有同样的发现[51]。研究证明,非洲湿生臂形牧草Brachiaria humidicola以及高粱的根系分泌物樱花素(Sakuranetin)和高粱醌(Sorgoleone)可同时抑制氨氧化和羟胺氧化过程[51,52],另一种高粱根系分泌物对羟基苯丙酸甲酯[MHPP,methyl 3-(4-hydroxyphenyl)propionate]则仅能抑制AMO催化氧化过程(图 1)[53]。有些生物硝化抑制剂还可以扰乱硝化微生物中HAO与辅酶、细胞色素之间的电子传递(图 1)[50]。
关于生物硝化抑制作用目前尚处于发现阶段,其在农业生产中应用的研究还不多,但这可能是以后控制农田氮素流失的一种有效途径[50]。 3 硝化抑制剂在科学研究中的应用
利用硝化抑制剂对硝化微生物和硝化作用专一性和高效性抑制的特点,硝化抑制剂在验证氨氧化微生物的功能活性,揭示氨氧化过程的内在机理等研究中也发挥了重要作用。
DCD和乙炔等由于其良好的抑制效果经常用于实验室氨氧化微生物功能研究。如利用乙炔对氨氧化微生物的自杀式利用的原理,Offer等[42]在微宇宙培养体系中加入不同浓度的乙炔后进行培养,发现乙炔处理的土壤中硝化作用和氨氧化古菌的生长均受到明显抑制,与对照土壤(不加乙炔处理)完全相反,间接地证实了氨氧化古菌在该土壤硝化作用中的重要贡献;Jia等[41]利用稳定性同位素探测技术结合添加乙炔处理进行培养实验,发现在一处pH近中性的农田土壤中,AOB的数量在施氮肥后明显增加且与土壤硝化活性呈正相关,而乙炔能显著抑制这种增加,AOA则无此响应,揭示了该土壤中是AOB而不是AOA在硝化作用中起着关键的作用。Di等[21]利用DCD对新西兰高氮草地土壤的研究得到类似的结论,发现加DCD后土壤硝化作用和AOB受到明显抑制,但对AOA无明显影响。而Zhang等[7]利用DCD培养并结合稳定同位素技术得出氨氧化古菌在强酸性土壤硝化作用中占据主导地位的结论。这些研究共同揭示了AOA和AOB具有明显分化的生态位特征,即在高氮投入的pH中性和碱性的环境中,AOB是硝化作用的主要驱动者,而AOA则主要在较苛刻的环境包括低氮和强酸性环境中发挥功能活性。这些研究极大地丰富了人们对硝化作用机理的认识。
烯丙基硫脲(Allylthiourea,ATU)是一种非竞争性的含硫(S)类硝化抑制剂,由于具有化学毒性而难以在农业中使用,但却是一种实验室研究中常用的硝化抑制剂。一般来讲,含有C=S或P=S结构的含S化合物如硫代硫酸盐、含硫氨基酸、磺酸盐和硫代氨基甲酸酯等,均具有硝化抑制作用,但它们的硝化抑制机理因各自化学结构不同而不同。ATU的C=S位处中间,可以单齿配体的形式与AMO活性中心铜(Cu)发生螯合作用,从而抑制硝化作用(图 1)[2]。对富集培养物的研究发现,当ATU浓度为1 μmol·L-1时,对硝化作用的抑制效率可达到80%;ATU浓度为8~80 μmol·L-1时,即可显著或完全抑制AOB的生长及活性[54]。但ATU对AOA的抑制效果相对较弱,如在N. devanaterra的液体富集培养体系中,当ATU浓度为100 μmol·L-1时,硝化作用的抑制效率为85%,但对AOA丰度的抑制效率仅为32%[24];ATU对 N. devanaterra的半数效应浓度EC50为193.3 μmol·L-1,约为其对AOB(N. multiformis)的1000倍[36]。可见,抑制土壤中AOA的生长及活性需要更高浓度的ATU。 4 展望
综上所述,目前已发现的各种硝化抑制剂,包括人工合成和生物源硝化抑制剂,主要通过与氨氧化微生物的AMO竞争底物、螯合AMO的活性位点或被AMO氧化后的产物抑制其他蛋白质等作用方式抑制硝化作用。硝化抑制剂除在农业生产中起到提高氮肥肥效和作物产量、减少硝酸盐淋溶和N2O排放等作用外,在硝化作用的微生物学机理研究中也发挥了重要作用。
目前对有些硝化抑制剂(如DMPP、Nitrapyrin)的作用机理尚有争议。在今后的研究中应结合分子生物学及生物化学的方法对硝化抑制机理进行深入研究,以便更好地对其进行评估和使用。其次,硝化抑制剂的使用效果受到多种因素如土壤类型、土壤pH、温度、湿度等的影响,导致硝化抑制剂在实际应用中效果不佳。同时,对硝化微生物生理和生态学的研究揭示了不同氨氧化微生物类群对各种硝化抑制剂的响应及敏感程度并不相同,而不同土壤含有的氨氧化微生物优势类群不同,可能是硝化抑制剂在不同土壤中抑制效果存在差异的根本原因。因此,今后的研究应进一步加强抑制剂对硝化微生物的影响及其作用机理方面的研究,尤其应当注重结合传统微生物学方法(如分离或富集培养纯菌株)与分子生态学方法,在加强对AOB和AOA纯培养菌株比较研究的同时,深入探究不同土壤硝化微生物的组成及其对硝化抑制剂施用的响应特征。在此基础上,对硝化抑制剂进行优化或筛选,根据土壤理化特征和微生物学特征的差异,因地制宜、有针对性地选用适宜的硝化抑制剂,才能达到改善硝化抑制效率、减少氮肥流失和保护环境的目的。
| [1] | Farmaha B S. Evaluating Animo model for predicting nitrogen leaching in rice and wheat[J]. Arid Land Research and Management, 2014, 28(1):25-35. |
| [2] | McCarty C W. Modes of action of nitrification inhibitor[J]. Biology and Fertility of Soils, 1999, 29(1):1-9. |
| [3] | 孙志梅, 武志杰, 陈利军, 等. 硝化抑制剂的施用效果、影响因素及其评价[J]. 应用生态学报, 2008, 19(7):1611-1618. SUN Zhi-mei, WU Zhi-jie, CHEN Li-jun, et al. Application effect, affecting factors, and evaluation of nitrification inhibitor:A review[J]. Chinese Journal of Applied Ecology, 2008, 19(7):1611-1618. |
| [4] | 武志杰, 史云峰, 陈利军. 硝化抑制作用机理研究进展[J]. 土壤通报, 2008, 39(4):962-970. WU Zhi-jie, SHI Yun-feng, CHEN Li-jun. Research progress of the mechanisms of nitrification inhibition[J]. Chinese Journal of Soil Science, 2008, 39(4):962-970. |
| [5] | Treusch A H, Leininger S, Kletzin A, et al. Novel genes for nitrite reductase and Amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling[J]. Environmental Microbiology, 2005, 7(12):1985-1995. |
| [6] | Venter J C, Remington K, Heidelberg J F, et al. Environmental genome shotgun sequencing of the Sargasso Sea[J]. Science, 2004, 304(5667):66-74. |
| [7] | Zhang L M, Hu H W, Shen J P, et al. Ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils[J]. ISME J, 2012, 6(5):1032-1045. |
| [8] | Arp D J, Sayavedra-Soto L A, Hommes N G. Molecular biology and biochemistry of ammonia oxidation by Nitrosomonas europaea[J]. Archives of Microbiology, 2002, 178(4):250-255. |
| [9] | Hallam S J, Mincer T J, Schleper C, et al. Pathways of carbon assimilation and ammonia oxidation suggested by environmental genomic analyses of marine Crenarchaeota[J]. PLoS Biology, 2006, 4(4):520-536. |
| [10] | Walker C B, Torre J R d l, Klotz M G, et al. Nitrosopumilus maritimus genome reveals unique mechanisms for nitrification and autotrophy in globally distributed marine crenarchaea[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(19):8818-8823. |
| [11] | Robertson L, Vanniel E, Torremans R, et al. Simultaneous nitrification and denitrification in Aerobic Chemostat of Thiosphaera pantotropha[J]. Applied and Environmental Microbiology, 1988, 54(11):2812-2818. |
| [12] | Schimel J, Firestone M, Killham K. The relative importance of autotrophic and heterotrophic nitrification in a conifer forest soil as measured by 15N tracer and pool dilution techniques[J]. Applied and Environmental Microbiology, 1999, 48(4):802-806. |
| [13] | 王连峰, 蔡祖聪. 淹水与湿润水分前处理对旱地酸性土壤氧化亚氮和二氧化碳排放的影响[J]. 环境科学学报, 2011, 31(8):1736-1744. WANG Lian-feng, CAI Zu-cong. Nitrous oxide and carbon dioxide emissions from upland acidic soils under flooding and moistening pretreatments[J]. Acta Scientiae Circumstantiae, 2011, 31(8):1736-1744. |
| [14] | 王连峰, 蔡祖聪. 前期不同水分状况对土壤氧化亚氮排放的影响[J]. 土壤学报, 2009, 46(5):802-808. WANG Lian-feng, CAI Zu-cong. Effects of antecedent water regimes on nitrous oxide emission from an arable soil[J]. Chinese Journal of Soil Science, 2009, 46(5):802-808. |
| [15] | Tourna M, Stieglmeier M, Spang A, et al. Nitrososphaera viennensis, an ammonia oxidizing archaeon from soil[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(20):8420-8425. |
| [16] | Amberger A. Research on dicyandiamide as a nitrification inhibitor and future outlook[J]. Communications in Soil Science and Plant Analysis, 1989, 20(19-20): 1933-1955. |
| [17] | Zacherl B, Amberger A. Effect of the nitrification inhibitors dicyandiamide, nitrapyrin and thiourea on Nitrosomonas-Europaea[J]. Fertilizer Research, 1990, 22(1): 37-44. |
| [18] | Iizumi T, Mizumoto M, Nakamura K. A bioluminescence assay using Nitrosomonas europaeafor rapid and sensitive detection of nitrification inhibitors[J]. Applied and Environmental Microbiology, 1998, 64(10): 3656-3662. |
| [19] | Zaman M, Blennerhassett J D. Effects of the different rates of urease and nitrification inhibitors on gaseous emissions of ammonia and nitrous oxide, nitrate leaching and pasture production from urine patches in an intensive grazed pasture system[J]. Agriculture, Ecosystems & Environment, 2010, 136(3-4): 236-246. |
| [20] | Linquist B A, Adviento-Borbe M A, Pittelkow C M, et al. Fertilizer management practices and greenhouse gas emissions from rice systems: A quantitative review and analysis[J]. Field Crops Research, 2012, 135: 10-21. |
| [21] | Di H J, Cameron K C, Shen J P, et al. Nitrification driven by bacteria and not archaea in nitrogen-rich grassland soils[J]. Nature Geoscience, 2009, 2(9): 621-624. |
| [22] | Monaghan R M, Smith L C, de Klein C A M. The effectiveness of the nitrification inhibitor dicyandiamide(DCD) in reducing nitrate leaching and nitrous oxide emissions from a grazed winter forage crop in southern New Zealand[J]. Agriculture, Ecosystems & Environment, 2013, 175: 29-38. |
| [23] | Dai Y, Di H J, Cameron K C, et al. Effects of nitrogen application rate and a nitrification inhibitor dicyandiamide on ammonia oxidizers and N2O emissions in a grazed pasture soil[J]. Science of the Total Environment, 2013, 465: 125-135. |
| [24] | Lehtovirta-Morley L E, Verhamme D T, Nicol G W, et al. Effect of nitrification inhibitors on the growth and activity of Nitrosotalea devanaterra in culture and soil[J]. Soil Biology and Biochemistry, 2013, 62: 129-133. |
| [25] | Weiske A, Benckiser G, Ottow J C G. Effect of the new nitrification inhibitor DMPP in comparison to DCD on nitrous oxide (N2O) emissions and methane(CH4) oxidation during 3 years of repeated applications in field experiments[J]. Nutrient Cycling in Agroecosystems, 2001, 60(1-3): 57-64. |
| [26] | Di H J, Cameron K C. How does the application of different nitrification inhibitors affect nitrous oxide emissions and nitrate leaching from cow urine in grazed pastures?[J]. Soil Use and Management, 2012, 28(1): 54-61. |
| [27] | Zerulla W, Barth T, Dressel J, et al. 3,4-Dimethylpyrazole phosphate (DMPP): A new nitrification inhibitor for agriculture and horticulture[J]. Biology and Fertility of Soils, 2001, 34(2): 79-84. |
| [28] | Di H J, Cameron K C. Inhibition of ammonium oxidation by a liquid formulation of 3,4-Dimethylpyrazole phosphate(DMPP) compared with a dicyandiamide(DCD) solution in six new Zealand grazed grassland soils[J]. Journal of Soils and Sediments, 2011, 11(6): 1032-1039. |
| [29] | Li H, Chen Y, Liang X, et al. Mineral-nitrogen leaching and ammonia volatilization from a rice-rapeseed system as affected by 3,4-dimethylpyrazole phosphate[J]. Journal Environmental Quality, 2009, 38(5): 2131-2137. |
| [30] | Vitale L, Ottaiano L, Polimeno F, et al. Effects of 3,4-dimethylphyrazole phosphate-added nitrogen fertilizers on crop growth and N2O emissions in Southern Italy[J]. Plant Soil and Environment, 2013, 59(11): 517-523. |
| [31] | 殷建祯, 俞巧钢, 符建荣, 等. 不同作用因子下有机无机配施添加DMPP对氮素转化的影响[J]. 土壤学报, 2013, 50(3): 574-583. YIN Jian-zhen, YU Qiao-gang, FU Jian-rong, et al. Effects of combined application of organic and inorganic fertilizers plus DMPP on nitrogen transformation in soils as affected by different factors[J]. Acta Pedologica Sinica, 2013, 50(3): 574-583. |
| [32] | Barth G, von Tucher S, Schmidhalter U. Influence of soil parameters on the effect of 3,4-dimethylpyrazole-phosphate as a nitrification inhibitor[J]. Biology and Fertility of Soils, 2001, 34: 98-102. |
| [33] | Vannelli T, Hooper A. Oxidation of nitrapyrin to 6-chloropicolinic acid by the ammonia-oxiding bacterium nitrosomonas europaea[J]. Applied and Environmental Microbiology, 1992, 58(7): 2321-2325. |
| [34] | 许 超, 邝丽芳, 吴启堂, 等. 2-氯-6(三氯甲基)吡啶对菜地土壤氮素转化和径流流失及菜心品质的影响[J]. 水土保持学报, 2013, 27(6): 26-30. XU Chao, KUANG Li-fang, WU Qi-tang, et al. Effects of nitrification inhibitor Nitrapyrin on nitrogen transformation and nitrogen loss and quality of Brassica parachinensis in vegetable soil[J]. Journal of Soil and Water Conservation, 2013, 27(6): 26-30. |
| [35] | 顾艳, 吴良欢, 刘彦伶, 等. 氯甲基吡啶剂型对土壤硝化的抑制效果初步研究[J]. 农业环境科学学报, 2013, 32(2): 251-258. GU Yan, WU Liang-huan, LIU Yan-ling, et al. A preliminary study on the inhibitory effect of Nitrapyrin formulations on soil nitrification[J]. Journal of Agro-Environment Science, 2013, 32(2): 251-258. |
| [36] | Shen T, Stieglmeier M, Dai J, et al. Responses of the terrestrial ammonia-oxidizing archaeon Ca. Nitrososphaera viennensis and the ammonia-oxidizing bacterium Nitrosospira multiformis to nitrification inhibitors[J]. FEMS Microbiology Letters, 2013, 344(2): 121-129. |
| [37] | Belser L W, Schmidt E L. Inhibitory effect of nitrapyrin on 3 genera of ammonia-oxidizing nitrifiers[J]. Applied and Environmental Microbiology, 1981, 41(3): 819-821. |
| [38] | Mccarty G W, Bremner J M. Inhibition of nitrification in soil by acetylenic-compounds[J]. Soil Science Society of America Journal, 1986, 50(5): 1198-1201. |
| [39] | Hyman M R, Arp D J. 14C2H2-labeling and 14CO2-labeling studies of the denovo synthesis of polypeptides by nitrosomonas-europaea during recovery from acetylene and light inactivation of ammonia monooxygenase[J]. Journal of Biological Chemistry, 1992, 267(3): 1534-1545. |
| [40] | 赵 维, 蔡祖聪. 乙炔抑制方式对潮土硝化和矿化作用的影响[J]. 土壤, 2011, 43(4): 584-589. ZHAO Wei, CAI Zu-cong. The effects of methods of exposure to acetylene on nitrification and mineralization in the fluvo-aquic soil[J]. Soils, 2011, 43(4): 584-589. |
| [41] | Jia Z, Conrad R. Bacteria rather than Archaea dominate microbial ammonia oxidation in an agricultural soil[J]. Environmental Microbiology, 2009, 11(7): 1658-1671. |
| [42] | Offre P, Prosser J I, Nicol G W. Growth of ammonia-oxidizing archaea in soil microcosms is inhibited by acetylene[J]. FEMS Microbiology Ecology, 2009, 70(1): 99-108. |
| [43] | Yaseen M, Arshad M, Khalid A. Effect of acetylene and ethylene gases released from encapsulated calcium carbide on growth and yield of wheat and cotton[J]. Pedobiologia, 2006, 50(5): 405-411. |
| [44] | Khalid A, Akhtar M J, Mahmood M H, et al. Effect of substrate-dependent microbial ethylene production on plant growth[J]. Microbiology, 2006, 75(2): 231-236. |
| [45] | 孙志梅, 武志杰, 陈利军, 等. 土壤硝化作用的抑制剂调控及其机理[J]. 应用生态学报, 2008, 19(6): 1389-1395. SUN Zhi-mei, WU Zhi-jie, CHEN Li-jun, et al. Regulation of soil nitrification with nitrification inhibitors and related mechanisms[J]. Chinese Journal of Applied Ecology, 2008, 19(6): 1389-1395. |
| [46] | Taylor A E, Vajrala N, Giguere A T, et al. Use of aliphatic n-alkynes to discriminate soil nitrification activities of ammonia-oxidizing thaumarchaea and bacteria[J]. Applied and Environmental Microbiology, 2013, 79(21): 6544-6551. |
| [47] | Puttanna K, Gowda N M N, Rao E V S P. Evaluation of nitrification inhibitors for use under tropical conditions[J]. Communications in Soil Science and Plant Analysis, 1999, 30(3-4): 519-524. |
| [48] | Hyman M, Sansomesmith A, Shears J, et al. A kinetic-study of benzene oxidation to phenol by whole cells of Nitrosomonas-europaea and evidence for the future oxidation of phenol to hydroquinone[J]. Achives of Microbiology, 1985, 143(3): 302-306. |
| [49] | Zhang L L, Wu Z J, Shi Y F, et al. Inhibitory effects of aromatic compounds on soil nitrification[J]. Pedosphere, 2010, 20(3): 326-333. |
| [50] | Subbarao G V, Sahrawat K L, Nakahara K, et al. Biological nitrification inhibition: A novel strategy to regulate nitrification in agricultural systems[J]. Advances in Agronomy, 2012, 114: 249-302. |
| [51] | Subbarao G V, Nakahara K, Hurtado M P, et al. Evidence for biological nitrification inhibition in Brachiaria pastures[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(41): 17302-17307. |
| [52] | Subbarao G V, Nakahara K, Ishikawa T, et al. Biological nitrification inhibition(BNI) activity in sorghum and its characterization[J]. Plant and Soil, 2012, 366(1-2): 243-259. |
| [53] | Zakir H A K M, Subbarao G V, Pearse S J, et al. Detection, isolation and characterization of a root-exuded compound, methyl 3-(4-hydroxyphenyl) propionate, responsible for biological nitrification inhibition by sorghum(Sorghum bicolor)[J]. New Phytologist, 2008, 180(2): 442-451. |
| [54] | Philippe Ginestet, Jean-Marc Audic, Vincent Urbain, et al. Estimation of nitrifying bacterial activities by measuring oxygen uptake in the presence of the metabolic inhibitors allythiourea and azide[J]. Applied and Environmental Microbiology, 1998, 64(6): 2266-2268. |
 2014, Vol. 33
2014, Vol. 33