文章信息
- 李燕捷, 马天行, 郭学涛, 杨琛, 党志
- LI Yan-jie, MA Tian-xing, GUO Xue-tao, YANG Chen, DANG Zhi
- 纳米二氧化钛负载腐植酸对菲的吸附行为
- Sorption of Phenanthrene on Nano-TiO2 Coated with Humic Acid
- 农业环境科学学报, 2014, 33(11): 2247-2253
- Journal of Agro-Environment Science, 2014, 33(11): 2247-2253
- http://dx.doi.org/10.11654/jaes.2014.11.025
-
文章历史
- 收稿日期:2014-3-18
2. 华南理工大学广东省大气环境与污染控制重点实验室, 广州 510006;
3. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. Guangdong Provincial Key Laboratory of Atmospheric Environment and Pollution Control, South China University of Technology, Guangzhou 510006, China;
3. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangdong, Guangzhou 510006, China
纳米二氧化钛因具有很高的化学和热稳定性、亲水性及光催化等特性而被广泛应用在各行各业[1]。大量的纳米二氧化钛在生产、储备、运输、使用及废弃的过程中,可经多种渠道进入水环境中。纳米颗粒的比表面积大,对污染物表现出较强的吸附能力[2,3,4],可对污染物在水环境中的迁移转化产生影响。水体中还广泛存在一种天然有机大分子物质——腐植酸(HA),可对有机物和无机物在环境中的分布、迁移、转化和归宿行为等产生非常重要的影响[5,6,7]。当纳米二氧化钛进入水体,腐植酸可附着在纳米二氧化钛表面,对污染物在其表面的吸附行为造成影响。有研究[8,9] 表明,负载腐植酸后纳米颗粒对有机污染物的吸附能力将显著增强,从而影响有机污染物在环境中的迁移与转化。目前,关于负载腐植酸的纳米颗粒的吸附行为的研究主要集中于不同种类的纳米材料和不同类型的污染物。然而,在实际环境水体中,腐植酸的结构组成和性质随其来源母质的不同而存在较大差异,这种异质性是否影响污染物在纳米二氧化钛表面的吸附行为以及是否会随水环境条件的变化而发生改变尚不清楚。本研究通过提取两种不同来源的腐植酸,考察其结构组成以及水环境因素对菲在纳米二氧化钛上吸附行为的影响,为正确评估纳米颗粒的环境风险提供科学依据。 1 材料与方法 1.1 材料与试剂
本实验所用纳米二氧化钛(40 nm,锐钛型)购自阿拉丁公司,纯度>99%。腐植酸分别提取自泥炭和珠江底泥,提取方法参照国际腐殖质协会推荐的标准方法[10]。腐植酸的结构组成通过瑞士Bruker公司的Avance AV 400 13C核磁共振仪进行测定。菲(纯度>95%)购自美国Sigma公司,其他化学试剂如硝酸钾等均为分析纯,购自国药集团药业股份有限公司(上海)。实验所用超纯水为Milli-Q超纯水仪制备。
纳米二氧化钛-腐植酸负载颗粒的制备[8]:配制质量浓度为1 g·L-1的腐植酸溶液,向溶液中加入纳米二氧化钛,避光恒温振荡(25 ℃±1 ℃,150 r·min-1) 2 d后,离心分离。沉淀用去离子水洗涤至上清液无色,真空冷冻干燥,研磨后避光保存备用。 1.2 吸附实验
吸附实验采用批量平衡振荡法。依据预实验结果,按预计达到表观吸附平衡时吸附量为40%~60%,称取适量吸附剂(0.01~0.05 g)于玻璃离心管中,然后加入一系列初始浓度范围为25~400 μg·L-1的菲溶液,离子强度(KNO3)设为0.01 mol·L-1,溶液pH值为6.5,超声处理15 min,于(25±1)℃,150 r·min-1 的条件下振荡7 d,4000 r·min-1 速度下离心30 min,将上清液转移到棕色色谱瓶中待分析。每个样品做3个平行,并设置空白样品对照。吸附动力学实验菲溶液的初始浓度为100 μg·L-1,在设定时间点取样分析。离子强度影响实验设置菲浓度为100 μg·L-1,用KNO3将体系离子强度分别调节至0、0.005、0.01、0.03、0.05、0.07、0.1 mol·L-1,pH值设为6.5;pH值影响实验设置菲的初始浓度为100 μg·L-1,用HNO3或者KOH调节体系pH值为3、4、5、6、7,离子强度设为0.01 mol·L-1。 1.3 菲的检测
液相中菲的浓度采用高效液相色谱仪(Agilent 1200,USA)配Luna C18(2)型色谱柱(250 × 4.6 mm,5 μm)进行检测,色谱分析具体条件为:流动相乙腈∶水=90∶10,流速1.0 mL·min-1,进样量100 μL;荧光检测器的激发波长为237 nm,发射波长为385 nm。 1.4 吸附模型
吸附剂的单位吸附量计算公式如下:

吸附动力学分别用拉格朗日一级动力学方程、拉格朗日二级动力学方程和颗粒间扩散模型进行拟合,其表达式分别如公式(2)、(3)和(4)[11]所示:
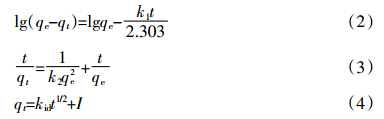
吸附等温线分别用Henry模型和Freundlich模型[12]对数据进行拟合:
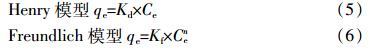
用比表面积分析仪(Micromeritics,ASAP2020M,美国)测得纳米二氧化钛的比表面积为103 m2·g-1,负载泥炭腐植酸和底泥腐植酸的纳米二氧化钛颗粒比表面积分别为99、102 m2·g-1。负载前后颗粒的平均粒径用透射电子显微镜(TEM,JEM-2010HR,日本电子株式会社)测得均为40 nm左右。这些结果说明,纳米二氧化钛负载腐植酸前后物理特性基本没有变化。通过红外光谱证明腐植酸负载在纳米二氧化钛表面主要通过腐植酸的酚羟基与纳米二氧化钛之间的作用[13]。 2.2 腐植酸的结构组成
两种腐植酸样品的固体13C核磁共振各共振峰相对百分含量分析见表 1。根据结构的不同可以将核磁共振峰划分为六个带[14]:脂肪碳(0~50 ppm)、含氧脂肪碳(50~100 ppm)、芳香碳(110~143 ppm)、含氧芳香碳(143~158 ppm)、羧酸碳(158~190 ppm)、羰基碳(190~220 ppm)。两种腐植酸虽然具有相似的结构,但是不同结构的含量具有较大差异并具有各自独特的结构特征,这可能主要归因于其生物来源和形成环境不同[15]。两种腐植酸之间的结构差异主要表现在脂肪碳和芳香碳含量的差异。腐植酸的芳香度可以通过计算(110~158 ppm)/(0~158 ppm)面积比来表征。结果如表 1所示,泥炭腐植酸的芳香碳含量较高,脂肪碳含量较低,而底泥腐植酸的脂肪碳含量较高,芳香碳含量较低。这意味着泥炭腐植酸比底泥腐植酸具有更强的芳香性,可能使纳米二氧化钛对菲表现出更强的亲合力[16]。
 |
菲在纳米二氧化钛负载腐植酸前后的吸附动力学曲线如图 1a和图 1b所示。菲在纳米二氧化钛上168 h可达到表观吸附平衡,而菲在两种负载腐植酸的纳米二氧化钛上则仅需要48 h便能达到表观吸附平衡,这说明负载腐植酸后吸附速率明显增强。菲在纳米二氧化钛负载腐植酸前后的吸附数据用拉格朗日一级动力学方程和拉格朗日二级动力学方程进行拟合,拟合参数见表 2。结果表明,菲在纳米二氧化钛负载腐植酸前后的吸附过程均符合二级动力学模型,且具有很好的线性关系(R2>0.995)。这说明吸附可能存在多种吸附过程,如外部液膜扩散、吸附和内部颗粒扩散等[17],并且吸附过程可能涉及化学吸附作用[18]。为了进一步研究纳米二氧化钛及负载腐植酸后对菲的吸附动力学过程,用颗粒间扩散模型对吸附动力学进行了拟合,如图 1c所示。若图呈线性关系,则吸附过程仅被颗粒间扩散控制,否则吸附由2个或多个步骤控制。从图 1c可以看出,纳米二氧化钛对菲的吸附数据的拟合均有较好的相关性(R2=0.973),说明颗粒间扩散可能是吸附的主要控制步骤之一[19]。而两种负载了腐植酸的纳米二氧化钛对菲的吸附数据的拟合呈现一定的非线性(R2分别为0.504和0.669),说明吸附由2个或多个步骤控制,如膜扩散、颗粒间扩散和溶质在表面的吸附[11]。

|
| 图 1 菲在负载前(a)和负载后(b)纳米二氧化钛上的吸附动力学曲线及颗粒间扩散模型对吸附动力学拟合(c) Figure 1 Kinetic curves of phenanthrene sorption on nano-TiO2 alone(a) and coated with HA(b) and fitting of intraparticle diffusion model to kinetic data(c) |
 |
纳米二氧化钛和负载腐植酸后对菲的吸附量随时间呈规律性变化。在纳米二氧化钛上的吸附,开始为初始快速吸附阶段(0~1 h),纳米二氧化钛对菲的吸附量短时间内就达到饱和吸附量的40%以上;随后为慢吸附阶段(1~168 h),吸附量随时间缓慢上升。这种现象可用双速率模型解释[20]。迅速扩散是菲分子先附着在纳米颗粒表面,随后向纳米颗粒内大孔径中扩散,再由大孔径向小孔径扩散,阻力变大,因此吸附变得缓慢。两种负载了腐植酸的纳米二氧化钛对菲的吸附量都是在1 h达到最高,然后迅速下降,再慢慢上升后趋于平衡。这种现象可能是由于在吸附开始阶段,腐植酸对菲的高亲和力使菲迅速扩散到复合物表面,其主要吸附作用是分配作用[21]。菲扩散到腐植酸表面时,腐植酸表面存在的亲水基团与菲产生排斥作用[21],从而吸附量减小,随后菲向腐植酸分子间扩散,菲吸附缓慢上升,最后趋于稳定。余贵芬等[22]研究腐植酸对汞的吸附动力学研究时同样出现汞吸附量随时间先增大后减少的现象。这部分数据表明,腐植酸能够加快纳米材料对有机污染物的吸附,从而改变污染物在水环境中的迁移与转化,进而影响其在环境中的风险。 2.4 吸附等温线
负载腐植酸前后纳米二氧化钛对菲的吸附等温线如图 2所示。从图中可以看出,负载腐植酸后纳米二氧化钛对菲的吸附作用明显增强,吸附等温线用Henry模型和Freundlich模型进行拟合,拟合参数见表 3。纳米二氧化钛对菲的吸附等温线能够用线性模型较好地拟合,说明纳米二氧化钛对菲的吸附等温线表现出线性,与前人研究一致。前人研究高岭石等无机矿物质对菲的吸附表现为线性吸附[9,23],意味着菲这种疏水有机物的吸附位点可能不在矿物表面而在外部水层,不能与矿物表面形成离子-离子或者离子-偶极子相互作用[24],使得其吸附过程表现为线性分配。负载腐植酸后的吸附数据用线性模型和Freundlich模型都能较好地拟合,线性相关系数均在0.99以上。显然腐植酸的存在改变了纳米二氧化钛对菲的吸附机理,纳米二氧化钛表面的腐植酸可能为菲的吸附提供了更多的疏水性结合位点[9],吸附主要发生在纳米二氧化钛表面的腐植酸上。腐植酸分子中的羧基、酚羟基等官能团所产生的范德华力和氢键架桥作用促进吸附。

|
| 图 2 纳米二氧化钛及负载腐植酸后对菲的吸附等温线 Figure 2 Isotherms of phenanthrene sorption on nano-TiO2 alone and coated with HA |
由表 3可知,纳米二氧化钛、负载泥炭腐植酸后和负载底泥腐植酸后的kd值分别为6.71、715、348 L·kg-1,与前人研究纳米二氧化钛以及负载腐植酸后吸附多环芳烃的Kd值的范围相近。Wang等[9]报道纳米材料对芘的吸附系数Kd值范围为26~63 L·kg-1,纳米材料负载腐植酸后的吸附系数Kd值范围为226~1530 L·kg-1。负载泥炭腐植酸后纳米二氧化钛的吸附系数Kd和Kf值均明显大于负载底泥腐植酸后的Kd和Kf值,表明负载泥炭腐植酸后纳米二氧化钛对菲的吸附能力更强。这一差异可能与两种腐植酸之间的物理化学性质有关:一方面,芳香性结构的腐植酸对疏水性有机物有更强的亲和力[25,26];另一方面,腐植酸中含有较多的羧基、酚羟基等官能团,它们能够与氧化物表面紧密结合[27]。纳米二氧化钛主要与腐植酸的酚羟基发生络合作用[8],使得纳米二氧化钛表面结合较多的芳香碳结构的有机质,而根据“相似相容”原理,这种非极性有机质对菲等非极性有机物有很强的亲和力。腐植酸(特别是芳香碳含量高的腐植酸)可以显著增强纳米二氧化钛对菲的吸附,从而增大菲在水中的迁移能力,减小菲的生物可利用性,增加菲的环境风险。
不同pH值对负载腐植酸后的纳米二氧化钛吸附菲的影响如图 3所示。当pH值由3增加到7时,两种负载腐植酸的纳米二氧化钛的吸附分配系数Kd值都先减小后增大。HA是带有负电荷的聚合物,其所含有的羧基、羟基以及磺酸基等官能团会随着pH值的不同而改变其存在状态。Kd值的变化表明,随pH值的变化,负载到纳米二氧化钛表面的腐植酸结构也发生了改变。当pH=3时,负载在纳米二氧化钛表面的HA可能被质子化而产生静电斥力,使复合物能够均匀分散。随着pH值的增大,HA的质子化变弱而容易发生团聚,造成了疏水基团和亲水基团空间上的接近,从而减小菲在复合物上的结合位点[28]。同时,紧密结合在纳米二氧化钛表面上的HA的构型从卷曲结构变化为伸展的链状结构,HA的极性也逐渐增大,对菲的结合减弱[29]。当pH值上升到7时,吸附系数Kd值明显增大。这可能是因为HA在pH=7的条件下最容易形成“假胶束”结构[28],而假胶束是疏水性有机物的有利结合体,从而pH=7时Kd值增大。李文慧等[29]利用原子力显微镜对pH=4和pH=7条件下的HA构型进行了扫描,结果显示,在pH=4时HA呈现出聚集结合的状态,而在pH=7时,HA分布比较均匀。通过对比可以看出,随pH值的变化,负载泥炭腐植酸后的Kd值的变化比负载底泥腐植酸后的Kd值的变化更显著,这可能是由于芳香碳腐植酸的构型较紧密,而脂肪碳腐植酸的构型较疏松[30]。当pH值升高时,芳香碳腐植酸的结构容易变化为伸展的链状结构,进而影响菲的吸附,而脂肪碳腐植酸的结构变化可能随pH值的变化较小。

|
| 图 3 pH值对负载腐植酸的纳米二氧化钛吸附菲的影响 Figure 3 Effects of pH on phenanthrene sorption on nano-TiO2 coated with HA |
不同离子强度溶液下,负载腐植酸的纳米二氧化钛对菲的吸附情况见图 4。当离子强度由0增加到0.1 mol·L-1时,菲在复合物上的吸附容量Kd值先增大后减小。在中性或者更高的pH值下,腐植酸的基团带负电而产生静电斥力作用,一定量K+的加入可以中和腐植酸上的负电荷,从而降低腐植酸分子间的静电排斥使腐植酸卷曲变小到一定程度发生团聚,不仅促进吸附能力较强的腐植酸聚集体的形成,还能促进腐殖质的胶束化和腐殖质与纳米二氧化钛的反应,进而加大吸附剂对吸附质的吸附[31,32]。但是随着K+离子的增加,腐植酸继续团聚形成絮凝或沉淀[32,33],同时负载颗粒的双电层被压缩,颗粒产生一定的团聚,减少了颗粒的分散度[13],从而减少菲的有效吸附位点。同样,随着离子强度的变化,负载泥炭腐植酸后的Kd值的变化比负载底泥腐植酸后的Kd值的变化显著,说明芳香碳腐植酸的有效吸附位点更容易受离子强度的影响。这可能与负载腐植酸影响纳米二氧化钛颗粒在水中的稳定性有关。吴其圣等[13]曾报道,负载在纳米二氧化钛表面的腐植酸能增加水中纳米颗粒之间的空间位阻,使纳米颗粒更稳定。同时,泥炭腐植酸对纳米二氧化钛稳定性的促进作用比底泥腐植酸强。因此,当pH值和离子强度变化时,纳米颗粒的分散程度也会随之改变,从而改变其有效吸附位点的数量。而泥炭腐植酸对纳米二氧化钛稳定性的促进作用可能会随pH值和离子强度变化而发生更显著的变化,造成纳米颗粒的吸附能力变化更大。

|
| 图 4 离子强度对负载腐植酸的纳米二氧化钛吸附菲的影响 Figure 4 Effects of ionic strengths on phenanthrene sorption on nano-TiO2 coated with HA |
腐植酸负载到纳米二氧化钛表面后对菲的吸附更容易达到吸附平衡,同时对菲的吸附能力显著提高,且芳香碳含量高的腐植酸对菲的吸附容量的增量效应明显高于脂肪碳含量高的腐植酸。负载在纳米二氧化钛表面的腐植酸的结构会随pH值、离子强度的变化而变化,影响对菲的有效吸附位点,从而使复合物对菲的吸附系数随pH值和离子强度的变化而变化。芳香碳含量高的腐植酸负载到纳米二氧化钛后,其吸附系数受pH值和离子强度的影响更显著,说明芳香碳腐植酸的有效吸附位点更容易受pH值和离子强度的影响。可见,腐植酸对纳米二氧化钛的吸附性能有显著影响,进而影响污染物在环境中的迁移和转化,因此在评价其环境风险时,应考虑环境因素的影响。
| [1] | 郭树梁. 纳米二氧化钛的性能研究及其在环保领域的应用[J]. 广西纺织科技, 2010, 39(3):31-33 GUO Shu-liang. Characteristics of nano titanium dioxide and its application in environmental protection[J]. Guangxi Textile Science and Technology, 2010, 39(3):31-33. |
| [2] | Pena M, Meng X, Korfiatis G P, et al. Adsorption mechanism of arsenic on nanocrystalline titanium dioxide[J]. Environmental Science & Technology, 2006, 40(4):1257-1262. |
| [3] | 肖亚兵, 钱沙华, 黄淦泉, 等. 纳米二氧化钛对砷(Ⅲ)和砷(Ⅴ)吸附性能的研究[J]. 分析科学学报, 2003, 19(2):172-174. XIAO Ya-bing, QIAN Sha-hua, HUANG Gan-quan, et al. Adsorption properties of nanometer-size TiO2 for As(Ⅲ) and As(Ⅴ)[J]. Journal of Analytical Science, 2003, 19(2):172-174. |
| [4] | 宋晨怡, 胡霞林, 尹大强. 四环素在光催化剂 TiO2上的吸附研究[J]. 环境化学, 2011, 30(7):1291-1296. SONG Chen-yi, HU Xia-lin, YIN Da-qiang. Adsorption of tetracycline TiO2 photocatalyst[J]. Environmental Chemistry, 2011, 30(7):1291-1296. |
| [5] | Stevenson F J. Humus chemistry:Genesis, composition, reactions[M]. John Wiley & Sons, 1994. |
| [6] | Chen K L, Elimelech M. Influence of humic acid on the aggregation kinetics of fullerene(C60) nanoparticles in monovalent and divalent electrolyte solutions[J]. Journal of Colloid and Interface Science, 2007, 309(1):126-134. |
| [7] | Laor Y, Farmer W J, Aochi Y, et al. Phenanthrene binding and sorption to dissolved and to mineral-associated humic acid[J]. Water Research, 1998, 32(6):1923-1931. |
| [8] | Yang K, Xing B. Sorption of phenanthrene by humic acid-coated nanosized TiO2 and ZnO[J]. Environmental Science & Technology, 2009, 43(6):1845-1851. |
| [9] | Wang X, Lu J, Xu M, et al. Sorption of pyrene by regular and nanoscaled metal oxide particles:Influence of adsorbed organic matter[J]. Environmental Science & Technology, 2008, 42(19):7267-7272. |
| [10] | Swift R S. Organic matter characterization[J]. Methods of Soil Analysis Part 3-Chemical Methods, 1996, 1011-1069. |
| [11] | ünlü N, Ersoz M. Adsorption characteristics of heavy metal ions onto a low cost biopolymeric sorbent from aqueous solutions[J]. Journal of Hazardous Materials, 2006, 136(2):272-280. |
| [12] | 余志扬, 岳 玲, 汪海燕, 等. [A 环-U-14C] 丙酯草醚在土壤中的吸附与解吸特性研究[J]. 核农学报, 2008, 22(3):324-328. YU Zhi-yang, YUE Ling, WANG Hai-yan, et al. Sorption and desorption of [A ring-U-14C] ZJ0273 in soils[J]. Journal of Nuclear Agricultural Sciences, 2008, 22(3):324-328. |
| [13] | 吴其圣, 杨 琛, 胡秀敏, 等. 环境因素对纳米二氧化钛颗粒在水体中沉降性能的影响[J]. 环境科学学报, 2012, 32(7):1596-1603. WU Qi-sheng, YANG Chen, HU Xiu-min, et al. Influences of environmental factors on aggregation of titanium dioxide nanoparticles[J]. Acta Scientiae Circumstantiae, 2012, 32(7):1596-1603. |
| [14] | Kang S, Amarasiriwardena D, Veneman P, et al. Characterization of ten sequentially extracted humic acids and a humin from a soil in western Massachusetts[J]. Soil Science, 2003, 168(12):880-887. |
| [15] | Lu X, Hanna J, Johnson W. Source indicators of humic substances:An elemental composition, solid state 13C CP/MAS NMR and Py-GC/MS study[J]. Applied Geochemistry, 2000, 15(7):1019-1033. |
| [16] | De Paolis F, Kukkonen J. Binding of organic pollutants to humic and fulvic acids:Influence of pH and the structure of humic material[J]. Chemosphere, 1997, 34(8):1693-1704. |
| [17] | Chang M Y, Juang R S. Adsorption of tannic acid, humic acid, and dyes from water using the composite of chitosan and activated clay[J]. Journal of Colloid and Interface Science, 2004, 278(1):18-25. |
| [18] | Ho Y S. Second-order kinetic model for the sorption of cadmium onto tree fern:A comparison of linear and non-linear methods[J]. Water research, 2006, 40(1):119-125. |
| [19] | 吴应琴, 周 敏, 马明广, 等. 不溶性腐植酸吸附对硝基苯胺的动力学研究[J]. 水处理技术, 2007, 33(2):14-17. WU Ying-qin, ZHOU Min, MA Ming-guang, et al. Adsorption kinetics of P-Nitraoniline on the insolubilized humic acid[J]. Technology of Water Treatment, 2007, 33(2):14-17. |
| [20] | 李朝丽, 周立祥. 黄棕壤不同粒级组分对镉的吸附动力学与热力学研究[J]. 环境科学, 2008, 29(5):1406-1411. LI Chao-li, ZHOU Li-xiang. Kinetics and thermodynamics of Cd(Ⅱ)adsorption onto particle-sized fractions of yellow brown soil[J]. Environmental Science, 2008, 29(5):1406-1411. |
| [21] | 周岩梅, 张 琼, 汤鸿霄. 多环芳烃类有机物在腐植酸上的吸附行为研究[J]. 环境科学学报, 2010, 30(8):1564-1571. ZHOU Yan-mei, ZHANG Qiong, TANG Hong-xiao. Sorption behavior of polycyclic aromatic hydrocarbons onto humic acid particulates[J]. Acta Scientiae Circumstantiae, 2010, 30(8):1564-1571 |
| [22] | 余贵芬, 青长乐, 牟树森, 等. 汞在腐植酸上的吸附与解吸特征[J]. 环境科学学报, 2001, 21(5):601-606. YU Gui-fen, QING Chang-le, MOU Shu-sen, et al. Characteristics of mercury adsorption and desorption on humic acids[J]. Acta Scientiae Circumstantiae, 2001, 21(5):601-606. |
| [23] | Huang W, Schlautman M A, Weber W J. A distributed reactivity model for sorption by soils and sediments:5. The influence of near-surface characteristics in mineral domains[J]. Environmental Science & Technology, 1996, 30(10):2993-3000. |
| [24] | Mader B T, Uwe-Goss K, Eisenreich S J. Sorption of nonionic, hydrophobic organic chemicals to mineral surfaces[J]. Environmental Science & Technology, 1997, 31(4):1079-1086. |
| [25] | Perminova I V, Grechishcheva N Y, Petrosyan V S. Relationships between structure and binding affinity of humic substances for polycyclic aromatic hydrocarbons:Relevance of molecular descriptors[J]. Environmental Science & Technology, 1999, 33(21):3781-3787. |
| [26] | Ahmad R, Kookana R S, Alston A M, et al. The nature of soil organic matter affects sorption of pesticides:1. Relationships with carbon chemistry as determined by 13C CPMAS NMR spectroscopy[J]. Environmental Science & Technology, 2001, 35(5):878-884. |
| [27] | Davis J A. Adsorption of natural dissolved organic matter at the oxide/water interface[J]. Geochimica et Cosmochimica Acta, 1982, 46(11):2381-2393. |
| [28] | 李毓骐, 朱亚先, 鹿贞彬, 等. 荧光极性探针在腐植酸和芘相互作用研究中的应用[J]. 厦门大学学报(自然科学版), 2007, 46(1):59-62. LI Yu-qi, ZHU Ya-xian, LU Zhen-bin, et al. Study on the interaction between humic acid and pyreneby polarity probe[J]. Journal of Xiamen University(Natural Science), 2007, 46(1):59-62 |
| [29] | 李文慧, 李爱民, 王学军. pH 值和离子强度对胡敏酸与芘之间相互作用的影响[J]. 环境化学, 2009, 28(5):636-639. LI Wen-hui, LI Ai-min, WANG Xue-jun. Effects of pH values and ionic strengths on bindings between humic acid and pyrene[J]. Environmental Chemistry, 2009, 28(5):636-639. |
| [30] | Cuypers C, Grotenhuis T, Nierop K G, et al. Amorphous and condensed organic matter domains:The effect of persulfate oxidation on the composition of soil/sediment organic matter[J]. Chemosphere, 2002, 48(9):919-931. |
| [31] | Lee C L, Kuo L J, Wang H L, et al. Effects of ionic strength on the binding of phenanthrene and pyrene to humic substances:Three-stage variation model[J]. Water Research, 2003, 37(17):4250-4258. |
| [32] | 罗雪梅, 刘昌明. 离子强度对土壤与沉积物吸附多环芳烃的影响研究[J]. 生态环境, 2006, 15(5):983-987. LUO Xue-mei, LIU Chang-ming. Effects of Ca2+ ionic strength on sorption of polycyclic aromatic hydrocarbons(PAHs) on soils and sediments in Yellow River Delta[J]. Ecology and Environment, 2006, 15(5):983-987. |
| [33] | 龙石红, 邓 斌. 不同分散剂对二氧化钛颗粒分散稳定性的影响[J]. 渝西学院学报(自然科学版), 2003, 2(4):12-14. LONG Shi-hong, DENG Bin. Influence of different dispersants on dispersion stabilities of TiO2 powders in water[J]. Journal of Western Chong-qing University(Nature Sciences Edition), 2003, 2(4):12-14. |
 2014, Vol. 33
2014, Vol. 33





