文章信息
- 张伟, 窦森
- ZHANG Wei, DOU Sen
- 纤维素降解过程中链霉菌菌体及其碱提取物组分研究
- Chemical Characterization of Cellulose-degrading Streptomyces and Its Alkaline Extraction Fraction During Cellulose Degradation
- 农业环境科学学报, 2014, 33(12): 2412-2419
- Journal of Agro-Environment Science, 2014, 33(12): 2412-2419
- http://dx.doi.org/10.11654/jaes.2014.12.019
-
文章历史
- 收稿日期:2014-04-12
放线菌作为土壤微生物的重要组成部分,是木质纤维素、几丁质等高分子聚合物的主要分解者[1],其中,链霉菌以其产生抗生素及二级代谢物的种类最多而著名[2]。目前,国内外研究者们已经从土壤中筛选到20多种具有纤维素分解能力的链霉菌[3, 4],但是,一直致力于研究放线菌产纤维素酶,很少关注链霉菌降解纤维素后形成的产物,这种产物是否就是腐殖质的这一科学问题成为研究腐殖质生物化学(腐殖质的形成、本性、化学组成与结构特征、稳定性机制及其相互关系)无法回避的基础资料。已有研究认为,微生物利用有机物质作为能源[5],通过生物转化可产生大量的低分子有机酸,并在腐熟过程中形成大量稳定的腐植酸类物质[6]。美国麦克拉伦等[7]研究了十几种单一微生物在土壤腐殖质形成中的作用。来航线等[8]认为各类微生物在土壤腐殖质总量的形成中均起到积极作用,特别是木霉在土壤腐殖质总量形成中的作用最大,其次为灰褐链霉菌。
本实验在土壤以外的场所(摇床振荡)培养后,用现代分析技术手段,进行链霉菌降解纤维素后形成菌体的结构特征和碱提取物组分分析,比较不同培养时间形成的菌体结构特征和碱提取物组分变化,尚未见有关报道。以期为探索如何通过微生物组成和环境条件预设来调控腐殖质组成,近而为调控土壤肥力和固碳提供新的理论依据,为实现纤维素的资源化利用提供理论支持。
1 材料与方法 1.1 供试菌种实验所用菌种由崔俊涛等从吉林农业大学试验田的黑土中分离获得[9],固体培养基4 ℃下保存。液体培养研究前将保存的放线菌放入电热恒温培养箱培养若干天,使之活化。经上海生工生物工程技术服务有限公司鉴定菌属,结果为:链霉菌属的一个菌株(Streptomyces sp. F)。
1.2 培养基纤维素:羧甲基纤维素钠(CMC-Na),分子式为RnOCH2COONa。 固体培养基:可溶性淀粉20 g,KNO3 1 g,NaCl 0.5 g,K2HPO4 0.5 g,MgSO4 0.5 g,FeSO4 0.01 g,琼脂20 g,蒸馏水 1000 mL,pH 7.2~7.4。 纤维素液体培养基:NaNO3 2.0 g,K2HPO4 1.0 g,KCl 0.5 g,MgSO4 0.5 g,FeSO4 0.01 g,羧甲基纤维素钠14.4 g,蒸馏水1000 mL,pH 7.2~7.4。 实验所用试剂均购自天津市科密欧化学试剂有限公司,纯度为分析纯。 1.3 实验方法 1.3.1 实验设计
液体菌种的制备:固体培养基于121 ℃高压蒸汽灭菌20 min,在无菌室中冷却至50~60 ℃后倒平板,每皿控制在15 mL左右,待凝固后用移液器接入液体菌种(将1.1 分离得到的菌株用15~20 mL蒸馏水洗入100 mL三角瓶)1 mL·皿-1,置于恒温培养箱中培养,培养温度25 ℃,培养7 d后用蒸馏水15 mL·皿-1刮取菌丝,得扩大培养后的液体菌种。
振荡培养实验:不同培养时间链霉菌菌体设7个处理,按0、7、14、21、38、60 d培养的6个处理和1个不加纤维素的链霉菌菌体(CK)处理。每个处理设3次重复。即在装有200 mL液体培养基的500 mL三角瓶中接入20 mL扩大培养后的链霉菌液体菌种,链霉菌液体菌种∶纤维素液体培养基=1∶10(体积比),置于28~30 ℃,180~200 r·min-1摇床上振荡培养,将各培养时间的培养液(0、7、14、21、38、60 d)从摇床上取下,每个培养时间取3瓶,高速离心(16 000 r·min-1) 15 min,收集沉淀,沉淀为菌体-残余基质混合物,可能包含有菌体、残余基质、新形成的类腐殖物质和少量的细胞代谢产物,但大部分为菌体,故简称之为菌体。
1.3.2 测定项目及方法菌体碱溶组分的提取和分离:用腐殖质组成修改法[10]即采用0.1 mol·L-1 NaOH+0.025 mol·L-1 Na4P2O7提取菌体碱溶组分,再用0.5 mol·L-1 H2SO4和0.1 mol·L-1 NaOH分离菌体碱溶组分。 菌体结构性质的测定:元素组成用元素分析仪(德国 Elementar Vario EL-CHN)测定;热性质用差热分析仪(日本岛津DTG-60)测定;红外光谱分析用红外光谱仪(美国 Nicolet-AV360型),采用KBr压片法[11]测定。 1.4 数据处理
用Microsoft Excel 2003进行数据处理,用SPSS 17.0统计软件进行Duncan新复极差5%水平的差异显著性分析,用Origin 7.5 软件绘图。
2 结果与讨论 2.1 不同培养时间链霉菌分解纤维素形成菌体的产率将放线菌菌株接入液体培养基中振荡培养,实质上是菌株的液体发酵培养过程,在发酵过程中同时存在着菌体生长和产物形成两个过程,它们都需要消耗培养基中的基质(如纤维素、木质素、葡萄糖等),随着基质浓度的降低,菌体的生长会进入衰退期。菌体产率是菌体、残余基质、新形成的类腐殖物质和少量细胞代谢产物的重量占加入纤维素的百分数,其变化间接反映了纤维素剩余量的多少及菌体的降解能力。由图 1可以看出,纤维素降解的过程中,菌体产率总体呈上升趋势,但有一定的波动:培养初期(0~14 d),随着培养时间的延长,链霉菌分解纤维素后形成菌体的产率逐渐升高,各处理差异不显著;培养中期(21~38 d),菌体产率呈现相对降低的变化;培养后期(60 d),菌体产率显著增加,达到7.29%。这一总体变化趋势可能是因为在链霉菌降解纤维素的过程中,链霉菌进入到纤维素致密结构的内部,形成一种包裹混合体,造成离心分离的困难,这时离心产物并不能完全代表菌体的产量,直到链霉菌的“啃噬”打开了一条通道,菌体才从包裹体中被“释放”出来。也可能是因为链霉菌在降解纤维素的过程中,菌体生长和产物的形成导致了菌体产率的波动性变化。

|
| 图 1 链霉菌在纤维素纯培养中菌体产率的动态变化 Figure 1 Dynamic changes of Streptomyces yield in pure culture of CMC-Na |
从菌体元素分析(表 1)可知,不同培养时间链霉菌菌体的元素含量差异不大,其中C元素含量为410~509 g·kg-1,菌体N元素含量除培养的第7 d(195.56 g·kg-1)外,含量为52.34~74.26 g·kg-1,与细菌菌体细胞含碳量一般小于50%、含氮量小于15%的规律一致。而在以纤维素钠为唯一碳源的液体培养中,菌体含氮量均高于对照,而且培养的第7 d菌体氮元素含量达到峰值,高达195.56 g·kg-1。这很可能与供试菌株在该培养期体内合成大量纤维素酶有关。Wang等[12]研究结果表明:水解水溶性纤维素(CMC-Na)的纤维素酶多为糖蛋白,该类酶分子的一级结构由核心催化域(Catalytic Domain,CD)、纤维素结合域(Cellulose Binding Domain,CBD)和将这两部分相连的链接区(Linker)三部分组成,也有仅含核心催化区而无CBD区的纤维素酶,而在CMC-Na为碳源的液体培养条件下,毕赤酵母纤维素酶蛋白表达量可达8.80 mg·mL-1[13],表明CMC-Na具有促进纤维素分解菌大量合成纤维素酶的作用。因此,本研究中以纤维素钠为唯一碳源的液体培养中,菌体含氮量均高于对照,并在培养的第7 d菌体N元素含量达到峰值,但有关供试菌株纤维素酶的性质和产率还有待进一步研究。总的来说,以纤维素钠为唯一碳源的不同培养时间链霉菌菌体的元素含量与黑土HA和不加纤维素的链霉菌相比,不同培养时间链霉菌菌体含有更多的N元素,黑土HA和不加纤维素的链霉菌含有更多的C元素。H元素含量为73.5~90.5 g·kg-1,H和N元素含量均高于黑土HA,且N元素含量高于不加纤维素的链霉菌,O+S元素含量为297~459 g·kg-1,与黑土HA和不加纤维素的链霉菌相比,无规律性变化。
通常O/C、H/C和C/N等原子比通常可以用来鉴别腐殖质的来源,描述不同环境中腐殖质的结构差异及性质[14, 15, 16]。其中,H/C可以标志有机质来源[17],不同培养时间菌体H/C为2.031~2.235,较黑土HA和不加纤维素的链霉菌大,说明不同培养时间的链霉菌菌体含有更多的脂肪链结构,且各处理均大于1。这与Humphreys 等[18]关于“生物合成的有机物H/C>1”是一致的。各个处理的H/C表现为:H/CHA
C/N作为衡量自然体系中腐殖质来源的一个指标,Gonzalez-Vila等[17]认为非维管水生植物来源的C/N在2.0~10之间,而以维管植物为主要来源的C/N主要为20或者更大。黑土HA的C/N为20.7,表明黑土HA主要来源为维管植物,而不同时间菌体C/N为7.05~11.22,均低于黑土HA。这说明在腐殖质形成过程中有链霉菌活动的作用,链霉菌中的氮素可能与腐植酸结合在一起而成为腐植酸的一部分[19]。
2.2.1.2 元素原子比分布从表 1的分析,各处理的元素含量高低几乎看不出什么规律,为表示植物残体腐殖化过程中元素组成的变化,Van Krevelen[20]用H/C原子数比和O/C原子数比作图,如图 2。Steelink[21]认为H/C值大于1.3的物质可能不属于腐殖质。由图 2可以看出,不同培养时间的菌体,黑土腐植酸(HA和FA)和纤维素的分布区域差异明显,菌体H/C值都在1.4以上,O/C的分布面较窄,据此可以推断,链霉菌降解纤维素的过程中可能发生脱羧、脱水和脱甲基等反应,不加纤维素的链霉菌与不同培养时间的菌体的芳香核结构类物质较少,缩合度较低,分子结构与腐植酸是有差别的。

|
| 图 2 链霉菌在纤维素培养过程中菌体的H/C-O/C关联图(Van-Krevelen图) Figure 2 Van Krevelen diagram showing H/C-O/C of Streptomyces in pure culture of CMC-Na |
差热分析(Differential Thermal Analysis)技术被用于有机质、复合体、FA-金属络合物和HA 的研究等[22],图 3和表 2分别为5 ℃·min-1升温速率下对应的热重(DTA)曲线和热重变化规律。由图 3可知,不同培养时间的菌体的DTA曲线大体一致,在110 ℃之前,发生了微弱的吸热变化,表明链霉菌降解纤维素的过程中首先失去水分,之后随着温度的升高,DTA曲线在300 ℃左右进入中温放热阶段且呈现较宽的“波浪形”峰。这个阶段可能是菌体中的有机物质挥发燃烧,产生热量,即脂族化合物的分解和外围官能团的脱羧等导致的放热反应,经过一阶段降低后,重新出现放热反应,此次放热反应的峰温较高,这可能是因为菌体中挥发出的物质完全氧化和分子内部芳香化合物分解[12]。不同时间菌体的中温放热峰的峰温较黑土HA低,根据分解温度越高,结晶度越高的规律,可知菌体的结晶度较低,而发生剧烈氧化的温度较HA高,说明菌体热稳定性较强。
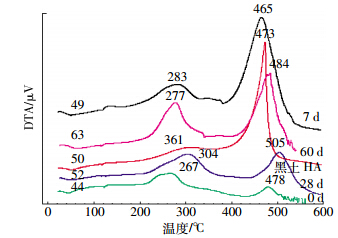
|
| 图 3 链霉菌在纤维素培养过程中菌体的DTA曲线 Figure 3 Differential thermal analysis curves of Streptomyces in pure culture of CMC-Na |
 |
一般来说,热量高中比(H3/H2)和失重高/中比(W3/W2)分别是高温放热量与中温放热量、高温失重量与中温失重量的比值,它们可以反映物质芳香性与脂族性的相对变化。由表 2可知,热量高中比与失重高中比变化规律一致。不同培养时间的链霉菌菌体高中比均低于黑土HA,表明链霉菌的芳香性较黑土HA弱,这与元素分析的结果是一致的。培养60 d菌体高中比高于培养0 d的高中比,表明培养过程中链霉菌的芳香性有明显提高。
发生放热反应的同时,一定会伴随着重量的损失,各个处理的失重量主要在中、高温放热阶段,中温放热阶段占的比例较大,且各处理菌体失重情况处于波动变化。培养过程中,不同培养时间的链霉菌中温失重量大于黑土HA,黑土HA高温失重量大于不同培养时间的链霉菌,也表明不同培养时间的链霉菌的芳香性较黑土HA弱。总的来说,链霉菌菌体与黑土HA有一定的差别。
2.2.3 红外光谱红外光谱可以提供化合物的分子结构和官能团等方面信息[23],根据化合物红外吸收曲线的峰位、峰强及一些化合物官能团的特异性吸收峰可以判断化合物是否存在某些官能团[24]。不同培养时间菌体的红外光谱谱图基本相似(图 4),说明不同时间培养的菌体具有基本一致的结构。另一方面不同培养时间菌体在某些特征峰吸收强度上有不同程度的差异,反映了不同时间对菌体的结构单元和官能团数量有明显的影响。参照Drousssi等[25]的结果,不同培养时间菌体各组分特征峰归属如下:在3400 cm-1(带羟基O-H振动)、2920~2860 cm-1(脂族C-H的伸缩振动)、1620 cm-1(芳香C=C的伸缩振动)和1410 cm-1(脂族C-H变形,临位取代芳香环伸展)、1320 cm-1(甲基、亚甲基、异丙基及丁基等官能团[26, 27])、1240 cm-1(羧基中的C-O伸展和OH变形)、1070 cm-1等附近有特征吸收带,但其吸收强度不同。与黑土HA相对照,主要区别为菌体在1720 cm-1(羧基C=O伸展)不存在吸收峰,在1320 cm-1存在吸收峰,进一步证明了链霉菌菌体组分中含有更多的亚甲基类物质[28]。

|
| 图 4 链霉菌在纤维素培养过程中菌体的红外光谱 Figure 4 Infrared spectra of Streptomyces in pure culture of CMC-Na |
结合半定量分析结果(表 3)可知,与黑土HA相比,不同培养时间链霉菌菌体3400 cm-1宽峰吸收强度都有增强,表明不同培养时间的菌体可以有效增加菌体-OH的含量;在2920 cm-1处的吸收强度增强,表明不同培养时间的菌体存在较多的不对称脂肪碳链结构;在1400 cm-1和1240 cm-1处的吸收强度增强,说明不同培养时间的菌体含有更多的含氧官能团。这与元素分析氧元素的含量是一致的。3400/2920比值为60 d>0 d,这是由于经纤维素培养后期(60 d)链霉菌菌体组分中含有较多的酚羟基类物质[28]。菌体红外光谱解析表明,不同培养时间的菌体含有更多的脂肪碳链结构和含氧官能团,与元素分析的H/C和O/C一致。
 |
用腐殖质组成修改法提取和分离链霉菌碱提取物各组分的相对碳量列于表 4。可以看出链霉菌菌体降解纤维素后,形成了富含水溶性组分的物质。不同培养时间的链霉菌菌体碱提取物组分中“水溶性组分”碳相对含量较黑土大10倍以上,而不加纤维素的链霉菌,“水溶性组分”碳相对含量较低,仅为黑土的3倍,表明水溶性组分含量受纤维素[29]和链霉菌[30]的共同作用影响,且受纤维素的作用影响更大。
 |
不同培养时间的链霉菌菌体的“碱溶组分”(相当于类胡敏酸和富里酸的总和)[31]碳相对含量仅占黑土中该组分的7.85%~24.2%,而不加纤维素的链霉菌“碱溶组分”占黑土中该组分的24.4%,而纤维素“碱溶组分”与黑土近似,说明加纤维素的链霉菌“碱溶组分”受纤维素和链霉菌的共同作用影响,且与黑土的腐植酸组分存在差别。
加纤维素不同培养时间的链霉菌菌体的“碱溶酸不溶组分”(相当于类胡敏酸)碳相对含量高于“碱溶酸溶组分”(相当于类富里酸),与大多数土壤腐殖质组分碳的分配状况是一致的[32, 33],而不加纤维素的链霉菌菌体的“碱溶酸不溶组分” 碳相对含量低于“碱溶酸溶组分”,说明加入纤维素有助于菌体“碱溶酸不溶组分”的形成。这与刘艳丽[31]报道的放线菌有利于类胡敏酸的形成这一结论一致。
碱溶酸不溶组分C/碱溶组分C可以反映碱溶性组分碳的转化方向。纤维素培养链霉菌期间,该比例范围在78.7%~88.1%,较黑土高,而不加纤维素的链霉菌和纤维素均较黑土低,也表明了“碱溶酸不溶组分”受纤维素和链霉菌的共同作用影响,加入纤维素有助于菌体“碱溶酸不溶组分”的形成。
加纤维素不同培养时间链霉菌和纤维素的“碱不溶组分”(相当于类胡敏素)与黑土近似,而不加纤维素的链霉菌是黑土的1.85倍,表明加入纤维素后有助于链霉菌中“碱不溶组分”的分解。
本研究结果表明,加纤维素不同培养时间链霉菌菌体的碱提取物各组分均受纤维素的影响,其中“水溶性组分”和“碱溶酸不溶组分”同时受链霉菌和纤维素的共同作用影响,且不同培养时间链霉菌菌体与黑土腐植酸有区别。
3 结论链霉菌利用纤维素形成的菌体,随着培养时间的延长,培养后期(60 d)的链霉菌菌体产率显著增加,达到7.29%;链霉菌菌体与真正的土壤腐殖质相差较大,表现为缩合程度和结晶度较低,芳香性、脂肪碳链和含氧官能团含量较高;链霉菌降解纤维素后有助于“碱溶酸不溶组分”(相当于类胡敏酸)物质的形成,“碱溶酸不溶组分”和“水溶性组分”物质的形成均与链霉菌和纤维素的共同作用有关,不同培养时间链霉菌菌体与黑土腐植酸存在差别。
| [1] | Goodfellow M, Williams S T. Ecology of actinomycetes[J]. Annual Review of Microbiol ogy, 1983, 37:189-216. |
| [2] | Maleki H, Mashinchian O. Characterization of streptomyces isolates with UV, FTIR spectroscopy and HPLC analyses[J]. Bioimpacts, 2011, 1(1):47-52. |
| [3] | Thierie J, Penninckx M J. Modeling of competitive mutualistic relationships, application to cellulose degradation by Streptomyces sp. strains[J]. Current Microbiology, 2007, 55(6):507-511. |
| [4] | Abdulla H M, El-Shatoury S A. Actinomycetes in rice straw decomposition[J]. Waste Management, 2007, 27(6):850-853. |
| [5] | Chefetz B, Hadar Y, Chen Y. Dissolved organic carbon fractions formed during composting of municipal solid waste:Properties and significance[J]. Acta Hydrochim Hydrobiol, 1998, 26(3):172-179. |
| [6] | 刘艳华, 魏 颖, 李 成, 等. 生活垃圾接种微生物堆肥对腐殖组分的影响[J]. 东北农业大学学报, 2006, 37(1):43-47. LIU Yan-hua, WEI Ying, LI Cheng, et al. Effect on humic substance of inoculating microbes on municipal solid waste composting[J]. Journal of Northeast Agricultural University, 2006, 37(1):43-47. |
| [7] | 麦克拉伦A D, 等. 土壤生物化学[M]. 闵九康(译). 北京:科学出版社, 1984. McLaren A D, et al. Soil biochemistry[M]. MIN Jiu-kang(Translator). Beijing:Science Press, 1984. |
| [8] | 来航线, 程丽娟, 王中科, 等. 几种微生物对土壤腐殖质形成的作用[J]. 西北农业大学学报, 1997, 25(6):80-82. LAI Hang-xian, CHENG Li-juan, WANG Zhong-ke, et al. Effect of several microorganisms on the formation of soil humus[J]. Acta Univ Agric Boreali-occidentalis, 1997, 25(6):80-82. |
| [9] | 王 帅, 窦 森, 崔俊涛, 等. 微生物对黑土添加麦秸后腐殖质结构特征影响的红外光谱研究[J]. 光谱学与光谱分析, 2012, 32(9):2409-2413. WANG Shuai, DOU Sen, CUI Jun-tao, et al. Characterization of soil humus by FTIR spectroscopic analyses after Beijing inoculated wih different microorganisms plus wheat straw[J]. Spectroscopy and Spectra Analysis, 2012, 32(9):2409-2413. |
| [10] | 窦 森. 土壤有机质[M]. 北京:科学出版社, 2010. DOU Sen. Soil organic matter[M]. Beijing:Science Press, 2010. |
| [11] | 罗固源, 刘 静, 王金霞, 等. 一株溶藻细菌对铜绿微囊藻的溶藻机理初探[J]. 生态环境学报, 2010, 19(11):2647-2651. LUO Gu-yuan, LIU Jing, WANG Jin-xia, et al. Primary research on algicidal mechanism of an algae-lysing bacterium to microcystics aeruginosa[J]. Ecology and Environmental Sciences, 2010, 19(11):2647-2651. |
| [12] | Wang H M, Bao K. Neutral cellulase catalytic core and method of producing same[P]. United States Patent 20060154843, A1, 2006. |
| [13] | 顾方媛, 陈朝银, 钱世钧, 等. 纤维素酶的研究进展与发展趋势[J]. 微生物学杂志, 2008, 28(1):83-87. GU Fang-yuan, CHEN Chao-yin, QIAN Shi-jun, et al. Advances in cellulase and its development tendency[J]. Journal of Microbiology, 2008, 28(1):83-87. |
| [14] | Rice J A, Maccarthy P. Statisitical evaluation of the elemental composition of humic substances[J]. Organic Geochemistry, 1991, 17(5):634-648. |
| [15] | Hargitai L. Biochemical of elemental characteristics of humic substances during humification related to their environmental functions[J]. Environmental International, 1994, 20:43-48. |
| [16] | Kim J I, Buckau G, Li G H. Characterization of humic and fulvic acids from Gorleben groundwater[J]. Fresenius Journal of Analytical Chemistry, 1990, 338(3):245-252. |
| [17] | Gonzalez Vila F J, Martin F, del Rio J C, et al. Structure characteristics and geochemical significance of humic acids isolated from three Spanish lignite deposits[J]. Science of Total Environment, 1992, 17(118):335-343. |
| [18] | Humphreys J M, Chapple C. Rewriting the lignin roadmap[J]. Current Opinion in Plant Biology, 2002, 5(3):224-229. |
| [19] | 李会杰. 腐植酸和富里酸的提取与表征研究[D]. 武汉:华中科技大学, 2012. LI Hui-jie. Study on Extraction and Characterization of HA and FA[D]. Wuhan:Huazhong University of Science and Technology, 2012. |
| [20] | Van Krevelen D W. Graphical-statistical method for the study of structure and reaction processes of coal[J]. Fuel, 1950, 29:269-283. |
| [21] | Steelink C. Implications of elemental characteristics of humic substances in humic substances in soil, sediment, and water:Geochemistry, isolation, and characterization[M]. New York:John Wiley and Sons, 1985:457-476. |
| [22] | 梁重山, 刘丛强, 党 志. 现代分析技术在土壤腐殖质研究中的应用[J]. 土壤, 2001, 33(3):154-158. LIANG Chong-shan, LIU Cong-qiang, DANG Zhi. Application of modern instruments on soil humus research[J]. Soils, 2001, 33(3):154-158. |
| [23] | 牛灵安, 郝晋珉. 盐渍土熟化过程中腐殖质特性的研究[J]. 土壤学报, 2001, 38(1):114-122. NIU Ling-an, HAO Jin-min. Characteristics of humus in maturing salt affected soil[J]. Acta Pedologica Sinica, 2001, 38(1):114-122. |
| [24] | 黄兆琴, 胡林潮, 史 明, 等. 水稻秸秆燃烧对土壤有机质组成的影响研究[J]. 土壤学报, 2012, 49(1):61-66. HUANG Zhao-qin, HU Lin-chao, SHI Ming, et al. Changes in composition of soil organic matter after burning of straw[J]. Acta Pedologica Sinica, 2012, 49(1):61-66. |
| [25] | Droussi Z V, Dorazio M R, Provenzano M, et al. Study of the biodegradation and transformation of olive-mill residues during composting using FTIR spectroscopy and differential scanning calorimetry[J]. Journal of Hazardous Materials, 2009, 164(2):1281-1285. |
| [26] | Lubal P, Siroky D, Fetsch D, et al. The acidobasic and complexation properties of humic acids:Study of complexation of czech humic acids with metal ions[J]. Talanta, 1998, 47(2):401-402. |
| [27] | Landgraf M D, Dasilva S C, Rezende M O D. Mechanism of metribuzin herbicide sorption by humic acid samples from peat and vermicompost[J]. Anal Chim Acta, 1998, 368(2):155-164. |
| [28] | 李圆圆, 李 夏, 胡林潮, 等. 水田土壤富里酸组分的结构表征及对多环芳烃芘的吸附特征[J]. 农业环境科学学报, 2009, 28(2):269-274. LI Yuan-yuan, LI Xia, HU Lin-chao, et al. Structral characterization and pyrene binding properties of the fulvic acid fractions by pH gradients from paddy soils[J]. Journal of Agro-Environment Science, 2009, 28(2):269-274. |
| [29] | He W M, Hu H R. Predicition of hot-water-soluble extractive, pentosan and cellulose content of various wood species using FT-NIR spectroscopy[J]. Bioresource Technology, 2013, 140:299-305. |
| [30] | 窦 森, 于水强, 张晋京. 不同CO2浓度对玉米秸秆分解期间土壤腐殖质形成的影响[J]. 土壤学报, 2007, 44(3):458-466. DOU Sen, YU Shui-qiang, ZHANG Jin-jing. Effects of carbon dioxide concentration on humus formation in corn stalked composition[J]. Acta Pedologica Sinica, 2007, 44(3):458-466. |
| [31] | 刘艳丽. 添加有机物料后不同微生物对土壤腐殖质形成的影响[D]. 长春:吉林农业大学, 2011. LIU Yan-li. Effect of different microbial upon the formation of soil humus after application organic material[D]. Changchun:Jilin Agriculture University, 2011. |
| [32] | Hargitai L. Biochemical of elemental characteristics of humic substances during humification related to their environmental functions[J]. Environmental International, 1994, 20:43-48. |
| [33] | 刘永欣. 秸秆深还对土壤腐殖质及其结构特征的影响[D]. 长春:吉林农业大学, 2014. LIU Yong-xin. Effect of straw deep application on distribution and structural characteristics of humus[D]. Changchun:Jilin Agriculture University, 2014. |
 2014, Vol. 33
2014, Vol. 33





