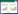文章信息
- 沈伟航, 朱能武, 王华金, 党志, 陈小强
- SHEN Wei-hang, ZHU Neng-wu, WANG Hua-jin, DANG Zhi, CHEN Xiao-qiang
- 石油污染土壤生物修复过程中毒性的植物指示
- Plant Bio-indicators of Eco-toxicity of Oil-contaminated Soil During Bioremediation
- 农业环境科学学报, 2015, 34(1): 22-28
- Journal of Agro-Environment Science, 2015, 34(1): 22-28
- http://dx.doi.org/10.11654/jaes.2015.01.004
-
文章历史
- 收稿日期:2014-07-26
2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006, China
石油类污染物进入土壤后,会引起土壤理化性质的变化、土壤微生物区系的改变、可渗入地下并污染地下水等一系列问题,如何修复石油污染土壤成为人们关注的焦点。石油污染土壤的生物修复技术以其具有的投入低、操作性强、适应性广、无二次污染,可在清除土壤污染的同时,清除污染土壤周围的大气和水体中的污染物等优点,正逐步成为未来石油污染土壤治理研究的一个重要方向[1]。然而,生物修复的成功运作并非易事,恢复污染土壤原有生态功能是一个长期而复杂的系统生态过程[2],在修复过程中,土壤从污染状态逐渐向健康方向恢复,并伴随着一系列科学指标的变化。因此,有必要对土壤的修复过程及土壤的健康状况进行科学全面的监测和评价。近年来,国内外频繁地采用高等植物[3]、指示微生物[4]、蚯蚓[5]、土壤酶活性[6, 7]等来描述、评价和监测污染土壤修复过程。其中,高等植物作为土壤生态系统中的基本组成部分,利用其生长发育状况来诊断和评价土壤污染是土壤污染生态毒理学诊断试验中的重要组成部分。目前已经建立的高等植物毒理研究主要是采用急性毒性试验方法,包括根伸长抑制试验、种子发芽试验和植物幼苗早期生长试验。近年来,高等植物毒性测试已广泛地应用于石油污染土壤的毒性诊断以及石油污染土壤修复效果的评价。
在前期研究中,课题组分离筛选的三株石油组分降解菌构建的混合菌体系,表现出较好的修复效果[8, 9, 10, 11]。然而,该混合菌用于石油污染土壤修复过程中对高等植物的各种生理生化指标影响的变化规律尚不清楚。因此,本文在前期研究基础上,选取大白菜、小青菜、黑麦草、莴苣、小麦、萝卜分别进行试验,最终筛选出对土壤毒性变化反应相对敏感的小麦(Triticum acstivnm L.)、萝卜(Raphanus sativus L.)为供试种子或植物,并通过模拟实验研究了不同修复时期植物种子的发芽率和早期幼苗生长发育及叶片的生化指标的变化,并进一步从中选取敏感的指示植物和对应的指示指标,为石油污染土壤环境质量的评价标准制定提供理论依据。 1 材料与方法 1.1 混合菌的制备
GS3C[8]是一株烷烃降解菌,属于洋葱伯克霍尔德氏菌(Burkholderiacepacia),其16S rDNA在GenBank中的登录号为EU2821101。GY2B[9]是一株菲降解菌,属于鞘氨醇单胞菌(Sphingomonas sp.),其16S rDNA在GenBank中的登录号为DQ139343。GP3B[10]是一株芘降解菌,属于伯克菌科Pandoraea菌属的pnomenusa种,其16S rDNA在GenBank中的登陆号为EU233279。
将GS3C、GY2B、GP3B这3种石油降解菌株分别取1环进行富集培养,在原油无机盐培养基中分别加入1 mL富集液,然后将加入石油降解菌的原油无机盐培养基放置于30 ℃、150 r·min-1的摇床中驯化5 d,如此重复驯化8周后,分别收获驯化产物。将驯化后的GS3C、GY2B、GP3B菌(菌悬细菌浓度为108 cfu·mL-1)按等量配比的原则(1∶1∶1,体积比)复配形成石油降解混合菌体系。 1.2 石油污染土壤的制备[12]
供试土壤采自广东增城,为水稻田表层土壤(0~20 cm)。土壤取回经干燥处理后过4.75 mm筛,去除大颗粒物质后分为两份,一份保存于4 ℃黑暗条件下用于测定新鲜土样指标(数据未列出),另一份置于阴凉处风干后过2 mm筛,保存待用。供试石油为广州石化提供的原油(饱和烃45.55%,芳烃17.69%,胶质和沥青质9.68%)。
在直径15 cm、高20 cm塑料盆中分别装入3 kg干土,将溶于石油醚中的石油定量加入土壤中,使土壤中石油烃的初始浓度为5000 mg·kg-1干土,拌匀,待石油醚挥发完全,再将复配的混合石油降解菌按照每100 g土加3 mL(3%)接种于石油污染土壤中。然后,加入适量的NH4NO3和K2HPO4,将N∶P调节为15∶1,土壤含水率维持在25%。
最后将土壤放置在恒温培养箱(30 ℃)中进行石油污染土壤的生物修复实验,每隔2 d翻土一次并保证土壤含水率的稳定。设置无污染土壤和未投加降解菌株的石油污染土壤为对照,在实验过程中,分别采集干净土壤,污染第0、8、16、24、32、40 d的土壤,分别标记为S0、S1、S2、S3、S4、S5、S6,作为不同修复时期石油污染土壤样品,并将其放置在阴凉处风干备用。 1.3 测试项目及方法
小麦和萝卜种子发芽率的测定参考Al-Mutairi等[3]及Banks等[13]的方法,在种子发芽实验的基础上,在16∶8的光照(光照强度4300±430 lx)条件下继续培养9 d(共计14 d)后,测定幼苗生长发育指标、叶片光合色素指标以及叶片生理生化指标。 叶片叶绿素a(Chl-a)及类胡萝卜素(Car)含量采用Porra[14, 15]的联立方程法精确测定;超氧化物歧化酶(SOD)活性和丙二醛含量分别采用NBT光化还原法以及硫代巴比妥酸(TBA)显色法来测定[16];SOD总活性以每克鲜重酶单位表示(即U·g-1 FW),以抑制氮蓝四唑光化还原50%为一个酶活性单位(U);MDA(nmol·g-1),以单位质量植物组织鲜重中MDA的含量表示。 1.4 数据处理
实验数据使用SPSS 17.0进行双变量相关性分析、回归分析以及方差分析。 2 结果与讨论 2.1 不同处理土壤对高等植物种子发芽率的影响
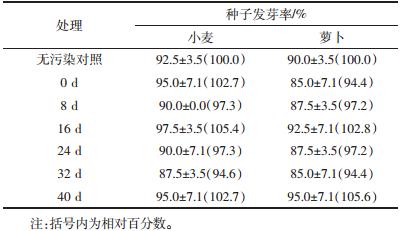
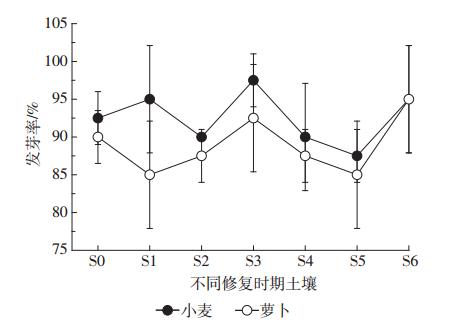
不同处理土壤对小麦和萝卜种子发芽率和幼苗生长的影响结果如表 1和图 1所示。小麦种子的发芽率受本研究中不同修复时期土壤的影响较小,与无污染土壤对照处理间不存在显著差异(P>0.05),萝卜种子的发芽率在不同修复时期土壤中与对照组之间同样差异不显著,说明本研究中所采用的供试植物种子发芽率的敏感性相对较低。这可能是由于高等植物种子萌发所需的营养主要来源于其胚乳中的能量,从而使得其对土壤环境污染的敏感性较低[17]。有研究认为,种子的特殊结构具有多种防范功能,能够有效阻止有毒有害物质的进入,只有当土壤污染较严重时,种子发芽才会完全被抑制[17]。
 |
|
| 图 1 不同处理土壤对高等植物种子发芽率的影响 Figure 1 Seed germination rates of higher plants in different phases of the bioremediation |
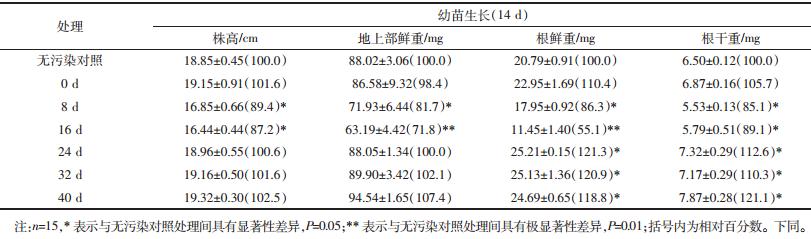
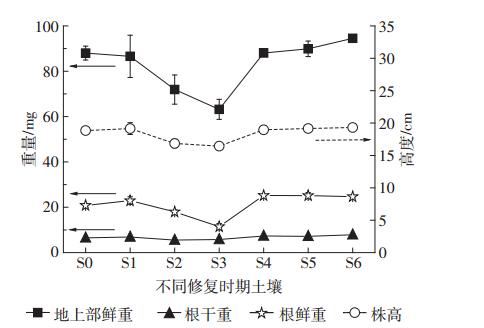
小麦幼苗在各修复时期土壤中的生长发育总体情况见表 2和图 2所示。在修复8 d和16 d土壤中,无论是株高还是根长均与其他处理土壤之间存在明显的差异,与无污染土壤相比表现出明显的抑制。从株高和根长两方面来看,在修复0、24、32、40 d的土壤中与无污染土壤对照组相比均表现出诱导作用。小麦幼苗生长发育各指标受不同处理土壤胁迫的响应存在差异。修复8 d和16 d的污染土壤中小麦株高与无污染土壤对照间存在显著差异,显著低于无污染土壤对照(P<0.05),分别为无污染土壤对照组的89.4% 和87.2%;而在修复0、24、32、40 d土壤中小麦株高相对于无污染土壤对照虽有不同程度的增加,但均不显著(P>0.05)。小麦地上部鲜重在修复8 d土壤中与对照组相比有显著降低(P<0.05),为对照组的81.7%;修复16 d土壤中小麦地上部鲜重与对照组间存在极显著差异(P<0.01),为对照组的71.8%,其他处理土壤与对照组之间均不存在显著差异(P<0.05)。小麦的根鲜重和干重除在0 d土壤中与对照组之间不存在显著差异外,其他各处理土壤中均与对照组间存在显著差异,其中:根鲜重在修复8 d土壤中表现出显著降低(P<0.05),为对照组的86.3%,在修复16 d土壤中表现出极显著降低(P<0.01),为对照组的55.1%;在修复24、32、40 d土壤中均表现出显著增加(P<0.05),分别为对照组的121.3%、120.9%和118.8%。根干重在8 d和16 d土壤中表现出显著降低,在修复16 d后的土壤中则表现显著增加(P<0.05)。
 |
|
| 图 2 小麦幼苗在不同土壤中14 d生长发育情况 Figure 2 Wheat seedling growth in different phases of the bioremediation(after 14 d growth) |
从表 3可以看出,不同修复时期土壤中萝卜幼苗的生长发育状况存在明显的差异。从株高和根长两方面来看,萝卜在整个修复时期的处理土壤中与无污染土壤对照组相比均表现出抑制作用,且在修复8、16、24 d的土壤中抑制作用相对明显。
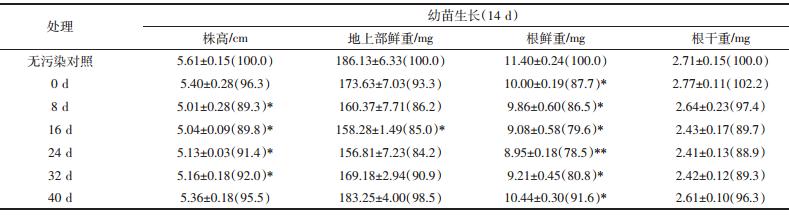 |
由表 3还可以看出,萝卜幼苗株高在修复8、16、24、32 d土壤中与对照组之间均存在显著降低(P<0.05),分别为对照组的89.3%、89.8%、91.4%和92.0%。地上部鲜重在整个修复时期土壤中均表现出不同程度的抑制作用,为对照组的98.5%~93.1%,但除了在修复16 d土壤中与对照组间存在显著差异外(P<0.05),其他各处理与对照之间的差异均不明显(P>0.05)。同样,萝卜幼苗根鲜重指标在各修复时期的土壤中均产生抑制且低于对照,为对照组的91.6%~78.5%,其中在修复24 d土壤中极显著低于无污染对照(P<0.01),在其他处理土壤中均为显著低于对照组(P<0.05)。不同修复时期污染土壤中萝卜幼苗根干重指标与无污染土壤对照组之间差异均不显著(P>0.05)。
通过以上结果可以看出,不同生长指标在各处理土壤中的敏感程度各不相同,不同的植物对各处理土壤中的污染胁迫也存在差异。小麦的株高、地上部鲜重、根鲜重及根干重的幼苗生长发育指标在修复8 d和16 d土壤中表现为抑制作用,在其他修复时期的处理土壤中表现为刺激作用。在修复后期对小麦的某些幼苗的生长发芽指标产生刺激作用,这种现象在宋雪英等[18]的研究中同样得到了体现。这可能由于:石油进入土壤导致有机质含量增加,使土壤肥力有所增大,随着修复的进行石油烃浓度相应降低,土壤肥力和石油烃浓度的共同作用刺激了小麦幼苗各生长发育指标的增长。宋玉芳等[19]考察了不同水平浓度的污染物对高等植物的影响,表明低浓度组对高等植物的生长产生刺激作用,高浓度组对植物的生长产生抑制作用。低浓度的石油组分对植物的生长有促进作用主要可能是因为植物的根系与土壤微生物联合作用,将土壤中的石油烃转化成CO2和H2O,为土壤微生物提供能量和碳源;同时,植物可以将部分石油烃通过木质化作用,转化成自身的组成部分[20]。萝卜的各幼苗生长发育指标在不同处理土壤中的响应与小麦存在一定的差异,萝卜的各幼苗生长发育指标在整个修复时期都表现出不同程度的抑制,其中株高在修复16 d的土壤中抑制效果达到最大,地上部鲜重和根鲜重在修复24 d土壤中的抑制效果最为明显。这说明萝卜在本研究的土壤中表现得更加敏感一些,同时也说明本研究中的不同修复时期土壤均存在一定的毒性,并且在修复的第一阶段,土壤的毒性上升到最大。
在本研究中,可能是生物修复过程中产生了某些有毒中间代谢产物,其毒性比原始污染物毒性更大,导致污染土壤修复中期毒性增强。Gibson等[21]研究也发现,某些烃尤其是PAHs的氧化中间产物具有比母本烃更强的生物毒性。通过统计学的相关关系分析可知,石油在土壤中的残留量与小麦和萝卜幼苗各生长发育指标的影响结果不存在显著相关性。有研究表明,生物毒性的评价结果并不总是与TPH含量的降低呈现必然的相关关系[3]。从表 2和表 3结果分析可得,植物各指标的响应并不随石油烃浓度的变化呈现相应的变化趋势:当石油烃浓度最高时,供试植物幼苗各生长指标的抑制效果不是最明显;相反,在石油污染土壤修复过程的前中期,石油污染土壤的抑制作用最强。这说明在石油污染土壤的修复过程中,目标污染物残留量的减少并不能笼统地说土壤的修复效果好,应结合土壤的生态学毒性试验,综合评价土壤的修复效果和健康质量。此外,Al-Mutairi等[3]和Xu等[22]研究发现,不同修复时期土壤中发光细菌相对发光强度呈现“先减弱后增强”的变化趋势。当发光细菌受到外界影响时,其发光过程就会受到相应的干扰,并且发光细菌的发光强度与毒性作用强度呈线性负相关关系[23]。这也说明土壤中的生态毒性强度也是先增强后减弱,与本实验结果是一致的。 2.3 幼苗光合作用色素
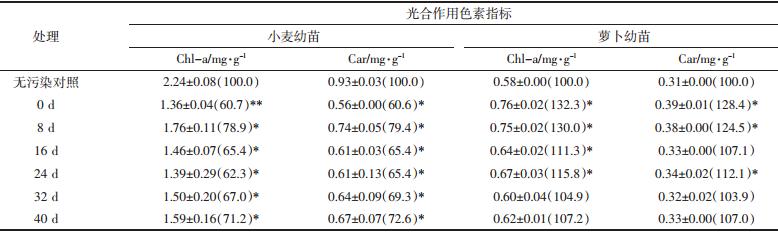
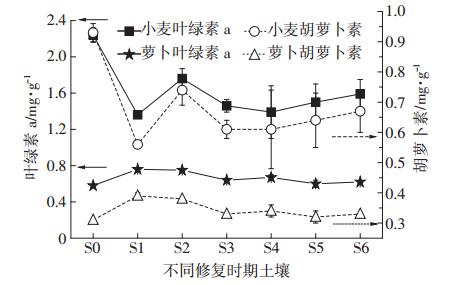
当植株受到伤害时叶片的光合作用会受到影响,叶片中光合作用色素含量跟着发生变化,不同修复时期污染土壤中小麦和萝卜叶片的光合作用色素指标见表 4和图 4。小麦的叶绿素a(Chl-a)含量在不同修复时期的污染土壤中均表现出显著抑制作用,在修复0 d时抑制作用达到最大,为对照处理的60.7%;其次是修复16 d和24 d,分别为对照组的65.4%和62.3%。小麦的类胡萝卜素(Car)和叶绿素a的变化趋势一致。经过统计学分析,两者在统计学上具有极显著的正相关性,r=0.996(P<0.01),说明在石油污染的胁迫下叶绿素a和类胡萝卜素含量具有较好的一致性,主要原因是这两种色素都属于光合作用色素。
 |
|
| 图 4 不同处理土壤对供试植物叶片光合作用色素的影响 Figure 4 Photosynthetic pigments of wheat and radish in different phases of the bioremediation |
同样,萝卜的叶绿素a(Chl-a)含量在不同修复时期的污染土壤中均表现出诱导作用,在修复的前中期(0、8、16、24 d)与对照组相比出现显著诱导效应,分别为对照处理的132.3%、130.0%、111.3%和115.8%,类胡萝卜素的结果和叶绿素a的结果同样表现出极显著的正相关性。这与小麦的叶绿素a和类胡萝卜素结果恰好相反,说明不同的植物种类在石油污染胁迫下叶绿素a和类胡萝卜素的变化表现出差异。 2.4 叶片超氧化物歧化酶(SOD)活性
植物体内细胞膜有酶促和非酶促两类过氧化物防御系统,而抗氧化酶是酶促防御系统的重要组成部分,它们能及时、有效地清除逆境条件下细胞内产生的自由基,是植物体内重要的膜保护酶之一[24]。其中抗氧化酶系中SOD是一种以氧自由基为底物的酶,它能把O2-歧化成O2和H2O2,解除氧自由基对生物体的毒害作用。因此,SOD是抵御自由基毒害的第一道防线[19, 25]。
不同修复时期土壤对供试植物叶片SOD影响结果如表 5所示。小麦叶片中的SOD活性在整个修复时期土壤中均表现出刺激作用,为对照处理的105.5%~131.7%。在修复0 d土壤中显著高于对照处理,在修复8、16、24 d土壤中极显著高于对照处理组,并且在修复16 d土壤中刺激作用达到最大,为无污染对照处理的131.7%;在修复32 d和40 d土壤中虽然表现出诱导作用,但是与对照组之间差异不显著。
同样,萝卜叶片中SOD活性与小麦的结果变化趋势大致相同,也是在修复16 d土壤中刺激作用最明显。研究表明,逆境胁迫条件下会使植物细胞内产生大量活性氧自由基,这些自由基能对植物细胞产生毒害作用,SOD活性的升高,有利于自由基的清除,及时解除其对植物的毒害作用。这说明小麦和萝卜这两种植物对本研究中的处理土壤有一定的抗性。有研究认为,SOD活性升高的植物其抗污性和在逆境中生存的能力要强于SOD下降的植物,与SOD的本底值没有直接关系[26]。在正常的情况下,植物组织SOD的活性与氧自由基处于动态平衡,叶片中氧自由基含量的增加必然导致SOD活性的升高,SOD活性越高说明土壤的逆境胁迫越严重。这可以间接说明石油污染土壤修复的前中期生态毒性有所增强,导致土壤中逆境胁迫增加。 2.5 叶片丙二醛(MDA)含量
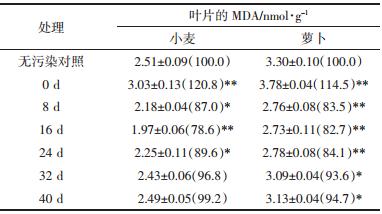
MDA是细胞膜脂过氧化作用的产物之一。其含量是细胞膜受损程度的重要指标,因此植物组织中MDA含量可用来表征植物生存环境的恶劣程度[27]。
不同处理土壤对供试植物叶片MDA影响结果如表 6所示。小麦叶片中MDA含量随修复时期的延长,呈现先上升后下降最后又慢慢回升的变化趋势。萝卜叶片中MDA含量在不同修复时期的污染土壤中呈现同样的变化趋势,只是在修复后期(32 d和40 d)小麦叶片中MDA含量与对照处理不存在显著差异,而萝卜叶片中MDA含量与对照处理仍然存在显著降低。在开始修复时(0 d)石油烃浓度最高,在这种逆境下,植物叶片产生大量的自由基,为了解除自由基的毒害,膜脂过氧化反应加剧,导致膜脂过氧化产物MDA含量增加。在修复开始后,不同处理土壤中出现抑制作用的主要原因可能是:SOD活性的增加,导致其酶反应过程中产生大量的H2O2,其对植物细胞的毒害作用,导致MDA含量的降低;植物在逆境条件下虽然抗氧化酶系统的功能加强,但是其调节能力仍很有限,导致植物细胞体内还是积累了过剩的氧自由基,这些氧自由基破坏了细胞膜的结构,致使MDA含量的降低。
 |
(1)在高等植物生态毒性评价指标中,小麦幼苗生长发育指标(株高、地上部鲜重、根鲜重、根干重)指示出在修复8 d和16 d时土壤生态毒性较强。小麦叶片的生化指标(叶绿素a、类胡萝卜素、SOD活性、MDA含量)进一步说明微生物修复的前期土壤的生态毒性有所上升,随后毒性有所降低。
(2)小麦和萝卜的幼苗生长发育和叶片生理生化指标均能有效地指示土壤的毒性。小麦幼苗生长指标(株高、地上部鲜重、根鲜重和根干重)和生理生化指标(SOD活性和MDA含量)以及萝卜幼苗的株高、根鲜重以及叶片中SOD活性、MDA含量均对土壤的生物毒性强弱有较好的指示效果。
(3)石油污染土壤微生物修复后土壤毒性变得复杂化,在修复的前中期出现毒性上升,后期毒性逐渐减弱,但在整个修复时期土壤均存在一定的生态毒性。
| [1] | 周启星, 宋玉芳. 污染土壤修复原理与方法[M]. 北京:科学出版社, 2004:22-42. ZHOU Qi-xin, SONG Yu-fang. Principle and method of contaminated soil remediation[M]. Beijing:Science Press, 2004:22-42. |
| [2] | 宋玉芳, 宋雪英, 张 薇, 等. 污染土壤生物修复中存在问题的探讨[J]. 环境科学, 2004, 25(2):129-133. SONG Yu-fang, SONG Xue-ying, ZHANG Wei, et al. Issues concerned with the bioremediation of contaminated soils[J]. Environmental Science, 2004, 25(2):129-133. |
| [3] | Al-Mutairi N, Bufarsan A, Al-Rukaibi F. Ecorisk evaluation and treatability potential of soils contaminated with petroleum hydrocarbon-based fuels[J]. Chemosphere, 2008, 74(1):142-148. |
| [4] | Phillips T M, Liu D, Seech A G, et al. Monitoring bioremediation in creosote-contaminated soils using chemical analysis and toxicity tests[J]. Journal of Industrial Microbiology & Biotechnology, 2000, 24(2):132-139. |
| [5] | Geissen V, Gomez-Rivera P, Lwanga E H, et al. Using earthworms to test the efficiency of remediation of oil-polluted soil in tropical Mexico[J]. Ecotoxicology and Environmental Safety, 2008, 71(3):638-642. |
| [6] | 蔺 昕, 李培军, 孙铁珩, 等. 石油污染土壤的生物修复与土壤酶活性关系[J]. 生态学杂志, 2005, 24(10):1226-1229. LIN Xin, LI Pei-jun, SUN Tie-heng, et al. Bioremediation of petroleum-contaminated soil and its relationship with soil enzyme activities[J]. Chinese Journal of Ecology, 2005, 24(10):1226-1229. |
| [7] | 李玉瑛, 李 冰. 柴油污染土壤生物修复对土壤酶活性的影响[J]. 生态环境学报, 2009, 18(5):1753-1756. LI Yu-ying, LI Bing. Effect of bioremediation of diesel oil contaminated soil on soil enzyme activity[J]. Ecology and Environmental Sciences, 2009, 18(5):1753-1756. |
| [8] | 吴仁人, 党 志, 易筱筠, 等. 氨基酸对烷烃降解菌GS3C降解性能的影响[J]. 环境科学研究, 2009, 22(6):702-706. WU Ren-ren, DANG Zhi, YI Xiao-yun, et al. Effect of amino acids on degrading capability of a n-alkanes degrading strain GS3C[J]. Research of Environmental Sciences, 2009, 22(6):702-706. |
| [9] | 陶雪琴, 卢桂宁, 党 志, 等. 菲降解菌株GY2B的分离鉴定及其降解特性[J]. 中国环境科学, 2006, 26(4):478-481. TAO Xue-qin, LU Gui-ning, DANG Zhi, et al. Isolation and identification of phenanthrene-degrading strain GY2B and its degradation character[J]. China Environmental Science, 2006, 26(4):478-481. |
| [10] | 陈晓鹏, 易筱筠, 陶雪琴, 等. 石油污染土壤中芘高效降解菌群的筛选及降解特性研究[J]. 环境工程学报, 2008, 2(3):413-417. CHEN Xiao-peng, YI Xiao-yun, TAO Xue-qin, et al. Screening and characterization of pyrene-degrading microbial[J]. Chinese Journal of Environmental Engineering, 2008, 2(3):413-417. |
| [11] | 何丽媛, 党 志, 唐 霞, 等. 混合菌对原油的降解及其降解性能的研究[J]. 环境科学学报, 2010, 30(6):1220-1227. HE Li-yuan, DANG Zhi, TANG Xia, et al. Biodegradation characteristics of crude oil by mixed bacterial strains[J]. Acta Scientiae Circumstantiae, 2010, 30(6):1220-1227. |
| [12] | Vouillamoz J, Milke M W. Effect of compost in phytoremediation of diesel-contaminated soils[J]. Water Science and Technology, 2001, 43(2):291. |
| [13] | Banks M K, Schutz K E. Comparison of plants for germination toxicity tests in petroleum-contaminated soils[J]. Water, Air, and Soil Pollution, 2005, 167(1-4):211-219. |
| [14] | Porra R J. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophylls a and b[J]. Photosynthesis Research, 2002, 73(1-3):149-156. |
| [15] | Parsons T R, Strickland J D. Discussion of spectrophotometric determination of marine-plant pigments, with revised equations for ascertaining chlorophylls and carotenoids[J]. Journal of Marine Research, 1963, 21(3):155-163. |
| [16] | 陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社, 2002. CHEN Jian-xun, WANG Xiao-feng. The guidance of plant physiology experiments[M]. Guangzhou:South China University of Technology Press, 2002. |
| [17] | 刘 宛, 宋玉芳, 周启星, 等. 氯苯胁迫对小麦种子发芽和幼苗生长的影响[J]. 农业环境保护, 2001, 20(2):65-68. LIU Wan, SONG Yu-fang, ZHOU Qi-xing, et al. Effect of chlorobenzene-stress on seed germination and seedling growth of wheat[J]. Agro-environmental Protection, 2001, 20(2):65-68. |
| [18] | 宋雪英, 宋玉芳, 孙铁珩, 等. 石油污染土壤植物修复后对陆生高等植物的生态毒性[J]. 环境科学, 2006, 27(9):1866-1871. SONG Xue-ying, SONG Yu-fang, SUN Tie-heng, et al. Soil-based eco-toxicity of petroleum to terrestrial higher plant after phytoremediation[J]. Environmental Science, 2006, 27(9):1866-1871. |
| [19] | 宋玉芳, 周启星, 许华夏, 等. 菲, 芘, 1, 2, 4-三氯苯对土壤高等植物根伸长抑制的生态毒性效应[J]. 生态学报, 2002, 22(11):1945-1950. SONG Yu-fang, ZHOU Qi-xing, XU Hua-xia, et al. Eco-toxicological effects of Phenanthrene, Pyrene and 1, 2, 4-Trichlorobenzene in soils on the inhibition of root elongation of higher plants[J]. Acta Ecologica Sinica, 2002, 22(11):1945-1950. |
| [20] | 张大庚, 依艳丽, 郑西来. 沈抚污水灌区石油烃对土壤及水稻的影响[J]. 土壤通报, 2003, 34(4):333-336. ZHANG Da-geng, YI Yan-li, ZHENG Xi-lai. Effect of petroleum groups on soil and rice in the Shen-Fu irrigation region[J]. Chinese Journal of Soil Science, 2003, 34(4):333-336. |
| [21] | Gibson D T. Microbial degradation of organic compounds[M]. Marcel Dekker, 1984 |
| [22] | Xu Y, Lu M. Bioremediation of crude oil-contaminated soil:Comparison of different biostimulation and bioaugmentation treatments[J]. Journal of Hazardous Materials, 2010, 183(1):395-401. |
| [23] | 马 梅, 童中华, 王子健, 等. 新型淡水发光菌(Vibro qinghaiensis sp. -Q67)应用于环境样品毒性测试的初步研究[J]. 环境科学学报, 1998, 18(1):86. MA Mei, TONG Zhong-hua, WANG Zi-jian, et al. Application of new type of fresh water luminescent bacterium(Vibrio qinghaiensis sp. -Q67) for toxicity bioassay[J]. Acta Scientiae Circumstantiae, 1998, 18(1):86. |
| [24] | Tang C F, Liu Y G, Zeng G M, et al. Effects of exogenous spermidine on antioxidant system responses of Typha latifolia L. under Cd2+ stress[J]. Journal of Integrative Plant Biology, 2005, 47(4):428-434. |
| [25] | 荣 亮. 石油污染对植物生长毒性效应的影响研究[D]. 南昌:南昌大学, 2010. RONG Liang. Study on the effects of eco-toxicity of petroleum-contaminated soil on plants growth[D]. Nanchang: Nanchang University, 2010. |
| [26] | 刘天兵, 冯宗炜. 植物SOD活性变化与其抗污能力的关系[J]. 环境污染与防治, 1997, 19(1):12-13. LIU Tian-bing, FENG Zong-wei. Relationship between SOD activity variation and pollution-resistance of plants[J]. Environment Pollution and Control, 1997, 19(1):12-13. |
| [27] | Debus R, Hund K. Development of analytical methods for the assessment of ecotoxicological relevant soil contamination:Part B-Ecotoxicological analysis in soil and soil extracts[J]. Chemosphere, 1997, 35(1):239-261. |
 2015, Vol. 34
2015, Vol. 34