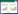文章信息
- 陆凡, 胡清华, 李廷强
- LU Fan, HU Qing-hua, LI Ting-qiang
- 生物表面活性剂皂角苷对柴油污染土壤脱附的强化作用
- Enhancing Removal Efficiency of Diesel Contaminant from Soil by Biosurfactant Saponin
- 农业环境科学学报, 2015, 34(1): 37-43
- Journal of Agro-Environment Science, 2015, 34(1): 37-43
- http://dx.doi.org/10.11654/jaes.2015.01.006
-
文章历史
- 收稿日期:2014-07-01
2. 浙江大学出版社, 杭州 310028
2. Zhejiang University Press, Hangzhou 310028, China
当前世界石油总产量约为每年22亿t,其中17.5亿t是由陆地油田生产的。每年全世界有800万t石油进入环境,我国每年有近60万t进入环境,其中有约10万t进入土壤,全国石油污染土壤面积约500万hm2 [1]。作为基本燃料,石油制品中柴油污染面积也已达到30万hm2 。柴油污染使土壤的结构和功能遭受破坏,使作物减产,其中多环芳烃对人还有致癌、致畸和致突变等作用。由于柴油类污染物多属于疏水性有机污染物(Hydrophobic organic contaminants,HOC),能长期存在于土壤中,且释放缓慢,这也成为其难以修复的一个重要因素[2]。目前国内外关于HOC污染土壤的修复方法众多,其中物理方法虽简单易行,但一般不能从根本上解决土壤的污染问题,而且在操作过程中会破坏原土壤结构及其生态环境[3]。生物类方法对环境友好程度高,但是该方法须进行微生物的优化选种,受生长周期限制明显[4,5,6]。化学强化修复技术因效率高、周期短,已成为修复土壤有机污染物的主要方法之一。但当所使用脱附剂浓度较高时,会造成土壤的二次污染。Hussein等研究发现,当土壤吸附的脱附剂浓度超过了其临界胶束浓度(Critical micelle concentration CMC)时,会改变土壤pH,降低土壤的吸水性,增加重金属在土壤中的移动性等[7]。因此,选择合适的化学脱附剂,在保证高脱附率的同时降低使用量成为化学修复技术的关键。
当前所使用的化学脱附剂主要由表面活性剂和助剂组成。表面活性剂主要有阳离子表面活性剂、阴离子表面活性剂及非离子表面活性剂。通常,阳离子表面活性剂因土壤带负电荷而易被土壤吸附,大大降低其修复效率[8];阴离子表面活性剂溶解性好,易于降解,但容易与土壤中的二价阳离子(Ca2+、Mg2+)发生络合反应,降低修复效率[9];非离子表面活性剂有更强的增溶能力,但在土壤上吸附损失较为严重,同样降低了修复的效率;Urum等研究发现,当使用非离子表面活性剂修复石油污染土壤时,最高吸附量达到50%左右[10],因而无毒、易降解且脱附效率高的新型脱附剂日益受到欢迎。
与化学表面活性剂相比,生物表面活性剂具有无毒,能够被生物完全降解,作为增效试剂,不会对环境造成二次污染,具有更低临界胶束浓度等优点,近年来在污染土壤的化学强化修复研究中得到广泛关注。Szulc等研究发现,生物表面活性剂皂角苷在较低浓度时,便能对土壤中的HOC达到较好的脱附效果[11,12,13,14]。迄今,有关传统脱附剂对土壤中HOC脱附的研究较多,而对生物表面活性剂增效传统脱附剂脱附HOC的相关研究报道较少,限制了生物表面活性剂与传统脱附剂的复合及其在土壤HOC脱附中的应用。 皂角苷是一类广泛存在于植物(如皂荚树、无患子等)中的生物表面活性剂,易从植物中提取和分离[14]。但是皂角苷在以往的实验中多用于无机污染土壤的处理[15,16],针对柴油污染土壤的研究较少。本文以柴油污染土壤为代表,研究皂角苷对柴油污染土壤脱附的强化作用,为生物表面活性剂与传统脱附剂复合对HOC污染土壤的脱附提供理论依据。 1 材料与方法 1.1 柴油污染土壤
供试土壤采自绍兴某加油站附近农田,取0~20 cm 表层土壤,自然风干,研磨、过18目筛,再加入柴油进行老化。具体操作方法为:取0号柴油25 g溶于300 mL丙醇,分散均匀后,添加到300 g土样中,充分搅拌后于25 ℃避光条件下通风老化处理,每日早晚各搅拌一次;待丙酮挥发完全后继续通风老化10 d,土壤风干后磨细待用。土壤的基本性质如下:有机质含量为0.87%,pH为6.84,总柴油含量为7.8%。土壤质地为粉砂质粘壤土,粘粒、粉粒、沙粒的含量分别为19.5%、52.8%、27.7%。 1.2 实验仪器及试剂
主要仪器:TSQ-280 Jinghong台式振荡器;Mettler Toledo AL104天平;Beckman J2-HS离心机;Kudos SK8210LHC数控超声波清洗器。
试剂:丙醇、曲拉通(TX-100)、三氯甲烷、十二烷基硫酸钠(SDS)、皂角苷(Saponin)、助剂硅酸钠均为分析纯,购自西格玛奥德里奇(上海)贸易有限公司。
表面活性剂的性质见表 1。
试验使用L9(34)正交表,根据文献[17]选取试验因素及水平,见表 2。
试验操作方法:在30 mL的玻璃离心管中,加入3 g柴油污染土壤和不同浓度的助剂,并加入超纯水至30 mL,根据试验设计要求设置振荡温度和时间,振荡频率为150 r·min-1,振荡结束后离心(3000 r·min-1)15 min,弃去液相,烘箱中烘干土壤(70 ℃)。准确称取2 g烘干后的土壤于玻璃离心管中,添加三氯甲烷,超声萃取三次(直至萃取液澄清),每次加入三氯甲烷15 mL,每次萃取时间为20 min,温度30 ℃,功率50 kHz,超声萃取后离心(3000 r·min-1)15 min,结束后合并上清液于烧杯中,70 ℃水浴加热除去三氯甲烷,利用重量法计算柴油脱附率[17],计算公式为:
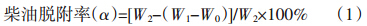
每组实验均设置3个重复,实验数据采用SPSS11.0进行统计分析。 1.4 脱附试验
通过考察不同表面活性剂和助剂的特点[18],最终选取阴离子表面活性剂(SDS),非离子表面活性剂(TX-100)以及生物表面活性剂皂角苷作为配制新型脱附剂所需的表面活性剂,硅酸钠作为助剂。其中所选脱附剂的组合为SDS-TX-100、SDS-皂角苷和TX-100-皂角苷,设定三种不同浓度(1、3、5 g·L-1),三种不同的质量比(5∶5、6∶4、8∶2)。根据正交实验确定的最适条件,加入所选脱附剂,检测脱附后的土壤含油量,计算柴油脱附率。试验操作方法同1.3。 1.5 脱附剂回用试验
在1.4脱附试验的基础上,选用复合表面活性剂SDS-皂角苷,质量比5∶5,浓度1 g·L-1的处理对柴油污染土壤进行脱附,通过离心的方法(3000 r·min-1,15 min)对脱附液进行回收,去除脱附液表面的浮油层,回收脱附液按照1.4的方法对脱附后的土壤再次脱附。试验结束后,再次回收脱附液,对上述脱附土壤进行再次脱附,重复上述过程,连续脱附土壤四次。每脱附一次,计算柴油脱附率。 1.6 淋洗试验及脱附剂残留量的检测
称取3 g柴油污染土壤于30 mL玻璃离心管中,表面活性剂组合为SDS-皂角苷,质量比为5∶5,浓度为1 g·L-1,试验操作方法同1.3。试验结束后在离心机中离心(3000 r·min-1)15 min,弃去液相,在烘箱中烘干土壤(70 ℃)。冷却后称重,记为W1;脱附后柴油污染土壤的质量为W2;重量法测定脱附剂残留量,计算公式为:
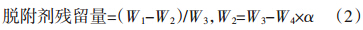
根据文献[18]可知,通过水溶液淋洗,可以降低土壤中脱附剂的残留量,据此本试验采用去离子水作为淋洗剂。淋洗试验具体操作方法如下:在30 mL玻璃离心管中,放入70 ℃烘干后的土壤,加入30 mL去离子水,70 ℃下振荡50 min,振荡频率为150 r·min-1。试验结束后在离心机中离心(3000 r·min-1)15 min,弃去液相,在烘箱中烘干土壤(70 ℃)。冷却后称重,记为W5。重量法测定淋洗后脱附剂残留量,计算公式为:
采用正交试验对柴油污染土壤脱附的最适温度、振荡时间以及助剂浓度进行研究。 由表 3可以看出,温度对于脱附率的影响最大,在70 ℃时,脱附率都达到了50%以上。而且随着温度的升高脱附率也基本上保持着递增的关系(K3>K2>K1)。柴油脱附率与助剂浓度有明显的线性关系。随着助剂浓度的增加,脱附率也不断的增加(K3>K2>K1)。这主要是因为,硅酸钠是一种碱性物质能与石油中的酸性组分反应生成盐,增加了柴油在水中的溶解度,有利于柴油污染物从土壤中脱出。但是过多的硅酸钠不但起不到增溶作用,而且可能造成土壤的盐碱化[19]。从表 3还可以看出,振荡时间对柴油脱附的影响最小,振荡时间和脱附率之间没有明显的线性关系(K2>K1>K3)。一些研究表明[20],脱附率是随着振荡时间的增加而增加的,呈一定的线性关系。本实验中表现出的现象可能是因为振荡时间对柴油脱附率的影响没有温度和助剂浓度对其影响大,导致其对柴油脱附率的影响被温度和助剂浓度所掩盖,从而造成了这一结果。
通过极差分析可知,对柴油污染土壤而言,脱附最适条件为:助剂的浓度为5 g·L-1,温度为70 ℃,振荡时间为50 min,此时脱附率为55.99%。 2.2 单一脱附剂对柴油脱附的影响
在最适试验条件下,选择两种表面活性剂SDS和TX-100进行单一脱附剂的脱附试验。从图 1可以看出,两种不同的脱附剂对土壤中柴油均有一定的去除作用。但随着浓度的增加,两种脱附剂脱附率没有明显的差异(P<0.05),可能是因为在浓度为1 g·L-1时,溶液中表面活性剂胶束的数量就已经趋于饱和,所以单纯的增加表面活性剂的浓度,并不能使其脱附率显著增加[21]。本试验中,SDS的最高柴油脱附率仅为68.48%,TX-100的最高柴油脱附率为66.92%,且脱附率最高时,其所用浓度都为5 g·L-1,用量较高。

|
| 图 1 单一脱附剂对柴油的脱附效果 Figure 1 Removal efficiency of diesel fuel by single surfactant as a function of surfactant initial concentrations |
在浓度为1 g·L-1时,由于浓度较低,且TX-100本身就易被土壤吸附,造成其脱附率低于SDS,而在浓度为3 g·L-1时TX-100的脱附率高于SDS。这是因为离子型表面活性剂的胶束内核由疏水性的烷基链构成,而表面由亲水基团构成,这些表面基团不能与疏水有机物结合,而且对疏水有机物向胶束的扩散还起到排斥作用[22];当溶液中非离子型表面活性剂浓度增高时,疏水性有机物除了在胶束核中的分配外,也能在胶束表面定向排列的聚氧乙烯链中分散[23,24],所以非离子型表面活性剂对柴油的增容作用比相应的离子型表面活性剂要高些。当浓度为5 g·L-1时,虽然TX-100对柴油的脱附率在增加,但是增加的幅度却没有SDS大,以致大量的TX-100被吸附于土壤颗粒表面甚至深入颗粒内部,增加了土壤中有机质含量,特别是有机碳的含量,增强了土壤对其中有机污染物的束缚强度,甚至直接分配进入被土壤吸附的表面活性剂中[25],导致了其脱附率降低。另外需要指出的是,虽然阴离子表面活性剂的脱附效率较高,但是其毒性较大,当其使用浓度较高时,容易对土壤中的微生物造成危害,对土壤环境影响较大[9]。
当SDS的浓度为1 g·L-1时,柴油脱附率反而比浓度为3 g·L-1时要高,说明柴油脱附率与表面活性剂浓度之间并不是简单的线性关系;当表面活性剂的浓度为5 g·L-1时,对土壤中柴油的脱附率比表面活性剂浓度为1 g·L-1或3 g·L-1高。有研究表明[18],单一使用某种脱附剂时,助剂浓度和表面活性剂浓度保持1∶1时能达到最佳的脱附效果。 2.3 复合型脱附剂组分中皂角苷对柴油脱附的影响
图 2给出了不同质量比下(6∶4、5∶5、8∶2)复合型脱附剂对土壤中柴油的脱附结果。可以看出,三种复合表面活性剂(SDS-TX-100、SDS-皂角苷、TX-100-皂角苷)对柴油的脱附率均比单一使用SDS和TX-100时对柴油的脱附率高。研究表明[26],由于不同类型的脱附剂在溶液中混合时能形成混合胶束,而复合型脱附剂的混合胶束CMC更低,污染物在其中的分配系数更大,因而复合型脱附剂对HOC的脱附效果比单一脱附剂更好。此外,混合胶束外层的负电荷更多,而且极性更低,抑制了氢键结合作用和静电作用,从而可以明显降低其在土壤上的吸附损失。

|
| 图 2 复合型脱附剂对柴油的脱附效果 Figure 2 Removal efficiency of diesel fuel by mixed surfactants as a function of surfactant initial concentrations |
从图 2可以看出,在相同浓度下,含皂角苷的复合表面活性剂(SDS-皂角苷、TX-100-皂角苷)对柴油的脱附效果比SDS-TX-100复合表面活性剂好(P<0.05)。这是因为皂角苷是一种具有表面活性的生物分子,其化学结构要比化学合成的表面活性剂复杂和庞大得多,单个分子要占据更大的空间,表面活性要强于化学合成的表面活性剂,其对有机污染物的增溶作用也占更大的优势[27],因而可以增强对柴油的脱附效果。研究表明超过CMC以后,随着总表面活性剂浓度的增加,脱附率会不断增大[28]。但从图 2可以看出,在相同质量比的条件下,随着表面活性剂浓度的增加,同种类型的脱附剂之间,柴油脱附率并没有显著差异(P<0.05)。可能是因为表面活性剂在浓度为1 g·L-1时,柴油的脱附率已经达到了峰值,所以继续增加表面活性剂的浓度,其脱附率没有显著增高。本研究结果表明,在SDS与皂角苷按质量比为5∶5、浓度为1 g·L-1时,对柴油的脱附效果最好,脱附率达到88.65%,分别比SDS-TX100和TX-100-皂角苷提高了16.65个和4.81个百分点。 2.4 脱附剂的回用
柴油污染土壤经脱附后,脱附液中仍含有可以重复利用的成分,如果直接排放,不仅造成浪费,而且会污染环境。因此,我们进一步就SDS-皂角苷复合脱附液的回收次数对柴油脱附的影响进行了研究。从图 3可以看出,利用脱附液对脱附后的土壤再次脱附,仍有一定的效果,当回用次数为两次时,柴油脱附率为17.6%。这是因为脱附液中表面活性剂胶束还未饱和,仍有吸附柴油烃的能力,所以能取得一定的效果,而当回用次数为三次时,脱附率只有9.6%,此时液相中表面活性剂胶束已趋于饱和,且大量悬浮的泥沙颗粒物对表面活性剂也有一定的吸附作用,从而使脱附率不断降低。

|
| 图 3 回用次数对柴油脱附的影响 Figure 3 Influence of surfactant reuse times on diesel removal efficiency |
污染土壤经三次脱附后,柴油含量明显降低,其含量在0.09%左右,根据土壤环境质量标准[30]可知(表 4),土壤中的柴油含量在第一级(0.01%)与第二级标准值(0.5%)之间,属于尚清洁土壤(土壤环境质量第三级标准值因不同场地土壤、污染物、受体和环境条件等差别而具有特定性,故难以设定具体值)。
从图 4可以看出,使用SDS与皂角苷组合的脱附剂,脱附剂残留量仅为2510 mg·kg-1。Zhou等[31]研究表明,脱附剂的残留量与脱附剂的使用浓度线性相关。当使用传统复合型脱附剂SDS-TX-100时,在不同质量比下,脱附剂残留量都超过2000 mg·kg-1,当浓度增加到1.75 g·L-1时,残留量可达到5000 mg·kg-1;而使用皂角苷进行柴油污染土壤的脱附时,达到最高脱附率时,其浓度仅为1 g·L-1时,减少了脱附剂的用量,相应降低了对土壤的二次污染。

|
| 图 4 淋洗次数对脱附剂的影响 Figure 4 Effects of washing times on surfactant residues |
从图 4还可以看出,脱附剂残留量与淋洗次数线性相关,经过3次淋洗后脱附剂的残留量从2510 mg·kg-1下降到1790 mg·kg-1,与文献[32]得出的结论相符。因此,通过去离子水的淋洗可以有效地降低土壤中脱附剂的残留量。 3 结论
(1)通过正交试验得出脱附柴油的最适条件为:助剂硅酸钠浓度为5 g·L-1,温度为70 ℃,振荡时间为50 min。
(2)皂角苷与SDS、TX-100复合后能显著提高柴油脱附率。当SDS与皂角苷质量比为5∶5,总表面活性剂的浓度为1 g·L-1时,脱附率达88.65%,比SDS-TX-100复合脱附剂提高了16.6个百分点。
(3)脱附液回用试验表明,SDS-皂角苷复合脱附液仍有一定的脱附能力,回用两次后,柴油的脱附率为17.6%,经过三次脱附,土壤达到尚清洁的标准。
(4)SDS-皂角苷复合脱附剂的残留量显著低于相同浓度的SDS-TX-100复合脱附剂,经过三次淋洗后,使土壤中脱附剂残留量从2510 mg·kg-1下降到了1790 mg·kg-1。
| [1] | ShamsiJazeyi H, Verduzco R, Hirasaki G J. Reducing adsorption of anionic surfactant for enhanced oil recovery:Part I. Competitive adsorption mechanism[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2014, 453:162-167. |
| [2] | Sheng J J. Review of surfactant enhanced oil recovery in carbonate reservoirs[J]. Advances in Petroleum Exploration and Development, 2013, 6(1):1-10. |
| [3] | Li C R, Wang W K, Chai L H. Study on bioremediation of petroleum-contaminated soil[J]. Soil, 2008, 40(5):824-827. |
| [4] | Worthen A J, Foster L M, Dong J, et al. Synergistic formation and stabilization of oil-in-water emulsions by a weakly interacting mixture of zwitterionic surfactant and silica nanoparticles[J]. Langmuir, 2014, 30(4):984-994. |
| [5] | Reichert M D, Walker L M. Interfacial tension dynamics, interfacial mechanics, and response to rapid dilution of bulk surfactant of a model oil-water-dispersant system[J]. Langmuir, 2013, 29(6):1857-1867. |
| [6] | Chong Z Y, Liao X Y, Yan X L, et al. Enhanced desorption of PAHs from manufactured gas plant soils using different types of surfactants[J]. Pedosphere, 2014, 24(2):209-219. |
| [7] | Hussein T A, Ismail Z Z. Desorption of selected PAHs as individuals and as a ternary PAH mixture within a water-soil-nonionic surfactant system[J]. Environmental Technology, 2013, 34(3):351-361. |
| [8] | Tang J C, Wang R G, Niu X W, et al. Characterisation of the rhizoremediation of petroleum-contaminated soil:Effect of different influencing factors[J]. Biogeosciences, 2010, 7(12):3961-3969. |
| [9] | 程国玲, 李培军. 石油污染土壤的植物与微生物修复技术[J]. 环境工程学报, 2007, 1(6):91-96. CHENG Guo-ling, LI Pei-jun. Phytoremediation and microbial remediation of petroleum contaminated soil[J]. Journal of Environmental Engineering, 2007, 1(6):91-96. |
| [10] | Urum K, Grigson S, Pekdemir T, et al. A comparison of the efficiency of different surfactantsfor removal of crude oil from contaminated soils[J]. Chemosphere, 2006, 62(9):1403-1410. |
| [11] | Szulc A, Ambrozewicz D, Sydow M, et al. The influence of bioaugmentation and biosurfactant addition on bioremediation efficiency of diesel-oil contaminated soil:Feasibility during field studies[J]. Journal of Environmental Management, 2014, 132:121-128. |
| [12] | Wojtera-Kwiczor J, zukowska W, Graj W, et al. Rhizoremediation of diesel-contaminated soil with two rapeseed varieties and petroleum degraders reveals different responses of the plant defense mechanisms[J]. International Journal of Phytoremediation, 2014, 16(7-8):770-789. |
| [13] | Zhou W J, Zhu L Z. Efficiency of surfactant-enhanced desorption for contaminated soils depending on the component characteristics of soil-surfactant-PAHs system[J]. Environmental Pollution, 2007, 147(1):66-73. |
| [14] | Mata-Sandoval J C, Karns J, Torrents A. Influence of rhamnolipids and Triton X-100 on the desorption of pesticides from soils[J]. Environmental Science Technology, 2002, 36(21):4669-4675. |
| [15] | Dixit N, Maloney K M, Kalonia D S. Protein-silicone oil interactions:Comparative effect of nonionic surfactants on the interfacial behavior of a fusion protein[J]. Pharmaceutical Research, 2013, 30(7):1848-1859. |
| [16] | Delille D, Pelletier E, Coulon F. The influence of temperature on bacterial assemblages during bioremediation of a diesel fuel contaminated subantarctic soil[J]. Cold Regions Science and Technology, 2007, 48(2):74-83. |
| [17] | 杜艳梅, 廉景燕, 杨 坚, 等. 表面活性剂处理重度石油污染土壤的改良[J]. 天津理工大学学报, 2009, 25(2):8-9. DU Yan-mei, LIAN Jing-yan, YANG Jian, et al. Improvement of the idea about dealing with soil polluted by oil using surfactants[J]. Journal of Tianjin University of Technology, 2009, 25(2):8-9. |
| [18] | Mulligan C N, Yong R N, Gibbs B F, et al. Metal removal from contaminated soil and sediments by the biosurfactant surfactin[J]. Environmental Science Techology, 1999, 33(21):3812-3820. |
| [19] | Wu T, Crapper M. Simulation of biopile processes using a hydraulics approach[J]. Journal of Hazardous Materials, 2009, 171(1-3):1103-1111. |
| [20] | Erin A G, William F, Paul R J. Phylogenetic diversity of grampositive bacteria cultured form marine sediment[J]. Applied and Environmental Microbiology, 2009, 73(10):3272-3282. |
| [21] | Xu Z, Shaw A Y, Cappelli A, et al. Estimation of the capability of surfactant in reducing the interfacial tension in Surfactant/Alkali/Crude oil systems via quantification[J]. Energy Sources, Part A:Recovery, Utilization, and Environmental Effects, 2013, 35(23):2189-2197. |
| [22] | Zhang Z Q, Xia S Q, Wang X J, et al. A novel biosorbent for dye removal:Extracellular polymeric substance(EPS) of Proteus mirabilis[J]. Journal of Hazardous Materials, 2009, 163(1):279-284. |
| [23] | Uchechukwu V O, Ana C, Jordi D, et al. Biodegradation of phenanthrene by indigenous microorganisms in soils from Livingstone Island, Antarctica[J]. Fems Microbiology Letter, 2012, 329(1):69-77. |
| [24] | Zhou X, Xin Z J, Lu X H, et al. High effciency degradation crude oil by a novel mutant irradiated from Dietzia strain by 12C6+ Heavy ion using response surface methodology[J]. Bioresource Technology, 2013, 137:386-393. |
| [25] | Bera A, Mandal A, Guha B B. Synergistic effect of surfactant and salt mixture on interfacial tension reduction between crude oil and water in enhanced oil recovery[J]. Journal of Chemical & Engineering Data, 2013, 59(1):89-96. |
| [26] | Pons-Jiménez M, Cartas-Rosado R, Martínez-Magadán J M, et al. Theoretical and experimental insights on the true impact of C12 TAC cationic surfactant in enhanced oil recovery for heavy oil carbonate reservoirs[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2014, 455:76-91. |
| [27] | 苏 丹, 李培军, 鞠京丽, 等. 非流体介质中多环芳烃污染的微生物固定化修复技术[J]. 生态应用学报, 2006, 17(8):1530-1534. SU Dan, LI Pei-jun, JU Jing-li, et al. Remediation of polycyclic aromatic hydrocarbons in non-fluid medium with immobilized microorganism technique[J]. Chinese Journal of Applied Ecology, 2006, 17(8):1530-1534. |
| [28] | Viisimaa M, Karpenko O, Novikov V, et al. Influence of biosurfactant on combined chemical-biological treatment of PCB-contaminated soil[J]. Chemical Engineering Journal, 2013, 220:352-359. |
| [29] | Xu J, Zhang Y, Chen H, et al. Effect of surfactant headgroups on the oil/water interface:An interfacial tension measurement and simulation study[J]. Journal of Molecular Structure, 2013, 1052:50-56. |
| [30] | 曹云者, 施烈焰, 李 丽, 等. 石油烃污染场地环境风险评价与风险管理[J]. 生态毒理学报, 2007, 2(3):266-272. CAO Yun-zhe, SHI Lie-yan, LI Li, et al. Petroleum hydrocarbons-contaminated sites and related risk-based management strategy[J]. Journal of Ecotoxicology, 2007, 2(3):266-272. |
| [31] | Zhou W J, Zhu L Z. Enhanced soil flushing of phenanthrene by anionic-nonionic mixed surfactant[J]. Water Research, 2008, 42(1-2):101-108. |
| [32] | Wan J Z, Yuan S H, Lu X H, et al. Enhanced washing of HCB contaminated soils by methyl-β-cyclodextrin combined with ethanol[J]. Chemosphere, 2009, 75(6):759-764. |
 2015, Vol. 34
2015, Vol. 34