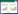文章信息
- 于志红, 黄一帆, 廉菲, 谢丽坤, 刘爽, 宋正国
- YU Zhi-hong, HUANG Yi-fan, LIAN Fei, XIE Li-kun, LIU Shuang, SONG Zheng-guo
- 生物炭-锰氧化物复合材料吸附砷(Ⅲ)的性能研究
- Adsorption of Arsenic(Ⅲ) on Biochar-manganese Oxide Composites
- 农业环境科学学报, 2015, 34(1): 155-161
- Journal of Agro-Environment Science, 2015, 34(1): 155-161
- http://dx.doi.org/10.11654/jaes.2015.01.022
-
文章历史
- 收稿日期:2014-06-30
2. 中国农业科学院农业环境与可持续发展研究所, 北京 100086
2. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Science, Beijing 100086, China
含砷金属的开采、冶炼以及以砷及其化合物为原料进行的工业生产,已经造成严重的砷污染。在环境中无机砷化合物毒性是有机砷化合物毒性的100倍[1],其中无机态的砷(Ⅲ)毒性最大,对动植物及人体都有不同程度的危害[2,3]。目前对砷污染的修复包括去除和氧化两种类型,水体的砷污染治理有很多方法,如:氧化聚沉[4],化学、静电沉淀[5,6],铝盐凝聚[7],反渗透[8],离子交换树脂[9],吸附和凝聚过微孔膜[10]。然而,这些相关技术操作复杂,成本较高且难以推广应用,有些甚至需要后续处理(铝盐凝聚等)。吸附法由于成本低、操作简单、可以原位修复而且去除效果较好,已成为一种有效实用的除砷方法。
作为一种吸附材料,生物炭已被广泛地研究。生物炭是生物质(如农作物秸秆、树木纤维等[11])在缺氧条件下高温裂解产生的固相物质[12,13],其元素组成主要是碳、氢、氧等,有机碳含量可达70%~80%[14],其主要成分是烷基和芳香结构[15],此外还含少量矿物质和挥发性有机物。很多研究[16,17,18,19]表明生物炭表面特殊的微孔结构和表面化学特性使其对重金属具有一定的吸附能力,影响着重金属在环境中的分布、迁移以及生物有效性。低温(低于400 ℃)热解对重金属吸附能力差,高温(大于400 ℃)热解可以获得更高的比表面积和更多的微孔结构[20],为了得到更好的吸附效果,本文采用600 ℃高温热解秸秆制得生物炭。
单一的生物炭对重金属的吸附效果远不如与其他物质结合之后的复合材料的吸附效果。复合材料是将两种或两种以上不同性质的材料,利用物理、化学方法合成的具有新性能新结构的材料,其综合性能优于原组成材料而满足各种不同的要求[21]。近年来将锰氧化物作为改性材料应用于制造复合材料一直是研究热点,如锰氧化物-活性炭材料、锰氧化物-树脂、锰氧化物-纳米材料等[22,23,24],在水处理、空气清新剂等领域应用广泛[22,25]。樊伟等[22]用交联壳聚糖(CCTS)固载纳米MnO2,制作成膜进行吸附研究,发现对砷的吸附在8 mg·L-1浓度以下去除效果可达到国家污水排放标准,其最大去除量达13.33 mg·g-1,吸附机制为物理化学多分子吸附。Luo等[26]发现,将Fe3O4固载到MnO2纳米材料上对砷(Ⅲ)进行吸附,效果也较好。但将锰氧化物与生物炭结合即炭-锰复合材料的研究还不多见[27]。
锰氧化物对砷(Ⅲ)有很强的吸附能力[28],将其固定在材料上对重金属的吸附效果更好、更快,且适用pH范围宽[19,21]。已有研究证实,锰氧化物固载树脂对液体中的铅和钙有较好的吸附作用[29],而且相对于铁氧化物来说锰氧化物对重金属有更强的约束力[30],我们设想锰氧化物负载到生物炭上对砷也可能有较好的吸附效果。已知秸秆生物炭对砷也有一定的吸附作用,但将两者结合起来作为吸附材料的研究较少。因此,本文选用高温(600 ℃)热解玉米秸秆制备的生物炭为炭基,制备出炭-锰复合材料,研究其对砷(Ⅲ)的吸附特征与吸附效果,以期为砷污染水体环境修复提供数据支撑。 1 试验材料与方法 1.1 供试吸附材料
生物炭(英文简写为BC):将玉米秸秆磨碎,放入马弗炉内,氮气保护下600 ℃热解2 h,冷却至室温。用抽滤法将生物炭用去离子水清洗至中性,60 ℃烘干研磨后,过100目尼龙筛备用。
生物炭-锰氧化物复合材料(简称炭-锰复合材料):称取5 g生物炭放入刚玉坩埚,加入浓度0.035~0.35 mol·L-1的高锰酸钾溶液40 mL,超声波超声2 h混匀,95 ℃水浴蒸干后,放入马弗炉600 ℃无氧热解30 min,冷却至室温备用[19]。理论上生物炭与锰氧化物的质量比为20∶1、10∶1、10∶3、10∶5。
制备的炭-锰复合材料宏观上是一种黑色粉末状固体,微观形貌通过扫描电镜观察。从图 1可以看出,锰氧化物较均匀地附着在生物炭表面,生物炭中大部分中、微孔隙被锰氧化物填充,导致其比表面积变小。生物炭与炭-锰复合材料的性质测定方法参见 Uchimiya等[31]的方法。

|
| 图 1 制备的炭-锰复合材料扫描电子显微镜照片 Figure 1 Scanning electron micrograph of biochar-manganese oxides composite |
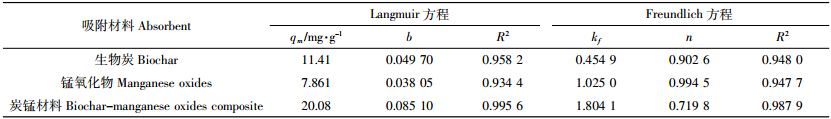
炭-锰复合材料和生物炭的基本理化性质见表 1。从表 1可以看出,炭-锰复合材料的锰含量为7.41%,略低于理论计算值(9.09%);炭-锰复合材料的比表面积降幅明显,只为生物炭的5.20%。与生物炭材料相比,炭-锰复合材料C和H的含量明显下降,而氧含量却增加了一倍。一般来说,H/C可以用来评价碳化程度[32];炭-锰复合材料和生物炭的H/C分别为0.020 5和0.004 5,较Samsuri等[23]用空果皮和水稻籽粒壳制作的生物炭H/C(分别为0.08和0.05)要低,表明600 ℃热解后的炭-锰复合材料和生物炭碳化程度较高。
 |
吸附实验采用一次平衡法,每个处理重复3次。 分别称取0.04、0.08、0.16、0.24、0.32 g生物炭与炭-锰复合材料(20∶1、10∶1、10∶3、10∶5),置于50 mL棕色玻璃瓶中,加入20 mg·L-1的含砷(Ⅲ)溶液20 mL(0.01 mol·L-1硝酸钠为支持电解质,下同),振荡平衡6 h后,用Whatman滤纸过滤。用氢化物发生原子荧光光谱仪(AFS9780)测定滤液中砷浓度,根据吸附平衡前后砷浓度差计算材料砷吸附量,进而计算砷(Ⅲ)的去除率。 1.2.2 动力学吸附试验
称取0.10 g生物炭与炭-锰复合材料(10∶1),置于50 mL棕色玻璃瓶中。加入50 mg·L-1的含砷溶液20 mL,在pH(6±0.2)和(25±0.5)℃下振荡,在不同时间(2 min~7 h)取样后操作同1.2.1。实验重复3次。 1.2.3 不同pH下吸附材料对砷(Ⅲ)的吸附
分别称取生物炭与炭-锰复合材料(10∶1)0.10 g,置于50 mL棕色玻璃瓶中。加入10 mg·L-1砷溶液20 mL,用HCl和NaOH调节溶液的pH3~7,在(25±0.5) ℃下振荡3 h后操作同1.2.1。实验重复3次。 1.2.4 等温吸附试验
分别称取生物炭、炭-锰复合材料(10∶1)与锰氧化物各0.10 g,置于50 mL棕色玻璃瓶中。向每个玻璃瓶中加入一定浓度的砷(Ⅲ)溶液,使溶液中砷(Ⅲ)浓度分别为0.2~50 mg·L-1,溶液最终体积为20 mL。玻璃瓶密封后水平放置,在(25±0.5)℃下振荡6 h后操作同1.2.1。实验重复3次。 1.3 数据处理与分析
采用氢化物发生原子荧光光谱仪(AFS9780)同时测定滤液中砷(Ⅲ)与砷(Ⅴ)浓度。采用Spss16.0和Origin8.6进行数据分析与绘图。 1.3.1 砷吸附量计算
砷吸附量qe=V(C0 -Ce)/m
砷去除率(%)=(C0-Ce)/C0×100%
式中:qe为吸附量,mg·g-1;Ce为平衡浓度,mg·L-1;C0为初始浓度,mg·L-1;V是溶液体积,L;m为吸附材料的质量,g。 1.3.2 动力学方程
准一级动力学方程:y=qe[1 - exp(-k1t)]
准二级动力学方程:t/qt=1/(k2qe2)+t/qe
式中:t为吸附时间,min;qe为平衡吸附量,mg·g-1,qe为t时刻的平衡浓度,mg·L-1;k1,k2分别为两方程的系数。 1.3.3 Langmuir和Freundlich拟合方程
Langmuir方程:qm=qebCe/(1+bCe)
Freundlich方程:qe=keCen
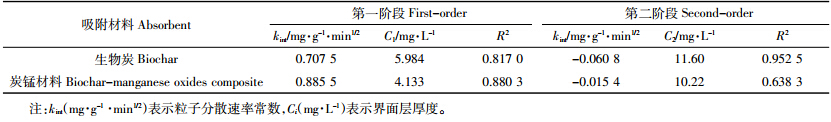
式中:qe表示平衡时吸附量,mg·g-1;Ce表示平衡后溶液中吸附质的质量浓度,mg·L-1;qm表示Langmuir吸附等温线的最大吸附容量,mg·g-1;kf、b、n分别为相应模型中的常数。
粒子分散模型方程: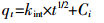
式中:kint表示粒子分散速率常数,mg·g-1· 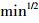 ;Ci表示界面层厚度,mg·L-1。
2 结果与讨论
2.1 不同吸附材料及其用量对砷的去除效果
;Ci表示界面层厚度,mg·L-1。
2 结果与讨论
2.1 不同吸附材料及其用量对砷的去除效果
不同炭-锰质量比的复合材料对砷的去除率明显不同(图 2)。与生物炭相比,不同炭锰质量比的吸附材料对砷的去除率差异显著(P<0.05),炭-锰质量比为10∶5的吸附材料去除砷的效果最好,其次是10∶1炭锰材料,表明吸附效果的增强与锰含量的增加存在一定的关系,但也不完全取决于此。因为锰含量增加导致吸附增加,主要原因应该是锰与生物炭结合后的结构决定了其吸附性能,Song等[19]的研究也表明锰氧化物在合成过程中嵌入生物炭中,而且应用于铜的吸附研究也发现,并不是锰氧化物含量越高吸附效果越好,不同锰氧化物和生物炭质量比改性后的生物炭结构是不同的。随着质量比的增大,比表面积由61.0 m2·g-1(BC)降低到2.2 m2·g-1(10∶3),孔径由23.7 nm(BC)增大到92.2 nm(10∶3),而且灰分、锰、氧的含量都随之增加,但是碳的含量随之降低。当用量为0.32 g时,炭-锰质量比为10∶5的吸附材料砷的去除率可达到84.86%,质量比为10∶1的吸附材料砷的去除率也达到了73.18%。不同量吸附材料对砷的去除率差异显著(P<0.05),随着用量的增加,其对砷(Ⅲ)的去除率明显增加。考虑到炭-锰复合材料在实际应用中性价比的因素,本实验选择炭-锰质量比为10∶1的复合材料作为实验材料。
|
| 图 2 不同生物炭材料及不同用量对砷 (Ⅲ) 去除率的影响 Figure 2 Effects of different biochars and doses on arsenic (Ⅲ) adsorption |
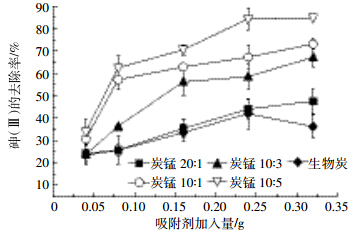
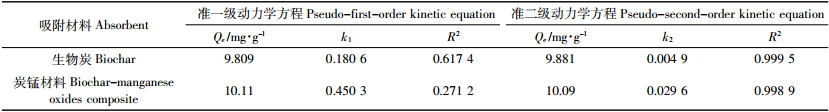
在30 min内,炭-锰复合材料和生物炭对砷(Ⅲ)的吸附量迅速增加,30 min后达到最大吸附;120 min以后出现下降趋势并趋于稳定(图 3)。炭-锰复合材料(10∶1)和生物炭对砷的吸附曲线类似,但是炭-锰复合材料效果好于生物炭。用准一级和准二级动力学方程进行拟合,发现准二级动力学方程拟合效果较好。准一级动力学方程拟合系数分别为0.271 2和0.617 4,准二级动力学方程拟合系数分别达到0.998 9和0.999 5(表 2),表明两种吸附材料吸附过程用准二级动力学方程拟合更好,可在100 min左右达到吸附平衡。且在最初阶段,炭-锰复合材料对砷(Ⅲ)的吸附速率便明显大于生物炭吸附速率,表明炭-锰复合材料对砷(Ⅲ)的吸附性能优于生物炭的性能,是一种更优的污染修复材料。
|
| 图 3 生物炭与炭锰材料吸附砷 (Ⅲ) 的动力学 Figure 3 Kinetics of arsenic (Ⅲ) adsorption by biochar and biochar-manganese oxides composite |
 |
为更详细地阐述其吸附机理,用粒子分散模型[33]对数据进行拟合,粒子分散模型中Ci越大说明界面层厚度影响越大,C2>C1说明第二阶段的界面层厚度对砷的吸附影响增大(表 3)。用此模型进行拟合后发现吸附过程为多过程吸附阶段,第一阶段随着时间的推移qt迅速增长,而后出现轻微的负增长趋势,最后趋于平衡。这与Huang等[34]的研究基本一致,说明吸附过程中包含颗粒内部的分散过程。炭-锰复合材料及生物炭对砷(Ⅲ)的吸附过程一开始溶液中的砷(Ⅲ)就迅速聚集到生物炭表面,表面离子吸附位点达到饱和后又出现离子交换,将砷(Ⅲ)交换下来,最后完成内部扩散达到平衡。
综合来说,该材料对砷(Ⅲ)的吸附过程是一个复杂的过程,包括表面吸附、表面扩散、颗粒内部吸附和聚沉平衡,而且吸附过程更符合准二级动力学方程,所以静电离子交换作用可以忽略。
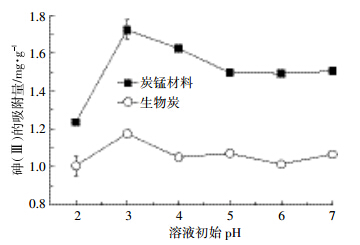
pH是影响重金属在环境中迁移转化的一个非常重要的因素。吸附量在初始pH为2时吸附量最小,pH=3时吸附达到最大(图 4),而后吸附量随pH(3~7)升高无明显变化(P生物炭=0.448和P炭-锰材料=0.437,均大于0.05),与前人的研究结果一致[22,23,35],说明初始pH对砷的吸附影响较小。显示pH在3~7的范围内,对炭-锰复合材料吸附砷的吸附性能影响不大。
|
| 图 4 pH 对生物炭及炭锰材料对砷 (Ⅲ) 的吸附量的影响 Figure 4 Effect of pH on arsenic (Ⅲ) adsorption capacity by biochar and biochar-manganese oxides composite |
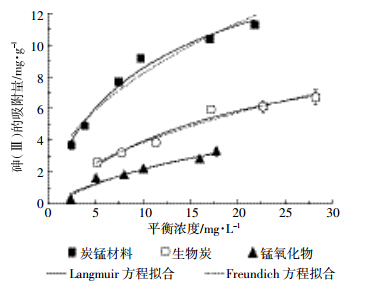
炭-锰复合材料、生物炭与锰氧化物对砷的吸附能力明显不同(图 5)。炭-锰复合材料的吸附量明显高于锰氧化物和生物炭的吸附量,三种材料的吸附效果差异显著(P<0. 05)。随着平衡浓度的增加,炭-锰复合材料、生物炭与锰氧化物对砷的吸附作用增强,在平衡浓度为7.5 mg·L-1左右时,炭-锰复合材料的吸附量(7.67 mg·g-1)是生物炭吸附量(3.21 mg·g-1)的2倍,是锰氧化物吸附量(1.79 mg·g-1)的4.28倍。
|
| 图 5 生物炭与炭锰材料吸附砷 (Ⅲ) 的等温曲线 Figure 5 Isotherms of arsenic (Ⅲ) adsorption by biochar and biochar-manganese oxide composite |
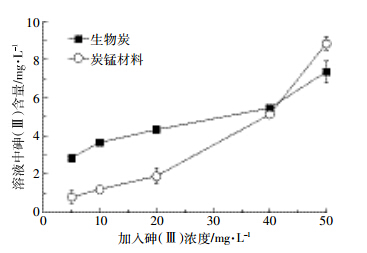
炭-锰材料和生物炭对砷的氧化作用明显存在(图 6)。Song等[19]研究发现高锰酸钾高温(600 ℃)条件,降低了生物炭的比表面积,但是平均孔径增大,增强了锰氧化物的负载,而且也增强了生物炭的极性及其含氧官能团的含量,从而增强了其氧化性能。目前没有关于生物炭的氧化作用的报道,具体氧化过程有待进一步研究。
|
| 图 6 生物炭与炭锰材料对砷 (Ⅲ) 的氧化效果 Figure 6 Arsenic (Ⅲ) oxidation by biochar and biochar-manganese oxide composite |
两种材料吸附砷的特性均可以用Langmuir方程和Freundlich方程进行拟合,且相关系数均在0.92以上,拟合效果较好(表 4)。炭-锰复合材料对不同浓度的砷吸附,用Langmuir方程拟合效果好于Freundlich方程拟合效果,说明其吸附更趋向于均匀介质表面的单层吸附;但生物炭是Freundlich方程拟合效果略好于Langmuir方程,其吸附更趋向于不均匀介质表面的多层吸附。炭-锰复合材料最大吸附量(qm)为20.08 mg·g-1,较生物炭的最大吸附量(11.41 mg·g-1)提高近一倍,是锰氧化物最大吸附量(7.861 mg·g-1)的2.55倍,表明炭-锰复合材料对砷(Ⅲ)的吸附能力明显高于前人[11,34]的研究结果。Luo等[26]用Fe3O4与MnO2改性石墨制成复合材料,对砷(Ⅲ)的最大吸附量为14.04 mg·g-1;Fierro等[36]用氯化铁改性活性炭吸附砷,最大吸附量只有0.028 mg·g-1。在水体砷(Ⅲ)含量低于1.2 mg·L-1时,炭-锰复合材料对砷(Ⅲ)的吸附接近99%。炭-锰材料结合了生物炭的吸附性能与锰氧化物氧化作用[19]的优势,并且改性后孔径增大[21],更有利于其吸附作用。这说明炭-锰复合材料对砷(Ⅲ)有较好的去除作用,可用于砷水体污染环境的修复。
(1)不同质量比的炭-锰复合材料对砷(Ⅲ)的吸附效果有明显差异。与生物炭相比,不同炭锰质量比的吸附材料对砷的去除率差异显著(P<0.05),炭-锰质量比为10∶5的吸附材料去除砷的效果最好,其次是10∶1。考虑到经济与炭锰材料自身安全性问题,质量比为10∶1的炭锰材料是一种相对有发展前景的材料。
(2)pH值为3~7的范围内,pH对炭-锰复合材料和生物炭吸附砷(Ⅲ)的性能影响不大。
(3)锰氧化物、生物炭和炭-锰复合材料对砷(Ⅲ)都有一定的吸附效果,其中炭-锰复合材料对砷(Ⅲ)吸附性能明显优于前两者,其最大吸附量为20.08 mg·g-1。
| [1] | Jain C K, Ali I. Arsenic: Occurrence, toxicity and speciation techniques[J]. Water Research, 2000, 34(17):4304-4312. |
| [2] | 陈怀满. 土壤-植物系统中的重金属污染[M]. 北京: 科学出版社,1996: 1-15. CHEN Huai-man. Heavy mental pollution in soil-plant system[M]. Beijing: Science Press, 1996: 1-15. |
| [3] | 白爱梅, 李 跃, 范中学. 砷对人体健康的危害[J]. 微量元素与健康研究, 2007, 7:61-62. BAI Ai-mei, LI Yue, FAN Zhong-xue. The health hazards in arsenic[J]. Studies of Trace Elements and Health, 2007, 7: 61-62. |
| [4] | Olivier X L, Stephan J H.Oxidation and removal of arsenic(Ⅲ) from aerated groundwater by filtration through sand and zero-valent iron[J].Water Research, 2005, 39(9): 1729-1740. |
| [5] | Kumar P R,Chaudhari S, Khilar K C,et al. Removal of arsenic from water by electrocoagulation[J]. Chemosphere, 2004, 55(9): 1245-1252. |
| [6] | Balasubramanian N, Toshinori K, Ahmed B C, et al. Removal of arsenic from aqueous solution using electrocoagulation[J]. Journal of Hazardous Materials, 2009, 167(15): 966-969. |
| [7] | 袁金华, 徐仁扣. 生物质炭的性质及其对土壤环境功能影响的研究进展[J]. 生态环境学报, 2011, 20(4): 779-785. YUAN Jin-xua, XU Ren-kou. Progress of the research on the properties of biochars and their influence on soil environmental functions[J]. Ecological Environmental Science, 2011, 20(4): 779-785. |
| [8] | Beesley L, Moreno J E, Gomez-Eyles J L, et al. A review of biochars'potential role in the remediation, revegetation and restoration of contaminated soils[J]. Environmental Pollution, 2011, 159(12): 3269-3282. |
| [9] | Shih M C. An overview of arsenic removal by pressure-driven membrane processes[J]. Desalination, 2005, 172(1): 85-97. |
| [10] | Han B B, Reunnells T, Zimbron J, et al. Arsenic removal from drinking water by flocculation and microfiltration[J]. Desalination, 2002,145(1-3): 293-298. |
| [11] | Kwapinski W, Byrne C M P, Kryachko E P, et al. Biochar from biomass and waste[J]. Waste Biomass Valorizat, 2010,1(2): 177-189. |
| [12] | Woolf D, Amonette J E, Street-Perrott A, et al.Sustainable biochar to mitigate global climate change[J]. Nature Communications, 2010, 1: 1-9. |
| [13] | Kolodynska D, Wnetrzakb R, Leahy J J. Kinetic and adsorptive characterization of biochar in metal ions removal[J]. Chemical Engineering Journal, 2012, 197(15): 295-305. |
| [14] | Lehmann J, Joseph S M. Biochar for environmental management: Science and technology, Earthscan, London UK[J]. Forest Policy and Economics, 2009, 11(7): 535-536. |
| [15] | Sun K, Ro K, Guo M X, et al. Sorption of biosphenol A, alpha-ethinyl estradiol and phenanthrene on thermally and hydrothermally produced biochars[J]. Bioresource Technology, 2011, 102(10):5757-5763. |
| [16] | Borchard N, Prost K, Kautz T, et al. Sorption of copper(Ⅱ) and sulphate to different biochars before and after composting with farmyard manure[J]. European Journal of Soil Science, 2012, 63(3): 399-409. |
| [17] | Gupta K, Maity A, Ghosh U C. Manganese associated nanoparticles agglomerate of iron(Ⅲ) oxide: Synthesis, characterization and arsenic(Ⅲ) sorption behavior with mechanism[J]. Journal of Hazardous Materials, 2010, 184(1-3): 832-842. |
| [18] | Biswas B K, Inoue J, Inoue K, et al. Adsorptive removal of As(Ⅴ) and As(Ⅲ) from water by a Zr(Ⅳ)-loaded orange waste gel[J]. Journal of Hazardous Materials, 2008, 154(1-3):1066-1074. |
| [19] | Song Z G, Lian F, Yu Z H, et al. Synthesis and characterization of a novel MnOx-loaded biochar and its adsorption properties for Cu2+ in aqueous solution[J]. Chemical Engineering Journal, 2014, 242(15):36-42. |
| [20] | Chen B, Chen Z. Sorption of naphthalene and 1-naphthol by biochars of orange peels with different pyrolytic temperatures[J]. Chemosphere,2009, 76(2-3):127-136. |
| [21] | 沃丁柱. 复合材料大全[M]. 北京:化学工业出版社,2000:1-50. WO Ding-zhu. Encyclopedia of composites[M]. Beijing: Chemical Industry Press, 2000:1-50. |
| [22] | 樊 伟, 卞战强, 田向红, 等. 固载化纳米MnO2对砷的吸附性能研究[J]. 水处理技术, 2013, 39(1): 60-64. FAN Wei, BIAN Zhan-qiang, TIAN Xiang-hong, et al. Study on the adsorption properties of nano-MnO2 materials on arsenic immobilization[J]. Water Treatment Technology, 2013, 39(1): 60-64. |
| [23] | Samsuri A W, Sadegh-Zadeh F, Seh-Bardan B J. Adsorption of As(Ⅲ) and As(Ⅴ) by Fe coated biochars and biochars produced from empty fruit bunch and rice husk[J]. Journal of Environmental Chemical Engineering, 2013, 1(4): 981-988. |
| [24] | Lenoble V, Laclautre C, Serpaud B, et al. As(Ⅴ) retention and As(Ⅲ) simultaneous oxidation and removal on a MnO2-loaded polystyrene resin [J]. Science of the Total Environment, 2004, 326(1-3):197-207. |
| [25] | Christophe T, Laurent C, Dirk B, et al. Arsenic(Ⅲ) oxidation by birnessite and precipitation of manganeses(Ⅱ) arsenate[J]. Environmental Science & Technology, 2002, 36(3): 493-500. |
| [26] | Luo X B, Wang C C,Luo S L, et al. Adsorption of As(Ⅲ) and As(V) from water using magnetite Fe3O4-reduced graphite oxide-MnO2 nanocomposites[J]. Chemical Engineering Journal, 2012, 187(1): 45-52. |
| [27] | 陈 钰,龚正君,杨顺生, 等. 改性玉米秸秆吸附Cu2+的动力学和热力学[J]. 环境工程学报, 2013, 7(2): 523-529. CHEN Yu, GONG Zheng-jun, YANG Shun-sheng, et al. Kinetics and thermodynamics for Cu2+ adsorption by modified corn straw[J]. Techniques and Equipment for Environmental Pollution Control, 2013, 7(2): 523-529. |
| [28] | Mohammad A, Westerhoff P, Knappeb D R U. Intraparticle diffusion and adsorption of arsenate onto granular ferric hydroxide(GFH)[J].Water Research, 2004, 38(18): 4002-4012. |
| [29] | Dong L, Zhu Z, Ma H, et al. Simultaneous adsorption of lead and cadmium on MnO2-loaded resin[J]. Journal of Environmental Science, 2010, 22(2): 225-229. |
| [30] | O'Reilly S E, Hochella Jr M F. Lead sorption efficiencies of natural and synthetic Mn and Fe-oxides[J]. Geochim Cosmochim Ac, 2003, 67(23): 4471-4487. |
| [31] | Uchimiya M, Wartelle L H, Klasson K T, et al. Influence of pyrolysis temperature on biochar property and function as a heavy metal sorbent in soil[J]. Journal of Agriculture and Food Chemistry, 2011, 59(6):2501-2510. |
| [32] | Chun Y, Sheng G, Chiou C T, et al. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science & Technology, 2004, 38(17): 4649-4655. |
| [33] | Huang L H, Kong J J, Wang W L, et al. Study on Fe(Ⅲ) and Mn(Ⅱ) modified activated carbons derived from Zizanialatifolia to removal basic fuchsin[J]. Desalination, 2012, 286: 268-276. |
| [34] | 代天娇, 彭 彤, 陶 晨, 等. 天然锰砂去除水中的砷[J]. 环境工程学报,2013, 7(1): 58-64. DAI Tian-jiao, PENG Tong, TAO Chen,et al. Remove arsenic in water natural manganese sand[J]. Chinese Journal of Environmental Engineering, 2013, 7(1): 58-64. |
| [35] | Fierro V, Muniz G, Gonezlez-Sanchez G, et al. Arsenic removal by iron-doped activated carbons prepared by ferricchloride forced hydrolysis[J]. Journal of Hazardous Materials, 2009,168(1): 430-437. |
 2015, Vol. 34
2015, Vol. 34