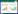文章信息
- 薛培英, 陈苗苗, 耿丽平, 赵全利, 王亚琼
- XUE Pei-ying, CHEN Miao-miao, GENG Li-ping, ZHAO Quan-li, WANG Ya-qiong
- 轮叶黑藻对无机砷的吸收和释放
- Uptake and Release of Inorganic Arsenic by Hydrilla verticillata(L.f.) Royle
- 农业环境科学学报, 2015, 34(10): 1853-1857
- Journal of Agro-Environment Science, 2015, 34(10): 1853-1857
- http://dx.doi.org/10.11654/jaes.2015.10.003
-
文章历史
- 收稿日期: 2015-04-12
2. 河北农业大学科学技术研究院, 河北 保定 071001;
3. 河北农业大学教学实验场, 河北 保定 071001
2. Science and Technology Research Institute, Agriculture University of Hebei, Baoding 071001, China;
3. Farm of Teaching and Experimentation, Agriculture University of Hebei, Baoding 071001, China
砷是一种“已知的人类致癌物质”[1]。自然水体中砷浓度由1 μg·L-1到1000 μg·L-1,范围很广[2]。我国是砷污染最为严重的国家之一,近年来水体砷污染事件频发,例如:2008年云南阳宗海水体遭受砷污染,总砷含量达到160 μg·L-1;2009年江苏邳苍分洪道东西两省界断面水体砷浓度分别达到1978 μg·L-1和510 μg·L-1,远超过地表水环境质量标准(GB 3838—2002)Ⅲ类水标准限值(50 μg·L-1)。水体中的砷会最终随着食物链传递进入人体而危害健康,水体砷污染问题亟待解决。沉水植物完全浸没在水中,地上部茎、叶同根一样具有吸收作用,研究表明沉水植物对水体中的污染物质包括砷具有较强的富集能力,且富集能力通常高于其他大型水生植物(挺水植物、浮叶植物和漂浮植物),一些沉水植物体内砷含量甚至超过1000 mg·kg-1,可以作为砷超富集植物[3, 4, 5]。
轮叶黑藻是我国乃至世界自然水体中最常见的沉水植物,通常可以在深度0.5~2 m的水中生长,其生物量较大,且对砷具有较强的富集能力[6, 7, 8]。本文作者的前期研究表明,轮叶黑藻在20 μmol·L-1砷溶液中暴露4 d后,体内富集的砷>700 mg·kg-1DW[9],但是其对不同形态无机砷的吸收、体内形态转化以及释放能力尚不清楚。Xu等[10]和Zhang等[11, 12, 13]的研究表明,陆生植物水稻和番茄的根以及水生植物满江红(Azolla)、无根萍(Wolffia globose)和紫萍(Spirodela polyrhiza L.)均可以迅速吸收环境中的五价砷(AsⅤ),并可以将其还原为毒性更高的三价砷(AsⅢ)排出。如果沉水植物轮叶黑藻对无机砷也存在这种吸收和代谢过程,将会阻碍其应用于修复砷污染水体。因此,本研究以轮叶黑藻为对象,通过短期吸收动力学以及吸收、释放过程研究,明确沉水植物黑藻对无机砷(AsⅤ和AsⅢ)的吸收与释放能力,及其应用于砷污染水体修复的潜力。
1 材料与方法 1.1 植物材料与培养轮叶黑藻[Hydrilla verticillata(L.f.) Royle]取自江苏省无锡市太湖水域。样品采集后,于温室中将10~20 cm植物顶枝栽于盛土的塑料桶内(容积200 L,直径50 cm,高85 cm),培育3~5个月,待其生出新根和顶枝。对植物进行处理之前,取生长一致的顶枝于人工淡水中驯化7 d。人工淡水配方[9]:22.7 mg·L-1 MgSO4·7H2O,30.7 mg·L-1 MgCl2·2H2O,20.4 mg·L-1 CaCl2·2H2O,45.7 mg·L-1 NaCl,26.0 mg·L-1 NaHCO3,3.61 mg·L-1 KCl,1.41 mg·L-1 FeCl3·6H2O,0.97 mg·L-1 Al2(SO4)3·18H2O,0.19 mg·L-1 MnCl2·4H2O,3.86 μg·L-1 ZnSO4·7H2O,2.17 μg·L-1 CuCl2·2H2O。其pH值用NaOH和HCl调至7.0。
试验在可控光温的培养箱中进行,光暗周期为14 h/10 h,温度(25±2)℃,光照强度为115 μmol·m-2·s-1,相对湿度70%。
1.2 砷的短期吸收动力学研究黑藻在室内驯化7 d后,挑选生长一致、健康的顶枝进行吸收动力学试验。称取0.3 g新鲜植物样品置于一系列盛有50 mL AsⅤ和AsⅢ溶液(0、20、40、80、160 μmol·L-1)的具塞三角瓶中,每个处理三个重复。所有待测液中均含有5.0 mmol·L-1的MES(2-N-吗啉代乙磺酸)和0.5 mmol·L-1 CaCl2以维持体系的pH值(6.0)和离子强度。三角瓶置于60 r·min-1的摇床上,振荡20 min后将植物取出,于冰磷酸溶液(1 mmol·L-1 K2HPO4,5 mmol·L-1 MES和0.5 mmol·L-1 CaCl2,pH 6.0)中浸提10 min去除吸附在植物表面的砷[11]。之后用去离子水冲洗三遍,拭干后于70 ℃烘箱烘干至恒重,消煮测定植物体内砷含量(见1.6)。
通常米氏方程用于表征酶促反应动力学,在此通过拟合该方程表示植物对金属的吸收动力学特征[11]:
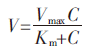
将准备好的植物材料转移到2 L 0.1 mmol·L-1 CaCl2溶液中驯化12 h,之后称取1.0 g植物转移到装有200 mL混合溶液(0.1 mmol·L-1 CaCl2和 2 μmol·L-1 AsⅤ的水溶液)的三角瓶中,用封口膜封住三角瓶瓶口防止蒸发,并扎有小孔保证瓶内气体交换,设三个重复。分别在培养1、6、12、24和48 h后取0.5 mL溶液,用磷酸缓冲溶液(2 mmol·L-1 NaH2PO4和0.2 mmol·L-1 Na2-EDTA,pH 6.0)稀释并于4 ℃保存,待测砷形态。
1.4 磷和抑制剂对黑藻吸收和释放砷的影响研究表明陆生高等植物可以通过磷通道吸收AsⅤ,并且进入体内的砷一部分可能与植物螯合肽(PCs)络合来达到解毒的目的[14],因此通过研究磷(NaH2PO4·2H2O)和PCs合成抑制剂丁胱亚磺酰亚胺(BSO)对黑藻吸收和释放砷能力影响,进一步探讨沉水植物黑藻对砷的吸收和体内转化作用机制。将挑选好的植物顶枝(1 g鲜重/盆)分别置于盛有如下溶液(用人工淡水配制)的塑料瓶(500 mL)中:10 μmol·L-1 AsⅤ/AsⅢ,10 μmol·L-1 AsⅤ/AsⅢ+100 μmol·L-1 P,10 μmol·L-1 AsⅤ/AsⅢ+100 μmol·L-1 BSO。培养4 d后,每瓶取1 mL溶液,用上述磷酸缓冲液稀释并于4 ℃储存以测定溶液中的As形态。植物先于冰磷酸溶液中提取10 min,洗去吸附在其表面的砷(如上所述),用去离子水清洗并拭干后,迅速置于液氮中冷冻保存待进行砷形态测定。
1.5 砷形态测定将冷冻的植物样品在液氮中研磨成粉末,称取0.3 g植物粉末于50 mL离心管中,加入10 mL PBS溶液,4 ℃条件下超声处理1 h[10]。测定砷形态之前,所有待测溶液和提取液均过0.45 μm滤膜,于4 ℃黑暗中储存,并在取样后12 h内完成测定。砷形态用高效液相色谱-等离子体质谱联用仪(HPLC-ICP-MS)测定(Agilent LC1100 series 和 Agilent ICP-MS 7500a),分离柱为Hamilton公司的PRP(苯乙烯-二乙烯基苯共聚物)-X100(240 mm× 4.1 mm)型阴离子交换柱。流动相为7.5 mmol·L-1磷酸二氢铵(NH4H2PO4)和7.5 mmol·L-1硝酸铵(NH4NO3),用优级纯的氨水和硝酸调节pH 为6.2。在测试开始和即将结束时对样品进行抽检,未发现砷形态转化。
1.6 植物样品消煮和分析将烘干的植物样品剪碎称取0.02 g,置于50 mL聚丙烯酰胺管中,加入5 mL优级纯浓硝酸过夜,置于CEM微波消解炉进行微波消煮[11](MARS,CEM Microwave Technology Ltd,U.S.)。消煮过程中温度缓慢上升,第一阶段55 ℃加热10 min,第二阶段75 ℃加热10 min,第三阶段95 ℃加热30 min至酸解液澄清透明,植物样完全分解。加入试剂空白和标准物质(灌木枝叶,GBW07602,国家标准物质研究中心)作为消煮过程和测定分析的质量控制,采用原子荧光光谱仪(AF-640,北京瑞利分析仪器公司,中国)测定消解液中的砷浓度。实验测得标准物质的平均砷浓度为(0.95±0.12)mg·kg-1 DW,该值在标准物质的参考阈值范围内[(0.90±0.15)mg·kg-1 DW]。
1.7 数据分析试验数据采用SPSS 13.0进行单因素方差分析(One-way ANOVA),用LSD法进行数据多重比较,采用SigmaPlot 10.0软件作图。
2 结果与分析 2.1 砷的短期吸收动力学特征随着外部砷浓度的增加,黑藻AsⅤ和AsⅢ的吸收速率均迅速增加(图 1),并且其吸收动力学曲线均可以很好地拟合米氏方程(R2>0.99),(表 1)。黑藻对AsⅤ和AsⅢ的最大吸收速率Vmax和米氏常数Km差异均不显著(P>0.05)。
|
| 图 1 黑藻对AsⅤ和AsⅢ的吸收动力学特征 Figure 1 Kinetics of AsⅤ and AsⅢ uptake by H. verticillata |
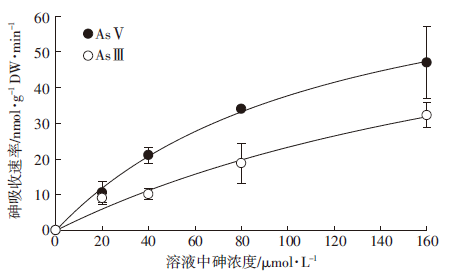
黑藻置于2 μmol·L-1 AsⅤ溶液48 h后,溶液中的砷形态变化如图 2所示。48 h后溶液中总砷浓度(AsⅢ和 AsⅤ之和)降低了41%,其中AsⅤ浓度降低的速率远高于总砷浓度,48 h后溶液中的AsⅤ浓度降低约90%。但是AsⅤ被吸收的同时,溶液中有大量AsⅢ产生,随处理时间的延续AsⅢ浓度逐渐增加,且增加速率逐渐降低,趋于稳定。AsⅢ的产生和AsⅤ的降低呈线性关系(R2>0.9),且斜率< 1(数据未列出),说明AsⅢ的产生速率略低于AsⅤ的吸收速率。处理48 h后,溶液中AsⅢ的浓度占溶液中总砷浓度的81%,为AsⅤ吸收量的53%。
|
| 图 2 黑藻作用于2 μmol·L-1 AsⅤ溶液48 h内砷形态变化 Figure 2 Changes in As species concentrations in fresh waters with H. verticillata at 2 μmol·L-1 AsⅤ during 48-h time course |
磷(P)和BSO对黑藻体内砷形态含量的影响如图 3所示。不论是AsⅤ处理还是AsⅢ处理,黑藻体内均以AsⅢ为主要存在形态,且均未检测到有机砷。加P后,AsⅤ处理黑藻体内的AsⅤ和AsⅢ含量均显著降低,分别为不加P时的1/3和1/2,但体内砷形态还是以AsⅢ为主;AsⅢ + P处理黑藻体内各砷形态含量与AsⅢ-P处理相比略降低,可能是加P促进植物生长稀释的结果。无论是AsⅤ还是AsⅢ处理,加入BSO后,黑藻体内的AsⅢ含量均显著降低,分别为不加BSO处理时的8%和10%。
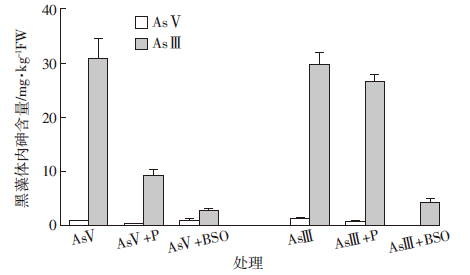
|
| 图 3 添加P和BSO对黑藻体内砷形态的影响 Figure 3 Effects of P and BSO on As species in H. verticillata |
如图 4所示,对于AsⅤ处理,黑藻于10 μmol·L-1 AsⅤ溶液暴露4 d后,溶液中的AsⅤ降低约80%,但是同时有大量AsⅢ产生,占溶液中总砷含量的82%;加P后溶液中砷形态分布与单独AsⅤ处理截然不同,溶液中仍然以AsⅤ为主,只有少量AsⅢ产生,仅占总砷含量的10%;加入BSO后,溶液中的AsⅢ和AsⅤ的浓度与单独AsⅤ处理相比差异均不显著(P>0.05)。对于三种AsⅢ处理,溶液中AsⅢ浓度占总砷浓度的比例均保持在94%~98%范围内;与单独AsⅢ处理相比,加P和加BSO后溶液中各砷形态浓度变化均不显著(P>0.05)。
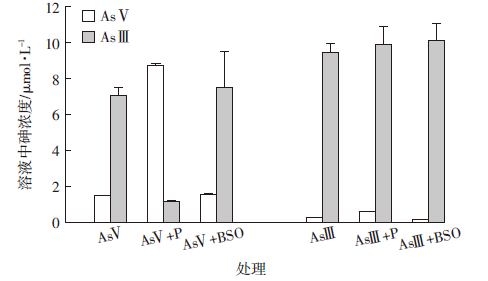
|
| 图 4 添加P和BSO对溶液中砷形态的影响 Figure 4 Effects of P and BSO on As species in solution |
短期吸收动力学试验表明,黑藻对AsⅤ的最大吸收速率Vmax与AsⅢ差异不显著(图 1和表 1)。与其他水生植物相比,黑藻对AsⅢ的吸收速率与无根萍(Wolffia globosa)和金鱼藻(Ceratophyllum demersum L.)相近,黑藻对AsⅤ的最大吸收速率为满江红(Azolla)、无根萍和紫背萍(Spirodela polyrhiza L.)的2~4倍[11, 12, 13],但是仅为金鱼藻AsⅤ最大吸收速率(214 nmol·g-1 DW·min-1)的1/2[15],而且Km为金鱼藻的10倍,说明沉水植物金鱼藻对AsⅤ具有更强的亲和能力。这与前期研究结果一致,黑藻对AsⅤ的富集能力也低于金鱼藻[9, 15]。
无论暴露于何种形态无机砷溶液中,黑藻体内的砷均主要以AsⅢ形态存在(图 3),与陆生植物水稻、番茄,水生植物满江红、无根萍和紫背萍等的研究结果一致[10, 11, 12, 13],可见大部分植物都具有较强的砷酸还原能力,然而P的加入抑制了植物对AsⅤ的吸收,进而导致溶液中的砷主要以AsⅤ而非AsⅢ形态存在。此外,Xu等[10]和Xue等[15]的研究表明,溶液中的微生物对AsⅤ还原作用很小,还原的AsⅢ占溶液总砷浓度的比例仅为10%左右,远低于有植物作用的溶液中AsⅢ所占比例(>85%)。这些都说明溶液中的AsⅢ是经植物体内AsⅤ还原之后被释放到体外的,主要是植物体内砷代谢的结果。通常将吸收进体内的AsⅤ还原为AsⅢ并释放至体外是微生物解除砷毒害的重要作用机制[16],就黑藻而言,其对两种无机砷的吸收能力相同,对AsⅤ的还原和释放并不能降低其对砷的吸收,但是自然水体中存在的一些锰氧化物和过渡金属可以促进AsⅢ的氧化,形成移动性和毒性较低的AsⅤ。另外水体中的一些微生物作用同样会对AsⅢ的氧化起到重要作用[1]。因此,这是否就是沉水植物黑藻对砷的解毒机制还有待进一步研究。砷的吸收和释放过程研究表明,黑藻对砷的还原和释放是一个快速的过程,且随着处理时间的延续,AsⅢ的释放速率逐渐降低趋于平衡(图 2),可能是溶液中的AsⅢ被二次吸收的结果。AsⅢ释放的量占AsⅤ吸收总量的53%,阻碍其应用于修复砷污染水体。总之黑藻对不同形态无机砷的吸收和释放是一个循环并逐渐达到平衡的过程,但是黑藻对AsⅢ的释放可能阻碍其对净化砷污染水体的应用。
PCs合成抑制剂BSO的加入,使得黑藻对砷的敏感性增加,对砷的富集能力也显著降低,但是对溶液中砷含量未产生显著影响(图 3和图 4),可见AsⅢ与植物体内PCs络合可能是黑藻对砷的重要抗性机制之一。Mishra等[17, 18]研究表明,沉水植物黑藻和金鱼藻暴露于≥10 μmol·L-1的砷溶液中时,体内PCs络合态的砷最多可占总砷的35%左右。Mishra等[17]应用同步辐射技术研究了沉水植物金鱼藻体内富集的砷形态,发现金鱼藻富集的砷60%以上与PCs、谷胱甘肽等巯基物质络合,其存在形态包括Cys-As(Ⅲ)-PC2、Cys-As-(GS)2和GS-As(Ⅲ)- desgly-PC2等。
4 结论(1)黑藻对AsⅤ和AsⅢ的最大吸收速率和米氏常数差异均不显著,其对AsⅤ和AsⅢ具有相近的吸收能力。
(2)无论是AsⅤ还是AsⅢ处理,黑藻体内均主要以AsⅢ形态存在(>90%),并且黑藻可以将AsⅤ迅速吸收进入体内还原为AsⅢ,并将一部分AsⅢ迅速释放到体外环境中(AsⅢ释放量占AsⅤ吸收量的53%)。
| [1] | 杨 芬, 朱晓东, 韦朝阳. 陆地水环境中砷的迁移转化[J/OL]. 生态学杂志, 2015. http://www. cnki. net/kcms/detail/21. 1148. Q. 20150311. 1505. 065. html YANG Fen, ZHU Xiao-dong, WEI Chao-yang. A overview on the process and mechanism of arsenic transformation and transportation in aquatic environment[J/OL]. Chinese Journal of Ecology, 2015. http://www. cnki. net/kcms/detail/21. 1148. Q. 20150311. 1505. 065. html |
| [2] | 胡立刚, 蔡 勇. 砷的生物地球化学[J]. 化学进展, 2009, 21(2/3), 458-466. HU Li-gang, CAI Yong. Biogeochemistry of arsenic[J]. Process in Chemistry, 2009, 21(2/3), 458-466. |
| [3] | Robinson B, Kim N, Marchetti M, et al. Arsenic hyperaccumulation by aquatic macrophytes in the Taupo Volcanic Zone, New Zealand[J]. Environmental and Experimental Botany, 2006, 58:206-215. |
| [4] | Xing W, Wu H P, Hao B B, et al. Bioaccumulation of heavy metals by submerged macrophytes:Looking for hyperaccumulator in eutrophic lakes[J]. Environmental Science & Technology, 2013, 47:4695-4703. |
| [5] | Wang Z X, Yao L, Liu G H, et al. Heavy metals in water, sediments and submerged macrophytes in ponds around Dianchi Lake, China[J]. Ecotoxicology and Environmental Safety, 2014, 107:200-206. |
| [6] | Srivastava S, Mishra S, Tripathi R D, et al. Phytochelatins and antioxidant systems respond differentially during arsenite and arsenate stress in Hydrilla verticillata(L. f) Royle[J]. Environmental Science & Technology, 2007, 41:2930-2936. |
| [7] | Srivastava S, Mishra S, Dwivedi S, et al. Role of thiol metabolism in arsenic detoxification in Hydrilla verticillata(L. f.) Royle[J]. Water, Air, and Soil Pollution, 2010, 212:155-165. |
| [8] | 马 丽, 王海娟, 杨晓燕. Fe3+对3种水生植物吸收不同形态砷的影响[J]. 农业环境科学学报, 2013, 32(6):1111-1121. MA Li, WANG Hai-juan, YANG Xiao-yan. The uptake of different arsenic forms in three aquatic plants as affected by Fe3++[J]. Journal of Agro-Environment Science, 2013, 32(6):1111-1121. |
| [9] | Xue P Y, Yan C Z. Arsenic accumulation and translocation in the submerged aquatic plant Hydrilla verticillata(L. f.) Royle[J]. Chemosphere, 2011, 85(7):1176-1181. |
| [10] | Xu X Y, McGrath S P, Zhao F J. Rapid reduction of arsenate in the medium mediated by plant roots[J]. New Phytologist, 2007, 176:590-599. |
| [11] | Zhang X, Lin A J, Zhao F J, et al. Arsenic accumulation by the aquatic fern Azolla:Comparison of arsenate uptake, speciation and efflux by A. caroliniana and A. filiculoides[J]. Environmental Pollution, 2008, 156:1149-1155. |
| [12] | Zhang X, Zhao F J, Huang Q, et al. Arsenic uptake and speciation in the rootless duckweed Wolffia globose[J]. New Phytologist, 2009, 182, 421-428. |
| [13] | Zhang X, Hu Y, Liu Y X, et al. Arsenic uptake, accumulation and phytofiltration by duckweed(Spirodela polyrhiza L.)[J]. Journal of Environmental Sciences, 2011, 23(4):601-606. |
| [14] | Zhao F J, Steve P, McGrath S P, et al. Arsenic as a food chain contaminant:Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61:535-59. |
| [15] | Xue P Y, Yan C Z, Sun G X, et al. Arsenic accumulation and speciation in the submerged macrophyte Ceratophyllum demersum L.[J]. Environmental Science and Pollution Research, 2012, 19(9):3969-3976. |
| [16] | 杨 婧, 朱永官. 微生物砷代谢机制的研究进展[J]. 生态毒理学报, 2009, 4(6):761-769. YANG Jing, ZHU Yong-guan. Progress in study of mechanisms of microbial arsenic transformation in environment[J]. Asian Journal of Ecotoxicology, 2009, 4(6):761-769. |
| [17] | Mishra S, Srivastava S, Tripathi R D, et al. Thiol metabolism and antioxidant systems complement each other during arsenate detoxification in Ceratophyllum demersum L.[J]. Aquatic Toxicology, 2008, 86(2):205-215. |
| [18] | Mishra S, Wellenreuther G, Mattusch J, et al. Speciation and distribution of arsenic in the nonhyperaccumulator macrophyte Ceratophyllum demersum[J]. Plant Physiology, 2013, 163(3):1396-1408. |
 2015, Vol. 34
2015, Vol. 34