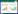文章信息
- 雷丽萍, 刘彬, 陈世宝, 李宁, 郑涵
- LEI Li-ping, LIU Bin, CHEN Shi-bao, LI Ning, ZHENG Han
- 不同烟草对Cd吸收的敏感性分布及烟草中Cd的结合形态
- Cd-phytotoxicity Species Sensitivity Distributions and Root Cd Forms of Different Tobacco Cultivars
- 农业环境科学学报, 2015, 34(10): 1858-1864
- Journal of Agro-Environment Science, 2015, 34(10): 1858-1864
- http://dx.doi.org/10.11654/jaes.2015.10.004
-
文章历史
- 收稿日期: 2015-07-27
2. 农业部植物营养与施肥重点实验室/中国农科院农业资源与农业区划研究所, 北京 100081
2. Key Laboratory of Plant Nutrition and Fertilizer, Ministry of Agriculture/Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China
近年来,随着我国经济快速发展,工业“三废”、畜禽粪便及化肥、农药等重金属污染的加剧,我国土壤镉(Cd)污染正在以不同尺度呈现蔓延趋势[1]。研究表明,土壤Cd污染是影响我国烟草品质安全性的主要因素之一[2, 3, 4, 5]。烟草属于易累积Cd 的作物之一[2],Cd 污染胁迫会对烟草的生理过程造成很大影响,如影响烟草体内叶绿素的合成等[4]。另外,Cd胁迫会影响烟草对大量营养元素和微量元素的吸收,从而影响烟草的品质,如烟叶中相关蛋白质的合成和烟碱的含量等,使烟叶中的酸碱失去平衡等[4];因此,植烟区Cd污染土壤的安全利用及降低Cd在土壤-烟草系统中的迁移、转化研究逐渐成为近年来国内外烟草研究的热点。随着土壤环境重金属污染的不断加剧,国内外大量学者针对重金属污染土壤的植物修复技术及农艺修复措施等方面进行了大量的研究[6, 7],包括不同Cd毒性敏感性植物品种的筛选及其应用技术等[8, 9],而针对污染土壤中重金属对不同生物物种的危害程度研究较少。在重金属污染土壤生态风险研究中,物种敏感度分布法(SSD)的应用旨在一定污染条件下,保护土壤中大多数生物安全的污染物浓度值[10],SSD法假设生态系统中不同物种或相同生物不同种类的毒性数据符合某概率分布函数,并且设定所获物种的毒性数据是生态系统所有物种中随机选取,通过概率数据模型拟合,计算出一定浓度条件下重金属对受试物种产生毒害的程度,以确定风险最大的物种类别,目前,该方法在确定一定保护程度污染物的浓度和环境基准值推导中有较多应用[11]。本文利用最新的剂量-效应关系模型及概率函数模型对我国南方主栽的16种不同烟草对Cd污染胁迫的物种敏感性分布曲线进行了测定,同时对不同Cd敏感性烟草植株内Cd的结合形态进行了分析,以探讨不同Cd敏感性烟草对Cd吸收、转化的机理,为植烟区Cd污染土壤的安全利用提供参考。
1 材料与方法 1.1 供试烟草供试烟草品种包括:K326(代号K326)、K346(代号K346)、云烟317(代号Y317)、云烟97(代号Y97)、云烟87(代号Y87)、云烟85(代号Y85)、白肋烟TN86(代号TN86)、巴斯玛(代号BSM)、KRK26(代号K26)、TN90(代号TN90)、红花大金元(代号DJY)、云烟201(代号Y201)、湘3号(代号X3)、贵烟2号(代号G2)、贵烟3号(代号G3)、CF220(代号F220),这些品种均选自我国南方植烟区主栽品种。
1.2 水培实验 1.2.1 种子准备将上述16种不同烟草种子以10%(V/V)双氧水消毒15 min后用去离子水冲洗干净,置于铺有纱布的培养皿上,用蒸馏水浸湿,然后于室温(25±2)℃的培养箱中培养直至种子露白后移至生长箱进行培养。生长箱的光照时间保持在12 h,光照强度约为280 μmol·m-2·s-1,相对湿度保持在70%。培养48 h后,挑选出大小一致、幼根长度不超过2 mm的种子进行根伸长抑制水培试验。
1.2.2 水培实验设计根伸长抑制试验参照ISO标准(11269-1)[12] 进行。将上述挑选一致的种子播种到装有珍珠岩和1/2 Hoagland(pH 6.0)营养液的花盆中进行前期培养。待7 d后小心将苗取出,用清水将根系轻轻洗净,然后选择长势一致的苗移栽至装有700 mL营养液的带孔盖PVC培养筒中,幼苗以玻璃棉进行固定。每个培养筒3株幼苗,营养液每2 d更换一次,试验在控温温室进行[白天温度(25±2)℃,夜间温度(20±2)℃]。在培养过程中,以2.0 mmol·L-1的2-吗啉乙磺酸缓冲液(MES)调节溶液pH为5.0。等幼苗生长7 d返青后,进行不同浓度Cd处理。本实验Cd以3CdSO4·8H2O(GR)溶液进行添加。Cd添加浓度为7个水平:0、0.5、1.0、5.0、10.0、30.0、 60.0 mg·L-1,同时对添加后溶液实际Cd含量进行测定。实验设置3个重复,培养28 d 后收获。收获时,记录不同Cd处理植株根长(3株最长根长的平均值),根据ISO标准方法进行烟草Cd毒害剂量-效应关系测定。
1.3 研究方法 1.3.1 烟草Cd含量测定植株中Cd含量采用HNO3-H2O2微波消解后,利用原子吸收光谱法进行测定[13]。测定方法如下:称取根/茎叶样品 0.500 g于消解罐中,加6 mL浓硝酸(优级纯)和2 mL H2O2,加盖拧紧,摇匀放置过夜,上机消解,160 ℃左右赶酸至尽干,5%硝酸转移定容到25 mL容量瓶中,利用火焰(石墨炉)原子吸收分光光度计(AAS/AFS:Varian AA 240FS +GTA)进行Cd含量测定,同时利用国家标准物质(GSS-3、GSS-6)进行测定质量控制。
1.3.2 烟草中Cd结合形态测定烟草中Cd不同结合形态的提取在Zhang等[14]及Wang等[15]的方法基础上进行改进后连续浸提,分别为乙醇浸提态(FE)、去离子水浸提态(FW)、氯化钠浸提态(FNaCl)、醋酸浸提态(FHAC)及盐酸浸提态(FHCl)。称取0.2 g植株鲜样进行研磨匀浆后,按照下列步骤逐步浸提:加入 10 mL 80%乙醇后,恒温(25±2)℃振荡24 h,在5000 r·min-1离心10 min,浸提2次后合并上清液进行Cd含量测定。此形态主要为氯化物硝酸盐结合态Cd;在上一形态离心后的残渣中,加10 mL去离子水,重复上述步骤进行浸提,此部分主要为水溶性有机酸盐及Cd(H2PO4)n结合态Cd;以10 mL的1 mol·L-1氯化钠作为浸提剂进行浸提,此部分以蛋白质与果胶结合态Cd为主;以10 mL 2.0%醋酸进行浸提,此部分为难溶性磷酸盐结合态Cd[Cd(H2PO4)n];以10 mL 0.6 mol·L-1的盐酸进行浸提,此部分主要为植株内草酸盐等结合态Cd。1.3.3 烟草Cd剂量-效应关系烟草Cd胁迫毒性的剂量-效应关系的拟合采用逻辑斯蒂克分布模型(Log-logistic)进行拟合[15]:Log-logistic模型:

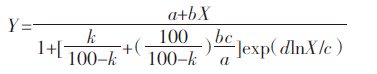
在不同烟草Cd毒性剂量-效应(EC50)测定基础上,对不同品种烟草Cd毒性阈值(EC50)进行对数变换后,利用最新的概率函数模型(Burr-Ⅲ)进行不同品种烟草Cd毒性的物种敏感性分布(SSD)曲线拟合[16, 17]:
Burr-Ⅲ型概率函数的参数方程为:
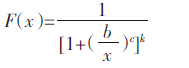
所有实验数据均采用Excel和SPSS(v16.0)进行统计处理,利用新复极差法(Duncan法)进行差异显著性分析(显著性水平为P<0.05)。
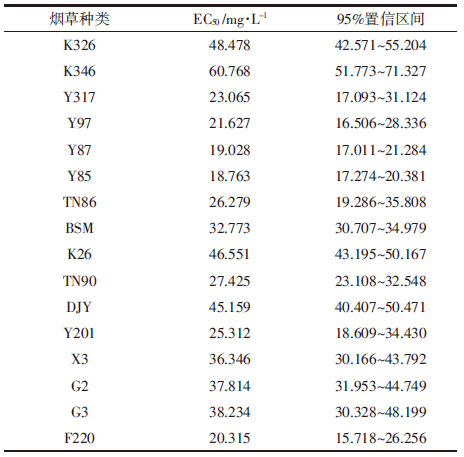
2 结果与讨论 2.1 不同烟草对Cd胁迫的剂量-效应关系对添加不同浓度Cd培养液的烟草根伸长抑制实验测定结果表明,随着溶液Cd浓度的增加,不同烟草的根生长均表现出不同程度的抑制作用,表现为植株根长的逐渐降低。总体而言,在溶液中Cd浓度低于5 mg·L-1时,不同烟草根系的生长开始表现出抑制作用,但不明显;而当溶液Cd浓度大于30 mg·L-1时,Cd对烟草生长毒性表现得很明显,根长显著下降,叶片失绿,但不同烟草中毒症状有明显差别。图 1为基于根伸长抑制作用的16种不同烟草对Cd胁迫毒性的剂量-效应关系。从图 1可以看出,溶液Cd胁迫对不同烟草根生长抑制具有显著差异:在相同抑制率(纵坐标值相等)条件下,不同烟草对Cd毒害的阈值(曲线对应横坐标的值,ECx)具有显著差异;相反,在相同Cd浓度条件下(横坐标值相等),溶液中Cd对不同烟草毒害程度(纵坐标值)也具有显著的差异。据此,本文利用逻辑斯蒂克分布模型(Log-logistic)对不同烟草Cd毒害的剂量-效应关系进行拟合,计算出溶液Cd对不同烟草50%毒性抑制率的溶液Cd浓度值(EC50)及其95%置信区间值见表 1。测定结果表明,16种不同烟草EC50值变化范围为18.76~60.77 mg·L-1,最大相差223.9%,其中,Y85对Cd胁迫毒性最为敏感(EC50为18.76 mg·L-1),而K346表现出最高的耐性特征(EC50为60.77 mg·L-1)。
 |
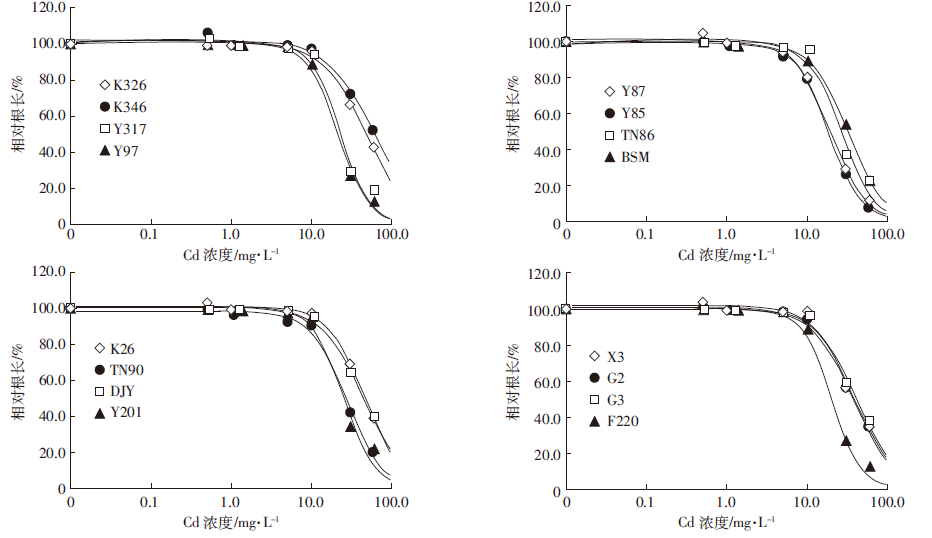
|
| 图 1 不同烟草对Cd胁迫毒性的剂量-效应关系 Figure 1 Dose-response curves of Cd toxicity to different tobacco cultivars |
镉为烟草非必需元素,当烟草植株内Cd的浓度达到一定程度时,烟草的根及幼苗的生长发育即可受到抑制。过量Cd对植株产生毒性的机理与Cd诱导产生自由基,导致植株体内的过氧化氢酶等活性降低,幼苗叶片膜脂过氧化物含量增加等有关[18]。Cd对不同烟草产生生长抑制作用的毒性阈值与烟草品种及环境介质条件相关,研究表明[19],Cd离子进入植物根细胞后,部分储存在根中,其余部分通过中柱长距离运输被转运到地上部各器官中,而进入根毛表皮细胞的Cd一般通过共质体运输或质外体运输进入木质部进行运输[20],而进入植株细胞中的Cd被分配在细胞壁、细胞液、叶绿体、细胞质及线粒体等不同亚细胞组分中,Cd在不同细胞器中的比例与植物的品种有关。耐Cd植物对Cd胁迫的解毒机制主要与植株体内Cd的亚细胞分布比例有关,耐Cd植物通过根部吸收Cd后,通过络合、螯合机制,将大部分Cd束缚在根细胞壁,而限制了Cd往地上部的传输,从而产生对Cd胁迫的更强的耐性[21];环境介质条件对烟草Cd吸收的影响主要是通过影响土壤中Cd的有效性,从而影响烟草对Cd的吸收、转运,如土壤pH条件、共存离子等[2]。
2.2 烟草对Cd胁迫毒性的物种敏感性分布(SSD)基于Burr-Ⅲ概率函数模型拟合得到的不同烟草对Cd毒性的敏感性分布曲线表明(图 2),不同品种烟草对Cd毒性的敏感性分布频次具有明显差异,表现为Y85>Y87>F220>Y97>Y317>Y201>TN86>TN90 >BSM>X3>G2>G3>DJY>K26>K326>K346。在所测试的16个不同品种烟草中,Y85、Y87是对Cd毒害比较敏感的烟草品种,相对而言,K326和K346对Cd的毒害最不敏感,即对Cd的污染胁迫具有较强的抗性。
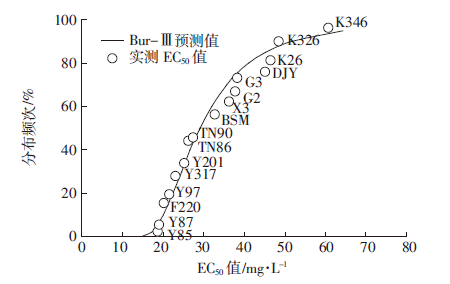
|
| FE:乙醇浸提态;FW:去离子水浸提态;FNaCl:氯化钠浸提态;FHAC:醋酸浸 图 2 不同烟草基于EC50的Cd毒性阈值累积分布曲线 Figure 2 Cumulative frequencies of Cd toxicity values(EC50) of tobacco cultivars |
物种敏感性分布SSD(Species Sensitivity Distributions)方法在国外环境质量基准制定和生态风险评价领域的应用较为广泛,而国内对SSD方法的研究与应用较少[11, 17]。相比其他生态风险评价方法,SSD法摒弃了以往单一物种、单一污染物的评价模式,通过选择某个概率(如95%、90%)并拟合SSD曲线的方法,描述某一种污染物对一系列物种或相同物种的不同品种间的生态毒性,包括某一类生物序列、一部分选定物种的组合或一个自然群落等[11]。本实验根据上述不同烟草根伸长毒性的浓度阈值(EC50)进行对数变换后,利用Burr-Ⅲ型概率函数统计模型的方法对烟草Cd植物毒性的敏感性分布曲线进行了拟合,通过拟合结果,可以对所测试的烟草品种Cd毒害的敏感性进行明确的分类。目前,虽然我国还没有基于健康风险的烟草Cd含量的国家标准,但是根据不同烟草Cd毒性的SSD曲线,可以对不同植烟区烟草Cd污染的生态风险进行有效的评价。
2.3 烟草对Cd吸收转运及植株内Cd的形态为了对不同Cd胁迫敏感性的烟草吸收、转运Cd的机理进行探讨,本实验在烟草根伸长实验的基础上,基于EC50值不同选择了4种具有显著差异的烟草品种进行Cd的吸收转运及植株Cd形态测定研究。4种烟草品种分别为Y85、TN86、K326及K346,Cd毒性阈值EC50分别为18.76、26.28、48.48、60.77 mg·L-1,具有显著差异。本文中,烟草Cd茎叶转运系数(TFs)定义为TFs = 茎叶中Cd浓度(mg·kg-1)/根中Cd浓度(mg·kg-1)。测定结果表明,上述4种不同烟草根、茎叶中Cd含量顺序为K346≈K326>Y85>TN86,而烟草茎叶对Cd转运系数TFs则相反,表现为Y85>TN86> K326≈K346(图 3),此结果意味着在耐Cd烟草品种K346及K326中,有较多Cd积累在根部,而向茎叶转运比例低于敏感性烟草品种Y85。
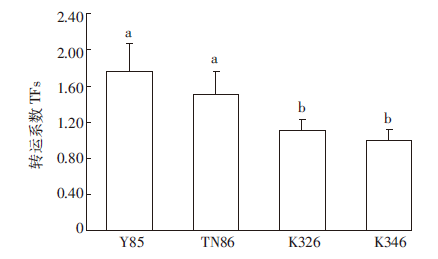
|
| 图 3 不同烟草品种对Cd茎叶/根转运系数 Figure 3 Transfer factors of Cd in different tobacco cultivars |
本实验利用不同的浸提剂(乙醇、去离子水、氯化钠、醋酸及盐酸等)对烟草根中Cd的结合形态测定结果表明,不同烟草根中Cd的形态以氯化物硝酸盐结合态Cd(FE)为主,其次为蛋白质与果胶结合态Cd(FNaCl)(图 4a),但烟草根中不同形态Cd的含量比例(%)在不同品种烟草间具有显著差异(图 4b)。在Cd敏感性烟草Y85及TN86中,氯化物硝酸盐结合态(FE)的Cd含量分别为47.0%和40.8%,在耐Cd品种K326及K346中的含量比例分别为35.3%和33.4%;与此相反的是,难溶性Cd的磷酸盐结合态[Cd(PO4)n]及蛋白质与果胶结合态(FNaCl)Cd的比例在K326(30.7%)及K346(29.8%)中的含量大于其在敏感性Cd品种Y85(25.1%)及TN86(27.0%)中的比例,这说明,在Cd敏感性品种Y85及TN86中,植株根部吸收的Cd主要以Cl-及NO3-等无机络合离子形态存在,而(CdCl)n+等无机结合态Cd在植株体内具有较强的活性,容易在植株体内进行长距离运输。在耐Cd的品种K326及K346中,氯化物与硝酸盐结合态Cd的含量(%)较低,而难溶性磷酸盐Cd(PO4)n及蛋白质与果胶结合态Cd的比例较高,说明与Cd敏感性品种Y85、TN86相比,K326及K346植株根部Cd的活性较强,赋存形态比例显著降低,而活性较弱的结合形态含量较高,这一结果说明以难溶性结合态将重金属束缚在根细胞中降低重金属在植株体内的迁移、转运可能是烟草对Cd胁迫产生耐性的机制之一[19, 22, 23]。
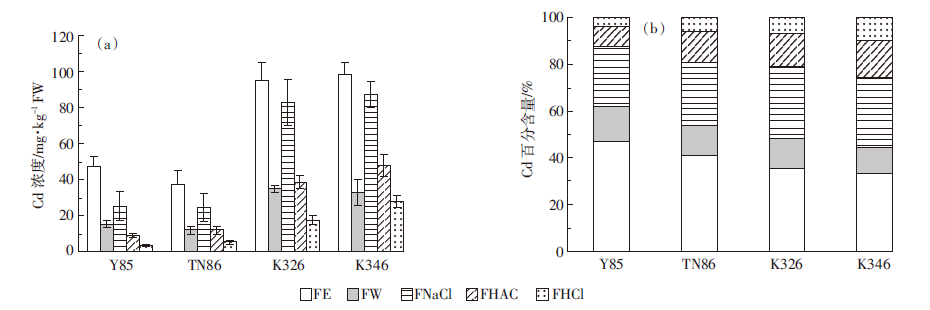
|
| 图 4 不同烟草品种根中Cd不同形态含量(a)及其百分比(b) Figure 4 Cadmium concentrations(a) and percentages(b) of different chemical forms in tobacco roots |
(1)基于根伸长抑制毒性的不同,烟草半抑制浓度EC50值在不同品种烟草中存在显著差异,EC50范围为18.76~60.77 mg·L-1,最大相差223.9%,其中对Cd最敏感品种为Y85,而对Cd毒害耐性最强品种为K346。
(2)基于Burr-Ⅲ概率函数模型拟合得到的不同烟草对Cd毒性的敏感性分布曲线表明,不同品种烟草对Cd毒性的敏感性分布频次具有明显差异,大小顺序为Y85>Y87>F220>Y97>Y317>Y201> TN86>TN90>BSM>X3>G2>G3>DJY>K26>K326>K346。
(3)对烟草根中Cd的结合形态测定结果表明,以难溶性结合态将Cd束缚在根细胞中,降低Cd在植株体内的迁移、转运可能是烟草对Cd胁迫产生耐性的机制之一。
| [1] | 宋文恩, 陈世宝, 唐杰伟. 稻田生态系统中镉污染及环境风险管理[J]. 农业环境科学学报, 2014, 33(9):1669-1678. SONG Wen-en, CHEN Shi-bao, TANG Jie-wei. Cadmium pollution and its environmental risk management in rice ecosystem[J]. Journal of Agro-Environment Science, 2014, 33(9):1669-1678. |
| [2] | 雷丽萍, 陈世宝, 夏振远, 等. 烟草对污染土壤中镉胁迫的响应机制及影响因素研究进展[J]. 中国烟草科学, 2011, 32(4):87-93. LEI Li-ping, CHEN Shi-bao, XIA Zhen-yuan, et al. Tolerance and accumulation of cadmium by tobacco plants and the influence factors in polluted soils[J]. Chinese Tobacco Science, 2011, 32(4):87-93. |
| [3] | 刘义新, 陶 涌, 孟丽华, 等. 烤烟品种K326 和云烟87对镉胁迫的生理响应及抗性差异[J]. 中国烟草科学, 2008, 29(4):1-5. LIU Yi-xin, TAO Yong, MENG Li-hua, et al. Physiological response and resistance of K326 and Yunyan87 to cadmium[J]. Chinese Tobacco Science, 2008, 29(4):1-5. |
| [4] | 贺 远, 王树声, 刘海伟, 等. 镉浓度对烤烟幼苗镉含量及生长和生理指标的影响[J]. 中国烟草科学, 2014, 35(2):37-42. HE Yuan, WANG Shu-sheng, LIU Hai-wei, et al. Effect of Cd concentration on Cd content and growth and physiological indices of tobacco seedlings[J]. Chinese Tobacco Science, 2014, 35(2):37-42. |
| [5] | 谢运球, 罗志鹏, 孟天友, 等. 毕节岩溶区坡耕地烟草镉安全评价研究[J]. 农业环境科学学报, 2011, 30(5):886-892. XIE Yun-qiu, LUO Zhi-peng, MENG Tian-you, et al. Evaluation on cadmium safety of tobacco planted in slope farmland of karst area in Bijie prefecture of Guizhou, China[J]. Journal of Agro-Environment Science, 2011, 30(5):886-892. |
| [6] | 殷永超, 吉普辉, 宋雪英, 等. 龙葵(Solanum nigrum L.)野外场地规模Cd污染土壤修复试验[J]. 生态学杂志, 2014, 33(11):3060-3067. YIN Yong-chao, JI Pu-hui, SONG Xue-ying, et al. Field experiment on phytoremediation of cadmium contaminated soils using Solanum nigrum L. [J]. Chinese Journal of Ecology, 2014, 33(11):3060-3067. |
| [7] | 魏树和, 周启星, 王 新. 超积累植物龙葵及其对镉的富集特征[J].环境科学, 2005, 26(3):167-171. WEI Shu-he, ZHOU Qi-xing, WANG Xin. Cadmium-hyperaccumulator Solanum nigrum L. and its accumulating characteristics[J]. Environmental Science, 2005, 26(3):167-171. |
| [8] | Liu H, Yuan M, Tan S Y, et al. Enhancement of arbuscular mycorrhizal fungus(Glomus versiforme) on the growth and Cd uptake by Cd-hyperaccumulator Solanum nigrum[J]. Applied Soil Ecology, 2015, 89: 44-49. |
| [9] | Redondo S, Mateos E, Andrades L. Accumulation and tolerance characteristics of cadmium in a halophytic Cd-hyperaccumulator, arthrocnemum macrostachyum[J]. Journal of Hazardous Materials, 2010, 184(1/3), 299-307. |
| [10] | 王小庆, 李句梅, 韦东普, 等. 土壤中铜生态阈值的影响因素及其预测模型[J]. 中国环境科学, 2014, 34(2):445-451. WANG Xiao-qing, LI Ju-mei, WEI Dong-pu, et al. Major soil factors affecting ecological threshold for copper and the predictable models[J]. China Environmental Science, 2014, 34(2):445-451 |
| [11] | Xu F L, Li Y L, Wang Y. Key issues for the development and application of the species sensitivity distribution(SSD) model for ecological risk assessment[J]. Ecological Indicators, 2015, 54: 227-237. |
| [12] | International Organization for Standardization. Soil quality determination of the effects of pollutants on soil flora, Part 1:Method for the measurement of inhibition of root growth, ISO 11269-1[S]. Geneva, Switzerland. 1993. |
| [13] | 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社. 2000. LU Ru-kun. Analytical methods for soils and agricultural chemistry[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [14] | Zhang W, Lin K F, Zhou J, et al. Cadmium accumulation, subcellular distribution and chemical forms in rice seedling in the presence of sulfur[J]. Environmental Toxicology and Pharmacology, 2014, 37(1):348-353. |
| [15] | Wang X, Liu Y G, Zeng G M, et al. Sub-cellular distribution and chemical forms of cadmium in Bechmeria nivea Gaud[J]. Environ Exp Bot, 2008, 62: 389-395. |
| [16] | Haanstra L, Doelman P, Voshaar J H O. The use of sigmoidal dose response curves in soil ecotoxicological research[J]. Plant Soil, 2005, 84(2):293-297. |
| [17] | 魏 威, 梁东丽, 陈世宝. 土壤中外源锌对不同植物毒性的敏感性分布[J]. 生态学杂志, 2012, 31(3):538-543. WEI Wei, LIANG Dong-li, CHEN Shi-bao. Plant species sensitivity distribution to the phytotoxicity of soil exogenous zinc[J]. Chinese Journal of Ecology, 2012, 31(3):538-543. |
| [18] | Iannone M F, Groppa M D, Benavides M P. Cadmium induces different biochemical responses in wild type and catalase-deficient tobacco plants[J]. Environmental and Experimental Botany, 2015, 109:201-211. |
| [19] | Rosén K, Eriksson J, Vinichuk M. Uptake and translocation of 109Cd and stable Cd within tobacco plants(Nicotiana sylvestris)[J]. Journal of Environmental Radioactivity, 2012, 113:16-20. |
| [20] | Moulin N L, Zhang M, Gadani F, et al. Critical review of the science and options for reducing cadmium in tobacco(Nicotiana Tabacum L.) and other plants[J]. Advances in Agronomy, 2004, 83: 111-180. |
| [21] | Ramos I, Esteban E, Jose J, et al. Cadmium uptake and subcellular distribution in plants of Lactuca sp. Cd-Mn interaction[J]. Plant Science, 2002, 162(5): 761-767. |
| [22] | 田阳阳, 陈江华, 张艳玲, 等. 不同Cd 积累基因型烟草中Cd 的亚细胞分布及化学形态[J]. 烟草科技, 2012(2):66-70. TIAN Yang-yang, CHEN Jiang-hua, ZHANG Yan-ling, et al. Subcellular distribution and chemical forms of Cd in two tobacco genotypes with different Cd accumulating pattern[J]. Tobacco Science & Technology, 2012(2):66-70. |
| [23] | 陈世宝, 孙 聪, 魏 威, 等. 根细胞壁及其组分差异对植物吸附、转运Zn的影响[J]. 中国环境科学, 2012, 32(9):1309-1313. CHEN Shi-bao, SUN Cong, WEI Wei, et al. Difference in cell wall components of roots and its effect on the transfer factor of Zn by plant species[J]. China Environmental Science, 2012, 32(9):1309-1313. |
 2015, Vol. 34
2015, Vol. 34