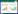文章信息
- 曹雅茹, 张世熔, 陈月, 王贵胤, 李婷
- CAO Ya-ru, ZHANG Shi-rong, CHEN Yue, WANG Gui-yin, LI Ting
- 铅锌矿区污染土壤的植物淋洗剂筛选研究
- Screening of Phyto-eluents for Contaminated Soil in Pb-Zn Mining Area
- 农业环境科学学报, 2015, 34(10): 1921-1927
- Journal of Agro-Environment Science, 2015, 34(10): 1921-1927
- http://dx.doi.org/10.11654/jaes.2015.10.012
-
文章历史
- 收稿日期: 2015-05-07
2. 四川农业大学资源学院, 成都 611130
2. College of Resources, Sichuan Agricultural University, Chengdu 611130, China
近几十年来铅锌矿资源的大量无序开采,导致矿区周围农田土壤污染问题日益严重[1, 2],土壤中过量的铅锌不仅对作物产生不同程度的危害,且有毒重金属通过食物链影响人体健康[3, 4]。因此,铅锌复合污染土壤的修复成为亟待解决的问题之一。常见的土壤重金属修复方法主要有物理、化学和生物修复三大类,包括固化稳定化、淋洗法和植物修复等[5, 6, 7]。其中淋洗技术虽对土壤基质有一定扰动,但由于其操作简单、周期短且修复效率高[8],因此,土壤淋洗技术是修复高浓度土壤重金属污染的有效技术[9, 10],而淋洗剂的选择是该修复技术实施的关键[11]。目前常用的淋洗剂主要有无机淋洗剂、螯合剂和表面活性剂等[12]。盐酸和CaCl2对土壤中的重金属有较好淋洗效果[13],但其使用的同时会造成土壤基质的破坏和养分流失,且过量的无机离子可能引起土壤盐渍化而增加后续处理费用[14];邓红侠等用皂苷与EDTA联合去除污染塿土中的Pb[15],但由于螯合剂在土壤中的生物降解性差,在淋洗过程中容易残留,造成土壤的二次污染[16];表面活性剂如鼠李糖脂等因成本高、来源有限而在实际运用中受到限制[17]。因此,筛选出高效率且环境友好的新型淋洗剂显得尤为重要。
植物作为一类天然材料,不仅绿色环保、来源广泛且植物可能含有与重金属离子络合的羟基、羧基等多种官能团而对土壤中重金属具有去除效果,同时四川西部铅锌矿产资源丰富,植物种类繁多。因此,本研究前期从该区域采集大量植物,从中筛选出蜈蚣草、马桑、土荆芥等14种生物量较大的植物,通过振荡淋洗试验分别探讨不同植物浸提液及其浓度、pH和淋洗时间对土壤铅锌去除效率的影响,进而筛选出对铅锌复合污染土壤有较高修复潜力且环境友好的植物淋洗剂,以期为重金属污染土壤的淋洗修复提供更好的材料。
1 材料与方法 1.1 供试土壤土壤样品采自四川省汉源县唐家铅锌矿区表层土壤(0~20 cm)。该矿区铅锌矿长期开采,尾矿大量堆积。样品经自然风干后,剔除其中的碎石及杂草,磨碎过2 mm的尼龙筛,混匀备用。供试土壤的基本理化性质为:粘粒 640 g·kg-1,粉粒 260 g·kg-1,砂砾 100 g·kg-1,pH 7.13,有机质26.49 g·kg-1,CEC 20.73 cmol·kg-1。土壤中铅、锌总量分别为2809、3715 mg·kg-1。
1.2 试验方法1.2.1 淋洗剂的制备
植物材料采自四川省汉源县唐家乡矿区附近。将14种植物的地上部分用蒸馏水清洗干净待其自然风干后,研磨成粉,过2 mm筛备用。分别称取6、10、16、20 g植物粉末,加入到200 mL蒸馏水中,在25 ℃、200 r·min-1下恒温振荡24 h,制得3%、5%、8%和10%四种浓度的淋洗剂,静置1 h后过滤备用。浓度为5%的植物浸提液的铅锌含量及基本性质见表 1。
|
取蒸馏水(空白对照)和浓度为3%、5%、8%和10%的14种材料的淋洗液各20 mL,按土液比1∶20加入到1.00 g污染土壤中。用5%的HNO3或NaOH调节pH为4.00±0.05。在25 ℃、200 r·min-1条件下恒温振荡2 h后以4000 r·min-1的速率离心5 min,而后将淋洗液用0.45 μm微孔滤膜过滤,滤液中的铅和锌含量用AAS,WFX-110型原子吸收分光光度法测定。测定的铅、锌浸提效率即为它们的淋洗率。每个处理3次重复。
1.2.3 pH对铅锌淋洗率的影响试验取蒸馏水(空白对照)和浓度为5%的14种材料的淋洗液各20 mL,分别加入到1.00 g污染土壤中,用5%的HNO3或NaOH分别调pH为4±0.05、7±0.05、8±0.05。在25 ℃、200 r·min-1下恒温振荡2 h后以4000 r·min-1的速率离心5 min,而后将淋洗液用0.45 μm微孔滤膜过滤,滤液中的铅和锌含量用原子吸收分光光度法测定。每个处理3次重复。
1.2.4 淋洗时间对铅锌淋洗率的影响试验取蒸馏水(空白对照)和浓度为5%的14种材料的淋洗液各20 mL,加入1.00污染土壤中,调节pH为4.00±0.05。每种淋洗液分别在25 ℃、200 r·min-1下恒温振荡2、4、8 h,振荡后以4000 r·min-1的速率离心5 min,而后将淋洗液用0.45 μm微孔滤膜过滤,滤液中的铅和锌含量用原子吸收分光光度法测定。每个处理3次重复。
1.3 分析测定项目土壤颗粒组成采用比重计法[18];土壤pH值用pHS-3CW型pH计测定(水土比2.5∶1);土壤有机质采用重铬酸钾氧化法[18];土壤阳离子交换量采用醋酸铵淋洗法测定[18];重金属元素全量用HNO3-HC1O4-HF三酸消化分析,并用AAS,WFX-110型原子吸收分光光度计测定[18]。植物浸提液TOC值用TOC分析仪测定。
1.4 数据处理试验数据用SPSS19.0软件进行单因素方差分析,平均数用S-N-K法进行差异显著 性检验。
2 结果与讨论2.1 不同植物浸提液的土壤铅锌提取效率
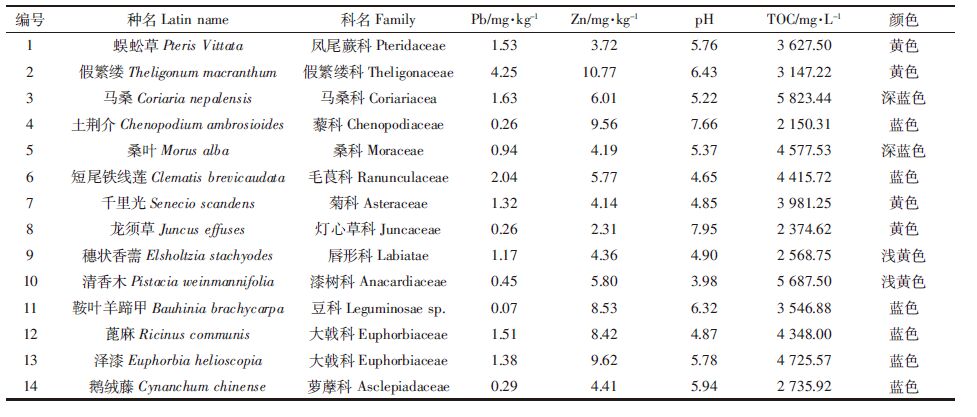
14种植物的铅淋洗率差异明显,而蒸馏水对土壤中的铅淋洗率仅为0.19%。马桑浸提液对土壤中铅的淋洗率最高达24.65%(图 1A),显著高于其余13种植物(P<0.05);清香木和鹅绒藤对土壤中铅的淋洗率均小于1.32%;其余11种植物对土壤铅的淋洗率显著高于清香木和鹅绒藤(P<0.05),而又明显低于马桑(P<0.05)。14种植物对土壤铅的淋洗率随处理浓度的增加呈两类变化趋势(图 1A):蜈蚣草、假繁缕、马桑、土荆介、千里光、龙须草、穗状香薷、清香木、蓖麻、泽漆和鹅绒藤对土壤铅的淋洗率随淋洗液浓度增加而提高;桑叶、短尾铁线莲和鞍叶羊蹄甲随淋洗液浓度增加对土壤中铅的淋洗率先增后减。马桑可能因含有二十三碳酸、二十七碳酸、马桑宁、熊果酸、3,5-二甲氧基-4-羟基苯甲酸、没食子酸等多种酸性基团或活性基团[19, 20, 21, 22],在淋洗过程中容易与土壤中的Pb2+发生络合作用或解离出H+,促进土壤胶体上的Pb2+解吸[23],所以其对土壤铅的淋洗效率较高。清香木叶可能因其主要的化学成分为醛类、脂类、烷烃类等,与土壤中的Pb2+发生络合作用或解离出H+的能力弱,故淋洗率较低[24]。
|
| 1-蜈蚣草Pteris Vittata;2-假繁缕Theligonum macranthum;3-马桑Coriaria nepalensis;4-土荆介Chenopodium ambrosioides; 5-桑叶Morus alba;6-短尾铁线莲Clematis brevicaudata;7-千里光Senecio scandens;8-龙须草Juncus effusus;9-穗状香薷 Elsholtzia stachyodes;10-清香木Pistacia weinmannifolia;11-鞍叶羊蹄 甲Bauhinia brachycarpa;12-蓖麻Ricinus communis; 13-泽漆Euphorbia helioscopia;14-鹅绒藤Cynanchum chinense。柱状图上方 不同小写字母代表同种植物在不同浓度下淋 洗率差异显著(P<0.05);柱状图上方不同斜体小写字母代表相同浓度下不同 植物间淋洗率差异显著(P<0.05)。下同 图 1 淋洗剂在不同浓度下对铅(A)和锌(B)淋洗率的影响 Figure 1 Effects of phyto-eluents at different concentrations on Pb (A) and Zn(B) removal efficiencies |
14种植物的锌淋洗率总体差异较大,而蒸馏水对土壤中锌的淋洗率最低为10.86%。马桑浸提液对土壤锌的淋洗率高达59.05%,显著高于其余13种植物22.52%~50.94%的淋洗率(P<0.05),也高于柠檬酸对土壤锌44.6%的淋洗率[25]。14种淋洗剂对土壤中锌的淋洗率仍呈两种变化趋势(图 1B):其一,随着淋洗剂浓度的增加,蜈蚣草、假繁缕、土荆芥、桑叶、短尾铁线莲、千里光、龙须草、穗状香薷、鞍叶羊蹄甲和蓖麻对土壤锌的淋洗率先上升而后趋于平缓。孟龙等利用油菜花、枫杨等4种植物研究对土壤中锌的淋洗率,结果随着浓度的增加也呈上升趋势[26]。其原因可能是这些淋洗剂的分子结构中含有羟基、羧基等酸性集团,在淋洗过程中随着淋洗剂浓度的增加解离出更多的H+,促进锌的解吸[23]。其二,随着淋洗剂浓度增加,马桑、清香木、泽漆和鹅绒藤对土壤中锌的淋洗率变化不明显(P>0.05)。
综合14种植物淋洗剂对污染土壤中铅锌的淋洗效果,不仅克服了无机酸、盐等传统淋洗剂在土壤中易残留、对土壤造成二次污染等缺陷,而且植物淋洗剂不会像低分子有机酸使土壤过度酸化导致土壤养分大量流失[27]。14种植物淋洗剂对土壤中铅锌的淋洗效率差异明显(P<0.05)。其中马桑的淋洗效果最好,短尾铁线莲、清香木、蓖麻和泽漆较好,而龙须草最差。因此,马桑是一种对土壤铅锌污染修复具有较好应用前景的植物淋洗剂。
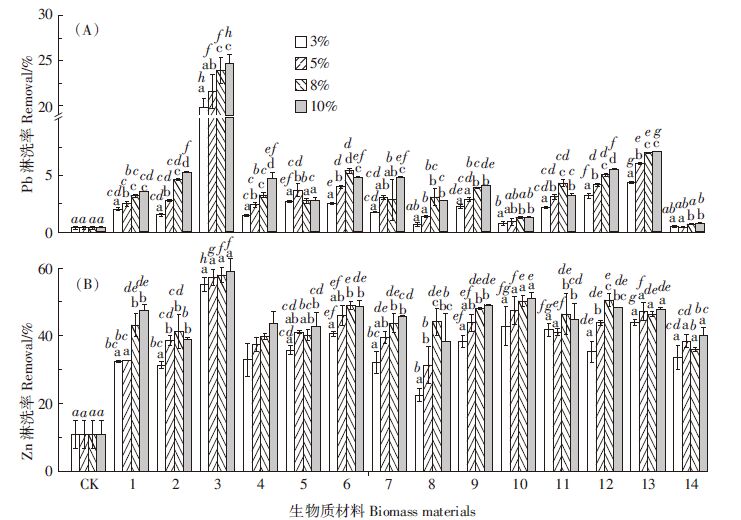
2.2 pH对土壤铅锌提取效率的影响14种植物在不同pH下对土壤中铅的淋洗率差异显著(P<0.05),而蒸馏水在不同pH下对土壤铅的淋洗率变化不明显(P>0.05)。随着淋洗液pH的增加,14种植物的铅淋洗率呈现4种变化趋势(图 2A):其一,假繁缕、马桑、土荆芥、桑叶、短尾铁线莲、龙须草、鞍叶羊蹄甲、蓖麻和泽漆随着淋洗液pH的增加,对土壤铅的淋洗率逐渐下降;当pH大于7时,淋洗率变化不大(P>0.05)。Begum等研究表明EDTA和GLDA两种螯合剂对土壤中铅的淋洗率随着pH的增加逐渐降低,pH大于7时,其对铅的淋洗率基本变化不大[28]。这可能是由于随着pH的增加,淋洗剂中的有机官能团与Pb2+的螯合能力下降。其二,蜈蚣草和鹅绒藤随着淋洗液pH增加,淋洗率逐渐上升。这是由于蜈蚣草含有黄酮和脂类等成分,而鹅绒藤则含有甾体、萜酯、黄酮苷、糖苷等,这些成分在碱性条件下更容易释放H+吸附Pb2+,进而增加其对土壤中铅的淋洗率。其三,千里光和穗状香薷随着pH增加,淋洗率先减后增,pH为4时淋洗率最大。其四,清香木在各pH试验条件下对土壤中铅的淋洗率变化不明显(P>0.05)。
|
| 图 2 淋洗剂在不同pH下对铅(A)和锌(B)淋洗率的影响 Figure 2 Effects of phyto-eluents at different pH on Pb(A) and Zn (B) removal efficiencies |
14种植物和蒸馏水的锌淋洗率均随着pH的增大明显降低(P<0.05)。当pH大于7时,其淋洗率变化均逐渐趋于平缓(图 2B)。郭晓方等研究表明,不同pH的混合螯合剂对土壤中的锌淋洗率不同,pH为5和7的淋洗率比pH为9的淋洗率高[29]。其原因可能在于随着pH的升高,与重金属离子结合的有机官能团解离出H+的能力降低。
2.3 淋洗时间对铅锌提取效率的影响淋洗时间是影响土壤淋洗效率高低的因素之一[30]。本研究中,随着淋洗时间的延长,蒸馏水对土壤铅的淋洗率变化不明显(P>0.05),而14种植物对土壤中铅的淋洗率呈3种变化趋势(图 3A):其一,随着淋洗时间的延长,马桑、土荆芥、短尾铁线莲、千里光和穗状香薷对土壤中铅的淋洗率逐渐增加。其中,淋洗时间为8 h时,马桑对铅的淋洗率为23.78%,显著高于其2 h和4 h的淋洗率。其二,蜈蚣草、龙须草、泽漆和鹅绒藤随着淋洗时间延长,对铅的淋洗率变化不明显(P> 0.05)。其三,假繁缕、桑叶、清香木、鞍叶羊蹄甲和蓖麻随着淋洗时间延长,对铅的淋洗率呈下降趋势。其原因可能是这些植物中的某些特殊能团随着淋洗时间的延长,对原已吸附的Pb2+重新解吸,而被土壤胶体重新吸附,导致淋洗率反而下降。Moutsatsou等[31]研究表明,0.1 mol的EDTA对土壤中铅的淋洗率随着淋洗时间的延长总体呈类似的下降趋势。
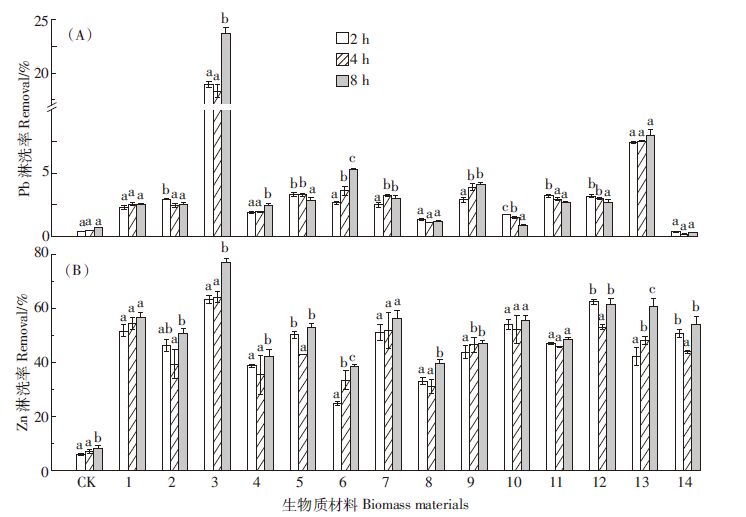
|
| 图 3 淋洗剂在不同淋洗时间下对铅(A)和锌(B)淋洗率的影响 Figure 3 Effects of phyto-eluents at different pH on Pb(A) and Zn (B) removal efficiencies 25 |
随着淋洗时间延长,蒸馏水对锌淋洗率逐渐上升,但总体仍较差。14种植物在不同淋洗时间下对土壤中锌的淋洗率均较好,并且随淋洗时间的延长呈3种变化趋势(图 3B):其一,假繁缕、马桑、土荆芥、短尾铁线莲、龙须草、穗状香薷和泽漆随着淋洗时间延长,对土壤中锌的淋洗率提高。淋洗时间为8 h时,马桑的锌淋洗率达77.03%。其二,蜈蚣草、千里光、清香木和鞍叶羊蹄甲对土壤中锌的淋洗率随淋洗时间延长几乎无变化(P>0.05)。同样,Moon等研究表明,2 mol HCl在淋洗时间为1 h和2 h时,对土壤中锌的淋洗率差异不大[32],可能因不同淋洗剂分子量大小不同,在进入土壤基质与Zn2+作用的时间上存在差异[33]。其三,桑叶、蓖麻和鹅绒藤随着淋洗时间的延长,对土壤锌的淋洗率呈先降后升的趋势。
3 结论(1)本研究采用的14种植物水浸提液作为淋洗剂对铅锌矿区污染土壤有较好的淋洗效率,且14种淋洗剂对重金属的淋洗能力为Zn>Pb。马桑对土壤中铅和锌的淋洗效果最好,是一种较好的环境友好型植物淋洗剂,在浓度为5%,pH为4,淋洗时间为8 h条件下,其对铅和锌的淋洗率分别为23.78%和77.03%。
(2)14种淋洗剂随着淋洗液浓度的增加,对土壤中铅和锌的淋洗率均呈两种上升趋势。蜈蚣草、土荆芥等对土壤中铅和锌的淋洗率随着浓度的增加逐渐增加;桑叶等随浓度增加对土壤中铅的淋洗率先增后减;马桑等对土壤中锌的淋洗率随浓度增加变化不明显。
(3)pH是影响土壤重金属淋洗效果的重要因素。本研究中,14种淋洗剂对土壤铅锌的淋洗率随着pH增加变化不同,总体呈下降趋势,但其中蜈蚣草和鹅绒藤随着pH增加,对土壤铅的淋洗率逐渐增加。
(4)随着淋洗时间的延长,14种淋洗剂对铅和锌的淋洗率呈三种变化趋势。当淋洗时间为8 h时,马桑对铅和锌的淋洗率均最大。
| [1] | 陈红琳, 张世熔, 李 婷, 等. 汉源铅锌矿区植物对Pb和Zn的积累及耐性研究[J]. 农业环境科学学报, 2007, 26(2):505-509. CHEN Hong-lin, ZHANG Shi-rong, LI Ting, et al. Heavy-metal accumulation and tolerance of plants at zinc-lead mine tailings in Hanyuan[J]. Journal of Agro-Environment Science, 2007, 26(2):505-509. |
| [2] | 杨 刚, 沈 飞, 钟贵江, 等. 西南山地铅锌矿区耕地土壤和谷类产品重金属含量及健康风险评价[J]. 环境科学学报, 2011, 31(9):2014-2021. YANG Gang, SHEN Fei, ZHONG Gui-jiang, et al. Concentration and health risk of heavy metals in crops and soils in a zinc-lead mining area in Southwest Mountainous Regions[J]. Acta Scientiae Circumstantiae, 2011, 31(9):2014-2021. |
| [3] | Bech J, Duran P, Roca N, et al. Accumulation of Pb and Zn in bidens triplinervia and seneciosp:Spontaneous species from mine spoils in Peru and their potential use in phytoremediation[J]. Journal of Geochemical Exploration, 2012, 123:109-113. |
| [4] | Qiu Q H, Deng S Y, Huang J, et al. Study on the influence of lead stress on the mustard family′s seed sprouting and seedling growing[J]. Chinese Agricultural Science Bulletin, 2010, 26(18):175-179. |
| [5] | LU Y S, HU X J, SONG X Y, et al. Remediation of cadmium-contaminated soil by extraction with para-sulphonato-thiacalix[4]arene, a novel supramolecular receptor[J]. Environmental Pollution, 2012, 167:93-100. |
| [6] | 曹心德, 魏晓欣, 代革联, 等. 土壤重金属复合污染及其化学钝化修复技术研究进展[J]. 环境工程学报, 2011(7):1441-1453. CAO Xin-de, WEI Xiao-xin, DAI Ge-lian, et al. Combined pollution of multiple heavy metals and their chemical immobilization in contaminated soils:A review[J]. Chinese Journal of Environmental Engineering, 2011(7):1441-1453. |
| [7] | 鲍 桐, 廉梅花, 孙丽娜, 等, 重金属污染土壤植物修复研究进展[J]. 生态环境, 2008, 17(2):858-865. BAO Tong, LIAN Mei-hua, SUN Li-na, et al. Research progress on the phytoremediation of soils contaminated by heavy metals[J]. Ecology and Environment, 2008, 17(2):858-865. |
| [8] | Dermont G, Bergeron M, Mercier G, et al. Soil washing for metal removal:A review of physical/chemical lechnologies and field applications[J]. J Hazard Maker, 2008, 152(1):1-31. |
| [9] | Peters W R. Chelant extraction of heavy metals from contaminated soil[J]. Journal of Hazardous Material, 1999, 66(1/2):151-210. |
| [10] | Hu P J, Yang B F, Dong C X, et al. Assessment of EDTA heap leaching of an agricultural soil highly contaminated with heavy metals[J]. Chemosphere, 2014, 117:532-537. |
| [11] | Lina M O, Rémi L, Jean-Francois B, et al. Effectiveness of soil washing, nanofiltration and electrochemical treatment for the recovery of metal ions coming from a contaminated soil[J]. Water Research, 2008, 42: 1943-1952. |
| [12] | Masahiro I, Shin-Ichiro W. Remediation of Pb-contaminated soils by washing with hydrochloric acid and subsequent immobilization with calcite and allophanic soil[J]. Journal of Hazardous Materials, 2007, 143(3):636-642. |
| [13] | Kuo S, Lai M S, Lin C W. Influence of solution acidity and CaCl2 concentration on the removal of heavy metals from metal-contaminated rice soils[J]. Environmental Pollution(Barking, Essex:1987), 2006, 144(3):918-925. |
| [14] | 可 欣, 李培军, 巩宗强, 等. 重金属污染土壤修复技术中有关淋洗剂的研究进展[J]. 生态学杂志, 2004, 23(5):145 -149. KE Xin, LI Pei-jun, GONG Zong-qiang, et al. Advances in flushing agents used for remediation of heavy metal-contaminated soil[J]. Chinese Journal of Ecology, 2004, 23(5):145-149. |
| [15] | 邓红侠, 李 珍, 杨亚莉, 等, 皂苷与EDTA复合淋洗污染塿土中Cu_Pb的效果研究[J]. 农业环境科学学报, 2015, 34(3):461-470. DENG Hong-xia, LI Zhen, YANG Ya-li, et al. Leaching of copper and lead in contaminated lou soil with combined saponin and EDTA[J]. Journal of Agro-Environment Science, 2015, 34(3):461-470. |
| [16] | Bucheli-Witschel M, Egli T. Environmental fate and microbial degradation of aminopolycarboxylic acids[J]. FEMS Microbiology Reviews, 2001, 25(1):69-106. |
| [17] | 雷国建, 陈志良, 刘千钧, 等. 生物表面活性剂及其在重金属污染土壤淋洗中的应用[J]. 土壤通报, 2013(06):1508-1511. LEI Jian-guo, CHEN Zhi-liang, LIU Qian-jun, et al. Biosurfactants and their applications in soil flushing of heavy metal pollution[J]. Chinese Journal of Soil Science, 2013(06):1508-1511. |
| [18] | Hossner L R. Dissolution for total elemental analysis//Sparks D L, ed. Methods of soil analysis, Part 3:Chemical methods[C]. Wisconsin:SSSA and ASA, Madison:49-64 |
| [19] | 韦 宏, 曾凡健, 陆敏仪, 等. 马桑根的化学成分研究[J]. 药学学报, 1998, 33(9):688-692. WEI Hong, ZENG Fan-jian, LU Min-yi, et al. Studies on chemical constituents from the root of Coriaria nepalensis wall(Coriaria sinica maxim)[J]. Acta Pharmaceutics Sinica, 1998, 33(9): 688-692 |
| [20] | Valenciaa E, Valenzuelaa U E, Barrosa E, et al. Constituents of Coriaria ruscifolia fruits[J]. Fitoterapia, 2001, 72:555-557 |
| [21] | 刘建超, 杨清美, 朱正方. 云南马桑子化学成分的研究[J]. 华中师范大学学报(自然科学版), 1996, 30(2):196-198. LIU Jian-chao, YANG Qing-mei, ZHU Zheng-fang. Studies on the chemical constituents of Coriaria sinica maxim[J]. Journal of Central China Normal University(Nat Sci), 1996, 30(2):196-198. |
| [22] | 张雁冰, 李 玲, 刘宏民, 等, 马桑化学成分研究[J]. 郑州大学学报(理学版), 2005, 37(1):75-77. ZHANG Yan-bin, LI Ling, LIU Hong-min, et al. Study on chemical constituents of Coriaria sinica maxin[J]. J of Zhengzhou Univ(Nat Sci Ed), 2005, 37(1):75-77. |
| [23] | Pacwa-Plociniczak M, Plaza G A, Piotrowska-Seget Z, et al. Environment applications of biosurfactants:Recent advances[J]. International Journal of Molecular Sciences, 2011, 12(1):633 -654. |
| [24] | 乔永锋, 彭永芳, 方云山, 等. 云南清香木绿叶和嫩红叶挥发性成分对比研究[J]. 安徽农业科学, 2013, 41(4):1583-1584, 1587. QIAO Yong-feng, PENG Yong-fang, FANG Yun-shan, et al. Study on the volatile component of green and red leave of the Pistacia weinmannifolia[J]. Journal of Anhui Agri Sci, 2013, 41(4):1583-1584, 1587. |
| [25] | 许中坚, 许丹丹, 郭素华, 等. 柠檬酸与皂素对重金属污染土壤的联合淋洗作用[J]. 农业环境科学学报, 2014, 33(8):1519-1525. XU Zhong-jian, XU Dan-dan, GUO Su-hua, et al. Combined leaching of heavy metals in soil by citric acid and saponin[J]. Journal of Agro-Environment Science, 2014, 33(8):1519-1525. |
| [26] | 孟 龙, 张世熔, 王贵胤, 等, 四种生物质材料水浸提液对锌污染土壤的淋洗效果研究[J]. 环境科学学报, 2015, 35(4):1152-1156. MENG Long, ZHANG Shi-rong, WANG Gui-yin, et al. Removal efficiency of Zn from contaminated soil by water extract of four biological materials[J]. Acta Scientiae Circumstantiae, 2015, 35(4):1152-1156. |
| [27] | Pichtel J, Vine B, Kuula-Vaisanen P, et al. Lead extraction from soils as affected by lead chemical and mineral forms[J]. Environmental Engineering Science, 2011, 18:91-98 |
| [28] | Begum Zinnat A, Rahman Ismail M M, Tate Yousuke, et al. Remediation of toxic metal contaminated soil by washing with biodegradable aminopolycarboxylate chelants[J]. Chemosphere, 2012, 87(10):1161-1170. |
| [29] | 郭晓方, 卫泽斌, 许田芬, 等. 不同pH值混合螯合剂对土壤重金属淋洗及植物提取的影响[J]. 农业工程学报, 2011, 27(7):96-100. GUO Xiao-fang, WEI Ze-bin, XU Tian-fen, et al. Effects of mixture of chelating agents with different pH values on phytoextraction and heavy metals removal[J]. Transactions of the CSAE, 2011, 27(7):96-100. |
| [30] | Mark C, Steele, John Pichtel. Ex-situ remediation of a metal-contaminated superfund soil using selective extractants[J]. Canadian Metallurgical Quarterly, 1998, 124:639-645. |
| [31] | Moutsatsou A, Gregou M, Matsas D, et al. Washing as a remediation technology applicable in soils heavily polluted by mining-metallurgical activities[J]. Chemosphere, 2006, 63(10):1632-1640. |
| [32] | Moon D H, Lee J, Wazne M, et al. Assessment of soil washing for Zn contaminated soils using various washing solutions[J]. Journal of Industrial and Engineering Chemistry, 2012, 18(2):822-825. |
| [33] | Gheju M, Pode R, Manea F. Comparative heavy metal chemical extraction from anaerobically digested biosolids[J]. Hydrometallurgy, 2011, 108(1/2):115-121. |
 2015, Vol. 34
2015, Vol. 34