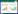文章信息
- 袁敏, 唐美珍, 罗彦鹤, 常文韬, 闫佩, 宋兵魁, 邢志杰, 赵晶磊, 廖光龙
- YUAN Min, TANG Mei-zhen, LUO Yan-he, CHANG Wen-tao, YAN Pei, SONG Bing-kui, XING Zhi-jie, ZHAO Jing-lei, LIAO Guang-long
- 盐胁迫下甲维盐·毒死蜱对菜田土壤微生物生态效应研究
- Effects of Salt and Emamectin Benzoate-Chlorpyrifos Mix on Ecological Characteristics of Microorganisms in Vegetable Soil
- 农业环境科学学报, 2015, 34(10): 1936-1942
- Journal of Agro-Environment Science, 2015, 34(10): 1936-1942
- http://dx.doi.org/10.11654/jaes.2015.10.014
-
文章历史
- 收稿日期: 2015-04-30
2. 曲阜师范大学南四湖湿地生态与环境保护重点实验室, 山东 曲阜 273165
2. Key Laboratory of Nasihu Lake Wetland Ecosystem & Environment Protection, Qufu Normal University, Shandong, Qufu 273165, China
土壤生态系统中的微生物和土壤酶是农田土壤比较活跃的组分,共同推动着土壤代谢过程,对自然和人为因素造成的变化反应敏感[1, 2]。Rajapaksha等[3]认为,对土壤酶活性的测定是最直接反应微生态状况的方法。因此,土壤微生物数量和土壤酶活性经常被用作评价土壤生态系统变化的重要指标。土壤微生物活性与土壤类型[4]、土地利用方式[5]、施肥[6]、农药[7]等外源污染物影响关系密切。
盐渍土分布广泛,其总面积约达9.5×108 hm2,占地球陆地面积的7.26%。我国的盐渍土面积约为1.0×108 hm2,其中盐渍土约占37%,潜在盐渍土约占18%[8]。土壤盐渍化对微生物种群、数量、活性以及土壤酶活性等产生毒害效应,导致土壤微生物生态区系的失衡,影响作物生产[9]。农药作为农田环境中主要的外源污染物之一,其对土壤生态环境的影响已引起越来越多的环境和土壤学领域相关学者的关注。40%甲维盐·毒死蜱水乳剂是甲维盐与毒死蜱按一定比例的混配农药,其有效成分为甲氨基阿维菌素苯甲酸盐0.5%、毒死蜱39.5%,它不仅能够替代大部分高毒杀虫剂,而且减少了生产成本,降低了制剂毒性。有研究表明,甲维盐和毒死蜱按不同配比复配后,均表现为增效作用,并且可以减少害虫对单一药剂的抗药性风险[10],具有较大的社会和经济效益。
随着甲维盐和毒死蜱复配制剂的广泛使用,其进入土壤环境的途径越来越多,剂量也越来越大,对土壤生态系统的风险也就越来越大,因此,研究40%甲维盐·毒死蜱混合溶剂对植物-土壤生态系统的影响,对农药的安全使用具有重要意义。
在自然界中,绝对意义上的单一污染是不存在的,污染多具伴生性与综合性,即多种污染物形成的复合污染[11]。目前对盐胁迫和40%甲维盐·毒死蜱的单因素研究较多,但对两者的复合污染研究较少,因此试验以小白菜土壤为研究对象,排除天气、植物根系及其他因素,研究了实验室内盆栽条件下,不同盐浓度与不同40%甲维盐·毒死蜱的施药量对土壤微生物数量和几种酶活性的影响,探明其中的规律,以期为甲维盐·毒死蜱对盐碱土壤环境的安全评价及合理使用提供科学依据。
1 材料与方法 1.1 供试农药与小白菜40%甲维盐·毒死蜱(成都新朝阳生物化学有限公司生产);小白菜(Non-heading Chinese cabbage),由苏州寒山种业有限公司提供。
1.2 供试土壤土样为采自曲阜师范大学农场的菜地棕壤,取0~20 cm深的棕壤,自然风干后研磨过筛(孔径=1 mm)备用。土样的理化性质[12]见表 1。
将盐浓度设3个处理(干土):0.3%、0.6%、1.2%(分别表示为A1、 A2、 A3)。所用盐为分析纯NaCl。土壤中盐浓度设定的依据为:根据我国土壤盐渍化标准,土壤含盐总量(干土重%)<0.03,为非盐渍土;土壤含盐总量(干土重%)0.5~1.0,为中盐渍土;土壤含盐总量(干土重%)1.0~2.2,为强盐渍土。按照土壤中甲维盐·毒死蜱的有效浓度设 3 个处理: 2.5、5.0、10.0 mg·kg-1(分别表示为B1、B2、B3)。土壤中甲维盐·毒死蜱浓度设定的依据为:甲维盐·毒死蜱的农药残留田间施药量为:低剂量450 g·hm-2,高剂量675 g·hm-2。农药施用农田后初始浸润土壤深度为0.3~0.4 cm[12]。甲维盐·毒死蜱低剂量施用时在土壤中的降解半衰期为5.3 d[13]。
盐和甲维盐·毒死蜱复合污染土样处理采用了有交互作用的正交表L9(34)设计安排试验[13, 14],正交设计L9(34)见表 2。 同时设空白对照。每个处理用风干土3 kg ,置于5 L塑料盆中,每盆播种20粒左右小白菜种子,在日光温室中培养,控制其含水量为田间持水量的(75±5)%。待小白菜长至三叶后进行喷洒农药及进行盐胁迫。加盐前控制喷水几天,以利于加盐后盐分在干燥土壤中迅速扩散。盐溶液(约500 mL) 一次性均匀浇入盆中,并在花盆下面放置一个塑料小盘,使下渗的溶液得以保留,对照组则浇入自来水。甲维盐·毒死蜱采用一次性喷洒,农药喷洒量为50 mL。于胁迫处理后第5、10、15、25、35 d 取样,测定土壤酶活性。
土壤脲酶采用靛酚蓝比色法测定。方法原理:以尿素为基质,酶促水解生成的氨与酚类化合物起反应生成蓝色的靛酚,颜色深度与氨含量相关。土壤脲酶的活性,以100 g土的NH3-N的毫克数表示。
脱氢酶活性采用三苯基四唑氯化物(TTC)比色法测定。方法原理:正常条件下用比色法测定,利用三苯基四氮唑氯化物作为氢的受体,当它接受氢后生成红色的甲醛,然后用比色法测定所生成的甲醛量用以表示酶的活性。按1 mg甲醛相当于150.35 μL H+换算,计算酶活性。
过氧化氢酶活性的测定采用高锰酸钾滴定法。原理是根据土壤(含过氧化氢酶)和过氧化氢作用析出的氧气体积或过氧化氢的消耗量,测定过氧化氢的分解速度,以此代表过氧化氢酶的活性。过氧化氢酶活性以100 g干土所消耗的KMnO4毫升数表示。
蔗糖酶活性的测定采用磷钼酸比色法,原理是蔗糖酶酶解所得还原糖具有还原性,能使磷钼酸络合物生成蓝色化合物,颜色强度与还原糖量相关,因此可用于比色测定还原糖量来表示酶的活性。
1.5 数据分析实验数据均为3次重复的平均数,采用Excel和SPSS19.0作统计处理,采用Duncan′s新复极差测验法进行方差分析。
2 结果与分析2.1 盐胁迫下甲维盐·毒死蜱对小白菜菜地土壤酶活性的影响
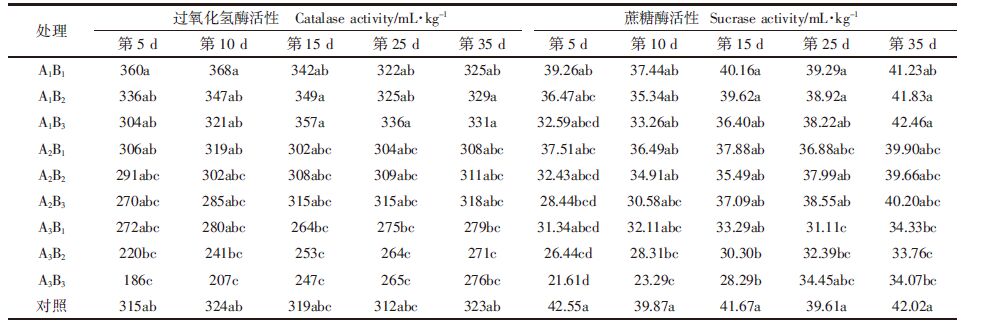
40%的甲维盐·毒死蜱、NaCl分别作用及其复合污染对小白菜菜地土壤酶活性的影响结果见表 3、表 4。
|
|
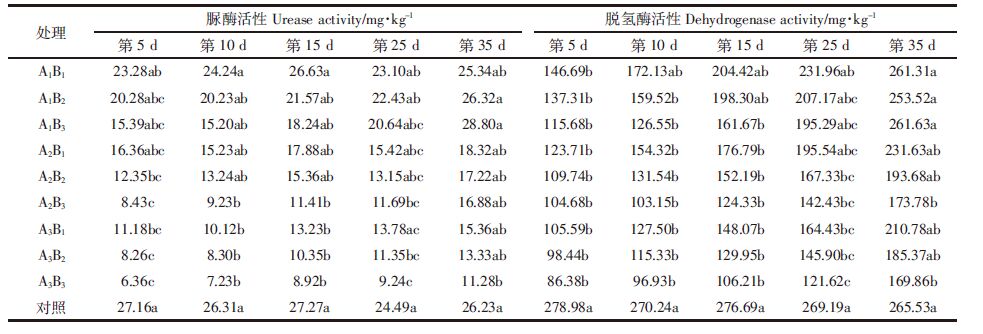
由表 3可以看出,在单一农药作用下,以低盐胁迫为例,施药初期,脲酶和脱氢酶活性随农药浓度的升高受抑制程度随之增大,与对照组相比,最大抑制率分别达43.34%和58.53%,差异显著;但随着随时间的推移,其抑制作用逐渐减弱,并于处理后35 d恢复到与对照组相一致的水平。
在单一盐胁迫作用下,土壤脲酶和脱氢酶活性与盐胁迫强度呈显著负相关,以低浓度农药施药量为例,外加盐量越高脲酶和脱氢酶活性越低,与对照组相比,土壤酶活性最大抑制率分别达到了58.84%和62.15%,随着时间的推移,低盐胁迫的土壤脲酶和脱氢酶活性基本上于处理后35 d能恢复到与对照组相一致的水平,但高盐胁迫情况下,土壤脲酶始终为抑制状态。
在盐与农药复合作用初期,土壤脲酶和脱氢酶活性均受不同程度的抑制作用,与对照组相比,最大酶活性抑制率达76.58%和69.04% (A3B3);随着时间的延长,低盐胁迫时,不同农药施药量的土壤脲酶活性均能恢复到与对照组相一致的水平,但随着盐浓度的提高,土壤脲酶和脱氢酶活性受抑制程度也相应提高,到胁迫35 d后,与对照组相比,高盐高农药处理的土壤脲酶和脱氢酶活性依然达到58.47%和36.03%(A3B3),由此可以说明盐胁迫是抑制土壤脲酶和脱氢酶活性的主导因素。
由表 4可知,在单一农药作用下,施药初期,以低盐胁迫为例,低浓度的甲维盐·毒死蜱对土壤过氧化氢酶活性表现为激活作用,但随农药浓度的升高,激活程度逐渐减弱,且当农药浓度达10 mg·kg-1时,土壤过氧化氢酶活性又表现为抑制作用;但随着时间的推移,低浓度农药处理的土壤过氧化氢酶活性激活作用逐渐减弱,并于处理后35 d恢复到与对照组相一致的水平;而高浓度农药处理的土壤过氧化氢酶活性在胁迫中期(15~25 d)表现为激活作用,与对照组相比,最大激活效率为10.64%,但最终于处理后35 d恢复到与对照组相一致的水平。单一农药对蔗糖酶活性的影响表现为:在施药初期,甲维盐·毒死蜱对土壤蔗糖酶活性表现为抑制作用,且随着农药浓度的升高,土壤蔗糖酶活性的抑制作用增强,与对照组相比,最大抑制率达23.41%,但随着时间的推移,甲维盐·毒死蜱对土壤蔗糖酶活性的抑制作用不断减弱,并于处理后35 d恢复到与对照组相一致的水平。
在单一盐胁迫作用下,土壤过氧化氢酶和蔗糖酶活性与盐胁迫强度呈显著负相关,以低浓度甲维盐·毒死蜱施药量为例,外加盐量越高土壤过氧化氢酶和蔗糖酶活性越低,与对照组相比,最大抑制率 (A3B1)分别达到了17.24%(处理后第15 d)和26.35% (处理后第5 d),随着时间的推移,低盐胁迫的土壤脲酶和脱氢酶活性基本上于处理后35 d能恢复到与对照组相一致的水平,但高盐胁迫情况下,土壤过氧化氢酶和蔗糖酶活性始终处于抑制状态。
在盐与甲维盐·毒死蜱复合作用初期,土壤过氧化氢酶在低盐低甲维盐·毒死蜱胁迫时,表现为激活作用,但随着盐浓度和甲维盐·毒死蜱浓度的升高,过氧化氢酶活性转为抑制作用,与对照组相比,最大酶活性抑制率达40.95%(A3B3);而土壤蔗糖酶活性在各种盐浓度和甲维盐·毒死蜱浓度胁迫下均表现为一定的抑制作用,且盐和甲维盐·毒死蜱浓度愈高,土壤蔗糖酶活性受抑制程度越大,与对照组相比,最大酶活性抑制率达49.21% (A3B3);随着时间的延长,低盐胁迫时,不同甲维盐·毒死蜱施药量的土壤过氧化氢酶和蔗糖酶活性均能于处理后35 d恢复到与对照组相一致的水平,但随着盐浓度的提高,不同甲维盐·毒死蜱施药量的土壤过氧化氢酶和蔗糖酶活性始终处于抑制状态,到胁迫35 d后,与对照组相比,高盐高甲维盐·毒死蜱处理的土壤过氧化氢酶和蔗糖酶活性依然达到14.55%和18.92% (A3B3),由此可以说明盐胁迫是抑制土壤过氧化氢酶和蔗糖酶活性的主导因素。
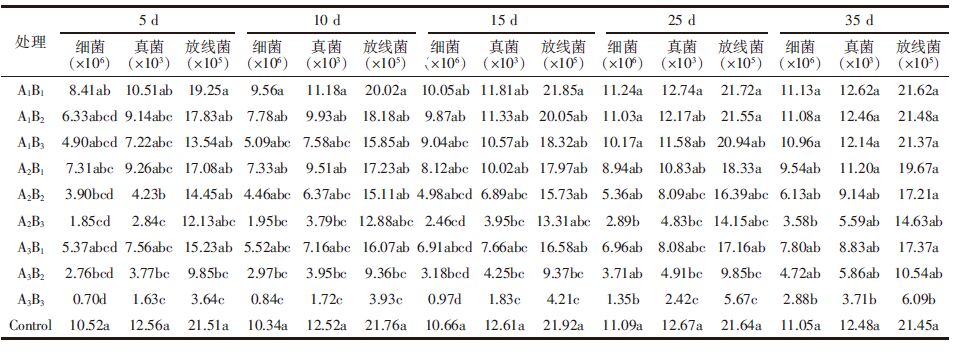
2.2 盐胁迫下甲维盐·毒死蜱对小白菜土壤微生物的影响40%的甲维盐·毒死蜱、NaCl分别作用及其复合污染对菜地土壤微生物数量的影响结果见表 5、表 6。
|
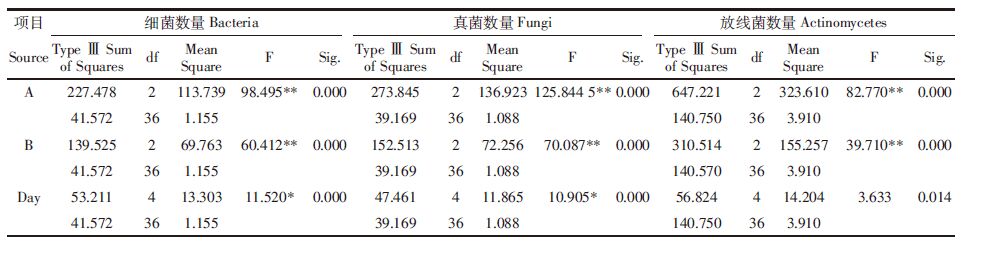
由表 5、表 6可以看出,在单一农药作用下,以低盐胁迫为例,施药初期,土壤细菌、真菌和放线菌数量对甲维盐·毒死蜱均比较敏感,处理后15 d内,土壤细菌数量均受一定程度的抑制作用,且随着农药浓度的增加,抑制强度增大。由统计分析可知,与对照组相比较,各浓度处理均表现为差异性显著。处理后5 d,甲维盐·毒死蜱对各种微生物数量的抑制作用最大,各浓度处理对细菌的抑制率分别为20.06%、39.83%、54.34%,对真菌的抑制率分别为16.32%、27.23%、42.52%,对放线菌的抑制率分别为10.51%、17.11%、37.05%。之后随着时间的延长,抑制作用逐渐减弱,并且于施药后25~35 d,土壤各种微生物数量恢复到与对照组相一致的水平。
在单一盐胁迫作用下,土壤细菌、真菌和放线菌数量与盐胁迫强度呈显著负相关,以低浓度甲维盐·毒死蜱施药量为例,外加盐量越高,土壤微生物数量越少,与对照组相比,土壤细菌、真菌和放线菌数量最大抑制率分别达到了48.95%、39.81%和29.20%,随着时间的推移,低盐胁迫下的土壤细菌、真菌和放线菌数量基本上于处理后25~35 d能恢复到与对照组相一致的水平,但高盐胁迫情况下,土壤各微生物数量始终处于抑制状态。
在盐与农药复合作用初期,土壤各种微生物数量均受不同程度的抑制作用,与对照组相比,细菌、真菌和放线菌的数量在处理后第5 d时抑制率最大,分别高达93.34%、87.02%和83.08%(A3B3);随着时间的延长,低盐胁迫时,不同甲维盐·毒死蜱施药量的土壤细菌、真菌和放线菌的数量均能恢复到与对照组相一致的水平,但随着盐浓度的提高,土壤细菌、真菌和放线菌受抑制程度也相应提高,到胁迫35 d后,与对照组相比,高盐高甲维盐·毒死蜱处理的土壤细菌、真菌和放线菌的抑制率依然达到73.94%、70.27%和71.61% (A3B3),由此说明高盐是抑制土壤微生物的主要因素。
表 6中F检验结果表明,盐和农药浓度对细菌、真菌及放线菌的数量有极其显著的影响;处理时间对细菌及真菌数量有显著影响,而对放线菌数量影响差异不显著。
3 讨论在盐和甲维盐·毒死蜱分别胁迫及其复合胁迫作用下,菜地土壤中脲酶、蔗糖酶、脱氢酶和过氧化氢酶活性均受到不同程度的抑制作用,且随着盐分水平和甲维盐·毒死蜱浓度的升高呈显著下降趋势;土壤细菌、真菌和放线菌数量亦随土壤盐分和甲维盐·毒死蜱浓度的增加而减少。这与在盐生植物和菜地植物上的研究结果基本一致[17, 18, 19, 20]。王晓坤[17]等在分析盐生植物根际微生物对含盐环境污染修复能力时,认为盐分抑制了微生物的繁殖。周德平[21]等在研究外源投加盐分对蔬菜地土壤微生物和土壤酶的生态毒理效应时发现,随着盐分水平的提高和胁迫时间延长,菜地土壤各种微生物呈现毒害效应,数量下降,且低于对照;同时盐胁迫明显抑制土壤脲酶、转化酶、过氧化氢酶和蛋白酶活性,且土壤盐胁迫强度与土壤酶活性均呈高度线性负相关。李正[22] 等研究发现,按厂家推荐浓度或其 2 倍浓度喷施 1~2 次毒死蜱,1周后土壤中细菌和真菌均受到抑制作用,放线菌无明显变化;解开治[23]等研究得出,毒死蜱与丁草胺复合污染降低了土壤细菌多样性。单敏[24]研究发现土壤酶活性在初期基本都受到毒死蜱的不利影响,并且这种抑制作用跟浓度呈正相关,浓度越高,抑制作用越明显,但抑制效应只是暂时的,随着试验时间的延长基本都恢复到对照水平。
土壤微生物和土壤酶既是土壤有机物转化的执行者,又是植物营养元素的活性库,常被认为是土壤肥力与质量的重要衡量指标[25, 26],其所处的生存条件均会对其生命过程产生或好或坏的影响。土壤微生物数量的下降和土壤酶活性的降低,必然影响土壤的肥力,进而影响植物的生长发育,导致植物根系活力、生物量及作物产量均随污染物浓度水平的上升而显著降低。在本试验中,土壤微生物数量与土壤酶活性随着盐浓度的增加而显著降低的原因,可能是由于高盐条件下微生物吸收了大量离子(Na+、Cl-等)进入细胞,这些离子会严重伤害酶和膜系统[27],同时盐分影响了土壤理化性状以及生长在其间的植物根系,使土壤pH值增大、土壤通气性下降,植物生长受到抑制,根系分泌有益物质减少,不利于微生物的生长繁殖,进而导致土壤酶来源锐减,酶活性降低。在处理初期,土壤微生物数量与土壤酶活性随着甲维盐·毒死蜱浓度的增大而降低;但随着时间的延长,甲维盐·毒死蜱的毒性逐渐减弱或消失,造成这一现象的原因可能是:在处理初期,农药浓度超过了土壤中微生物生存的阈值,因而对它们产生一定的急性毒性,微生物很难适应外界的强烈干扰,从而抑制其生长,并导致数量急剧减少。后来随着时间的延长,农药在土壤中不断被降解而减少,对微生物的毒害性也就随之减弱;同时可能多数微生物能够忍耐并适应了农药的加入剂量,且因农药打破了原来土壤微生物的平衡,使其对部分有“拮抗作用” 的微生物的抑制能力消除,微生物的数量不断增加,最终恢复到与对照组相一致的水平。但是在与高盐复合胁迫时,土壤微生物数量与土壤酶活性始终处于被抑制状态,由此可以说明高盐是抑制土壤微生物数量和酶活性的主导因素。
4 结论(1)在实验室内盆栽实验条件下,低盐和不同浓度的甲维盐·毒死蜱分别胁迫及其复合胁迫作用下,处理初期,小白菜菜地土壤中脲酶、蔗糖酶、脱氢酶和过氧化氢酶活性均受到不同程度的抑制作用,且随着盐分水平和甲维盐·毒死蜱浓度的升高呈显著下降趋势;土壤细菌、真菌和放线菌数量亦随土壤盐分和甲维盐·毒死蜱浓度的增加而减少。但随着时间的延长,农药在土壤中不断被降解而减少,对微生物的毒害性也就随之减弱,土壤酶活性和微生物数量最终恢复到与对照组相一致的水平。
(2)高盐和不同浓度的甲维盐·毒死蜱单独胁迫及其复合胁迫作用下,土壤酶活性和微生物数量在整个实验期间(35 d)始终处于被抑制状态,由此可以说明盐胁迫是抑制土壤酶活性和微生物数量的主导因素。
| [1] | 袁传卫, 姜兴印, 殷万元, 等. 毗唑醚菌酯对土壤微生物呼吸作用及土壤酶活性的影响[J]. 农业环境科学学报, 2015, 34(5): 897-903. YUAN Chuan-wei, JIANG Xing-yin,YIN Wan-yuan, et al. Effects of pyraclostrobin on soil microbial respiration and enzymatic activities[J].Journal of Agro-Environment Science, 2015, 34(5):897-903. |
| [2] | Chen C L, Liao M, Huang C. Effect of combined pollution by heavy metals on soil enzymatic activities in areas polluted by tailings from Pb-Zn-Ag mine[J]. Journal of Environmental Sciences, 2005, 17(4): 637-640. |
| [3] | Rajapaksha R M C P, Tobor-Kaplon M A, Määth E. Metal toxicity affects fungal and bacterial activities in soil differently[J]. Applied and Environmental Microbiology, 2004, 70(5):2966-2973. |
| [4] | 李媛媛,周运超,邹 军,等. 黔中石灰岩地区典型灌木林土壤酶活性与植物物种多样性研究[J]. 水土保持研究, 2010, 17(3):245-249. LI Yuan-yuan, ZHOU Yun-chao, ZOU Jun,et al. A study on soil enzyme and plant species diversity of typical shrub in the limestone area of central Guizhou[J]. Research of Soil and Water Conservation, 2010, 17(3):245-249. |
| [5] | 仉 欢, 朱玉坤, 乔 康, 等. 磷化铝对土壤微生物数量和酶活性的影响[J]. 农业环境科学学报, 2012,31(1):143-148. ZHANG Huan, ZHU Yu-kun, QIAO Kang, et al. Effects of aluminum phosphide on soil microbial population and enzyme activities[J]. Journal of Agro-Environment Science, 2012,31(1):143-148. |
| [6] | Maarit N R, Ilse H, Jukka H A, et al. Microbial toxicity and impacts on soil enzyme activities of pesticides used in potato cultivation[J]. Appl Soil Ecol, 2009, 41: 293-304. |
| [7] | 荆瑞勇, 王丽艳. 氯嘧磺隆对土壤微生物数量酶活性及呼吸强度的影响[J]. 水土保持研究, 2013, 20(3):60-64. JING Rui-yong,WANG Li-yan. Effect of chlorimuron-ethyl on soil microbial number enzyme activity and respiration[J]. Research of Soil and Water Conservation, 2013, 20(3): 60-64. |
| [8] | 房 朋, 任丽丽, 张立涛, 等. 盐胁迫对杂交酸模叶片光合活性的抑制作用[J]. 应用生态学报, 2008, 19(10): 2137-2142. FANG Peng, REN Li-li, ZHANG Li-tao, et al. Inhibition effects of salt stress on photosynthetic activity of Rumex K-1[J]. Chinese Journal of Applied Ecology, 2008, 19(10): 2137-2142 |
| [9] | 赵 索, 吴凤芝. NaCl胁迫对不同耐盐黄瓜品种生长及根区土壤酶活性的影响[J]. 中国蔬菜, 2012(10): 48-55. ZHAO Suo,WU Feng-zhi. Effects of NaCl stress on growth and rhizoplane soil enzyme activities of different cucumber cultivars with differing salt tolerance[J]. China Vegetables, 2012(10):48-55. |
| [10] | 张战泓, 刘建宇, 戴建平, 等. 甲维盐与毒死蜱复配对水稻稻纵卷叶螟防治效果研究[J]. 湖南农业科学, 2010(9): 63-65, 68. ZHANG Zhan-hong, LIU Jian-yu, DAI Jian-ping, et al. Control effect of combination of emamectin-benzoate and chlorpyrifos against Cnap-halocrocis medinalis Guenée[J]. Hunan Agricultural Sciences, 2010(9): 63-65, 68. |
| [11] | 李雪峤, 吴凤芝. NaCl胁迫下苯丙烯酸对黄瓜幼苗根际土壤微生物及产量的影响[J]. 土壤通报,2011,42(6):1364-1370. LI Xue-jiao, WU Feng-zhi. Effects of cinnamic acid on rhizosphere soil microorganism and yield of cucumber seedling under NaCl stress[J]. Chinese Journal of Soil Science, 2011, 42(6): 1364-1370. |
| [12] | 劳家柽. 土壤农化分析手册[M]. 北京: 农业出版社,1988. LAO Jia-cheng. Soil agricultural chemistry analysis manual[M]. Beijing: Agriculture Press, 1988. |
| [13] | 南京农业大学.田间试验和统计方法[M].北京:农业出版社,1979: 163-781. Nanjing Agricultural University. Field trial and statistical method[M]. Beijing: Agriculture Press, 1979: 163-781. |
| [14] | 杜荣骞. 生物统计学[M]. 北京:高等教育出版社, 2003. DU Rong-qian. Biostatistics[M]. Beijing: Higher Education Press, 2003. |
| [15] | 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. GUAN Song-yin. Soil enzyme and research method[M]. Beijing: Agriculture Press, 1986. |
| [16] | 中国科学院南京土壤研究所微生物室.土壤微生物研究法[M]. 北京: 科学出版社, 1985. Microbiology Laboratory, Institute of Soil Science, Chinese Academy of Science. Soil microbial method[M]. Beijing: Science Press, 1985. |
| [17] | 王晓坤, 王 刃, 周笑白, 等. 盐生植物根际微生物对含盐环境污染修复展望[J]. 土壤通报, 2007, 38(5):1003-1006. WANG Xiao-kun, WANG Ren, ZHOU Xiao-bai, et al. Prospect about remediation potential of halophytes rhizospheric microorganisms under salinity circumstance[J]. Chinese Journal of Soil Science, 2007, 38(5):1003-1006. |
| [18] | 柳王荣, 杨仁斌, 傅 强, 等. 甲维·毒死蜱40%水乳剂在水稻和稻田中的残留动态研究[J]. 中国农学通报, 2011, 27(30): 214-221. LIU Wang-rong, YANG Ren-bin, FU Qiang, et al. Residue dynamics of emamectin benzoate and chlorpyrifos in rice and paddy[J]. Chinese A gricultural Science Bulletin, 2011,27(30):214-221. |
| [19] | 马献发, 周连仁, 陈 然. 快速修复苏打草甸碱土植被对土壤盐分和酶活性的影响[J]. 土壤学报, 2007, 44(4):761-763. MA Xian-fa, ZHOU Lian-ren, CHEN Ran. Effect of recovering quickly vegetation ameliorative ways in meadow solonetz soil on salt content and enzyme activities[J]. Acta Pedologica Sinica, 2007, 44(4):761-763. |
| [20] | 张清明, 冯瑞芝, 张保华, 等. 盐胁迫下吡虫啉对棉田土壤微生物数量及酶活性的影响[J]. 水土保持研究, 2014, 21(3):25-30. ZHANG Qing-ming, FENG Rui-zhi, ZHANG Bao-hua, et al. Effects of imidacloprid on soil microbes and enzyme activities under the salinity stress[J]. Research of Soil and Water Conservation, 2014, 21(3):25-30. |
| [21] | 周德平, 吴淑杭, 褚长彬, 等. 盐胁迫对蔬菜地土壤微生物及土壤酶活的毒害效应[J]. 农业环境科学学报, 2011,30(8):1602-1607. ZHOU De-ping, WU Shu-hang, CHU Chang-bin, et al. Eco-toxicological effects of salt stress on microorganisms and enzymes activities in vegetable soil[J]. Journal of Agro-Environment Science, 2011, 30(8):1602-1607. |
| [22] | 李 正, 许鸿源, 周凤玨, 等. 毒死蜱对土壤微生物及碳、氮含量的生态效应[J]. 科技信息, 2009,(13): 407-408, 421. LI Zheng, XU Hong-yuan, ZHOU Feng-jue, et al. Ecological effect of chlorpyrifos on soil microorganism and carbon nitrogen content[J]. Science and Technology Information, 2009, (13): 407-408, 421. |
| [23] | 解开治, 徐培智, 陈建生, 等. 丁草胺和毒死蜱复合污染对稻田土壤细菌群落多样性的影响, 农业环境科学学报, 2009, 28(4): 686-690. XIE Kai-zhi, XU Pei-zhi, CHEN Jian-sheng, et al. Effect of combined pollution of Butachlor and Chlorpyrifos on soil bacteria diversity in paddy field[J]. Journal of Agro-Environment Science, 2009, 28(4):686-690. |
| [24] | 单 敏, 虞云龙, 方 华, 等. 丁草胺对土壤微生物数量和酶活性的影响[J]. 农药学学报, 2005, 7(4): 383-386. SHAN Min, YU Yun-long, FANG Hua, et al.Effect of butachlor on soil microbial populations and enzyme activities[J]. Chinese Journal of Pesticide Science, 2005, 7(4):383-386. |
| [25] | Ibekwe A M, Poss J A, Grattan S R. Bacterial diversity in cucumber(Cucumis sativus) rhizosphere in response to salinity,soil pH, and boron[J]. Soil Biology & Biochemistry, 2010,42:567-575. |
| [26] | Chen S L, Li J K, Eberhard F, et al. Sodium and chloride distribution in roots and transport in three poplar geno types under increasing NaCl stress[J]. For Ecol Man, 2002, 168(1/ 3) : 217-230. |
| [27] | Parida A K, Das A B. Salt tolerance and salinity effects on plants: A review[J]. Ecotoxicol Environ Sa, 2005, 60:324-349. |
 2015, Vol. 34
2015, Vol. 34