文章信息
- 高文萱, 张克强, 梁军锋, 宋香育, 韩冰雅, 杜连柱
- GAO Wen-xuan, ZHANG Ke-qiang, LIANG Jun-feng, SONG Xiang-yu, HAN Bing-ya, DU Lian-zhu
- 氨胁迫对猪粪厌氧消化性能的影响
- Effects of Ammonia Stresses on Anaerobic Digestion of Swine Manure
- 农业环境科学学报, 2015, 34(10): 1997-2003
- Journal of Agro-Environment Science, 2015, 34(10): 1997-2003
- http://dx.doi.org/10.11654/jaes.2015.10.023
-
文章历史
- 收稿日期: 2015-04-17
2. 沈阳农业大学土地环境学院, 沈阳 100161
2. College of Land and Environment, Shenyang Agriculture University, Shenyang 100161, China
近年来,养殖废弃物的产生量逐年增加,同时由于无害化处理和资源化利用率低,引发了严重的环境问题。厌氧消化技术能够降解养殖废弃物,生产清洁能源沼气,运行费用相对较低,是被广泛接受、优先选择的方法[1],已逐渐成为粪污处理的主要技术手段。但在厌氧消化过程中,猪粪等高含氮原料中大部分有机氮被转化成氨氮,而氨氮质量浓度的增加易产生氨抑制作用,降低厌氧消化效率,甚至导致厌氧发酵系统崩溃。国外学者对氨抑制进行了较为深入的研究,但由于原料和试验条件(有机负荷、pH、温度等)的差异,研究结果差异较大,甚至得到了相反的结论[2, 3, 4, 5]。国内针对猪粪厌氧消化氨抑制的研究相对较少。王悦超[6]的研究结果显示,总固体分数TS>15.6%的中温发酵和TS>7.4%的高温发酵均可能发生氨抑制,初始抑制质量浓度约为1100 mg·L-1。陈闯等[1]的猪粪连续干式发酵试验结果表明,氨氮质量浓度从2250 mg·L-1增加到3800 mg·L-1,产气速率降低74.1%。
本文针对猪粪厌氧消化过程中的氨抑制现象,研究不同氨氮质量浓度下消化体系产沼气性能,明确猪场粪污厌氧消化的氨抑制浓度及影响程度,并通过末端限制性酶切片段长度多态性(Terminal-Restriction Fragment Length Polymorph- ism,T-RFLP)和克隆文库,分析不同氨氮添加量下产甲烷微生物的变化规律,以期为预防和缓解猪场粪污厌氧消化氨抑制提供理论依据和数据支持。
1 材料与方法 1.1 试验材料发酵原料猪粪取自天津市西青区某规模化养殖基地,接种物取自实验室长期运行的猪粪厌氧消化反应器(Continuous Stirred Tank Reactor,CSTR)。猪粪及接种物基本性质见表 1。
批式厌氧消化试验装置为500 mL厌氧瓶;微量气体压力测量仪(GWH3111,德国);恒温摇床;气相色谱仪(GC-5890)。
1.3 试验方法 1.3.1 厌氧消化试验设计称取15.0 g猪粪至厌氧瓶中,接入100 g接种物,按400、800、1600、2400、3200、4000 mg·L-1(以N计)6个NH4+-N质量浓度梯度,加入相应量的NH4OH,以不添加氨氮为对照,用蒸馏水调整总质量为200 g。顶空氮气吹脱2 min后密封摇匀,置于37 ℃水浴槽内进行厌氧消化,每天定时手动振荡。每个处理设3个重复,初始pH分别为6.83、7.15、7.52、8.07、8.49、8.75、8.94。试验开始后定期测量厌氧瓶中气体的压力,并取气体样品测定其中CH4和CO2的体积分数,每次测压及取气样后将厌氧瓶内气体排出;试验结束后称量厌氧瓶质量,取消化后样品测量pH、氨氮质量浓度、TS和VS;计算标准状况下(1 atm,0 ℃)两次测压时间间隔内产生的气体体积。
1.3.2 基因组DNA提取参考Feng等[7]方法,厌氧消化完成后取每个处理中3个重复的混合样2 mL,14 000×g低温冷冻离心 10 min,弃上清液,采用FastDNAR ®Spin Kit for soil试剂盒(Mpbio,USA)提取基因组DNA。
1.3.3 T-RFLP产甲烷古菌PCR扩增采用通用引物A109f(ACKGCTCAGTAACACGT)和A912r(CTCCCCCGCCAATTCCTTTA)[8, 9],反向引物末端用6-carbixtfluorescein(FAM)荧光素标记。PCR条件:94 ℃预变性5 min,94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1.5 min,共30个循环,最后72 ℃延伸10 min。扩增产物纯化后用限制性内切酶HhaI酶切,酶切产物用毛细管电泳分离,选取50~600 bp的DNA片段进行分析,舍去T-RFs相对丰度小于1%的片段。
1.3.4 克隆文库构建用非荧光标记的引物(A109f和A912r)对基因组DNA样品中的古菌16S rDNA进行PCR扩增。扩增产物纯化后与pGEM-T Easy载体(Promega,美国)连接,转化到JM109 感受态细胞中,通过蓝白斑筛选,选取阳性克隆子进行测序。测序结果与NCBI数据库中已知菌属的16S rDNA进行比对,确定样品中古菌的种属[10]。
1.4 测试项目与方法猪粪和接种物的TS、VS采用称量法测定[11];总氮采用凯氏定氮法测定,总碳采用重铬酸钾氧化法测定,氨氮采用纳氏试剂法测定[11];CH4和CO2的体积分数采用气相色谱法,色谱柱长2 m、内径3 mm,Porapak Q柱,柱温40 ℃;热导检测器(TCD),温度180 ℃;载气(氦气)流速21 mL·min-1;进样口温度100 ℃,进样量500 μL[12]。
1.5 消化底物转化效率通过下式计算厌氧消化底物的生物转化产CH4效率(Biodegradability,BDA)[13]:

根据厌氧消化温度、氨氮质量浓度和pH,通过公式(2)计算游离氨(FAN)的质量浓度[14]:
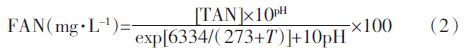
采用SPSS 17.0 进行差异显著性分析,用Duncan新复极差法在0.05 水平上检验。
2 结果与讨论 2.1 厌氧消化产气特征不同氨氮质量浓度胁迫下累积沼气产量见图 1。氨氮添加量为400、800 mg·L-1时,沼气累积产量与对照无明显差异,添加量为1600 mg·L-1时,沼气累积产量较对照下降11.1%,表明氨氮添加量小于800 mg·L-1对厌氧消化无不利影响,其添加量为1600 mg·L-1时对厌氧消化存在弱抑制;氨氮添加量达到或超过2400 mg·L-1时,累积沼气产量明显降低,而且添加量为2400、3200 mg·L-1时迟滞期分别延长到20 d和60 d左右,表明厌氧消化过程发生明显抑制,与Procházka等[15]的研究结果相似。试验结束时,对照和不同处理的VS沼气产率分别为502.4、517.9、491.7、460.6、388.9、181.3、92.7 mL·g-1,VS的CH4产率分别为328.5、338.1、323.2、304.9、276.2、124.9、56.1 mL·g-1,与对照相比,氨氮添加量为400 mg·L-1时增加了2.9%,其他处理分别降低了1.6%、7.2%、15.9%、62.0%和82.9%。

|
| 图 1 累积沼气产率曲线 Figure 1 Dynamics of cumulative biogas production during anaerobic digestion |
图 2为不同氨氮添加量下产CH4速率曲线。对照和氨氮添加量为400~2400 mg·L-1的处理中均有两个产气速率峰值,与Zhang等[16]的研究结果相符,其中第一个产气高峰对应溶解性有机质的快速降解,第二个产气高峰来自粗蛋白、粗脂肪和粗纤维等大分子不溶性物质的降解。氨氮添加量为0~800 mg·L-1的处理中,第一个产气高峰出现在第4~6 d,最大VS产CH4速率分别为18.3、18.4、17.1 mL·g-1·d-1,第二个产气高峰出现在第28 d左右,最大VS产CH4速率分别为10.4、12.1、13.1 mL·g-1·d-1;当氨氮添加量为1600、2400 mg·L-1时,第一个产气高峰分别推迟至第9 d和第28 d,最大VS产CH4速率分别为12.9、14.5 mL·g-1·d-1;而氨氮添加量为3200、4000 mg·L-1时,只有一个产CH4高峰,分别出现在第69 d和88 d,最大VS产CH4速率分别为4.8、2.9 mL·g-1·d-1。这是因为初始阶段消化体系中FAN的质量浓度随氨氮添加量的增加而升高,当氨氮添加量为2400 mg·L-1时,对产甲烷菌的活性产生抑制作用,导致产CH4高峰推迟、产CH4速率降低,当添加量为3200 mg·L-1时,产CH4反应在60 d左右逐渐恢复,但速率仍很低。

|
| 图 2 消化过程产CH4速率曲线 Figure 2 Dynamic curves of CH4 production rates during anaerobic digestion |
图 3为不同处理沼气中CH4的体积分数曲线。氨氮添加量低于2400 mg·L-1的处理中,CH4的体积分数变化趋势一致,第二个产气高峰期CH4的体积分数在77.0%~85.3%之间,相比第一个产气高峰有所升高,主要原因是转化生成CH4的底物不同,第一个产气高峰主要来自底物中碳水化合物为主的溶解性小分子有机物的降解,第二个产气高峰来自蛋白、脂肪和纤维等的进一步降解,而蛋白、脂肪等降解产生的沼气中CH4的体积分数通常较高。在氨氮添加量为3200、4000 mg·L-1时,随着厌氧消化时间的延长,CH4体积分数逐渐升高,主要是因为试验开始时氨氮对产甲烷菌具有显著的抑制作用,随着试验的进行,在氨氮耐受微生物的作用下抑制作用逐渐减弱,使CH4的体积分数逐渐增加。

|
| 图 3 沼气中CH4体积分数变化曲线 Figure 3 Dynamics of CH4 fraction in biogas |
图 4为不同处理厌氧消化后TS和VS的降解率。氨氮添加量为0~800 mg·L-1的处理中,TS的降解率高于48.5%,VS的降解率高于67.0%;氨氮添加量为1600 mg·L-1及以上时,TS和VS的降解率随氨氮添加量的增加而降低,TS的降解率分别为44.9%、39.9%、30.8%和27.0%,VS的降解率分别为62.0%、55.0%、42.1%和35.4%,与沼气产率的变化规律相符。

|
| 不同字母表示处理间差异达5%显著水平 图 4 不同氨氮添加量下TS和VS降解率 Figure 4 Degradation rates of TS and VS at different ammonia additions |
表 2为不同氨氮添加量胁迫下厌氧消化不同时期的BDA。根据消化原料理论CH4产率计算公式[17, 18],试验中猪粪的理论CH4产率为474 mL·g-1 VS。由表 2可知,氨氮添加量为400 mg·L-1,消化结束时的CH4产率为338 mL·g-1 VS,为理论产率的71.3%,当氨氮添加量高于400 mg·L-1时,CH4产率和BDA逐渐减小,氨氮添加量为4000 mg·L-1时,CH4产率仅为56 mL·g-1 VS,消化体系总CH4产生量占理论产量的11.8%。
厌氧消化中FAN是引发氨抑制的主要原因[19, 20]。CH4产率与FAN的质量浓度、氨氮初始添加量关系见图 5,消化前后pH及FAN见表 3。由图 5和表 3可知,消化后TAN的质量浓度随氨氮添加量的增加而升高,CH4产率随氨氮添加量的增加先升高后降低。

|
| 图 5 不同氨氮添加量与消化后CH4产率、FAN关系 Figure 5 Methane yields and FAN under different ammonia stresses |
FAN对厌氧消化抑制的浓度范围较宽,同时受原料种类、温度、pH和接种物等影响,不同学者研究结果(80~1200 mg·L-1 [21, 22, 23, 24])相差较大,如Baris等[22]的研究表明,经高浓度氨氮驯化的接种物中,乙酸利用型产甲烷菌对FAN的耐受浓度为700 mg·L-1,而H2利用型产甲烷菌对FAN的耐受浓度达到1200 mg·L-1。试验中,氨氮添加量为0~1600 mg·L-1时对CH4产率影响不显著,表明FAN初始质量浓度低于246.6 mg·L-1,对厌氧消化无明显影响。初始FAN质量浓度为754.4 mg·L-1(氨氮添加量为2400 mg·L-1)时,产CH4迟滞期达到20 d,累积沼气产量比对照降低22.6%,产沼气过程发生明显抑制;当氨氮添加量为3200、4000 mg·L-1时,消化前FAN的质量浓度在1400 mg·L-1以上,迟滞期长于60 d,CH4产率与对照相比分别降低了62.0%和82.9%。值得注意的是,消化后虽然TAN在3900 mg·L-1以上,但FAN质量浓度却低于80 mg·L-1,主要是因为产CH4过程受到抑制,在水解产酸作用下pH降低,导致FAN质量浓度远低于754.4 mg·L-1,但厌氧消化仍处于抑制状态[25, 26]。
2.5 氨氮添加量对产甲烷古菌群落影响将每个处理中提取的基因组DNA等浓度混合,进行克隆文库构建。根据构建的古菌16S rDNA基因文库及模拟酶切结果,将测得的序列分为9个操作分类单元(OTU),每个OTU代表一种古菌。测得序列与GenBank中公布的序列相似性在81%~100%之间不等,比对结果见表 4。
 |
利用限制性内切酶 HhaI酶切带荧光标记的产甲烷古菌PCR扩增产物得出T-RFLP 特征片段(T-RFs)。在GenBank中16S rDNA比对结果显示(表 4),T-RF 93为甲烷八叠球菌属(Methanosarcina),T-RF 114和T-RF 204为甲烷囊菌属(Methanoculleus),T-RF 159和T-RF 534 为甲烷球菌属(Methanococcus),T-RF 536为甲烷鬃菌属(Methanosaeta),T-RF 545为未知产甲烷古菌,“其他”为相对丰度低于1%的产甲烷古菌。图 6为不同处理中产CH4古菌特征片段(T-RFs)及相对丰度。由图 6可知,2400 mg·L-1的氨氮添加量是产甲烷古菌群落变化的拐点,添加量在0~2400 mg·L-1范围内,随添加氨氮质量浓度的增加,Methanosaeta的相对丰度总体逐渐降低,由对照的39.7%降至28.1%,Methanosarcina的相对丰度从对照的8.7%升到12.8%,Methanococcus的相对丰度从6.2%升到17.8%;当氨氮添加量从2400 mg·L-1增至4000 mg·L-1时,Methanosaeta的相对丰度明显升高,达到40.9%,与对照相近,Methanosarcina的相对丰度升到24.6%,Methanococcus相对丰度急剧下降至4.1%,Methanoculleus的变化趋势则与Methanococcus相似。

|
| 图 6 不同氨氮添加量厌氧消化后产甲烷古菌T-RFs变化 Figure 6 Change of T-RFs in methanogenic communities under different ammonia stresses |
一般情况下,厌氧消化产甲烷以代谢乙酸为主要途径,占总CH4产生量的60%以上,对应的产甲烷菌主要为乙酸营养型的Methanosaeta[27]。由上述结果可知,随氨氮质量浓度升高,产甲烷古菌属发生明显的变化,氨氮添加量在2400 mg·L-1、FAN质量浓度为754.4 mg·L-1以下时,对氨氮相对敏感的乙酸营养型产甲烷菌Methanosaeta(T-RF 536)的相对丰度随氨氮质量浓度的增加而逐渐降低,以H2营养型产甲烷菌属Methanococcus(T-RF 534)和Methanoculleus(T-RF 114,T-RF 204)的相对丰度呈明显升高趋势。Methanosarcina可以H2和乙酸等为底物生成CH4,相对丰度随氨氮质量浓度的增加呈逐渐升高趋势。由于H2营养型产甲烷菌代谢速率明显低于乙酸营养型产甲烷菌,乙酸营养型产甲烷菌受到抑制将严重影响厌氧消化效率[28, 29],与试验中产气量的结果相吻合。当氨氮添加量为3200、4000 mg·L-1时,Methanosaeta的相对丰度逐渐升高,而Methanoculleus和Methanococcus的相对丰度则呈下降的趋势。其原因可能是消化初始时FAN的质量浓度高于1400 mg·L-1,对乙酸营养型甲烷菌和H2营养型甲烷菌的生长繁殖和代谢均有较强的抑制作用,同时消化体系中相对丰度低于1%的甲烷菌有所增加,从而使Methanosaeta、Methanoculleus和Methanococcus的相对丰度表现出上述变化规律。
3 结论(1)氨氮添加量为0~800 mg·L-1、初始FAN质量浓度低于50 mg·L-1对猪粪厌氧消化无明显影响,氨氮添加量为2400 mg·L-1、初始FAN质量浓度为754.4 mg·L-1对厌氧消化具有显著影响。
(2)氨氮添加量在0~2400 mg·L-1范围内时,乙酸营养型产甲烷菌的相对丰度总体随氨氮质量浓度的增加而降低,氢营养型产甲烷菌相反,说明产气量的降低可能是由不同营养型产甲烷菌群落结构的改变造成的。
| [1] | 陈 闯, 邓良伟, 信 欣, 等. 上推流厌氧反应器连续干发酵猪粪产 沼气试验研究[J]. 环境科学, 2012, 33(3):1033-1040. CHEN Chuang, DENG Liang-wei, XIN Xin, et al. Continuous dry fermentation of pig manure using up plug-flow type anaerobic reactor[J]. Environmental Science, 2012, 33(3):1033-1040. |
| [2] | Lay J J, Li Y Y, Noike T, et al. Analysis of environmental factors affecting methane production from high-solids organic waste[J]. Water Science & Technology, 1997, 36(6/7):493-501. |
| [3] | Chen Y, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process:A review[J]. Bioresource Technology, 2008, 99(10):4044-4064. |
| [4] | 杜连柱, 杨继东, 张克强, 等. 厌氧消化过程氨抑制研究进展[J]. 可再生 能源,2012, 30(4):70-74. DU Lian-zhu, YANG Ji-dong, ZHANG Ke-qiang, et al. A review on research of ammonia inhibition in anaerobic digestion[J]. Renewable Energy Resources, 2012, 30(4):70-74. |
| [5] | 唐崇俭, 郑 平, 金仁村, 等. 猪场废水厌氧生物处理FAN抑制及其调控 对策的研究[J]. 高校化学工程学报, 2008, 22(4):697-702. TANG Chong-jian, ZHENG Ping, JIN Ren-cun, et al. Inhibition of anaerobic digestion of swine wastewater caused by free ammonia nitrogen and its control strategies[J]. Journal of Chemical Engineering of Chinese Universities, 2008, 22(4):697-702. |
| [6] | 王悦超. 高固体浓度猪粪的厌氧发酵特性研究[D]. 上海:复旦大学, 2011. WANG Yue-chao. Fermentation property of high solid digestion of swine manure[D]. Fudan University, Shanghai, 2011. |
| [7] | Feng X M, Karlsson A, Sevensson B H, et al. Impact of trace element addition on biogas production from food industrial waste-linking process to microbial communities[J]. Fems Microbiology Ecology, 2010, 74(1):226-240. |
| [8] | McGarvey J A, Miller W G, Zhang R, et al. Bacterial population dynamics in dairy waste during aerobic and anaerobic treatment and subsequent storage[J]. Applied and Environmental Microbiology, 2007, 73(1):193-202. |
| [9] | Ike M, Inoue D, Miyano T, et al. Microbial population dynamics during startup of a full-scale anaerobic digester treating industrial food waste in Kyoto eco-energy project[J]. Bioresource Technology, 2010, 101(11):3952-3957. |
| [10] | Xu K, Liu H, Du G, et al. Real-time PCR assays targeting formyltetrahydrofolate synthetase gene to enumerate acetogens in natural and engineered environments[J]. Anaerobe, 2009, 15(5):204 -213. |
| [11] | 国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京:中国环境 科学出版社, 2002:211-281. The State Environmental Protection Administration. Determination methods for examination of water and wastewater[M]. The fourth edition. Beijing: China Environmental Science Press, 2002: 211-281. |
| [12] | Zhang Y Y, Han X L. Determination of methane component in biogas by gas charomatography[J]. Environmental Engineering, 2010, 28(3): 113-114. |
| [13] | Sosnowski P, Wieczorek A, Ledakowicz S. Anaerobic co-digestion of sewage sludge and organic fraction of municipal solid wastes[J]. Advances in Environmental Research, 2003, 7(3):609-616. |
| [14] | Niu Q G, Hojo T, Qiao W, et al. Characterization of methanogenesis, acidogenesis and hydrolysis in thermophilic methane fermentation of chicken manure[J]. Chemical Engineering Journal, 2014, 244:587-596. |
| [15] | Procházka J, DolejšP, Máca J, et al. Stability and inhibition of anaerobic processes caused by insufficiency or excess of ammonia nitrogen[J]. Applied Microbiology and Biotechnology, 2012, 93(1): 439-447. |
| [16] | Zhang W Q, Lang Q Q, Wu S B, et al. Anaerobic digestion characteristics of pig manures depending on various growth stages and initial substrate concentrations in a scaled pig farm in Southern China[J]. Bioresource Technology, 2014, 156:63-69. |
| [17] | 田 梦, 刘晓玲, 李十中, 等. 香蕉秸秆与牲畜粪便固体联合厌氧发酵 产沼气的特性[J]. 农业工程学报, 2013, 29(7):177-184. TIAN Meng, LIU Xiao-ling, LI Shi-zhong, et al. Biogas production characteristics of solid-state anaerobic co-digestion of banana stalks and manure[J]. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(7):177-184. |
| [18] | MØller H B, Sommer S G, Ahring B K. Methane productivity of manure, straw and solid fractions of manure[J]. Biomass and Bioenergy, 2004, 26(5):485-495. |
| [19] | Ho L, Ho G. Mitigating ammonia inhibition of thermophilic anaerobic treatment of digested piggery wastewater:Use of pH reduction, zeolite, biomass and humic acid[J]. Water Research, 2012, 46(14):4339-4350. |
| [20] | Fernandes T V, Keesman K J, Zeeman G, et al. Effect of ammonia on the anaerobic hydrolysis of cellulose and tributyrin[J]. Biomass and Bioenergy, 2012, 47:316-323. |
| [21] | Katherine S, Manuel A, Estrella A, et al. Effect of ammonia on the methanogenic activity of methylaminotrophic methane producing archaea enriched biofilm[J]. Anaerobe, 2004, 10(1):13-18. |
| [22] | Baris C, Bulent M, Bulent I, et al. Methanogenic diversity in anaerobic bioreactors under extremely high ammonia levels[J]. Enzyme and Microbial Technology, 2005, 37(4):448-455. |
| [23] | Garciaa M L, Angenent L T. Interaction between temperature and ammonia in mesophilic digesters for animal waste treatment[J]. Water Research, 2009, 43(9):2373-2382. |
| [24] | Lu F, Chen M, He P J, et al. Effects of ammonia on acidogenesis of protein-rich organic wastes[J]. Environmental Engineering Science, 2008, 25(1):114-122. |
| [25] | Niu Q G, Qiao W, Qiang H, et al. Mesophilic methane fermentation of chicken manure at a wide range of ammonia concentration: Stability, inhibition and recovery[J]. Bioresource Technology, 2013, 137:358-367. |
| [26] | Rajagopal R, Massé D I, Singh G. A critical review on inhibition of anaerobic digestion process by excess ammonia[J]. Bioresource Technology, 2013, 143:632-641. |
| [27] | Liu Y, Whitman W B. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea[J]. Annals of the New York Academy of Sciences, 2008, 1125(1):171-189. |
| [28] | Xu K W, Liu H, Chen J. Effect of classic methanogenic inhibitors on the quantity and diversity of archaeal community and the reductive homoacetogenic activity during the process of anaerobic sludge digestion[J]. Bioresource Technology, 2010, 101:2600-2607. |
| [29] | Song M, Shin S G, Hwang S. Methanogenic population dynamics assessed by real-time quantitative PCR in sludge granule in upflow anaerobic sludge blanket treating swine wastewater[J]. Bioresource Technology, 2010, 101:23-28. |
 2015, Vol. 34
2015, Vol. 34