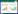文章信息
- 刘淑芬, 郭会琴, 颜流水, 李可心, 舒婷, 马文天
- LIU Shu-fen, GUO Hui-qin, YAN Liu-shui, LI Ke-xin, SHU Ting, MA Wen-tian
- 油茶果壳水热碳化液相产物分析
- Analysis of Liquefied Products from Hydrothermal Carbonization of Camellia Oleifera Shell by GC-MS
- 农业环境科学学报, 2015, 34(10): 2019-2026
- Journal of Agro-Environment Science, 2015, 34(10): 2019-2026
- http://dx.doi.org/10.11654/jaes.2015.10.026
-
文章历史
- 收稿日期: 2015-03-29
近年来以木质纤维素类生物质制备高价值化学品和燃料引起了研究者的广泛关注。目前生物质种类很多,如小麦秸秆[1]、玉米芯[2]、稻草[3]、藻类[4]、甘蔗渣[5]、棉杆[6]等。油茶是我国特有的木本油料作物,其种植面大,资源丰富,我国每年现有的油茶籽产量超过100万t,而其副产物油茶果壳(Camellia Oleifera shell,COS)占总质量的30%~40%,由于榨油后果壳一般被丢弃或作为燃料,资源化利用率非常低[7]。
水热转化是一种环境友好且具有前景的资源化利用热处理新技术,其在水热条件下可以解聚生物质获得生物基质平台化产品[8]。而且相比其他生物质能转化与利用技术,水热转化对于生物质原料的湿度无限制,无需对生物质原料进行干燥处理,减少了预处理的工序,且对于仪器和环境要求较传统热解技术低。但目前大部分研究主要集中在生物质水热气化和液化工艺研究上,而对水热碳化过程及其水热转化产物(液态产物)的研究尚未引起足够重视。
本研究以油茶果壳为原料,在230 ℃、12 h水热条件下进行水热碳化,然后对其液态产物进行GC-MS检测,并由谱库检索分析其产物并推测其水热碳化的可能转化路径。
1 材料与方法 1.1 主要仪器与试剂 1.1.1 主要仪器Agilent 7890/5975C 气相色谱/质谱联用仪(GC/MSD,美国Agilent公司);色谱柱HP-5MSI(30 m×0.25 mm×0.25 μm);MTM-2800W水浴氮吹浓缩装置(天津奥特赛思仪器有限公司);KQ-600型超声仪(昆山市超声仪器有限公司)。
1.1.2 试剂油茶果壳(江西省绿海油脂有限公司提供);N,O-双三甲基硅三氟乙酰胺(BSTFA,阿拉丁公司);其他所用试剂均为国产分析纯,实验用水为超纯水。
1.2 实验方法 1.2.1 水热碳化液相产物制备油茶果壳洗净自然风干,然后于粉碎机中粉碎并过200目筛,密封保存。准确称取2 g油茶果壳粉末于60 mL水中,在600 W功率超声仪中超声处理30 min后置于磁力搅拌器中搅拌6 h,充分混合和溶胀,然后将混合液移至100 mL反应釜,通氮去氧15 min后于230 ℃条件下反应12 h。
1.2.2 产物处理 1.2.2.1 溶剂萃取将所得水热碳化产物经过滤得到液相产物。移取样品30 mL入分液漏斗,加入 30 mL乙酸乙酯进行萃取。振荡萃取时间为5 min,静置时间为35 min,萃取次数2次。经无水硫酸钠干燥后,取6 mL萃取液于40 ℃条件下水浴氮吹至干,丙酮定容,待测。
1.2.2.2 硅烷化柱前衍生因样品中可能生成的小分子物质(如小分子有机酸类)在上述条件下无法直接检测到,所以实验中利用质子性化合物(如醇、酚、酸、胺等)与硅烷化试剂反应,生成挥发性硅烷衍生物并使这些物质的热稳定性和挥发性提高,从而对其进行间接检测。
直接取过滤后的液相产物6 mL于60 ℃条件下水浴氮吹至近干,再氮吹至干后加入1 mL丙酮和100 μL BSTFA,于60 ℃条件下水浴衍生化处理50 min后待测。
1.3 仪器分析条件色谱条件:色谱柱HP-5MSI(30 m×0.25 mm×0.25 μm);气化室温度260 ℃。升温程序为:初温50 ℃,停留2 min;以4 ℃·min-1升至230 ℃,停留6 min。载气(He)流速1.2 mL·min-1,进样量1.0 μL;分流比10∶1。
质谱条件:电子轰击(EI)离子源;电子能量70 eV;传输线温度250 ℃ ;四极杆温度150 ℃;离子源温度230 ℃ ;质量扫描范围30~500 amu;SCAN扫描。
2 结果与讨论 2.1 液液萃取溶剂的选择在萃取实验研究中,分别使用了乙酸乙酯、二氯甲烷、乙醚、丙酮等溶剂作为萃取剂,结果发现以中等极性的乙酸乙酯作为溶剂,可较好兼顾不同极性产物的萃取,获得较丰富的产物信息。因此,选择乙酸乙酯作为萃取溶剂。一些类似研究的文献[9]中也表明,采用乙酸乙酯作为萃取剂,提取生物质水热反应后液相中的组分,效果较好。
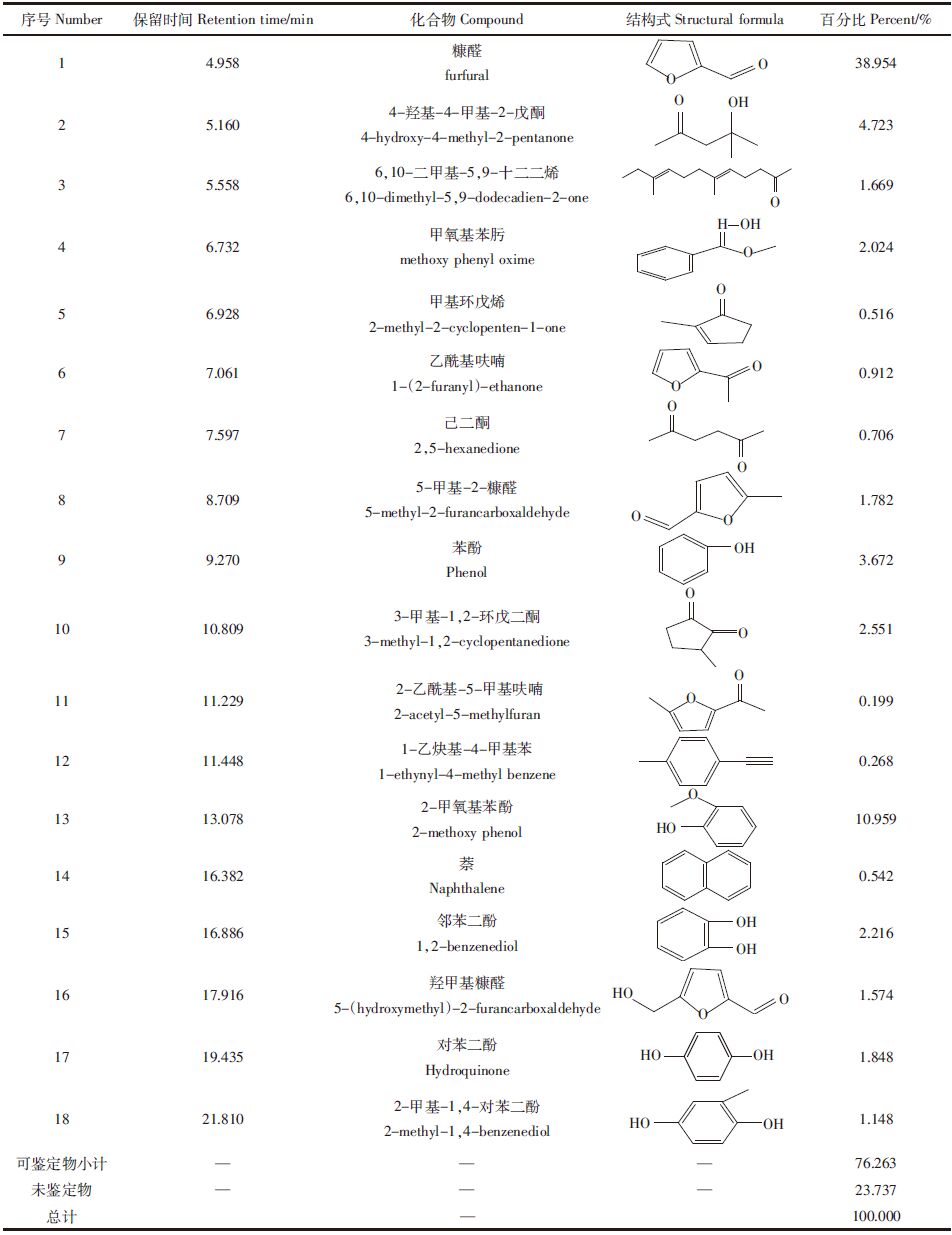
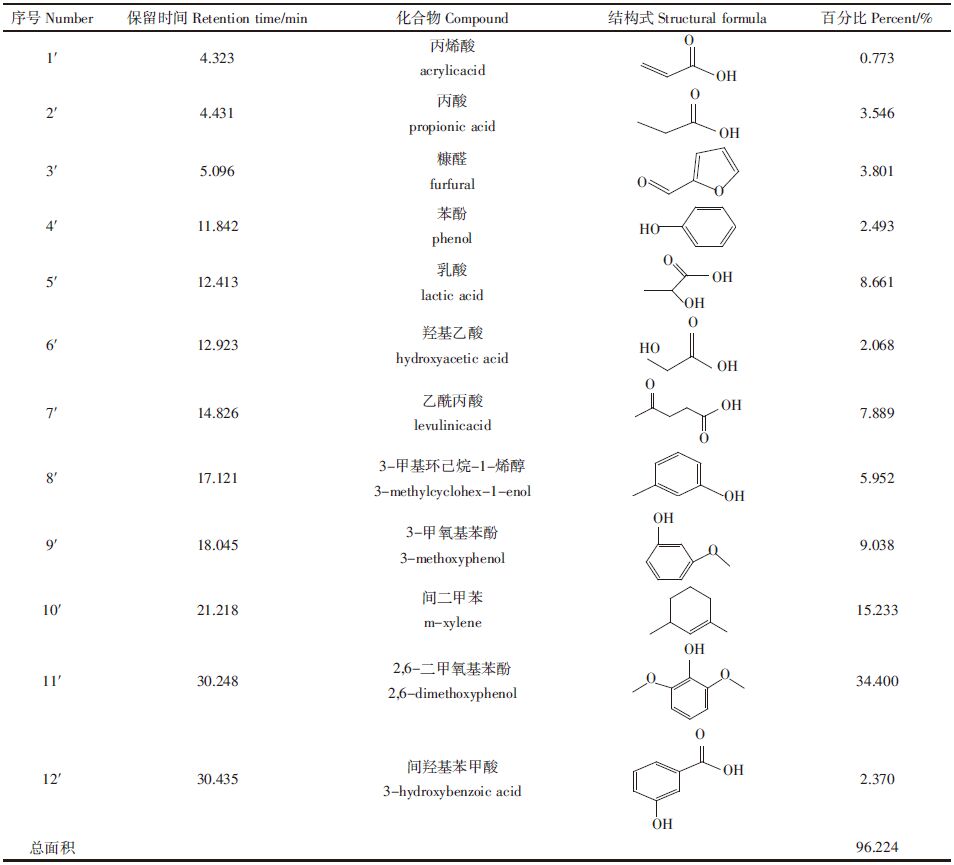
2.2 GC-MS分析结果水热碳化液相产物分别经乙酸乙酯溶剂萃取和BSTFA衍生化后,采用气质联用进行检测,结果如图 1、表 1及图 2、表 2所示。其中,采用面积归一化法对物质进行半定量分析。
|
| 图 1 萃取样品的GC-MS总离子流(TIC)图 Figure 1 Total ion chromatogram(TIC) of GC-MS for sample extract |
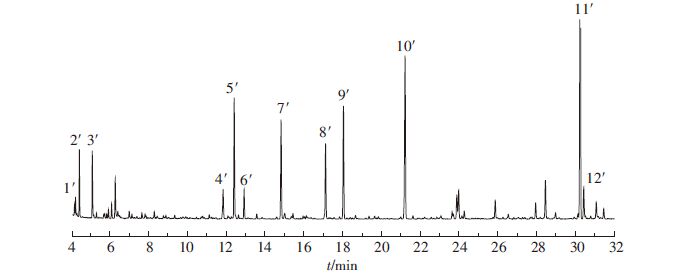
|
| 图 2 BSTFA衍生样品的GC-MS总离子流图 Figure 2 TIC of GC-MS for derivative sample by BSTFA |
根据GC-MS测定结果,油茶果壳水热碳化液相产物中,可鉴定组分有30个,主要是各种开链化合物和闭环类化合物。开链化合物主要是低分子有机酸、醇类和酮类等,闭环类化合物则主要是甲氧基苯酚、苯酚等酚类化合物以及呋喃衍生物等水溶性环氧化合物。因此,依据组分的结构将其分成三类,即开链化合物、酚类化合物以及环状化合物,具体归纳如图 3至图 5所示。
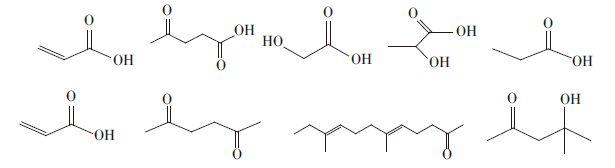
|
| 图 3 开链化合物 Figure 3 Open chain compound |
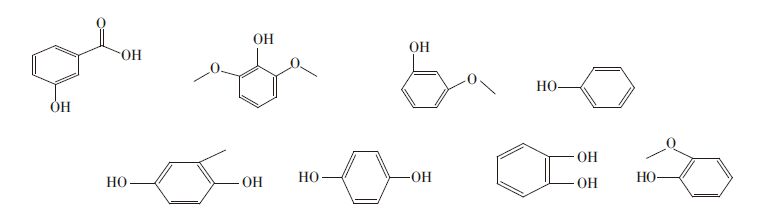
|
| 图 4 酚类化合物 Figure 4 Phenolic compound |
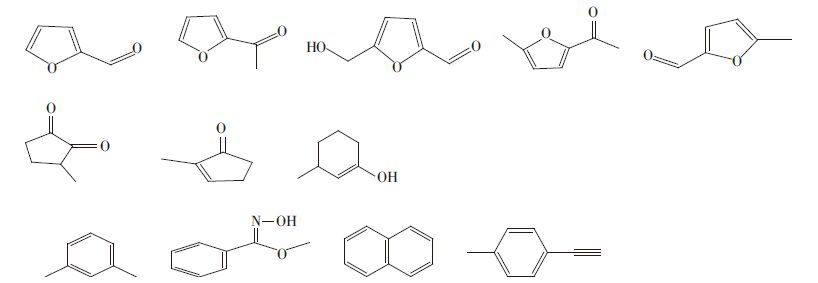
|
| 图 5 环状化合物 Figure 5 Ring compound |
油茶果壳的结构成分复杂,主要由纤维素、半纤维素、木质素和少量单宁(多酚)类物质组成,各成分含量分别为:纤维素17.32%、木质素21.35%、半纤维素22.00%[10]。纤维素是由D-六环葡萄糖基经β-1,4-糖苷键连接而成的借助分子间氢键拧在一起的直线状键状多聚体纤维状高分子,结构如图 6所示。半纤维素则主要是由五碳糖(如木糖、阿拉伯糖、鼠李糖、岩藻糖等)和六碳糖(如半乳糖、甘露糖和葡萄糖等)不同类型单糖组成的具有侧链的杂多糖。
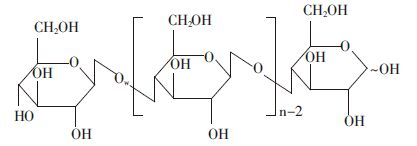
|
| 图 6 纤维素结构示意图 Figure 6 Types of structure units of cellulose |
木质素基本上是由C、H、O三种元素组成的苯丙烷基单元,其三种基本结构单元的化学结构如图 7所示。木质素的结构单元上连有各种功能基团,主要包含丙烷基、酚羟基和甲氧基等,而甲氧基一般以苯丙烷结构单元中苯环上的取代基形式存在[8]。
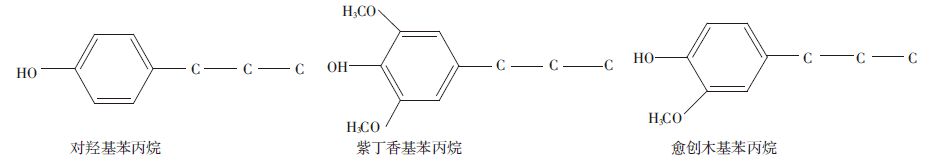
|
| 图 7 木质素的三种基本结构单元 Figure 7 Types of structural units in lignin |
对于油茶果壳中纤维素、半纤维素的水热转化过程,我们作如下推测:实验条件下超临界水电离出 H+与OH-,通过酸碱自催化而使其糖苷键的氧原子迅速质子化,糖苷键断裂形成碳正离子并与水相互作用最终形成单糖[11, 12];单糖上的羟基继续与氢离子结合脱去水,同时环断裂形成碳碳双键与碳氧双键,再次脱水成环状糠醛、5-羟甲基糠醛等呋喃衍生物[13, 14, 15]。Hashaikeh 等[16]发现纤维素的溶解温度非常高,其范围在280~320 ℃(反应时间小于1 h)。因本研究中水热碳化温度仅有230 ℃ ,该温度下纤维素的溶解性会受到很大限制,但在GC-MS结果中依然检测到大量的糠醛、羟甲基糠醛等呋喃衍生物,故我们进一步推测,在230 ℃水热条件下,这些糠醛类物质大部分来源于油茶果壳中半纤维素的水解,具体转化过程如图 8所示。即半纤维素以及少量的纤维素在该条件下降解为糖类物质,糖类物质通过异构化、键断裂、脱水等反应分解为呋喃衍生物以及副产物乙酰丙酸,而少量的环戊酮、苯的衍生物、短链醇和有机酸类等物质也在其水解过程中形成(这部分未在图中标注)。
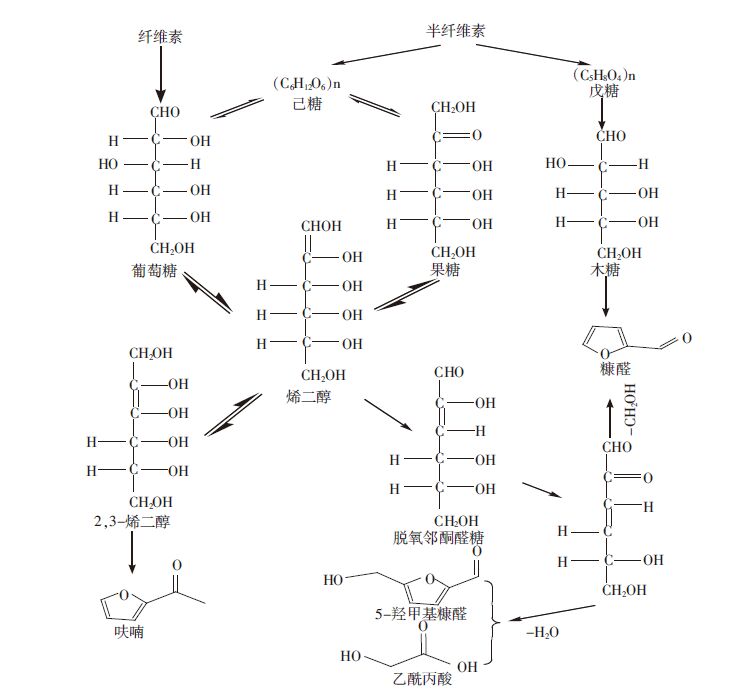
|
| 图 8 纤维素、半纤维素水热转化路径分析 Figure 8 Pathways for cellulose and hemicellulose transformation during hydrothermal carbonization |
关于油茶果壳中木质素的水热转化过程,一般认为其苯丙烷链断裂后主要转化为酚类、有机酸、醇类等物质[8]。木质素主要是由三种不同苯丙烷结构单元组成的聚合酚类化合物,且其单体之间三分之二的连接键是醚键[17]。结合产物的GC-MS分析结果可推测,实验条件下油茶果壳中木质素键的断裂在α碳与β碳之间以及β碳与γ碳之间都有发生,而其支链上的C-C键断裂主要发生在芳香环和α碳之间[18],即芳香环部分分解生成酚类物质,剩下支链部分由于含有羟基和羧基等基团而形成醇类和有机酸类(如乳酸等);且由产物中二甲氧基苯酚所占百分比高达34.4%,可推测出该油茶果壳中紫丁香基苯丙烷结构单元较多。以理想的含α-O-4和β-O-4键的木质素为模型结构来解释其水热转化机理,如图 9所示。油茶果壳中的木质素在水热条件下断裂成三种不同苯丙烷结构单元,然后支链上的C-C键在芳香环和α碳之间断裂,生成苯酚、甲氧基苯酚及二甲氧基苯酚等物质。
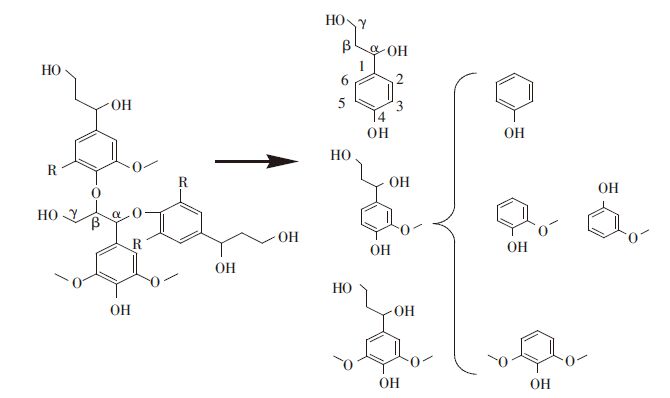
|
| 图 9 木质素水热转化路径分析 Figure 9 Pathways for lignin transformation during hydrothermal carbonization |
(1)油茶果壳水热液相产物主要包含糠醛、二甲氧基苯酚、甲氧基苯酚、苯酚以及小分子酸等,小分子酸主要是乳酸和乙酰丙酸。
(2)油茶果壳在水热条件下的水热转化难易程度顺序依次为纤维素>木质素>半纤维素。木质素中紫丁香基苯丙烷结构单元最多。
(3)油茶果壳水热条件下的可能转化路径为纤维素和半纤维素降解成多糖类物质,然后进一步通过发生异构化、键断裂、脱水等反应分解为糠醛类物质、短链醇及有机酸类;木质素主要断裂成三种基本苯丙烷结构,然后继续发生断裂,芳香环类主要形成酚类(如苯酚、甲氧基苯酚、二甲氧基苯酚),剩下的支链则形成小分子醇及有机酸类。
| [1] | 曲晶晶, 郑金伟, 郑聚锋, 等. 小麦秸秆生物质炭对水稻产量及晚稻氮素 利用率的影响[J]. 生态与农村环境学报, 2012, 28(3):288-293. QU Jing-jing, ZHENG Jin-wei, ZHENG Ju-feng, et al. Effects of wheat-straw-based biochar on yield of rice and nitrogen use efficiency of late rice[J]. Journal of Ecology and Rural Environment, 2012, 28(3) :288-293. |
| [2] | 李道静, 封 莉, 张立秋. 玉米芯掺杂对污泥基活性炭性能的影响[J]. 环 境工程学报, 2012, 6(3):1010-1014. LI Dao-jing, FENG Li, ZHANG Li-qiu. Effects of corncob addition on properties of sludge activated carbon[J]. Chinese Journal of Environmental Engineering, 2012, 6(3):1010-1014. |
| [3] | 蒋田雨, 姜 军, 徐仁扣, 等. 稻草生物质炭对3种可变电荷土壤吸附Cd(Ⅱ)的影响[J]. 农业环境科学学报, 2012, 31(6):1111-1117. JIANG Tian-yu, JIANG Jun, XU Ren-kou, et al. Effect of biochar from rice straw on adsorption of Cd(Ⅱ) by variable charge soils[J]. Journal of Agro-Environment Science, 2012, 31(6):1111-1117. |
| [4] | 潘春梅, 李 卓, 樊耀亭, 等. 海藻类生物质废弃物的发酵生物制氢研究[J]. 环境科学与技术, 2009, 32(2):1-4. PAN Chun-mei, LI Zhuo, FAN Yao-ting, et al. Biohydrogen production from alga waste by anaerobic fermentation[J]. Environmental Science & Technology, 2009, 32(2):1-4. |
| [5] | 聂艳丽, 周跃华, 李 娅, 等. 甘蔗渣堆肥化处理及用作团花育苗基质的研 究[J]. 农业环境科学学报, 2009, 28(2):380-387. NIE Yan-li, ZHOU Yue-hua, LI Ya, et al. Sugar cane bagasse compost used as anthocephalus chinensis nursing substrate[J]. Journal of Agro-Environment Science, 2009, 28(2):380-387. |
| [6] | 杨素文, 羊 亿, 陈建山, 等. 棉杆生物质真空热解液化制备生物油的研究[J]. 中南林业科技大学学报, 2012, 32(1):189-194. YANG Su-wen, YANG Yi, CHEN Jian-shan, et al. Vacuum pyrolysis liquefaction of cotton stalk for bio-oil preparation[J]. Journal of Central South University of Forestry & Technology, 2012, 32(1): 189-194. |
| [7] | 宋东阳, 郭会琴, 颜流水, 等. 油茶果壳对水溶液中结晶紫的吸附性能[J]. 环境工程学报, 2014, 8(12):5129-5134. SONG Dong-yang, GUO Hui-qin, YAN Liu-shui, et al. Adsorptive property of crystal violet on camellia oleifera shell in aqueous solution[J]. Chinese Journal of Environmental Engineering, 2014, 8(12):5129-5134. |
| [8] | 康世民. 木质素水热转化及其产物基础应用研究[D]. 广州:华南理工大学, 2013. KANG Shi-min. A dissertation submitted for the degree of doctor of philosophy[D]. Guangzhou:South China University of Technology, 2013. |
| [9] | Kang S M, Li X L, Fan J, et al. Characterization of hydrochars produced by hydrothermal carbonization of lignin, cellulose, d-xylose, and wood meal[J]. Industrial Engineering Chemistry Research, 2012, 51(26):9023-9031. |
| [10] | 杨俊换, 周建平, 胡尧超, 等. 油茶籽壳的化学成分分析与扫描电镜观察[J]. 湖南农业大学学报, 2013, 39(5):554-559. YANG Jun-huan, ZHOU Jian-ping, HU Yao-chao, et al. Analysis of chemical composition and observation of scanning electran microscopy on camellia testa[J]. Journal of Hunan Agricultural University, 2013, 39(5):554-559. |
| [11] | Mamman A S, Lee J M, Kim Y C, et al. Dilute acid hydrolysis reaction of biomass hemicellulose[J]. Biofuels Bioproducts & Biorefining-Biofpr, 2008, 2:438-454. |
| [12] | Lee Y Y, Iyer P, Torget R W, et al. Dilute acid hydrolysis of lignocellulosic biomass[M]. Springer Berlin Heidelberg, Recent Progress in Bioconversion of Lignocellulosics, 1999:93-115. |
| [13] | Ingram T, Rogalinski T, Bockemühl V, et al. Semi-continuous liquid hot water pretreatment of rye straw[J]. The Journal of Supercritical Fluids, 2009, 48(3):238-246. |
| [14] | Yu Y, Lou X, Wu H W, et al. Some recent advances in hydrolysis of biomass in hot-compressed water and its comparisons with other hydrolysis methods[J]. Energy Fuels, 2007, 22(1):46-60. |
| [15] | Gravitis J, Vedernikov N, Zandersons J, et al. Furfural and levoglucosan production from deciduous wood and agricultural wastes[J]. ACS Symposium Series:Chemicals and Materials from Renewable Resources, 2001, 784:110-122. |
| [16] | Hashaikeh R, Fang Z, Butler I S, et al. Hydrothermal dissolution of willow in hot compressed water as a model for biomass conversion[J]. Fuel, 2007, 86(10):1614-1622 |
| [17] | Pandey M P, Kim C S. Lignin depolymerization and conversion:A review of thermochemical methods[J]. Chemical Engineering & Technology, 2011, 34(1):29-41. |
| [18] | Taner F, Eratik A, Ardic I. Identification of the compounds in the aqueous phases from liquefaction of lignocellulosics[J]. Fuel Processing Technology, 2005, 86(4):407-418. |
 2015, Vol. 34
2015, Vol. 34