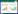文章信息
- 韦中, 徐春淼, 郑海平, 廖汉鹏, 王世梅, 沈其荣, 徐阳春
- WEI Zhong, XU Chun-miao, ZHENG Hai-ping, LIAO Han-peng, WANG Shi-mei, SHEN Qi-rong, XU Yang-chun
- “挂壁”法筛选常温稻秆腐解菌及其降解能力研究
- Degradation of Rice Straw by Degrading Strains Isolated by a “Hanging-Enrichment” Method
- 农业环境科学学报, 2015, 34(10): 2027-2031
- Journal of Agro-Environment Science, 2015, 34(10): 2027-2031
- http://dx.doi.org/10.11654/jaes.2015.10.027
-
文章历史
- 收稿日期: 2015-04-13
秸秆富含纤维素、木质素以及氮、磷、钾等多种营养元素,其还田有利于土壤有机质的提高,能达到培肥地力的作用[1, 2]。然而秸秆还田推广中秸秆量大,腐解缓慢,导致整地、出苗、栽秧难且秧苗生长易受缺氧、还田物质的影响,进而出现黄苗、易倒伏等新问题[3]。还田秸秆的生物降解主要由土壤微生物产生的一系列水解酶完成,研究表明秸秆还田时配施秸秆腐解菌剂(富含高效秸秆降解微生物)有助于缓解上述问题[4]。高效腐解菌可以打破秸秆中木质素、纤维素和半纤维素之间的紧密结构,提高腐解效率,降低秸秆还田的不利影响[5]。虽然已分离筛选到不少的秸秆降解菌资源[6, 7, 8, 9],但目前所应用的秸秆腐解菌还存在效率不高的问题[10]。因此,如何筛选到适用于秸秆还田的高效降解菌是目前秸秆还田推广过程中亟待解决的问题之一。
还田秸秆的腐解进程虽然缓慢,但在适宜的环境条件下,含水量适宜的秸秆部位的腐烂速度明显高于其他部位,说明此部位可能有丰富的高效腐解微生物。结合这一思路,本研究采用“挂壁”法,从水气交界面,即秸秆腐解程度高的部位富集筛选腐解菌,通过室内试验研究所筛选腐解菌的产酶能力,进而用土培试验验证其腐解效果。以“挂壁”法筛选秸秆降解菌,可为秸秆还田提供高效的腐解菌种资源。
1 材料与方法 1.1 供试材料腐解菌筛选材料:采集秸秆堆肥、腐烂枝叶、水稻秸秆还田土等作为腐解菌筛选材料。
1.2 培养基Mandels营养液[11]:(NH4)2SO4 1.4 g,KH2PO4 2.0 g,尿素0.3 g,MgSO4·7H2O 0.3 g,CaC12 0.3 g,FeSO4·7H2O 7.5 mg,MnSO4·H2O 2.5 mg,ZnSO4 2.0 mg,CoC12 3.0 mg,去离子水1000 mL。
稻秆粉培养基:稻秆于75 ℃烘干至恒重后粉碎成粉,过20目筛,以2 g·L-1添加在Mandels营养液中,调节pH为7.0,用于腐解菌的分离筛选及液体培养。
1.3 “挂壁”法富集筛选腐解菌“挂壁”法操作示意见图 1。称取10 g供试材料分别加入盛有90 mL生理盐水的500 mL三角瓶中制成悬液,于25 ℃、170 r·min-1条件下振荡培养2~3 d,取20 mL悬液接入180 mL Mandels营养液中(500 mL三角瓶内装5 g,25 cm长稻秆条)中,调节pH为7.0。25 ℃静置培养1周,镜检观察降解菌在悬挂稻秆上富集的情况。用消毒的剪刀在超净台上剪取挂壁稻秆气液交界处腐烂部分,剪成0.5~1.0 cm小段置于0.85% NaCl溶液中,加入灭菌玻璃珠,于25 ℃、170 r·min-1振荡混匀,得到稻秆降解菌的富集液。将富集液梯度稀释,吸取100 μL菌液均匀涂布于稻秆粉培养基平板上。置25 ℃培养箱中培养3 d,将平板上长出的单菌落在稻秆粉平板继续进行纯化,将分离得到的单菌落转接斜面,于4 ℃冰箱保存。
|
| 图 1 “挂壁”法筛选秸秆腐解菌示意图 Figure 1 "Hanging-enrichment" method for isolation of rice straw-degrading microorganisms |
将10株稻秆降解细菌分别接种到LB液体培养基中,25 ℃、170 r·min-1培养过夜,计数,调整菌体细胞达到106 cfu·mL-1,备用;将2株稻秆降解真菌分别接种在PDA培养平板上,25 ℃培养3~5 d,用0.85%生理盐水洗脱分生孢子得到孢子悬液,稀释、调整孢子浓度为106 cfu·mL-1。取细菌悬液(106 cfu·mL-1)、真菌孢子悬液(106 cfu·mL-1)各10 mL,分别接种至90 mL含0.5~1.0 cm长稻秆段的液体培养基中,25 ℃摇床振荡培养,每处理3个重复,并设置不接菌对照。7 d后将降解剩余物料置于75 ℃烘箱中烘至质量恒定。秸秆相对降解率计算参照徐春淼等[12] 的方法。
1.5 秸秆腐解菌粗酶液制备及测定取细菌悬液及真菌孢子悬液各1 mL到稻秆粉液体培养基中(250 mL三角瓶中装100 mL培养液),25 ℃、170 r·min-1振荡培养5 d。将培养液5000 r·min-1离心10 min后,取上清液用于酶活测定。纤维素酶、半纤维素酶及滤纸酶活测定方法参照文献[13]、[14]和[15]。
1.6 土培降解试验测定秸秆相对降解率用100目尼龙纱网袋装10 g剪断成2~3 cm的烘干水稻秸秆,每个处理加入30 mL Mandels营养液和相应处理的菌液10 mL,降解细菌接种终浓度106 cfu·g-1秸秆,真菌接种终浓度106孢子·g-1秸秆,设置不接菌对照。将处理后的尼龙网袋放入内置5.0 kg土的盆钵内,覆土5 cm,适量浇水浸透土壤。所有盆钵随机摆放于温室中,环境温度为20~25 ℃。分别在7、14、21、28 d后取出,洗净75 ℃烘干至恒重,测定水稻秸秆干质量变化动态,计算秸秆相对降解率。
1.7 腐解菌初步鉴定选取降解效果良好的2株细菌和2株真菌进行分子生物学鉴定。采用OMEGA试剂盒(美国OMEGA公司)提取细菌和真菌DNA,细菌PCR扩增通用引物为27F(5′-AGA GTT TGA TCC TGG CTC AG-3′)和1492R(5′-TAC CTT GTT ACG ACT T-3′)[16]。真菌PCR扩增的通用引物为ITS1(5′- AGA AGT CGT AAC AAG GTT TCC GTA GG- 3′)和ITS4(5′-TCC TCC GCT TAT TGA TAT GC- 3′)[17]。琼脂糖凝胶电泳检测PCR产物,PCR产物送上海美吉公司测序,按照文献[18]方法,将扩增的DNA 片段测序分析后于GenBank数据库中进行BLAST同源性比对,对菌株进行初步鉴定。
1.8 数据分析与处理数据处理使用Excel 2010程序和SigmaPlot 12.0等统计分析软件。试验数据进行ANOVA方差分析,分析方法为邓肯多重检验(Duncan′s Multiple Range Test,DMRT,P<0.05)。
2 结果与讨论2.1 “挂壁”法富集分离稻秆腐解菌
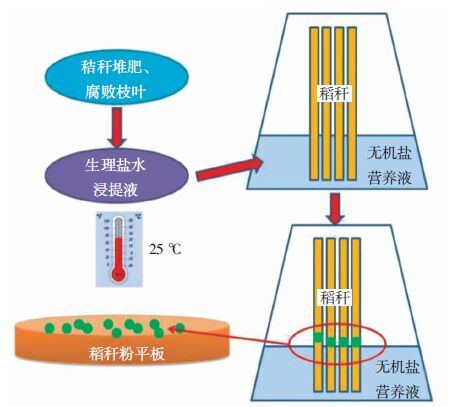
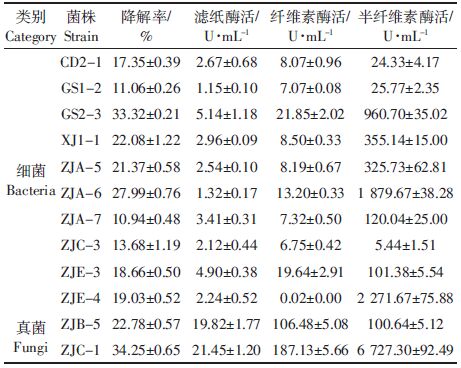
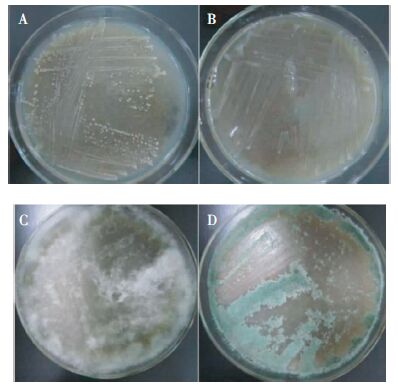
通过“挂壁”法富集,获得在稻秆粉培养基平板上生长较快的10株细菌和2株真菌(表 1),部分降解菌在稻秆粉平板生长情况如图 2所示。细菌GS2-3和ZJA-6在稻秆粉平板上生长速度较快,经3 d可形成菌落,且菌落形态差异明显。真菌ZJB-5在稻秆粉平板上生长,菌丝疏松,菌落呈白色,真菌ZJC-1在稻秆粉平板上菌落呈墨绿色,25 ℃培养3~4 d两株真菌即可长满整个平板。
 |
|
| 图 2 降解菌株GS2-3(A)、ZJA-6(B)、ZJB-5(C)和ZJC-1(D)在稻秆粉平板生长情况 Figure 2 Growth of rice straw-degrading strains GS2-3(A), ZJA-6(B), ZJB-5(C), and ZJC-1(D) on rice straw powder plates |
液体培养7 d后,12株菌的稻秆相对降解率差异显著(表 1)。真菌ZJB-5和ZJC-1对稻秆的相对降解率分别为22.78%、34.25%,细菌GS2-3和ZJA-6对稻秆的降解率较高,分别达到33.32%、27.99%,其余细菌对稻秆相对降解率均在23%以下。进一步分析发现,各腐解菌产滤纸酶、纤维素酶、半纤维素酶的能力差异显著(表 1)。真菌ZJB-5、ZJC-1的滤纸酶活力分别为19.82、21.45 U·mL-1,显著高于细菌的滤纸酶活力(P<0.000 1),细菌菌株GS2-3滤纸酶活力最高,也只有5.14 U·mL-1。由于滤纸酶活力是以滤纸为底物来测定纤维素酶对天然纤维素总的分解能力,是所有纤维素酶系共同作用结果的反映,对评价菌株的纤维素分解能力更加客观[19]。腐解能力较高的菌株GS2-3、ZJB-5、ZJC-1的滤纸酶活力也较高,两者呈正相关。菌株ZJA-6的降解率较高(27.99%),但其滤纸酶活力较低(1.32 U·mL-1),其原因需要进一步探索。
真菌ZJB-5、ZJC-1的纤维素酶活力显著高于细菌纤维素酶活力(P<0.000 1),分别达到106.48、187.13 U·mL-1。真菌产生的纤维素酶多为胞外酶,产酶量较高,且真菌所产纤维素酶的酶系结构较全,酶系中的各种酶之间协同作用,降解纤维素的效率高,亦是工业生产的主要菌种[20]。细菌菌株中GS2-3和ZJA-6的纤维素酶活力分别为21.85、13.20 U·mL-1,显著高于其他细菌菌株。文献报道细菌所产纤维素酶多为胞内酶,产量相对较低[20]。在12株降解菌中,真菌ZJC-1的半纤维素酶活最高为6 727.30 U·mL-1,其次是细菌菌株ZJE-4,其半纤维素酶活为2 271.67 U·mL-1。
2.3 腐解菌在土壤中的秸秆降解效率土培试验结果表明各菌株处理秸秆的相对降解率均随时间呈现上升趋势,真菌在后期降解率呈饱和性增加,而细菌后期降解速率增加较快(图 3)。真菌ZJC-1处理的秸秆相对降解率在7、14、21、28 d均显著高于其他三个处理(P<0.000 1),28 d时相对降解率达到23.2%。细菌GS2-3、ZJA-6处理的秸秆在前期降解较慢,相对降解率与真菌ZJB-5处理无显著差异,但在28 d时两株细菌相对降解率均显著高于真菌ZJB-5处理(P<0.001)。从图 3可见,28 d时GS2-3、ZJA-6及ZJB-5的降解率分别为19.2%、17.8%、14.7%。
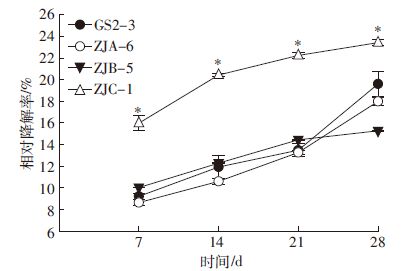
|
| *表示同一时间下差异显著(P<0.000 1) 图 3 土培试验接种菌液菌株降解秸秆的能力 Figure 3 Relative degradation rates of rice straw in soil inoculated with bacterial and fungal strains |
试验筛选出的4株降解菌经土培实验检测,其降解能力强弱不一,但其腐解效率与液体培养时的腐解率顺序基本一致。稻秆主要成分是纤维素、半纤维素和木质素,由于其自身结构复杂,导致降解过程缓慢。复合菌株可以相互协作,促进纤维素类物质的分解,尤其是细菌与真菌之间具有较强的相互作用。史玉英等[21] 报道复合菌群的腐解秸秆的能力明显高于任何单一菌株。因此,后续实验宜加强复合菌株腐解稻草秸秆的效果研究,为研发成熟的腐解菌剂,解决秸秆腐熟的实际问题提供基础和依据。
2.4 菌株初步鉴定结果鉴定可知,菌株GS2-3与降解淀粉芽孢杆菌Bacillus amyloliquefaciens FZB42(CP000560)同源性高达99%,菌株ZJA-6与类芽孢杆菌Paenibacillus pabuli(NR040853)同源性达99%,且镜检菌株GS2-3、ZJA-6在生长的后期产生芽孢。初步鉴定菌株GS2-3为B. amyloliquefaciens,菌株ZJA-6为P. pabuli。真菌ZJC-1与拟康宁木霉Trichoderma koningiopsis Tri021(HQ229944.1)同源性高达100%,ZJB-5与哈茨木霉Trichoderma harzianum GJS 97-265(AF442890)发育距离比较接近,同源性达98%,与真菌鉴定手册上康宁木霉的形态特征比对结果相符,故初步鉴定菌株ZJB-5为T. harzianum,菌株ZJC-1为T. koningiopsis。
3 结论经“挂壁”法富集、秸秆粉平板筛选得到两株细菌(B. amyloliquefaciens GS2-3和P. pabuli ZJA-6)和两株真菌(T. harzianum ZJB-5和T. koningiopsis ZJC-1)。液体培养实验研究表明,筛选的2株真菌和2株细菌的腐解效率、滤纸酶活力、纤维素酶活力和半纤维素酶活力均较高。
秸秆土培降解试验证实,4株降解菌的腐解效率与液体摇瓶培养的效果一致。接种真菌ZJC-1的处理,在培养28 d时,降解率最高为23.2%,而其余三个菌株GS2-3、ZJA-6及ZJB-5的降解率分别为19.2%、17.8%和14.7%。
| [1] | 杨志臣, 吕贻忠, 张凤荣, 等. 秸秆还田和腐熟有机肥对水稻土培肥效果 对比分析[J]. 农业工程学报, 2008, 24(3):214-218. YANG Zhi-chen, LÜYi-zhong, ZHANG Feng-rong, et al. Comparative analysis of the effects of straw-returning and decomposed manure on paddy soil fertility betterment[J]. Transactions of the Chinese Society of Agricultural Engineering, 2008, 24(3):214-218. |
| [2] | Yan D Z, Wang D J, Yang L Z. Long-term effect of chemical fertilizer, straw, and manure on labile organic matter fractions in a paddy soil[J]. Biology and Fertility of Soils, 2007, 44(1):93-101. |
| [3] | 李庆康, 王振中, 顾志权, 等. 秸秆腐解剂在秸秆还田中的效果研究初报[J]. 土壤与环境, 2001, 10(2):124-127. LI Qing-kang, WANG Zhen-zhong, GU Zhi-quan, et al. Effect of straw return to soil effective microorganisms on rice and wheat growth and their straw decay[J]. Soil and Environmental Sciences, 2001, 10(2) :124-127. |
| [4] | 史 央, 蒋爱芹, 戴传超, 等. 秸秆降解的微生物学机理研究及应用进展[J]. 微生物学杂志, 2002, 22(1):47-50. SHI Yang, JIANG Ai-qin, DAI Chuan-chao, et al. Advanced in microbiological mechanism and application of straw degradation[J]. Journal of Microbiology, 2002, 22(1):47-50. |
| [5] | 冯 炘, 裴宇航, 周晓飞, 等. 纤维素降解菌的筛选与高效混合菌群的构建[J]. 西北农林科技大学学报(自然科学版), 2012, 40(4):155-160. FENG Xin, PEI Yu-hang, ZHOU Xiao-fei, et al. Screening of stalk cellulose-degrading microorganisms and construction of microbial community with high capacity[J]. Journal of Northwest A&F University(Nat. Sci. Ed.), 2012, 40(4):155-160. |
| [6] | 向殿军, 满丽莉, 张春凤, 等. 玉米秸秆纤维素降解菌的分离纯化与产酶 工艺优化[J]. 安徽农业科学, 2014, 42(4):1159-1161. XIANG Dian-jun, MAN Li-li, ZHANG Chun-feng, et al. Optimization of the separation and fermentation conditions of corn straw cellulose-degrading fungus[J]. Journal of Anhui Agricultural Sciences, 2014, 42 (4):1159-1161. |
| [7] | 李文学, 李 力, 李 俊, 等. 小麦秸秆高效腐解菌复合系WSS-1的选育及其 菌群分析[J]. 生态学报, 2010, 30(3):759-764. LI Wen-xue, LI Li, LI Jun, et al. Screening and bacterial composition analysis of a complex microbial system WSS-1 for high efficiently decomposition of wheat straws[J]. Acta Ecologica Sinica, 2010, 30(3):759-764. |
| [8] | 殷中伟, 范丙全, 任 萍. 纤维素降解真菌 Y5 的筛选及其对小麦秸秆降解 效果[J]. 环境科学, 2011, 32(1):247-252. YIN Zhong-wei, FAN Bing-quan, REN Ping. Isolation and identification of a cellulose degrading fungus Y5 and its capability of degradating wheat straw[J]. Environmental Science, 2011, 32(1):247-252. |
| [9] | Liao H P, Xu C M, Tan S Y, et al. Production and characterization of acidophilic xylanolytic enzymes from Penicillium oxalicum GZ-2[J]. Bioresource Technology, 2012, 123:117-124. |
| [10] | 王伟东, 崔宗均, 王小芬, 等. 快速木质纤维素分解菌复合系 MC1 对秸 秆的分解能力及稳定性[J]. 环境科学, 2005, 26(5):156-160. WANG Wei-dong, CUI Zong-jun, WANG Xiao-fen, et al. Capability and stability of degrading rice straw of composite microbial system MC1[J]. Environmental Science, 2005, 26(5):156-160. |
| [11] | Kang S, Park Y, Lee J, et al. Production of cellulases and hemicellulases by Aspergillus niger KK2 from lignocellulosic biomass[J]. Bioresource Technology, 2004, 91(2):153-156. |
| [12] | 徐春淼, 韦 中, 廖汉鹏, 等. 一种评价稻秆降解菌分解能力的方法[J]. 南京农业大学学报, 2015, 38(3):417-423. XU Chun-miao, WEI Zhong, LIAO Han-peng, et al. Study on evaluation of the degradation ability of rice straw-degrading bacteria[J]. Journal of Nanjing Agricultural University, 2015, 38(3):417-423. |
| [13] | Ghose T. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 1987, 59:257-268. |
| [14] | Parry N J, Beever D E, Owen E, et al. Biochemical characterization and mechanism of action of a thermostable beta-glucosidase purified from Thermoascus aurantiacus[J]. The Biochemical Journal, 2001, 353(1):117-127. |
| [15] | Mandels M, Andreotti R E. Problem and challenges in cellulose to cellulose fermentation[J]. Process Biochemistry, 1978, 13(5):265-275. |
| [16] | Moreno C, Romero J, Espejo R T. Polymorphism in repeated 16S rRNA genes is a common property of type strains and environmental isolates of the genus Vibrio[J]. Microbiology, 2002, 148:1233-1239. |
| [17] | 曹永军, 程 萍, 喻国辉, 等. 利用ITS1 和ITS4 通用引物扩增香蕉枯萎 病菌核酸片段鉴定其生理小种[J]. 热带作物学报, 2010, 31(7):1098-1102. CAO Yong-jun, CHENG Ping, YU Guo-hui, et al. Utility of universal primers, ITS1 and ITS4, to amplify sequences for race identification of Fusarium oxysporum f. sp. cubense[J]. Chinese Journal of Tropical Crops, 2010, 31(7):1098-1102. |
| [18] | Sambrook J, Fuliqi E F, Mannyadys T. 分子克隆实验指南[M]. 金冬雁, 黎孟枫(译). 2 版. 北京:科学出版社, 1999:950-954. Sambrook J, Fuliqi E F, Mannyadys T. Molecular cloning manual[M]. JIN Dong-yan, LI Meng-feng(Translator). 2nd ed. Beijing:Science Press, 1999:950-954. |
| [19] | 刘东阳, 王蒙蒙, 马 磊, 等. 高效纤维素分解菌的分离筛选及其分解纤 维素研究[J]. 南京农业大学学报, 2014, 37(6):49-58. LIU Dong-yang, WANG Meng-meng, MA Lei, et al. Isolation of the efficient lignocelluloses degrading microbes and decomposition of cellulose[J]. Journal of Nanjing Agricultural University, 2014, 37(6):49-58. |
| [20] | 高海燕, 谢占玲, 汤易兰, 等. 混菌发酵降解燕麦秸秆及不同属真菌间的 协同和拮抗作用研究[J]. 青海师范大学学报, 2011(1):56-62. GAO Hai-yan, XIE Zhan-ling, TANG Yi-lan, et al. Synergistic and antagonistic effects of fungi mixed cultivation from four different genus strains on degradability towards oat straw degradation[J]. Journal of Qinghai Normal University(Natural Science), 2011(1): 56-62. |
| [21] | 史玉英, 沈其荣, 娄无忌, 等. 纤维素分解菌群的分离和筛选[J]. 南京 农业大学学报, 1996, 19(3):59-62. SHI Yu-ying, SHEN Qi-rong, LOU Wu-ji, et al. Isolated and screening cellulose-decomposing mixing strains[J]. Journal of Nanjing Agricultural University, 1996, 19(3):59-62. |
 2015, Vol. 34
2015, Vol. 34