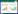文章信息
- 魏鹏, 曹梦超, 王全胜, 刘雅楠, 王蒙岑, 朱国念
- WEI Peng, CAO Meng-chao, WANG Quan-sheng, LIU Ya-nan, WANG Meng-cen, ZHU Guo-nian
- QuEChERS-PSA-气相色谱法分析联苯菊酯·啶虫脒微乳剂在茶园中的残留特征
- Analysis of Residual Profiles of Bifenthrin and Acetamiprid in Tea Garden by QuEChERS-PSA-GC
- 农业环境科学学报, 2015, 34(10): 2032-2038
- Journal of Agro-Environment Science, 2015, 34(10): 2032-2038
- http://dx.doi.org/10.11654/jaes.2015.10.028
-
文章历史
- 收稿日期: 2015-04-20
联苯菊酯(Bifenthrin)属拟除虫菊酯类杀虫剂,可用于鳞翅目幼虫、叶蝉、虱、蚜虫等的防治,但残效期较长[1];啶虫脒(Acetamiprid)是一种硝基甲基杂环类新型杀虫剂,其杀虫谱广,对半翅目害虫等有特效[1]。联苯菊酯有触杀、胃毒作用,作用迅速,击倒性强,但由于其大范围使用,害虫对其出现抗药性[2]。啶虫脒则作用于昆虫神经系统突触部位的烟碱乙酰胆碱受体能干扰昆虫神经系统的刺激传导,引起神经系统通路阻塞,造成神经递质乙胆碱在突触部位的积累,从而导致昆虫麻痹,最终死亡,由于其独特的作用理,与其他常用杀虫剂不存在交互抗性,对有机磷类、氨基甲酸酯类及拟除菊酯类农药产生抗性的害虫有特效[3]。邹华娇[4] 发现,联苯菊酯与啶虫脒混配制剂对茶叶害虫(如茶假眼小绿叶蝉)的防治效果表现为增效和相加作,二者复配能够集触杀、高效、长效于一体,尤其能有效防治茶叶上的多种虫。但由于联苯菊酯和啶虫脒对虹鳟、家蚕等非靶标生物存在高毒性,两者为在茶园中施用的主要杀虫剂,存在着一定的膳食和生态风险[5]。有效监测者在茶叶中的残留不仅对于保障我国茶叶安全生产和出口贸易具有重要意义也是全面评估其膳食及生态风险的重要基础。
联苯菊酯和啶虫脒在茶叶中单个药剂的残留分析方法虽已有报道,但采用石油-丙酮混合溶剂提取联苯菊酯的平均添加回收率仅为77%左右[6];采用丙酮-己烷混合溶剂提取啶虫脒后,需LC-C18SPE小柱净化,方法较为繁琐[7];定分析主要采用GC-ECD[8, 9]、GC-MS[10, 11]、HPLC-MS[12, 13]。目前,同时提和检测两种农药残留的分析方法及其在茶园中的残留特征尚未见报道。笔者用QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)萃取、PSAPrimary Secondary Amine)净化、GC-ECD测定,建立了一套快速、准确、灵度相对较低的可同时检测联苯菊酯和啶虫脒在茶叶及茶园土壤中残留的分析法,并结合在浙江余杭、安徽宣城和福建福鼎三地的田间试验,探明了联苯酯和啶虫脒在茶园中的残留特征,以期为其生态风险评价及膳食风险评估提重要基础。
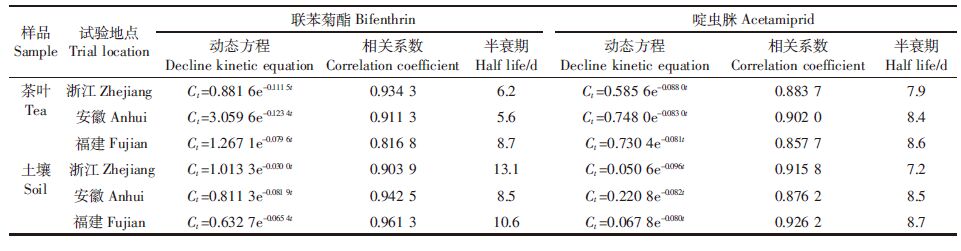
1 材料与方法 1.1 供试材料联苯菊酯(Bifenthrin)标准品(纯度99.0%)和啶虫脒(Acetamiprid)标准(纯度99.3%)均购于国家标准物质中心,其结构式见图 1。茶园供试药剂为.5%联苯菊酯·啶虫脒微乳剂(经浙江省药检所检定),试验地点为浙江省杭市余杭区仙宅村、安徽省宣城市天湖镇马村、福建省福鼎市白琳镇翁江村。江点为红壤,pH均值为5.4,有机质含量平均为2.69%;安徽点为沙质红壤,H均值为4.8,有机质含量平均为3.53%;福建点为红壤,pH均值为5.0,有机质量平均为3.89%。茶树品种为西湖龙井(浙江)、敬亭绿雪(安徽)、白毫银(福建)。
|
| 图 1 联苯菊酯(左)和啶虫脒(右)的结构式 Figure 1 Structural formulas of bifenthrin and acetamiprid |
SHIMADZU GC-2010配备ECD检测器(日本岛津公司),DHZ-DA大型冷冻恒温振荡(苏州太仓公司),R-210旋转蒸发仪及V-700真空泵(瑞士BUCHI公司),NEVAP 11氮吹仪(杭州尔力公司),Anke DL-5-B离心机(上海飞鸽公司)。试均为分析纯。
1.3 田间试验按照《农药残留试验准则》[14]和《农药登记残留田间试验标准操作规程》[15]的要求设计试验小区,小区面积15 m2,重复3次,小区间设保护带。
1.3.1 茶叶中农药的消解动态试验施药量为制剂量稀释 1000 倍(有效成分45 mg·kg-1),用水75 L·km-2,于虫发生期兑水喷雾施药,保证茶叶均匀着药。施药后2 h和1、3、5、7、14、1、28 d,采用五点采样法采集正常生长的茶叶1 kg,于 -20 ℃冰柜中保存。区内每行距离两端0.5 m内不采样,另设空白对照小区,仅施用与药液同体积清水。
1.3.2 土壤中农药的消解动态试验另选一块45 m2的茶园地块对土壤单独施药。施药量为制剂量稀释 1000 倍(有成分45 mg·kg-1),药液量5 L(药液喷至土表湿润为止),施药后2 h和13、5、7、14、21、28 d,用取土器按五点采样法采集0~10 cm的土壤样品1~2 g,除去碎石等杂物,于-20 ℃冰柜中保存。另设空白对照小区,施用与药液体积的清水。
1.4 分析方法 1.4.1 QuEChERS提取和PSA净化分别称取土壤(鲜茶)样品10 g(湿重)于250 mL具塞三角瓶中,加入20 mL去子水和20 mL乙腈,在振荡器上以180 r·min-1的转速振荡30 min,过滤至装5 g 氯化钠和8 g 硫酸镁的具塞量筒中,剧烈振荡2 min,静置30 min。用移管准确移取4 mL上清液,浓缩至近干,用乙酸乙酯定容至2 mL,待净化。将转移至装有100 mg PSA和150 mg无水硫酸镁的Eppendorf管中,涡旋1 min,4 下高速离心2 min,过0.22 μm滤膜,供GC检测。
1.4.2 GC-ECD测定DB-35色谱柱(30 m×0.32 mm×0.25 μm),进样口温度260 ℃,检测器温度00 ℃。柱温:初始80 ℃;以20 ℃·min-1速率升温至240 ℃,保持3 min;以10 ℃·min-1升温至270 ℃,保持7 min。进样量1 μL,不分流进样;载为99.99%的高纯氮气。
1.5 标准曲线的建立将1000 mg·kg-1的联苯菊酯和啶虫脒混合标准母液用正己烷稀释成 0.01、.05、0.1、0.5、1、5 mg·kg-1的系列混合标准工作溶液。在所选气相色谱条下进行测定,以进样质量浓度为横坐标、仪器响应值为纵坐标,得标准工作线。采用外标法定量[16]。
1.6 添加回收试验向茶叶和土壤的空白样品中添加联苯菊酯和啶虫脒的混合标准工作溶液,添加平分别为 0.01、0.1、1 mg·kg-1,采用所建立的方法测定添加回收率。每添加水平5次重复,同时设空白对照。
2 结果与分析 2.1 仪器的灵敏度在优化的分析条件下,联苯菊酯和啶虫脒的保留时间分别为11.3、14.7 min,器的最小检出量均为2.0×10-11 g。在0.01~5 mg·kg-1及0.01~1 mg·kg-1围内,联苯菊酯和啶虫脒的仪器响应值均与其质量浓度呈良好线性关系,表检测方法具有较高的灵敏度。标准曲线方程分别为:
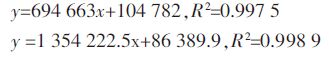
笔者在净化样品时对比了4种方法的净化效果,组别如下:100 mg PSA,12.5 g GCB(石墨化炭黑),100 mg PSA和12.5 mg GCB的混合吸附剂,100 mg PSA150 mg无水硫酸镁的混合吸附剂。结果表明:100 mg PSA 和12.5 mg GCB的合吸附剂及12.5 mg GCB的净化效果均较好,但联苯菊酯回收率偏低;采用00 mg PSA时,回收率较高但净化效果不够理想;100 mg PSA和150 mg无水硫镁混合吸附剂既具有良好的净化效果,又保证了理想的回收率(图 2)。

|
| 图 2 不同净化剂组合下联苯菊酯、啶虫脒在鲜茶中 添加回收率的比较 Figure 2 Comparison of recoveries of bifenthrin and acetamiprid in tea treated with different combinations of cleansing agents |
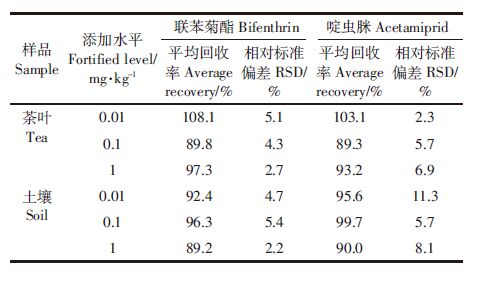
添加回收率试验结果见表 1。在添加水平为0.01~1 mg·kg-1时,联苯菊酯在茶和土壤中的添加回收率分别为89.8%~108.1%和89.2%~96.3%,相对标准偏差(SD)分别为2.7%~5.1%和2.2%~5.4%;啶虫脒在茶叶和土壤中的平均回收率分别89.3%~103.1%和90.0%~99.7%,RSD分别为2.3%~6.9%和5.7%~11.3%。表明本方具有较好的准确度和精密度,符合农药残留分析的要求[16, 17]。
 |
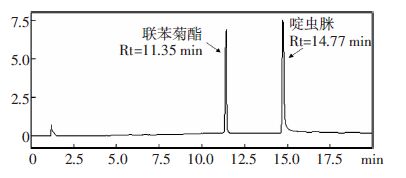
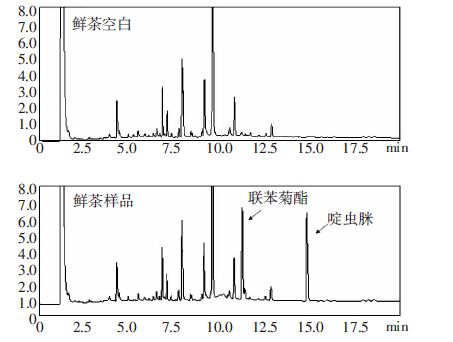
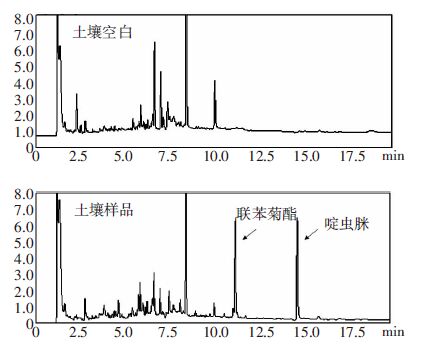
典型谱图见图 3至图 5。
|
| 图 3 0.1 mg·kg-1的联苯菊酯·啶虫脒混合标准样品色谱图 Figure 3 Chromatogram of mixed bifenthrin and acetamiprid standard( 0.1 mg·kg-1) |
|
| 图 4 鲜茶空白样品色谱图和鲜茶样品0.1 mg·kg-1水平的 联苯菊酯·啶虫脒混标添加回收率色谱图 Figure 4 Chromatograms of tea samples with and without fortification with bifenthrin and acetamipridin standards(0.1 mg·kg-1) |
|
| 图 5 土壤空白样品色谱图和土壤样品0.1 mg·kg-1水平的 联苯菊酯·啶虫脒混标添加回收率色谱图 Figure 5 Chromatograms of soil samples with and without fortification with bifenthrin and acetamipridin standards(0.1 mg·kg-1) |
消解动态试验结果表明,联苯菊酯、啶虫脒在鲜茶和土壤中的残留量均随时间长而逐渐降低(图 6),其消解动态符合一级动力学方程(表 2)。联苯菊酯茶园中的半衰期为5.6~13.1 d,浙江点与安徽点差异较大,而啶虫脒在茶园的半衰期为7.2~8.7 d,两试验点之间差异较小。
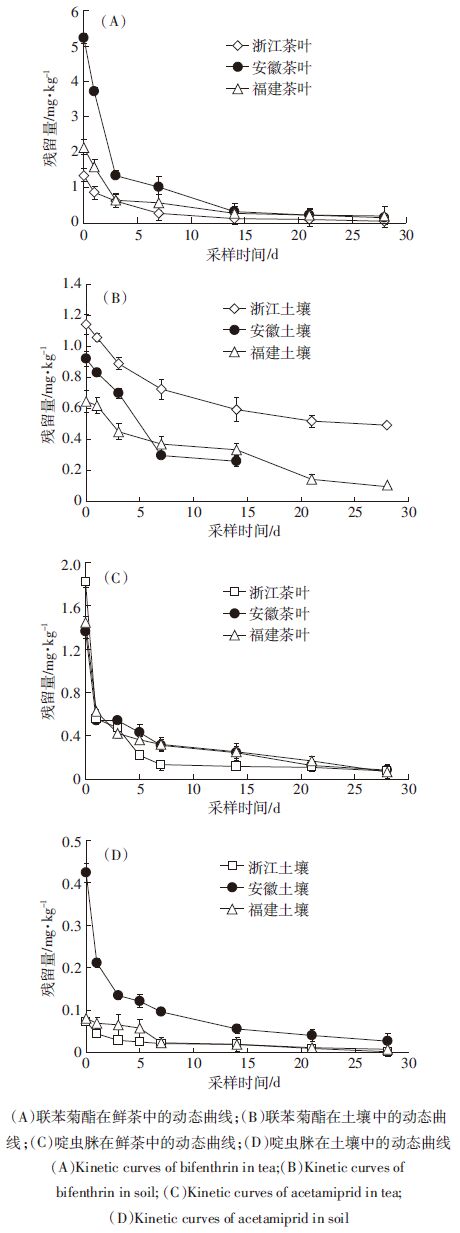
|
| 图 6 联苯菊酯、啶虫脒在鲜茶和土壤中的消解动态曲线 Figure 6 Kinetic curves of bifenthrin and acetamiprid in tea and soil |
联苯菊酯和啶虫脒沸点不同,并都具有热稳定性,通过增大程序升温速率,减高温保持时间,能使二者在240 ℃和270 ℃稳定状态下分别进行检测,并实良好分离,有效避免了杂质峰的干扰,从而为在茶叶和茶园土壤中同时监测苯菊酯和啶虫脒的残留提供了灵敏、准确的分析方法。
于啶虫脒和联苯菊酯在乙腈中的溶解度很高,但在水中的溶解度相差很大(别为4200、0.1 mg·kg-1),笔者考察了石油醚-丙酮、正己烷-丙酮和乙腈3萃取体系,发现采用乙腈为萃取剂的QuEChERS方法时,两种药剂在茶叶和土中具有较高的萃取效率,平均回收率为89.2%~108.1%;而石油醚-丙酮和正烷-丙酮两种萃取体系得到的平均回收率分别为54.6%~62.1% 和46.9%75.3%,萃取效率相对较低,且共萃取的共提物中杂质色素也相对较多。
在分析茶叶中的农药残留时,色素干扰是影响定量准确性的关键因素。在分析虫脒在黄瓜[18, 19]、金银花[20]和烟草[21]残留的研究报道中,净化过程多用弗罗里硅土填料,而在茶叶样品中多采用LC-C18SPE净化小柱来消除色素干[7]。笔者也尝试了弗罗里硅土、硅胶、氧化铝等填料净化样品,但发现茶叶的色素干扰仍无法得到有效抑制。石墨化炭黑(GCB)具有一定的物理吸附性,常被用于净化具有高含量色素的复杂基质[22]。如张新忠等[23]在分析茶中的氟环唑、茚虫威和苯醚甲环唑的残留时,利用弗罗里硅土与GCB混合柱消了茶叶中的色素干扰。基于此,笔者通过不同净化剂组合下联苯菊酯、啶虫在鲜茶中添加回收率的试验比较,发现PSA和GCB对色素都具有较好的净化效,但由于GCB表面具有特殊的六元环结构,其对对称的、平面的芳香结构农药有很强的选择性吸附和保留作用[24]。因此,本实验最终选择100 mg PSA和50 mg无水硫酸镁来共同净化茶叶样品中的色素。
在余杭、宣城和福鼎三地茶叶和土壤中,联苯菊酯的半衰期分别为5.6~8.7 d和.5~13.1 d,啶虫脒则分别为7.9~8.6 d和7.2~8.7 d。周子燕等[6]发现,联苯酯在安徽舒城茶叶中的消解半衰期仅为3.83 d,明显低于本研究的结果。首,这可能是由于农药剂型差异所引起,不同剂型往往导致药剂的初始沉积量同[25, 26];其次,本试验施药期间的茶树处于较稳定的生长后期,叶片面积生物量均相对稳定,生长稀释作用较弱,造成药剂降解速率相对较慢;再者茶叶的品种、土壤环境参数(土壤有机质含量等)及气候(光照、气温、降量)等的差异也会对降解速率产生一定的影响,有研究发现在土壤理化性质同的条件下,天气及土壤湿度也是影响联苯菊酯降解的主要因素[27]。因此影响这两种农药在茶园中消解的主要环境因子,仍需结合单因子模拟试验进步解析。
4 结论利用QuEChERS-PSA-GC建立了快速、灵敏且可同时监测茶园中联苯菊酯和啶虫脒留的分析方法,符合残留分析标准(RAQCG)的要求,能够满足不同茶类和不地区土壤中联苯菊酯、啶虫脒的检测和分析,并对监测两种农药在其他农产或食品中的残留具有参考意义。此外,探明了联苯菊酯和啶虫脒在茶园中的解动态,表明这两种杀虫剂在环境中均属于易降解农药。
| [1] | 刘长令. 世界农药信息手册[M]. 北京:化学工业出版社, 2000:12-14. LIU Chang-ling. World pesticide information manual[M]. Beijing: Chemical Industry Press, 2000:12-14. |
| [2] | 陈雪林, 杜予州, 王建军. 西花蓟马抗药性研究进展[J]. 植物保护, 2011, 37(5):34-38. CHEN Xue-lin, DU Yu-zhou, WANG jian-jun. Advances in insecticide resistance of the western flowerthrips, Frankliniella occidentalis[J]. Plant Protection, 2011, 37(5):34-38. |
| [3] | 李 健. 杀虫剂啶虫脒的高效降解微生物筛选及代谢研究[D]. 上海:上海 交通大学, 2011. LI Jian. The study of insecticide acetamipridscreening and degrading microbial metabolism[D]. Shanghai:Shanghai Jiao Tong University, 2011. |
| [4] | 邹华娇. 联苯菊酯与啶虫脒增效混配制剂对茶假眼小绿叶蝉的防治效果[J]. 福建农林科技, 2012(11):55-57. ZOU Hua-jiao. Efficacy of a synergistic mixture of bifenthrin and acetamiprid on controlling Empoascavitis Gothe[J]. Fujian Agricultural Science and Technology, 2012(11):55-57. |
| [5] | 陈石榕. 对欧盟茶叶农药残留新标准的思考[J]. 世界标准化与质量管理, 2000(7):28-29. CHEN Shi-rong. Thoughts about the new standards of pesticide residues in EU tea[J]. World Standardization and Quality Management, 2000(7) :28-29. |
| [6] | 周子燕, 李昌春, 胡本进, 等. 联苯菊酯在茶叶中的消解动态及最终残 留[J]. 安徽农业科学, 2009, 37(30):15045-15046. ZHOU Zi-yan, LI Chang-chun, HU Ben-jin, et al. Degradation dynamics and final residue of bifenthrin in tea[J]. Journal of Anhui Agricultural Sciences, 2009, 37(30):15045-15046. |
| [7] | 卢声宇, 徐敦明, 李捷, 等. 茶叶中啶虫脒残留量检测方法的研究[J]. 福 建分析测试, 2008, 17(3):4-6. LU Sheng-yu, XU Dun-ming, LI Jie, et al. Determination of acetamiprid residue in tea by gas chromatography[J]. Fujian Analysis & Testing, 2008, 17(3):4-6. |
| [8] | 谢艳丽, 梁振益, 章程辉, 等. 气相色谱法检测蔬菜中百菌清、联苯菊酯 、氟氯氰菊酯残留量[J]. 安徽农业科学, 2011, 39(5):2678-2679. XIE Yan-li, LIANG Zhen-yi, ZHANG Cheng-hui, et al. Determination of the residue of chlorothalonil, biphenyland, Cy fluthrinin vegetable swith gas chromatography[J]. Journal of Anhui A gricultural Sciences, 2011, 39(5):2678-2679. |
| [9] | 李雪春, 张卫国, 黄培林. 蔬菜中联苯菊酯气相色谱法质量控制[J]. 贵州 师范大学学报:自然科学版, 2011, 9(3):135-137. LI Xue-chun, ZHANG Wei-guo, HUANG Pei-lin. Study on quality control of determination of bifenthrinin vegetables by gas chromatography[J]. Journal of Guizhou Normal University(Natural Sciences), 2011, 9(3):135-137. |
| [10] | 董振霖, 杨春光, 薛大方, 等. 气相色谱-质谱法测定植物源性食品中 残留的联苯菊酯[J]. 色谱, 2009, 27(1):82-85. DONG Zhen-lin, YANG Chun-guang, XUE Da-fang, et al. Determination of bifenthrin residue in plant-based foods using gas chromatography-mass spectrometry[J]. Chinese Journal of Chromatography, 2009, 27(1): 82-85. |
| [11] | 仲岳桐, 陈春晓, 康 莉. 气质联用仪法检测茶叶中联苯菊酯等四种拟除 虫菊酯类农药[J]. 中国热带医学, 2010, 10(11):143-147. ZHONG Yue-tong, CHEN Chun-xiao, KANG Li. Determination of pyre-throidpesticide in tea leaf by gas chromatography mass spectrometry[J]. China Tropical Medicine, 2010, 10(11):143-147. |
| [12] | 张 亮, 孙剑宁, 贾慧娴, 等. 毒死蜱、联苯菊酯、氰戊菊酯的色谱分析[J]. 农药, 2005, 50(3):201-203. ZHANG Liang, SUN Jian-ning, JIA Hui-xian, et al. Chromatographic analysis of chlorpyrifos, bifenthrin, fenvalerate[J]. Agrochemicals, 2005, 50(3):201-203. |
| [13] | 梁贵平, 刘志娟. 高效液相色谱法测定乳油中联苯菊酯的含量[J]. 精细 化工中间体, 2005, 35(5):61-62. LIANG Gui-ping, LIU Zhi-juan. Determination of bifenthrin in emulsifable concentrates by high performance liquid chromatography[J]. Fine Chemical Intermediates, 2005, 35(5):61-62. |
| [14] | 中华人民共和国农业部. NY/T 788—2004. 农药残留试验准则[S]. 北京 :中国农业出版社, 2004. Ministry of Agriculture, People′s Republic of China. NY/T 788—2004. Guidelines for pesticide residue test[S]. Beijing:China Agriculture Press, 2004. |
| [15] | 王运浩, 季 颖, 龚 勇, 等. 农药登记残留田间试验标准操作规程[M]. 北京:中国标准出版社, 2007:43-47. WANG Yun-hao, JI Ying, GONG Yong, et al. SOPs of pesticide residues registration field trials[M]. Beijing:China Standard Press, 2007: 43-47. |
| [16] | 朱国念. 农药残留快速检测技术[M]. 北京:化学工业出版社, 2008:59 -61. ZHU Guo-nian. Rapid detection of pesticide residues[M]. Beijing: Chemical Industry Press, 2008:59-61. |
| [17] | 农业部农药检定所. 农药残留量实用检测方法手册[S]. 北京:中国农业 科技出版社, 1995. Ministry of Agriculture. Pesticide residues detection method practical manual[S]. Beijing:China Agricultural Science and Technology Press, 1995. |
| [18] | 李二虎, 胡 敏,吴兵兵, 等. 气相色谱法测定黄瓜中啶虫脒农药残留[J]. 农药, 2006, 45(7):479-480. LI Er-hu, HU Min, WU Bing-bing, et al. Determination of acetamiprid residue in cucumber by gas chromatography[J]. Agrochemicals, 2006, 45 (7): 479-480. |
| [19] | 孙 楠, 薛 健. 气相色谱法测定金银花中残留的啶虫脒[J]. 农药, 2007, 46(4):256-257. SUN Nan, XUN Jian. Determination of acetamiprid residue in honeysuckle by gas chromatography[J]. Agrochemicals, 2007, 46(4): 256-257. |
| [20] | 张少军, 王 莉, 钱 训, 等. 杀虫剂啶虫脒在黄瓜上的残留动态研究[J]. 河北农业科学, 2004, 8(2):54-56. ZHANG Shao-jun, WANG Li, QIAN Xun, et al. Study on the residue behavior of novel pesticide acetaniprid in cucumber[J]. Journal of Hebei Agricultural Sciences, 2004, 8(2):54-56. |
| [21] | 刘宝安, 徐光军, 曹爱华, 等. 莫比朗(Mospilan)3%乳油在烟草及土壤 中残留试验研究[J]. 中国烟草科学, 2002(2):45-48. LIU Bao-an, XU Guang-jun, CAO Ai-hua, et al. Study on residue experiment of 3% Mospilan emulsifable concentrate in tobacco leaves and soil[J]. Chinese Tobacco Science, 2002(2):45-48. |
| [22] | Walorczyk S. Application of gas chromatography/tandem quadruple mass spectrometry to the multi-residue analysis of pesticides in green leafy vegetables[J]. Rapid Communications in Mass Spectrometry, 2008, 22(22):3791. |
| [23] | 张新忠, 罗逢健, 刘光明, 等. 超高效液相色谱串联质谱法测定茶叶、茶 汤和土壤中氟环唑、茚虫威和苯醚甲环唑残留[J]. 分析化学研究报告, 2013, 2(41):215-222. ZHANG Xin-zhong, LUO Feng-Jian, LIU Guang-ming, et al. Residue determination of epoxiconazole, indoxacarb and difenoconazole in tea, tea infusion and soil using ultra high-performance liquid chromatography coupled with tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2013, 2(41):215-222. |
| [24] | 宋淑玲, 李重九, 马晓东. 蔬菜农药多残留分析中基质共提物净化方法的 研究[J]. 分析测试学报, 2008, 27(8):795-799. SONG Shu-ling, LI Chong-jiu, MA Xiao-dong. Study on clean up method for coextractions of multiple pesticide residues in vegetables[J]. Journal of Instrumental Analysis, 2008, 27(8):795-799. |
| [25] | Sopena F, Maqueda C, Morillo E. Norflurazon mobility, dissipation, activity, and persistence in a sandy soil as influenced by formulation[J]. J Agric Food Chem, 2007, 55(9):3561-3567. |
| [26] | Negre M, Gennari M, Raimondo E, et al. Alachlor dissipation in soil as influenced by formulation and soil moisture[J]. J Agric Food Chem, 1992, 40(6):1071-1075. |
| [27] | 方丽萍, 邬元娟, 李瑞菊, 等. 联苯菊酯在棉花和土壤中的残留和降解 行为研究[J]. 生态环境学报, 2012, 21(7):1493-1497. FANG Li-ping, WU Yuan-juan, LI Rui-ju, et al. The residue and degradation of bifenthrin in cotton and soil[J]. Ecology and Environmental Sciences, 2012, 21(7):1493-1497. |
 2015, Vol. 34
2015, Vol. 34