文章信息
- 李小康, 胡献刚, 周启星
- LI Xiao-kang, HU Xian-gang, ZHOU Qi-xing
- 碳纳米颗粒诱发植物毒性效应及其机理的研究进展
- Research Progress in Phytotoxicity of Carbon Nanoparticles and Its Mechanisms
- 农业环境科学学报, 2015, 34(11): 2041-2047
- Journal of Agro-Environment Science, 2015, 34(11): 2041-2047
- http://dx.doi.org/10.11654/jaes.2015.11.001
-
文章历史
- 收稿日期: 2015-06-06
碳纳米材料是由碳元素组成,至少有一个维度在纳米尺度的新型纳米材料,主要包括碳纳米管(Carbon nanotubes)、石墨烯(Graphene)和富勒烯(Fullerene)。近十年来,碳纳米材料的诸多优势使其用于导电材料、光学器件、量子计算机领域,并在生物污染修复、分子开关、组织工程学、制药、医学等方面得到了广泛的应用[1, 2, 3, 4, 5]。碳纳米材料的大量应用不可避免地造成这些材料向环境中的释放,其潜在的生态风险已引起了学术界的广泛关注[6]。植物是生态系统的必要组成部分,关注碳纳米材料与植物的作用对于评价纳米技术对环境和农业的影响至关重要[7]。
1 植物对碳纳米颗粒的吸附/吸收研究碳纳米材料的植物毒性效应首先要清楚碳纳米颗粒是否可以进入植物体内,这最终也将决定其是否会随食物链、食物网在动物体内富集,引发生态毒性。现阶段大部分研究发现植物可以吸附、吸收不同的碳纳米颗粒,包括单壁碳纳米管(SWCNTs)和多壁碳纳米管(MWCNTs)[8, 9]、石墨烯[10]和富勒烯[11, 12]。有研究发现碳纳米颗粒可以凝聚、吸附在植物的根表面:杨晓静等[13]研究发现SWCNTs在水体会凝聚成较大的颗粒,与小球藻共存时,会吸附大量的小球藻进而形成更大的颗粒;Begum等[10]研究发现石墨烯处理过的卷心菜、西红柿、红菠菜由于根尖和根毛产生大量的粘液、多糖而导致根表面聚集了大量的石墨烯。此外,Yan等[14]发现SWCNTs主要分布在玉米幼苗根部皮层组织的细胞间隙中。进一步研究发现碳纳米颗粒可以进入植物细胞中,如:Liu等[15]观察到SWCNTs能够穿透完整的细胞壁和细胞膜进入到烟草细胞中;Begum等[16]利用拉曼光谱在红菠菜的叶子里发现了MWCNTs,其进一步利用透射电子显微镜(TEM)观察0~80 mg·L-1石墨烯处理的拟南芥细胞,证实了石墨烯在细胞内的迁移且观察到细胞的胞吞结构,表明石墨烯通过胞吞作用进入拟南芥T87细胞;Hu等[17]研究发现氧化石墨烯(GO)包裹在小藻细胞表面,可以进一步进入到小藻细胞中;Lin等[18]亦发现水稻根系可以吸收C70,证实了富勒烯亦可以进入植物体内。
纳米颗粒通过植物根系进入到植物体的途径主要有两条:一是质外体途径[19],纳米颗粒扩散到细胞间隙、质外体中,并被吸附或结合在生物膜上。虽然凯氏带阻碍了质外体流动和运输,但是纳米颗粒可能通过小孔或被破坏的细胞而不通过细胞膜进入木质部,然后被运输到植物地上部。二是共质体途径[20],虽然细胞壁具有由多糖类和蛋白质相互联结而成的坚硬复杂的半渗透网络结构,允许小分子的通过而限制大分子的通过,能够阻碍碳纳米颗粒进入植物体内,只有粒径小于细胞壁上最大孔隙的纳米颗粒才能通过细胞壁到达原生质膜,但在细胞分裂过程中,新形成的细胞壁更易于纳米颗粒的通过。此外纳米颗粒与细胞的反应可能导致细胞壁上更大的新孔隙的形成,因此增大了纳米颗粒通过细胞壁的可能性,纳米颗粒穿过细胞壁并由质膜上的载体蛋白或胞吞作用[16]进入植物细胞,再逐级运输到木质部,最终被运移到植物地上部。
2 碳纳米颗粒在植物内的迁移纳米颗粒被吸附到植物表面,并通过植物自身纳米或微米级孔隙进入植物体内[21],进入植物体中的碳纳米颗粒可能通过植物木质部或韧皮部而实现在不同组织间的运输。Hu等[22]发现石墨烯可以从小麦根部迁移到茎部,并且在小麦细胞的细胞质和叶绿体中都发现石墨烯的存在;Lin等[18]发现水稻根系吸收的C70可以向地上部分的茎、叶中迁移,将收割的水稻再次种植,在其二代植株茎、叶中仍可发现C70的存在。
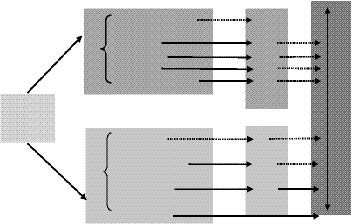
被吸收的纳米颗粒通过木质部和韧皮部实现在植物体内的长距离迁移(图 1)。叶子的外表面和表皮细胞覆盖有角质层,较小的亲脂性纳米颗粒可以被吸收在角质层的非极性流体区域。由于表皮细胞的角质层和气孔存在不同的渗透特征,较大的纳米颗粒也可以渗透到无角质层区域,如气孔、排水器、花的柱头。通过气孔进入叶细胞气体空间的纳米颗粒沉积在气室或相邻细胞的细胞壁上。在侧根较发达的基根区,新形成的侧根突破皮层,在新侧根形成的位置,纳米颗粒通过植物皮层进入木质部和中柱。随着蒸腾作用的增强,质外体途径与共质体途径的比重将会增加。地下食草动物和机械损伤造成的植物破损也将促进纳米颗粒通过被动扩散进入植物体内。
|
|
该图标识了纳米颗粒在植物地上芽部分(绿色方框)和地下根部分(黄色方框)的吸收及迁移途径,蓝色方框表示不同组织间长距离运输途径;虚线表示迁移速度较慢的途径 Figure shows uptake and translocation of nanoparticles in shoots (green boxes) and roots (yellow boxes).Blue box represents long-distance transport of nanoparticles in tissues.Broken lines indicate assumed low-rate transport 图 1 碳纳米颗粒在植物体内的归宿[21] Figure 1 Fate of carbon nanoparticles in plants |
现阶段有关碳纳米颗粒对植物个体生长发育影响的研究大致分为两派:小部分研究表明碳纳米颗粒对植物生长发育有促进作用或无明显的抑制作用;但绝大多数研究证实碳纳米颗粒物对植物生长发育主要表现为抑制作用。
3.1 碳纳米颗粒促进植物生长发育部分研究表明碳纳米颗粒物对植物没有明显毒性作用。Lin等[23]研究发现2000 mg·L-1 MWCNTs对6 种植物(萝卜、油菜、黑麦草、生菜、玉米、黄瓜)种子的发芽和根伸长都没有明显的抑制作用;Zhao等[24]研究发现0~1 mg·L-1的GO对拟南芥种子的发芽生长、幼苗根茎的伸长、植物的花期都没有显著的影响;碳纳米管和富勒烯可以增加某些植物的保水能力和生物量[1],Khodakovskaya等[25]的研究表明,10~40 mg·L-1 MWCNTs 能够加快西红柿种子萌发并同时增加其生物量,通过TEM观察到 MWCNTs 能够穿透种皮,因此认为增加种子对水分的吸收可能是 MWCNTs 促进种子发芽和生长的主要原因。亦有石墨烯能够促进植物生长发育的报道,如Liu等[26]发现5 mg·L-1的石墨烯对水稻幼苗的不定根数量、根鲜重、其他地上部位的鲜重都有促进作用。
3.2 碳纳米颗粒抑制植物生长发育现阶段绝大部分研究证实碳纳米材料对植物生长发育有明显的抑制作用(表 1)。纳米颗粒诱发植物毒性的受试物种主要集中在小麦、水稻、红菠菜、玉米等可食作物上,其对植物生长发育的影响主要表现为抑制植物种子萌发及幼苗生长。种子萌发主要包括种子发芽率和子叶长度。幼苗生长包括根长、芽长、叶数量、生物量、根叶形态以及叶绿素的合成等。
 |
纳米颗粒对植物生长的抑制可能不是直接来自纳米颗粒的化学毒性,毒性可能是由碳纳米颗粒与植物细胞运输路径的物理作用导致的[30],即通过堵塞细胞或细胞壁上的孔隙抑制质外体运输或是通过阻碍胞间连丝抑制细胞间共质体的连接。碳纳米颗粒对于不同植物个体生长发育的影响存在显著差异,可能是由于不同种类植物木质部的结构不同,导致其应对纳米材料的方式存在差异[10]。
4 碳纳米颗粒对植物结构功能的影响利用种子发芽和根伸长等个体发育的表观指标可能不能够敏感地反映出碳纳米颗粒对植物的毒性[27],纳米尺度颗粒会严重影响细胞、亚细胞和蛋白质的生理活性,甚至会造成细胞的死亡,这些结构功能的指标能够快速准确地从微观反映出碳纳米颗粒的植物毒性。表 2为已有研究观察到的碳纳米颗粒物对不同种类植物结构功能的影响,主要包括细胞死亡、细胞器的损伤、活性氧(ROS)的积累以及抗氧化酶活性的紊乱等。
 |
碳纳米颗粒物对植物的毒性不仅取决于作用的植物种类,也与碳纳米颗粒物自身特性和环境条件密切相关。尽管碳纳米颗粒的物化性质已被广泛研究,但是关于碳纳米颗粒的物化属性与其诱发植物不良效应的关系还不清楚[36]。碳纳米颗粒的基本理化属性包括粒径、比表面积、相貌、结构以及表面化学属性等。表 3分析了这些参数变化导致的碳纳米材料诱发植物毒性的变化。
环境条件亦对碳纳米颗粒的毒性有着重要的影响,环境介质中存在的生物体或者某些物质能与纳米颗粒发生相互作用从而改变纳米颗粒表面电荷量及其在环境中的分散聚集行为,进而影响纳米颗粒对植物的毒性。有研究表明阳离子表面比阴离子表面的纳米颗粒有更高的生物毒性,不带电荷的纳米颗粒具有更高的生物相容性[46],可能由于阳离子更容易与带负电荷的脂质和蛋白质结合所致[36]。如天然有机物腐植酸(HA),明显降低石墨烯的植物毒性并且恢复石墨烯引起的植物茎尖形态的改变,可能与HA增加石墨烯的无序结构和表面负电荷,减少石墨烯的凝聚,增加石墨烯在植物细胞液泡中的储量有关;同时石墨烯-HA下调了代谢中纤维糖、苯基丙氨酸、邻苯二甲酸、硬脂酸的含量。由此可看出HA通过调控石墨烯在活的有机体中的位置和代谢通量来实现石墨烯的解毒[22]。根系分泌物(包含小分子酸、醇化物、烷烃、次生代谢物)作为天然配合物明显改变了原始形态的GO(PGO)的属性[48],PGO接触根系分泌物形成GO配合体(LGO),相比PGO,LGO的厚度增加,有着更高的碳氧比,粒径、负电荷减小,稳定性变差,表现出更多不成对电子,结构更加无序,紫外吸收能力更强,因此具有更强的生物毒性。
环境体系中的pH、离子强度及环境介质其他特征都会影响纳米颗粒的稳定性[6]。未经修饰的碳纳米材料,通常亲水性比较差,容易在水体中发生团聚,进一步影响纳米材料的生物有效性。相比土壤介质,纳米材料在水体中可能发生的光化学转化也不容忽视。碳纳米材料在光照下通常会发生氧化反应,使其表面的含氧官能团增多。相比水体介质,土壤介质更为复杂,一般碳纳米颗粒由于亲水性较差,容易被土壤中的有机质固定。需要注意的是,土壤中的微生物及根际分泌物对碳纳米材料的修饰还未引起足够的重视。当然,纳米材料的毒性作用很大程度上也取决于纳米材料的剂量、反应时间和植物的种类[10]。
6 石墨烯对植物产生影响的分子机制研究碳纳米颗粒对植物组织、细胞、酶、蛋白质、DNA的作用对于理解其对植物的影响机制以及评估其生态风险是至关重要的[36]。碳纳米颗粒通过物理或化学作用对植物组织产生毒性,影响主要包括以下几种机制。
(1)碳纳米颗粒与植物细胞的机械作用[21]。机械作用依赖于碳纳米颗粒物的粒径大小而不是颗粒物的化学性质,包括植物细胞结构的破坏和机械堵塞,有研究表明由于GO与细胞膜的直接接触而造成细胞膜的物理损伤[49]。Akhavan等[50]认为细菌直接与纳米颗粒物锋利的边缘接触导致细胞膜损伤是致使细胞失活的有效机制,发现有外膜的革兰氏阴性菌Escherichia coli比没有外膜的革兰氏阳性菌Staphylococcus aureus更能抵抗纳米颗粒对其细胞膜的损伤。
(2)碳纳米颗粒物与带正电荷的蛋白质、脂质的亲和力效应[21],影响到植物蛋白质和脂类的代谢活性[17]。具有氧化表面的纳米颗粒在表面形成了带负电的羟基自由基表层可以吸引带正电荷的蛋白质组,这些蛋白质一旦结合在纳米颗粒物上,蛋白质的功能性将降低或消失[51]。石墨烯造成的细胞膜损伤很可能是由于带负电荷的石墨烯与带正电荷的磷脂酰胆碱的静电作用[52]。Li等[53]发现石墨烯通过降低线粒体膜电位而产生细胞毒性。Hu等[17]研究表明GO引起与生物关键过程有关的新陈代谢的紊乱,抑制碳水化合物和氨基酸的代谢,提高不饱和脂肪酸与饱和脂肪酸的比例,氮通量也由氨基酸向尸胺和尿素转变。
(3)纳米材料吸附在细胞表面并且将刺激信号传递到细胞中,细胞核下调与黏附有关的基因和蛋白,从而对细胞产生影响[54]。
(4)纳米颗粒进入细胞质,到达溶酶体、线粒体、细胞核中,影响细胞的代谢、基因的转录/翻译,从而引起细胞凋亡[54]。不少研究发现碳纳米颗粒能够影响植物细胞中某些基因的表达,从而对植物不同细胞及组织表现出促进或抑制作用。Yan等[14]发现SWCNTs对玉米根不同组织作用效果不同,与SWCNTs选择性地促进根细胞某些基因的转录并且改变某些基因表达有关,而这些基因能够抑制或促进根不同组织的生长;Khodakovskaya等[7]研究表明MWCNTs 处理增加了西红柿生物量,认为MWCNTs能够诱导叶片和根系中基因表达的差异,上调某些胁迫相关基因(如水通道蛋白基因 LeAqp2);Khodakovskaya等[9]进一步研究发现5~500 mg·L-1的MWCNTs能够促进培养的西红柿细胞的增长,认为MWCNTs促进细胞增长与其促进西红柿细胞分裂、细胞壁形成及水分运输的基因表达有关,MWCNTs极大地促进了西红柿水通道蛋白基因(NtPIP1)的产生与表达,同时促进了细胞分裂基因(CycB)、细胞壁形成基因(NtLRX1)的表达。
(5)催化活性[25]、自由基氧化损伤及植物产生ROS氧化应激效应[6, 37, 55, 57, 58]。植物的氧化应激主要是由于体内ROS的产生,碳纳米颗粒引起的ROS的积累是引起细胞死亡的关键因素[10],抗氧化酶如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)等能减少或消除体内的ROS,当植物遭受比较严重的胁迫时,积累的ROS超过抗氧化系统的清除能力,ROS将直接攻击蛋白质、脂类和DNA等多种生物大分子,引起体内脂质过氧化物的积累,导致机体损伤[55, 56, 59]。不论在细胞内还是细胞外产生的ROS都是纳米颗粒物产生毒性的首要因素[60]。
7 问题及展望目前,关于碳纳米颗粒对植物的毒性研究主要针对的是高浓度的碳纳米颗粒对植物的短期暴露[14, 26, 61, 62],不能很好地反映实际情况。因此,更多地关注低浓度的碳纳米颗粒对植物的长期暴露更有实际意义。虽然低浓度的碳纳米颗粒可能对植物的个体发育影响不明显,但仍然有必要利用电镜、光谱及同位素标记等技术观察低浓度的碳纳米颗粒是否会进入植物体内及其在植物体内的迁移归趋,甚至以食物链形式传递放大的可能性。
有研究表明碳纳米颗粒可以在过氧化物酶作用下发生生物降解[63, 64],我们不仅要关注碳纳米颗粒对植物的急性毒性,也要关注其对植物的慢性毒性。在纳米材料的慢性毒性分析中,需要结合多种表征技术,例如原子力显微镜、微区拉曼光谱、高分辨电镜、元素示踪等技术。
自然环境中植物通常会暴露于多种污染物,而不仅仅受单一的污染物的影响[65],碳纳米颗粒往往对环境中其他污染物毒性产生影响。有研究表明:SWNTs和富勒烯可以增加杀虫剂在植物体内的积累[66];富勒烯增加了异型生物质有机化合物在藻类和甲壳类的毒性和生物积累性[67];敌草隆可以吸附在碳纳米管上,使敌草隆对小球藻的毒性增加[68];GO增强了As对小麦的毒性[65]。但是有关碳纳米颗粒的复合污染的研究仍然很欠缺,未来研究可以通过逐一控制污染物进入植物体内的途径来探究碳纳米颗粒对污染物进入植物体内途径的影响。此外,碳纳米颗粒协同环境中其他污染物的复合植物毒性的表现形式及其机理尚不清楚,其中碳纳米颗粒对污染物生物受体的激活需要进一步的关注。
目前的报道主要集中在碳纳米材料对植物的毒性研究。Hu等[22]提出了HA可以通过调控纳米颗粒在植物体内的迁移和代谢而降低纳米颗粒的生物毒性,有关此类纳米毒性调控的研究还没有得到充分地开展,而纳米毒性调控研究对于避免过高评估纳米颗粒的毒性以及有效控制纳米颗粒的植物毒性是至关重要的。
| [1] | Husen A, Siddiqi K S. Carbon and fullerene nanomaterials in plant system[J]. Journal of Nanobiotechnology, 2014, 12(1):16. |
| [2] | Zhang W, Zhang Z, Zhang Y. The application of carbon nanotubes in target drug delivery systems for cancer therapies[J]. Nanoscale Research Letters, 2011, 6(1):1-22. |
| [3] | Ali-Boucetta H, Al-Jamal K T, Müller K H, et al. Cellular uptake and cytotoxic impact of chemically functionalized and polymer-coated carbon nanotubes[J]. Small, 2011, 7(22):3230-3238. [4] Lacerda L, Russier J, Pastorin G, et al. Translocation mechanisms of chemically functionalised carbon nanotubes across plasma membranes[J]. Biomaterials, 2012, 33(11):3334-3343. |
| [5] | Serag M F, Kaji N, Habuchi S, et al. Nanobiotechnology meets plant cell biology:Carbon nanotubes as organelle targeting nanocarriers[J]. RSC Advances, 2013, 3(15):4856-4862. |
| [6] | Dwivedi A D, Ma L Q. Biocatalytic synthesis pathways, transformation, and toxicity of nanoparticles in the environment[J]. Critical Reviews in Environmental Science and Technology, 2014, 44(15):1679-1739. |
| [7] | Khodakovskaya M V, de Silva K, Nedosekin D A, et al. Complex genetic, photothermal, and photoacoustic analysis of nanoparticle-plant interactions[J]. Proceedings of the National Academy of Sciences, 2011, 108(3):1028-1033. |
| [8] | Lahiani M H, Dervishi E, Chen J, et al. Impact of carbon nanotube exposure to seeds of valuable crops[J]. ACS Applied Materials & Interfaces, 2013, 5(16):7965-7973. |
| [9] | Khodakovskaya M V, de Silva K, Biris A S, et al. Carbon nanotubes induce growth enhancement of tobacco cells[J]. ACS nano, 2012, 6(3):2128-2135. |
| [10] | Begum P, Ikhtiari V, Fugetsu B. Graphene phytotoxicity in the seedling stage of cabbage, tomato, red spinach, and lettuce[J]. Carbon, 2011, 49(12):3907-3919. |
| [11] | De La Torre-Roche R, Hawthorne J, Deng Y, et al. Fullerene-enhanced accumulation of p, p'-DDE inagricultural crop species[J]. Environmental Science & Technology, 2012, 46(17):9315-9323. |
| [12] | Avanasi R, Jackson W A, Sherwin B, et al. C60 fullerene soil sorption, biodegradation, and plant uptake[J]. Environmental Science & Technology, 2014, 48(5):2792-2797. |
| [13] | 杨晓静, 陈 灏. 纳米二氧化钛和单壁碳纳米管对普通小球藻生长的抑制效应[J]. 生态毒理学报, 2010, 5(1):38-43. |
| [14] | Yan S H, Zhao L, Li H, et al. Single-walled carbon nanotubes selectively influence maize root tissue development accompanied by the change in the related gene expression[J]. Journal of Hazardous Materials, 2013, 246:110-118. |
| [15] | Liu Q L, Chen B, Wang Q L, et al. Carbon nanotubes as molecular transporters for walled plant cells[J]. Nano Letters, 2009, 9(3):1007-1010. |
| [16] | Begum P, Fugetsu B. Phytotoxicity of multi-walled carbon nanotubes on red spinach(Amaranthus tricolor L.) and the role of ascorbic acid as an antioxidant[J]. Journal of Hazardous Materials, 2012, 243:212-222. |
| [17] | Hu X G, Lu K C, Mu L, et al. Interactions between graphene oxide and plant cells:Regulation of cell morphology, uptake, organelle damage, oxidative effects and metabolic disorders[J]. Carbon, 2014, 80:665-676. |
| [18] | Lin S J, Reppert J, Hu Q, et al. Uptake, translocation, and transmission of carbon nanomaterials in rice plants[J]. Small, 2009, 5(10):1128-1132. |
| [19] | Nowack B, Bucheli T D. Occurrence, behavior and effects of nanoparticles in the environment[J]. Environmental Pollution, 2007, 150(1):5-22. |
| [20] | Navarro E, Baun A, Behra R. Environmental behavior and ecotoxicity of engineered nanoparticles to algae, plants, and fungi[J]. Ecotoxicology, 2008, 17(5):372-386. |
| [21] | Dietz K, Herth S. Plant nanotoxicology[J]. Trends in Plant Science, 2011, 16(11):582-589. |
| [22] | Hu X G, Mu L, Kang J, et al. Humic acid acts as a natural antidote of graphene by regulating nanomaterial translocation and metabolic fluxes in vivo[J]. Environmental Science & Technology, 2014, 48(12):6919-6927. |
| [23] | Lin D H, Xing B S. Phytotoxicity of nanoparticles:Inhibition of seed germination and root growth[J]. Environmental Pollution, 2007, 150(2):243-250. |
| [24] | Zhao S, Wang Q, Zhao Y, et al. Toxicity and translocation of graphene oxide in Arabidopsis thaliana[J]. Environmental Toxicology and Pharmacology, 2015, 39(1):145-156. |
| [25] | Khodakovskaya M, Dervishi E, Mahmood M, et al. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth[J]. ACS Nano, 2012, 6(8):7541-7541. |
| [26] | Liu S J, Wei H M, Li Z Y, et al. Effects of graphene on germination and seedling morphology in rice[J]. Journal of Nanoscience and Nanotechnology, 2015, 15(4):2695-2701. |
| [27] | Stampoulis D K, Sinha S, White J C. Assay-dependent phytotoxicity of nanoparticles to plants[J]. Environmental Science & Technology, 2009, 43(24):9473-9479. |
| [28] | Begum P, Ikhtiari R, Fugetsu B. Potential impact of multi-walled carbon nanotubes exposure to the seedling stage of selected plant species[J]. Nanomaterials, 2014, 4(2):203-221. |
| [29] | De La Torre-Roche R, Hawthorne J, Deng Y, et al. Multiwalled carbon nanotubes and C60 fullerenes differentially impact the accumulation of weathered pesticides in four agricultural plants[J]. Environmental Science & Technology, 2013, 47(21):12539-12547. |
| [30] | Ma X M, Geiser-Lee J, Deng Y, et al. Interactions between engineered nanoparticles(ENPs) and plants:Phytotoxicity, uptake and accumulation[J]. Science of the Total Environment, 2010, 408(16):3053-3061. |
| [31] | Shen C X, Zhang Q F, Li J, et al. Induction of programmed cell death in Arabidopsis and rice by single-wall carbon nanotubes[J]. American Journal of Botany, 2010, 97(10):1602-1609. |
| [32] | Tan X M, Fugetsu B. Multi-walled carbon nanotubes interact with cultured rice cells:Evidence of a self-defense response[J]. Journal of Biomedical Nanotechnology, 2007, 3(3):285-288. |
| [33] | Tan X M, Lin C, Fugetsu B. Studies on toxicity of multi-walled carbon nanotubes on suspension rice cells[J]. Carbon, 2009, 47(15):3479-3487. |
| [34] | Begum P, Fugetsu B. Induction of cell death by graphene in Arabidopsis thaliana(Columbia ecotype) T87 cell suspensions[J]. Journal of Hazardous Materials, 2013, 260:1032-1041. |
| [35] | Liu Q L, Zhao Y Y, Wan Y L, et al. Study of the inhibitory effect of water-soluble fullerenes on plant growth at the cellular level[J]. ACS Nano, 2010, 4(10):5743-5748. [36] Hu X G, Zhou Q X. Health and ecosystem risks of graphene[J]. Chemical Reviews, 2013, 113(5):3815-3835. |
| [37] | Sanchez V C, Jachak A, Hurt R H, et al. Biological interactions of graphene-family nanomaterials:An interdisciplinary review[J]. Chemical Research in Toxicology, 2011, 25(1):15-34. |
| [38] | Monteiller C, Tran L, MacNee W, et al. The pro-inflammatory effects of low-toxicity low-solubility particles, nanoparticles and fine particles, on epithelial cells in vitro:The role of surface area[J]. Occupational and Environmental Medicine, 2007, 64(9):609-615. |
| [39] | Yang K, Wan J M, Zhang S, et al. The influence of surface chemistry and size of nanoscale graphene oxide on photothermal therapy of cancer using ultra-low laser power[J]. Biomaterials, 2012, 33(7):2206-2214. |
| [40] | Verma A, Stellacci F. Effect of surface properties on nanoparticle-cell interactions[J]. Small, 2010, 6(1):12-21. |
| [41] | Jia G, Wang H F, Yan L, et al. Cytotoxicity of carbon nanomaterials:Single-wall nanotube, multi-wall nanotube, and fullerene[J]. Environmental Science & Technology, 2005, 39(5):1378-1383. |
| [42] | Kang S, Mauter M S, Elimelech M. Microbial cytotoxicity of carbon-based nanomaterials:Implications for river water and wastewater effluent[J]. Environmental Science & Technology, 2009, 43(7):2648-2653. |
| [43] | Seo J, Green A A, Antaris A L, et al. High-concentration aqueous dispersions of graphene using nonionic, biocompatible block copolymers[J]. Journal of Physical Chemistry Letters, 2011, 2(9):1004-1008. |
| [44] | Lee D Y, Khatun Z, Lee J H, et al. Blood compatible graphene/heparin conjugate through noncovalent chemistry[J]. Biomacromolecules, 2011, 12(2):336-341. |
| [45] | Oh W K, Kim S, Choi M, et al. Cellular uptake, cytotoxicity, and innate immune response of silica-titania hollow nanoparticles based on size and surface functionality[J]. ACS Nano, 2010, 4(9):5301-5313. |
| [46] | Hu X G, Mu L, Wen J P, et al. Covalently synthesized graphene oxide-aptamer nanosheets for efficient visible-light photocatalysis of nucleic acids and proteins of viruses[J]. Carbon, 2012, 50(8):2772-2781. |
| [47] | Hu X G, Mu L, Wen J P, et al. Immobilized smart RNA on graphene oxide nanosheets to specifically recognize and adsorb trace peptide toxins in drinking water[J]. Journal of Hazardous Materials, 2012, 213:387-392. |
| [48] | Du J J, Hu X G, Mu L, et al. Root exudates as natural ligands that alter the properties of grapheme oxide and environmental implications thereof[J]. RSC Advances, 2015, 5(23):17615-17622. |
| [49] | Karmali P P, Simberg D. Interactions of nanoparticles with plasma proteins:Implication on clearance and toxicity of drug delivery systems[J]. Expert Opinion on Drug Delivery, 2011, 8(3):343-357. |
| [50] | Akhavan O, Ghaderi E. Toxicity of graphene and graphene oxide nanowalls against bacteria[J]. ACS Nano, 2010, 4(10):5731-5736. |
| [51] | Larsen M R, Thingholm T E, Jensen O N, et al. Highly selective enrichment of phosphorylated peptides from peptide mixtures using titanium dioxide microcolumns[J]. Molecular & Cellular Proteomics, 2005, 4(7):873-886. |
| [52] | Peng C, Hu W B, Zhou Y T, et al. Intracellular imaging with a graphene-based fluorescent probe[J]. Small, 2010, 6(15):1686-1692. |
| [53] | Li Y, Liu Y, Fu Y J, et al. The triggering of apoptosis in macrophages by pristine graphene through the MAPK and TGF-beta signaling pathways[J]. Biomaterials, 2012, 33(2):402-411. |
| [54] | Wang K, Ruan J, Song H, et al. Biocompatibility of graphene oxide[J]. Nanoscale Research Letters, 2011, 6(8):1-8. |
| [55] | Zhang Y, Ali S F, Dervishi E, et al. Cytotoxicity effects of graphene and single-wall carbon nanotubes in neural phaeochromocytoma-derived PC12 cells[J]. ACS Nano, 2010, 4(6):3181-3186. |
| [56] | 王震宇, 于晓莉, 高冬梅. 人工合成纳米TiO2和MWCNTs对玉米生长及其抗氧化系统的影响[J]. 环境科学, 2010, 31(2):480-487. |
| [57] | Chang Y, Yang S T, Liu J H, et al. In vitro toxicity evaluation of graphene oxide on A549 cells[J]. Toxicology Letters, 2011, 200(3):201-210. |
| [58] | Gurunathan S, Han J W, Dayem A A, et al. Oxidative stress-mediated antibacterial activity of graphene oxide and reduced graphene oxide in Pseudomonas aeruginosa[J]. International Journal of Nanomedicine, 2012, 7:5901-5914. |
| [59] | Apel K, Hirt H. Reactive oxygen species:Metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55:373-399. |
| [60] | Nel A, Xia T, Mädler L, et al. Toxic potential of materials at the nanolevel[J]. Science, 2006, 311(5761):622-627. |
| [61] | Miralles P, Johnson E, Church T L, et al. Multi-walled carbon nanotubes in alfalfa and wheat:Toxicology and uptake[J]. Journal of the Royal Society Interface, 2012, 9(77):3514-3527. |
| [62] | Lahiani M H, Chen J, Irin F, et al. Interaction of carbon nanohorns with plants:Uptake and biological effects[J]. Carbon, 2015, 81:607-619. |
| [63] | Kotchey G P, Allen B L, Vedala H, et al. The enzymatic oxidation of graphene oxide[J]. ACS Nano, 2011, 5(3):2098-2108. |
| [64] | Kotchey G P, Zhao Y, Kagan V E, et al. Peroxidase-mediated biodegradation of carbon nanotubes invitro and in vivo[J]. Advanced Drug Delivery Reviews, 2013, 65(15):1921-1932. |
| [65] | Hu X G, Kang J, Lu K C, et al. Graphene oxide amplifies the phytotoxicity of arsenic in wheat[J]. Scientific Reports, 2014, 4: 6122. |
| [66] | Torre-Roche R D L, Hawthorne J, Deng Y, et al. Multiwalled carbon nanotubes and C60 fullerenes differentially impact the accumulation of weathered pesticides in four agricultural plants[J]. Environmental Science & Technology, 2013, 47(21):12539-12547. |
| [67] | Baun A, SΦrensen S N, Rasmussen R F, et al. Toxicity and bioaccumulation of xenobiotic organic compounds in the presence of aqueous suspensions of aggregates of nano C60[J]. Aquatic Toxicology, 2008, 86(3):379-387. |
| [68] | Schwab F, Bucheli T D, Camenzuli L, et al. Diuron sorbed to carbon nanotubes exhibits enhanced toxicity to Chlorella vulgaris[J]. Environmental Science & Technology, 2013, 47(13):7012-7019. |
 2015, Vol. 34
2015, Vol. 34