文章信息
- 赖金龙, 杨垒滟, 付倩, 何娇, 陶宗娅, 罗学刚
- LAI Jin-long, YANG Lei-yan, FU Qian, HE Jiao, TAO Zong-ya, LUO Xue-gang
- Sr2+在印度芥菜幼苗中的富集、亚细胞分布及贮存形态研究
- Bioaccumulation, Subcellular Distribution and Chemical Forms of Strontium in Brassica juncea L.
- 农业环境科学学报, 2015, 34(11): 2055-2062
- Journal of Agro-Environment Science, 2015, 34(11): 2055-2062
- http://dx.doi.org/10.11654/jaes.2015.11.003
-
文章历史
- 收稿日期: 2015-05-29
2. 西南科技大学生物质材料教育部工程研究中心, 四川 绵阳 621010
2. Engineering Research Center of Biomass Materials(SWUST), Ministry of Education, Mianyang 621010, China
锶(Strontium,Sr)作为第二主族金属元素,在土壤中主要以84Sr2+、86Sr2+、87Sr2+和88Sr2+四种稳定同位素存在[1]。随着核能的广泛利用,伴随产生大量的放射性核废物进入环境,其中90Sr2+作为主要的放射性核废物,具有半衰期长(28.9年)、危害性大等特点[2],其化学性质与Ca2+相似。当环境中的90Sr2+被植物根系吸收并富集到植物体内后,过量的Sr2+与Ca2+产生竞争性吸收效应,导致胞内Ca2+稳态失调,抑制膜电位的形成,ATP水解酶活性和抗氧化酶活性降低[3, 4, 5],植物表现出种子发芽率和生物量降低、光合作用下降等中毒症状[6, 7, 8, 9, 10, 11]。Sr2+也极易通过食物链进入动物或人体,替换骨骼中的Ca2+,形成内辐射,导致血细胞、骨细胞和皮肤细胞大量死亡,对健康带来危害。因此,放射性Sr2+的环境生物学效应已受到广泛关注[12, 13, 14]。
近年来,利用植物修复技术,筛选超富集植物(如向日葵、粗根大戟、毛蕊花和黄耆)并种植于重度污染区,通过植物的吸收和富集以达到清除土壤中放射性核素(90Sr2+)的应用研究已取得一些成果[15, 16, 17]。研究表明相同培养条件下,不同科属的植物对Sr2+的吸收和富集能力表现为葫芦科>豆科>禾本科。其干物质中90Sr含量最高的是豆科,较高的是十字花科[18]。印度芥菜(Brassica juncea L.)属于十字花科芸薹属一年生植物,生长快,具有高效的抗氧化系统、损伤修复系统和转运系统,对多种金属(如Cd、Cr、Ni、Zn、Cu、Au、Se等)具有较强的耐受及富集特性[19],已成为研究超富集植物富集机理的模式生物,但其对Sr2+的超富集特性及机理鲜有报道。
研究表明,超富集植物对重金属的耐性及富集特性,与重金属在植物细胞及亚细胞水平上区域化分布、植物体内的结合形态等紧密相关[20]。研究Sr2+在印度芥菜幼苗中的富集、亚细胞分布及贮存形态将为验证印度芥菜对Sr2+的超富集特性、解释超富集植物对Sr2+的耐性和富集机理提供理论依据。因此,本文以印度芥菜为试材,以稳定同位素88Sr2+为外源处理因子,模拟放射性核素90Sr2+污染,采用组织染色法、差速离心法、化学试剂逐步提取法和火焰原子吸收法检测Sr2+在印度芥菜各亚细胞组分及不同化学试剂提取态中的含量,分析印度芥菜对Sr2+的富集、转运特性,解释超富集植物对Sr2+的解毒和富集机理,为利用植物修复技术修复土壤中的放射性核素90Sr2+污染提供理论依据。
1 材料与方法 1.1 试材及处理印度芥菜(Brassica juncea L.)购自湖北武汉安谷农业科技有限公司(品种:Brassica juncea Garden PangentMix)。种子经浸种、萌发至露白。采用改良水培法培养幼苗至长出两片真叶,具体方法是:将露白的种子移栽至纸杯中(纸杯去底,用一层纱布包裹底部),20粒/杯,纸杯置于一次性塑料杯上,加入适量1/6改良霍格兰营养液(pH5.5,预实验结果显示,此浓度的营养液可避免后续处理中Sr2+沉淀),使根尖接触到营养液,每2 d更换一次营养液(培养条件:25 ℃,光强3500 lx,光/暗比12 h/12 h)。挑选长势一致的幼苗(两片真叶)进行试材处理。
目前我国土壤中Sr2+的背景值平均水平约为167 mg·kg-1[21],土壤栽培试验中采用国内学者研究的核素浓度,锶浓度为2.5~40 mg·kg-1[18]。据此,本研究Sr2+处理溶液的浓度(ρ)设计为200、250、300、350 mg·L-1,以ρ(Sr2+)167 mg·L-1为对照(CK),均采用1/6改良霍格兰营养液进行溶液配制。用上述Sr2+处理液在相同条件下培养已长出两片真叶的幼苗7 d后,将其根系依次用自来水冲洗、20 mmol·L-1 Na2-EDTA 处理20 min和去离子水冲洗,再将幼苗分为根、茎和叶三部分,液氮冷冻后-80 ℃保存,备用。
1.2 试验方法Sr2+在印度芥菜各器官中的分布,采用玫瑰红酸钠特异性染色法(Sr2+与玫瑰红酸钠特异性结合,形成红棕色沉淀)[22],即:选取ρ(Sr2+)350 mg·L-1处理后的印度芥菜幼苗,经95%乙醇60 ℃水浴抽提色素后,蒸馏水漂洗3次,0.2%玫瑰红酸钠溶液染色5 min,经95%乙醇漂洗30 s,蒸馏水漂洗2次后,置于显微镜下观察,采集图像数据并保存。
亚细胞组分的分离采用差速离心法[23],并略作改进。称取冷冻保存的样品1.000 g,加入10 mL STM提取液[0.25 mol·L-1蔗糖,50 mmol·L-1 Tris-HCl缓冲液(pH 7.5)和1 mmol·L-1巯基乙醇],冰浴,研磨匀浆后,4 ℃下采用不同转速依次离心,得到的沉淀即为不同的细胞组分。具体做法:研磨匀浆置300 r·min-1离心30 s,沉淀为细胞壁组分(F1);将上清液置2000 r·min-1离心15 min,沉淀为细胞核与叶绿体组分(F2);将上清液置10 000 r·min-1下离心20 min,沉淀为线粒体组分(F3),上清液为含核糖体、液泡的细胞液(Cell sap)、胞质溶胶(Cytosol)及内含物的可溶性组分(F4)。
化学形态的提取采用化学试剂逐步提取法[24],并略作改进。称取冷冻保存的样品1.000 g,加入10 mL提取剂(80%乙醇),冰浴,研磨匀浆后,转入离心管中,25 ℃恒温振荡24 h后,5000 r·min-1离心10 min,收集上清液;沉淀中依次加入10 mL提取剂,恒温振荡24 h后,5000 r·min-1离心10 min,依次收集各提取态的上清液,最后沉淀为残渣态。各提取剂及提取形态依次为:80%乙醇(主要提取以硝酸盐、氯化物为主的无机盐以及氨基盐等物质,记作FE);蒸馏水(主要提取水溶性有机酸盐、重金属的一代磷酸盐等,记作FW);1 mol·L-1氯化钠溶液(主要提取果胶酸盐、与蛋白质结合态或吸附态的重金属等,记作FNaCl);2%醋酸(主要提取难溶于水的重金属磷酸盐,包括二代磷酸盐、亚磷酸盐等,记作FHAc);0.6 mol·L-1盐酸(主要提取草酸盐等,记作FHCl)。
采用湿法消解法(HNO3∶HClO4=3∶1),将组分F1、F2、F3、残渣态及植物根、茎、叶进行消解至澄清,消解液用去离子水定容至50 mL;上列各化学形态的提取液和F4组分直接定容至50 mL。亚细胞组分含量的测定以STM提取液进行空白校零,化学形态含量的测定以各提取剂进行空白校零,用配有锶元素空心阴极灯的原子吸收分光光度计(北京普析,TAS-990型)测定Sr2+含量。
1.3 数据分析与处理转移系数(Translocation factor,TF)和生物富集系数(Bioaccumulation factor,BCF)计算公式分别为:TF=C地上/C地下,BCF=C总/C0,其中C地上、C地下和C总分别表示印度芥菜地上部分、地下部分和全株的Sr2+含量(mg·kg-1 FW),C0表示不同浓度的Sr2+处理溶液(mg·L-1)。
采用SPSS 18.0软件对数据进行方差分析,LSD多重比较,Origin 9.0作图。
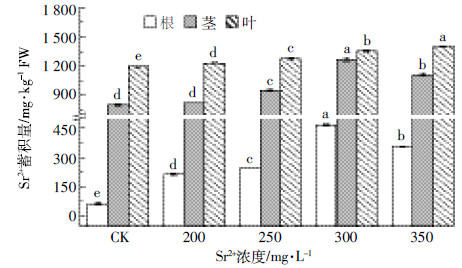
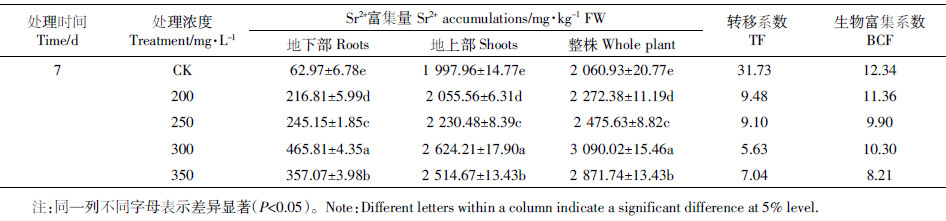
2 结果与分析 2.1 印度芥菜根、茎和叶对Sr2+的富集与转移特征由图 1(a)可见,Sr2+处理印度芥菜7 d,其叶部是Sr2+的主要富集器官(颜色为红棕色),显微观察显示,叶中的Sr2+主要富集在细胞壁位置[图 1(b-d)]。各器官中Sr2+的富集量呈“叶>茎>根”,随处理浓度[ρ(Sr2+)200~350 mg·L-1]的增加,根、茎对Sr2+富集量呈“先升后降”的趋势。当ρ(Sr2+)为300 mg·L-1时,根、茎对Sr2+的富集量最高,分别达到465.81、1 265.55 mg·kg-1 FW;叶作为Sr2+最后的贮存器官,对Sr2+的富集量则呈显著上升趋势(P < 0.05),(图 2)。地上部分、地下部分和整株对Sr2+的富集量也呈“先升后降”的趋势,转移系数(TF)达到5.63~9.48,生物富集系数(BCF)为8.21~12.34(表 1)。当ρ(Sr2+)300 mg·L-1时,地上部分、地下部分和全株富集量达到最高,分别为465.81、2 624.21、3 090.02 mg·kg-1 FW,地上部分含量占总量的84.93%~90.46%。这表明,印度芥菜对Sr2+具有很强的富集与转移能力,具有修复Sr2+污染土壤的潜力。

|
| 图 1 Sr2+在印度芥菜叶中的分布 Figure 1 Distribution of Sr2+ in leaves of Brassica junce |
|
|
同一图例的不同字母表示数据间差异显著(P < 0.05)。下同 Different letters above the same type of bar indicate a statistically significant difference according to LSD test (P < 0.05) 图 2 印度芥菜根、茎和叶对Sr2+的蓄积量 Figure 2 Contentof Sr2+ in roots, stems, and leavesof Brassicajunce |
 |
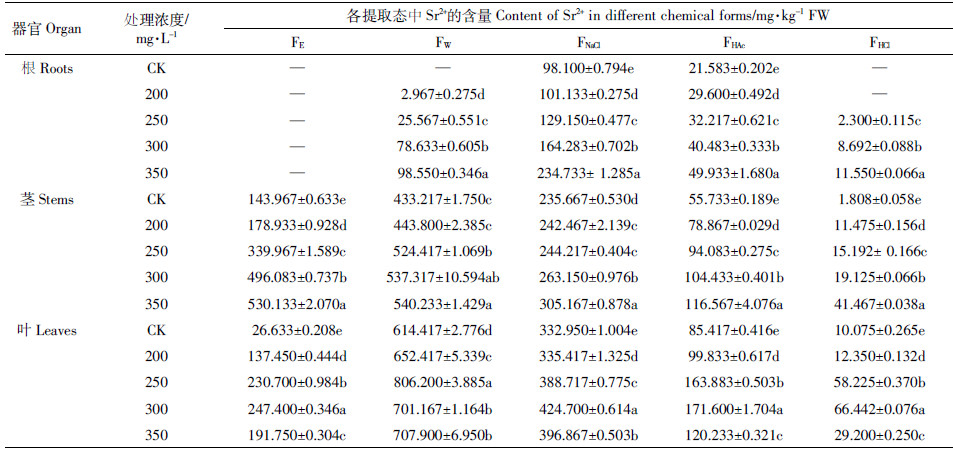
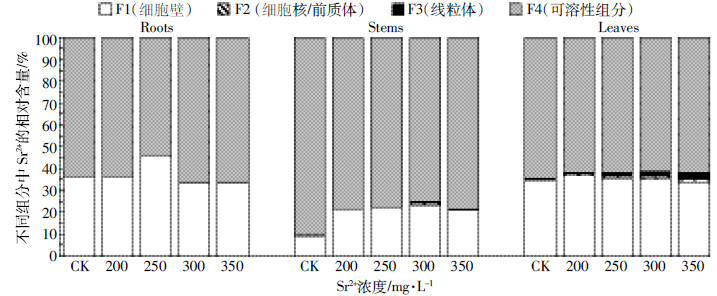
由表 2可知,随Sr2+浓度的增加,Sr2+在印度芥菜根、茎和叶中的亚细胞分布呈现“F4>F1>>(F2+F3)”。印度芥菜根、茎的细胞壁(F1)和可溶性组分(F4)中Sr2+的富集量呈“先升后降”的趋势,均显著高于CK(P < 0.05)。当ρ(Sr2+)300 mg·L-1时,根的细胞壁(F1)和可溶性组分(F2)中Sr2+的富集量达到最高,分别为119.99、238.88 mg·kg-1 FW;茎的不同亚细胞组分中富集量最高达到296.35、6.52、12.41、947.58 mg·kg-1 FW(表 2)。Sr2+在各亚细胞组分中的相对含量显示(图 3),95.62%~100%的Sr2+富集在细胞壁(F1)和可溶组分(F4),仅2.92%的Sr2+分布细胞器(F2、F3)。这表明,Sr2+绝大部分富集在印度芥菜的细胞壁(F1)和可溶组分(F4);细胞器(叶绿体、线粒体和细胞核)对Sr2+的富集量较低,缓解了Sr2+对植物细胞器的功能性损伤。
 |
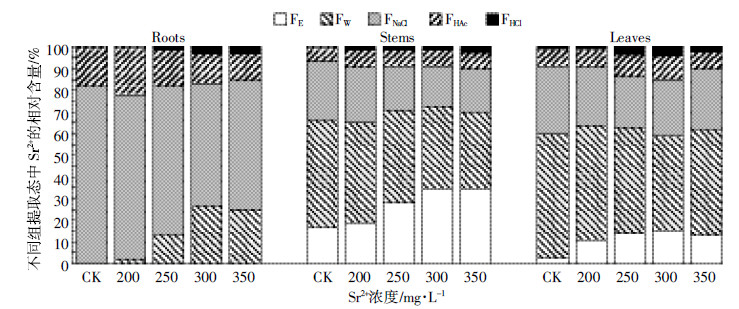
经不同化学试剂逐步提取后,在根、茎和叶的残渣态中未检测出Sr2+。根中Sr2+在各提取剂中的提取量呈现“FNaCl>FW>FHAc>FHCl”(表 3),56.24%~81.97%的Sr2+以果胶酸盐、蛋白质结合态或吸附态(FNaCl)存在(图 4)。茎中Sr2+的提取量呈现为“FW>FE>FNaCl>FHAc>FHCl”(表 3),Sr2+主要以水溶性有机酸盐和一代磷酸盐(FW),硝酸盐、氯化物为主的无机盐以及氨基盐(FE)及果胶酸盐、与蛋白质结合态或吸附态(FNaCl)存在,三者比例达到89.70%~93.39%(图 4);叶中Sr2+的提取量呈现为“FW> FNaCl> FE>FHAc>FHCl”(表 3),水溶性有机酸盐和一代磷酸盐(FW)含量占比43.52%~57.44%(图 4)。这表明,印度芥菜根中Sr2+主要为果胶酸盐、蛋白质结合态或吸附态,茎、叶中Sr2+主要为水溶性有机酸盐和一代磷酸盐。
 |
|
| 图 3 印度芥菜根、茎和叶亚细胞组分中Sr2+的相对含量 Figure 3 Relative content of Sr2+ in subcellular fractions in roots, stems, and leaves of Brassica juncea |
|
| 图 4 印度芥菜根、茎和叶中Sr2+的贮存形态相对含量 Figure 4 Relative content of Sr2+ in different chemical forms in roots, stems, and leaves of Brassica juncea |
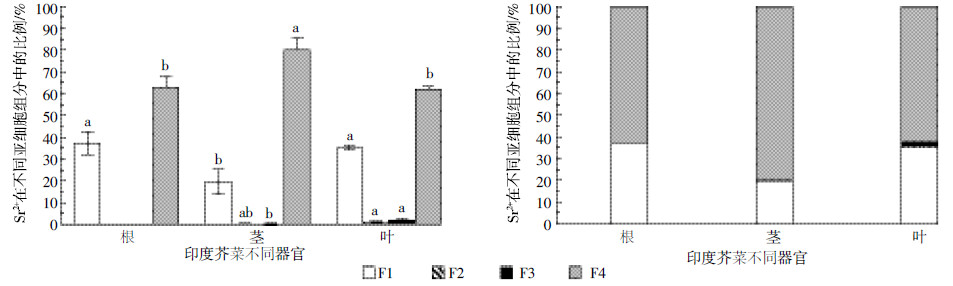
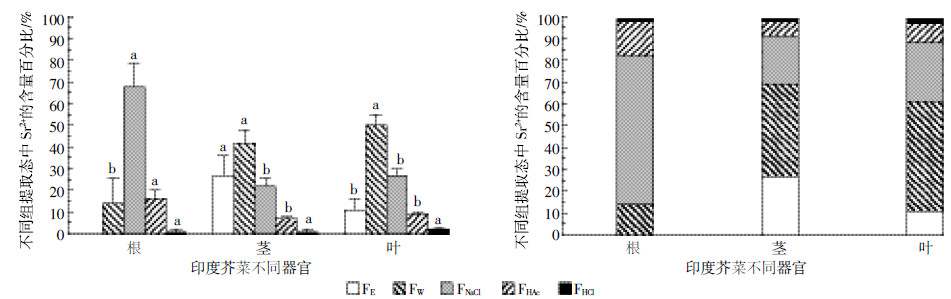
由图 5可见,Sr2+在茎的细胞壁(F1)中的富集量显著低于根、叶部的37.27%和35.20%(P < 0.05),占比仅为19.55%;其可溶组分(F4)中Sr2+的富集量显著高于根、叶部F4中所占比例(62.73%和62.15%),达到79.93%(P < 0.05)。由图 6可见,Sr2+在根部FNaCl中的含量占到总量的68.31%,显著高于茎和叶(22.19%和27.13%,P < 0.05),是Sr2+在根部的主要赋存形态;Sr2+在茎和叶部均主要以FW存在,占比分别达到42.47%和50.31%,显著高于Sr2+在根部Fw中所占比例(13.52%,P < 0.05)。这表明,印度芥菜根部通过分泌的果胶酸盐、蛋白质等物质,将Sr2+以结合态的形式结合在根中,茎部将水溶态的Sr2+转运至叶中贮存。
|
| 图 5 Sr2+在印度芥菜各器官中亚细胞分布差异比较 Figure 5 Comparison of difference in subcellular distributions of Sr2+ in different organs of Brassica juncea |
|
| 图 6 Sr2+在印度芥菜各器官中化学形态差异比较 Figure 6 Comparison of difference in chemical forms of Sr2+ in different organs of Brassica juncea |
重金属进入根部的途径,一是依赖质膜转运蛋白的共质体途径(Symplast),将一部分金属存贮到根部细胞液泡内,另一部分转运至木质部,贮存到叶器官;二是质外体运输途径(Apoplast),但由于内皮层凯式带的阻滞作用,目前认为此途径可能存在于发育未成熟的根部[19]。印度芥菜可富集/忍耐Cd、Zn 等多种重金属[25],水培条件下印度芥菜地上部分对Cd的生物富集系数(BCF)达到1178[26],土培条件下转移系数(TF)大于1[27]。本文结果显示,印度芥菜Sr2+处理7 d后,其对Sr2+的富集量达到2 060.93~3 090.02 mg·kg-1 FW,转移系数(TF)>1.0,生物富集系数(BCF)最高达到12.34(表 1),表明印度芥菜对Sr2+也具有很强的富集、转移能力,分析其富集转移特性可能与植物质膜上的金属阳离子转运蛋白家族转运系统密切相关。研究表明,Cd、Ni胁迫可诱导印度芥菜BjCET1、BjCET2、BjCET13、BjCET4及BjMTP1等CDF家族转运蛋白基因的表达[28]。BjCET2已定位至细胞质膜,其在根部的基因表达水平仅受Cd诱导的影响[29],BjMTP1可在根部特异表达且定位于根部木质部伴胞[30],表明印度芥菜对Sr2+的转运可能依赖于质膜转运蛋白的共质体途径,即印度芥菜的CDF蛋白家族可能参与了Sr2+从根部到地上部的运输以及在叶片中的富集过程。
(重)金属在植物中的亚细胞分布通常表现为“细胞壁>可溶组分>>细胞器”或“可溶组分>细胞壁>>细胞器”[31]。本文结果与此类似,即53.66%~90.54%的Sr2+进入可溶组分中(F4),9.30%~46.34%的Sr2+分布在印度芥菜的细胞壁(F1),仅2.92%的Sr2+富集在细胞器中,表明可溶组分和细胞壁是Sr2+的主要富集位点。构成植物细胞壁的结构组分具有多样性,大多含有多糖、蛋白质、羟基、羧基、氨基和醛基等基团[32, 33],可与Sr2+以配位键的方式结合,有效阻止Sr2+进入细胞,体现出细胞壁作为细胞与环境进行物质交换时第一道屏障的防卫作用。当细胞壁结合位点达饱和后,Sr2+可经过低亲和性的离子通道(被动转运)或高亲和性的转运蛋白(主动转运)进入细胞。成熟植物细胞的中央液泡可占据细胞体积的90%以上,经高速离心后,可溶性组分(F4)中含核糖体、液泡的细胞液(Cellsap)、胞质溶胶(Cytosol)及内含物,主要为液泡的细胞液(Cellsap)成分。已有研究表明,细胞液中存在多种蛋白质、有机酸和有机碱[34],其负电荷基团可与Sr2+以化学键的方式结合,导致细胞内的Sr2+主要被限制在液泡内,细胞器中仅富集少量的Sr2+,极大地降低了Sr2+对细胞器结构和功能产生损伤的风险。这是短期内(7 d)印度芥菜未表现出明显中毒症状的原因,也是印度芥菜对Sr2+的重要解毒机理之一。
植物中重金属(如Cd、Pb)的生物学活性与其赋存的化学形态紧密相关,以无机盐态(FE,80%乙醇提取)和水溶态(FW,如蒸馏水提取)赋存的金属离子比另外4种化学形态的金属迁移能力更强,更易对植物细胞造成损伤[35]。本文显示,Sr2+在根部主要以果胶酸盐、与蛋白质结合态或吸附态存在(FNaCl,68.31%),茎和叶部则以水溶性有机酸盐、Sr2+的一代磷酸盐存在(FW,43.52%、57.44%),其差异性主要是由于水溶性的Sr2+更易从印度芥菜地下部分(根部)转移到地上部分,此结果可解释印度芥菜对Sr2+的转移能力较强。重金属(如Cd)可诱导植物分泌大量的金属结合蛋白,其中植物螯合肽(PCs)的功能与金属的吸收、转运和解毒紧密相关[31]。根部Sr2+大部分以果胶酸盐或蛋白质结合态存在,此形态与根部对Sr2+富集密切相关。Sr2+胁迫下,诱导植物细胞分泌的果胶酸、PCs等物质,果胶酸中存在的羧基(-COOH)以及其PCs中的游离巯基(-SH)可与Sr2+以离子键的方式结合,形成果胶酸盐和低分子量PC-Sr复合物。其中果胶酸盐可沉积在细胞壁,低分子量PC-Sr复合物可转移进入液泡并与S2-共价连接形成高分子量复合物贮存在液泡中,达到区域化分布,此结果为细胞的可溶组分和细胞壁是Sr2+的主要富集位点的原因之一。
4 结论质膜转运蛋白介导的跨膜运输是印度芥菜根系吸收Sr2+的主要途径,将Sr2+以结合态的形式富集到根部,再以水溶态的形式将Sr2+经茎部转运至叶中贮存。同时,通过细胞壁的阻滞作用,将Sr2+结合固定在细胞壁,并将进入细胞质基质的一部分Sr2+转运到液泡内,暂时或“永久性”存贮。通过区域化分布有效降低了细胞器、胞质溶胶(Cytosol)及内含物中的Sr2+含量,极大地减缓了Sr2+对细胞器的功能性损伤,此为印度芥菜对耐受Sr2+胁迫的重要机理之一。
| [1] | Sasmaz A, Sasmaz M. The phytoremediation potential for strontium of indigenous plants growing in a mining area[J]. Environmental and Experimental Botany, 2009, 67(1):139-144. |
| [2] | Nielsen S P. The biological role of strontium[J]. Bone, 2004, 35(3):583-588. |
| [3] | Moyen C, Bonmort J, Roblin G. Early Sr2+-induced effects on membrane potential, proton pumping-and ATP hydrolysis activities of plasma membrane vesicles from maize root cells[J]. Environmental and Experimental Botany, 2011, 70(2/3):289-296. |
| [4] | Moyen C, Roblin G. Uptake and translocation of strontium in hydroponically grown maize plants, and subsequent effects on tissue ion content, growth and chlorophyll a/b ratio:Comparison with Ca effects[J]. Environmental and Experimental Botany, 2010, 68(3):247-257. |
| [5] | Soudek P, Valenova S, Vavrikova Z, et al. 137Cs and 90Sr uptake by sunflower cultivated under hydroponic conditions[J]. Journal of Environmental Radioactivity, 2006, 88(3):236-250. |
| [6] | 刘建琴, 陈 珂. 垂柳幼苗对锶胁迫的生理生化响应[J]. 安徽农业科学, 2013, 41(3):1399-1401. LIU Jian-qin, CHEN Ke. Physiological and biochemical responses of Salix babylonica Linn. to strontium stress[J]. Journal of Anhui Agri Science, 2013, 41(3):1399-1401. |
| [7] | 李 红, 唐永金, 曾 峰. 高浓度锶、铯胁迫对植物叶绿素荧光特性的影响[J]. 江苏农业科学, 2013, 41(9):349-352. LI Hong, TANG Yong-jin, ZENG Feng. Effect of strontium, and cesium on chlorophyll fluorescence of leaves in plants[J]. Jiangsu Agricultural Sciences, 2013, 41(9):349-352. |
| [8] | 周璐璐, 唐运来, 陈 霞, 等. 锶对油菜幼苗叶片光合作用的影响[J]. 植物学报, 2013, 48(3):313-319. ZHOU Lu-lu, TANG Yun-lai, CHEN Xia, et al. Effect of strontium on photosynthesis of leaves in rape seedlings[J]. Chinese Bulletin of Botany, 2013, 48(3):313-319. |
| [9] | 唐永金, 罗学刚, 江世杰, 等. 三种核素对植物烂种烂芽的影响[J]. 核农学报, 2013, 27(4):495-500. TANG Yong-jin, LUO Xue-gang, JIANG Shi-jie, et al. Influence of three nuclides upon seed and bud mortality of plants[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(4):495-500. |
| [10] | 唐永金, 罗学刚, 江世杰, 等. 锶、铯、铀对5种植物种子发芽的影响[J]. 种子, 2013, 32(4):1-4. TANG Yong-jin, LUO Xue-gang, JIANG Shi-jie, et al. Influence of strontium, cesium, uranium upon the seed germination of five plants[J]. Seed, 2013, 32(4):1-4. |
| [11] | 王 振, 陈刚明, 周建业. 不同浓度氯化锶浸种对西瓜生长的影响[J]. 安徽农学通报, 2012, 18(23):84-93. WANG Zhen, CHEN Gang-ming, ZHOU Jian-ye. The effects of different concentrations of strontium on the seeding growth of watermelon(Citrullus lanatus L. )[J]. Anhui Agricultural Science Bulletin, 2012, 18(23):84-93. |
| [12] | Achal V, Pan X L, Zhang D Y. Bioremediation of strontium(Sr) contaminated aquifer quartz sand based on carbonate precipitation induced by Sr resistant Halomonas sp.[J]. Chemosphere, 2012, 89(6):764-768. |
| [13] | Singh S, Eapen S, Thora V, et al. Phytoremediation of 137Cs and 90Sr from solutions and low-level nuclear waste by Vetiveria zizanoides[J]. Ecotoxicol Environ Safety, 2007, 69(2):306-311. |
| [14] | Moyen C, Bonmort J, Roblin G. Early Sr2+ induced effects on membrane potential, proton pumping and ATP hydrolysis activities of plasma membrane vesicles from maize root cells[J]. Environmental and Experimental Botany, 2011, 70(2/3):289-296. |
| [15] | Moyen C, Roblin G. Uptake and translocation of strontium in hydroponically grown maize plants, and subsequent effects on tissue ion content, growth and chlorophyll a/b ratio:Comparison with Ca effects[J]. Environmental and Experimental Botany, 2010, 68(3):247-257. |
| [16] | Soudek P, Valenova S, Vavrikova Z, et al. 137Cs and 90Sr uptake by sunflower cultivated under hydroponic conditions[J]. Journal of Environmental Radioactivity, 2006, 88(3):236-250. |
| [17] | 唐永金, 罗学刚, 曾 峰, 等. 不同植物对高浓度Sr、Cs胁迫的响应与修复植物筛选[J]. 农业环境科学学报, 2013, 32(5):960-965. TANG Yong-jin, LUO Xue-gang, ZENG Feng, et al. The responses of plants to high concentrations of strontium, cesium stress and the screening of remediation plants[J]. Journal of Agro-Environment Science, 2013, 32(5):960-965. |
| [18] | 姜晓燕, 刘淑娟, 闫 冬, 等. 植物对核素锶的吸附与富集作用研究现状[J]. 癌变·畸变·突变, 2014, 26(6):463-466. JIANG Xiao-yan, LIU Shu-juan, YAN Dong. The research status of adsorptive capabilities and enrichment in plants for radionuclide Sr[J]. Carcinogenesis, Teratogenesis & Mutagenesis, 2014, 26(6):463-466. |
| [19] | 孙 涛, 张玉秀, 柴团耀. 印度芥菜(Brassica juncea L.)重金属耐性机理研究进展[J]. 中国生态农业学报, 2011, 19(1):226-234. SUN Tao, ZHANG Yu-xiu, CHAI Tuan-yao. Research progress on tolerance of Indian mustard(Brassica juncea L.) to heavy metal[J]. Chinese Journal of Eco-Agriculture, 2011, 19(1):226-234. |
| [20] | 周小勇, 仇荣亮, 胡鹏杰, 等. 镉和铅对长柔毛委陵菜体内锌的亚细胞分布和化学形态的影响[J]. 环境科学, 2008, 29(7):2028-2039. ZHOU Xiao-yong, QIU Rong-liang, HU Peng-jie, et al. Effects of cadmium and lead on subcellular distribution and chemical form of zinc in Potentilla griff ithii var. velutina[J]. Environmental Science, 2008, 29(7):2028-2039. |
| [21] | 中国环境监测总站. 中国土壤元素背景值[M]. 北京:科学出版社, 1990:87. The National Environment Monitoring Station. The atlas of China soil background values[M]. Beijing:Sciences Press, 1990:87. |
| [22] | Seregin I V, Kozhevnikova A D. Histochemical methods for detection of heavy metals and strontium in the tissues of higher plants[J]. Russian Journal of Plant Physiology, 2011, 58(4):721-727. |
| [23] | Hou M, Hu C J, Xiong L, et al. Tissue accumulation and subcellular distribution of vanadium in Brassica juncea and Brassica chinensis[J]. Microchemical Journal, 2013, 110(1):575-578. |
| [24] | Fu X, Dou C, Chen Y, et al. Subcellular distribution and chemical forms of cadmium in Phytolacca americana L.[J]. Journal of Hazardous Materials, 2011, 186(1):103-107. |
| [25] | 蒋先军, 骆永明, 赵其国. 重金属污染土壤的植物修复研究Ⅲ. 金属富集植物 Brassica juncea对锌镉的吸收和积累[J]. 土壤学报, 2002, 39(5):664-670. JIANG Xian-jun, LUO Yong-ming, ZHAO Qi-guo. Study on phytoremediation of heavy metal polluted soils:Ⅲ. Cadmium and zinc uptake and accumulation by Indian mustard(Brassica juncea)[J]. Acta Pedologica Sinica, 2002, 39(5):664-670. |
| [26] | Salt D E, Prince R C, Pickering I J, et al. Mechanisms of cadmium mobility and accumulation in Indian mustard[J]. Plant Physiology, 1995, 109(4):1427-1433. |
| [27] | 苏德纯, 黄焕忠. 印度芥菜对土壤中难溶态Cd的吸收及活化[J]. 中国环境科学, 2002, 22(4):342-345. SU De-chun, HUANG Huan-zhong. The absorption and activation of insoluble Cd in soil by Indian mustard(Brassica juncea)[J]. China Environmental Science, 2002, 22(4):342-345. |
| [28] | Lang M L, Zhang Y X, Chai T Y. Identification of genes up-regulated in response to Cd exposure in Brassica juncea L.[J]. Gene, 2005, 363(2):151-158. |
| [29] | Xu J, Chai T Y, Zhang Y X, et al. The cation-efflux transporter BjCET2 mediates zinc and cadmium accumulation in Brassica juncea L. leaves[J]. Plant Cell Reports, 2009, 28(8):1235-1242. |
| [30] | Muthukumar B, Yakubov B, Salt D E. Transcriptional activation and localization of expression of Brassica juncea putative metal transport protein BjMTP1[J]. Bmc Plant Biology, 2007, 7(1):32. |
| [31] | Weng B, Xie X, Weiss D J, et al. Kandelia obovata(S., L.) yong tolerance mechanisms to cadmium:Subcellular distribution, chemical forms and thiol pools[J]. Marine Pollution Bulletin, 2012, 64(11):2453-2460. |
| [32] | Hernandez-Allica J, Garbisu C, Becerril J M, et al. Synthesis of low molecular weight thiols in response to Cd exposure in Thlaspi caerulescens[J]. Plant Cell Environment, 2006, 29(7):1422-1429. |
| [33] | Kupper H, Lombi E, Zhao F J, et al. Cellular compartmentation of cadmium and zinc in relation to other elements in the hyperaccumulator Arabidopsis halleri[J]. Planta, 2000, 212(1):75-84. |
| [34] | Zhao Y, Wu J, Shang D, et al. Subcellular distribution and chemical forms of cadmium in the edible seaweed, Porphyra yezoensis[J]. Food Chemistry, 2015, 168:48-54. |
| [35] | Wang X, Liu Y, Zeng G, et al. Subcellular distribution and chemical forms of cadmium in Bechmeria nivea(L.)Gaud[J]. Environmental & Experimental Botany, 2008, 62(3):389-395. |
 2015, Vol. 34
2015, Vol. 34