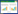文章信息
- 马兵兵, 姜昭, 叶思源, 刘晓雪, 马昱亨, 张颖
- MA Bing-bing, JIANG Zhao, YE Si-yuan, LIU Xiao-xue, MA Yu-heng, ZHANG Ying
- 狼尾草典型生理生化特征对阿特拉津胁迫的响应
- Typical Physiological and Biochemical Characteristics of Pennisetum americanum L.(cv. K. Schum) Under Atrazine Stresses
- 农业环境科学学报, 2015, 34(11): 2083-2088
- Journal of Agro-Environment Science, 2015, 34(11): 2083-2088
- http://dx.doi.org/10.11654/jaes.2015.11.007
-
文章历史
- 收稿日期: 2015-05-04
阿特拉津(2-氯-4-乙基胺-6-异丙基胺-1,3,5-三嗪)是三嗪类除草剂之一,其主要用于防除阔叶杂草和禾本科杂草[1]。随着人口的快速增长,人们需要不断增加粮食产量来满足日益增长的粮食需求,致使阿特拉津在世界各国得到了广泛的使用。据统计,2008—2009年间,仅中国就有5000~10 000 kg阿特拉津被用于粮食生产[2]。由于阿特拉津结构稳定,难降解,其在土壤中的半衰期可达4~57周[3]。Mandelbaum等[4]报道,在美国阿特拉津污染比较严重的地区,其浓度可达到10 mg·kg-1。此外,阿特拉津水溶性较强,导致其频繁地在地表水和地下水中被检出。有关阿特拉津生态毒理效应的研究结果已经证实:阿特拉津对生物体具有明显的毒性作用。土壤中残留的阿特拉津,会影响后茬敏感作物的生长,同时过量的阿特拉津进入高等植物体内会诱导同源DNA的重组和改变关键功能基因的表达[5, 6]。此外,阿特拉津还可造成哺乳动物繁殖功能异常,如减少睾酮的分泌,改变性成熟时间,降低体内雄激素的含量,提高雌激素的含量等,长期接触会导致动物乳腺癌和卵巢癌的发生[7]。因此,有效减少阿特拉津在环境中的残留量是当前环境保护领域关注的焦点。
阿特拉津污染土壤的治理技术主要有生物修复、物理修复和化学修复技术等。生物修复技术,即利用活的有机体(微生物或植物等)的生命代谢活动促进土壤中有机污染物质的降解或固定,是当前世界范围普遍认可的一种污染修复方式[8, 9, 10, 11]。植物修复由于低成本、无二次污染等特性,被认为是一种安全、可靠的修复阿特拉津污染土壤的生物修复技术,因此成功筛选对阿特拉津具有较好耐受能力的植物是开展后续植物修复污染土壤的关键。Singh等[12]发现狼牙草(Pennisetum clandestinum)能够加速土壤中阿特拉津和西马津的降解。此外,Arthur等[13]证明阿特拉津在植物根区土壤中的半衰期较无植物对照土壤缩短约75%,且根区土壤中阿特拉津的降解菌数量比对照土壤多9倍。因此,阿特拉津污染土壤的植物修复备受人们关注。
狼尾草P. americanum L.(cv. K. Schum)为多年生植物,其具有土壤适应性强,根系发达,能耐轻微碱性与干旱环境等特点。已有研究初步证实狼尾草对阿特拉津具有一定的耐受能力[14],但有关狼尾草生长及生理生化指标对阿特拉津胁迫的响应规律及相关耐受机制尚未明确。基于上述研究现状,本试验着重探讨在不同浓度梯度阿特拉津胁迫水平条件下,狼尾草生长状况(生物量、根冠比)及叶绿素、游离脯氨酸、丙二醛等与植物抗逆能力密切相关的生理生化指标含量的变化规律,以期从植物生长与生理角度进一步揭示狼尾草对阿特拉津所表现出的耐受限度,并初步探讨供试植物对阿特拉津的耐受机制,同时为利用狼尾草修复阿特拉津污染土壤提供理论依据。
1 材料与方法 1.1 试验材料土壤样品采自黑龙江省阿城区舍利屯玉米地耕层(0~20 cm),属于典型的东北黑钙土,土壤基础理化性质如下:pH 7.92,粘粒14.46%,粉粒56.17%,砂砾29.37%,有机质4.83 mg·kg-1,铵态氮16.60 mg·kg-1,硝态氮4.78 mg·kg-1,速效钾86.00 mg·kg-1,速效磷44.31 mg·kg-1。土样采集后,风干、磨碎并过2 mm筛备用。
供试植物狼尾草P. americanum L.(cv. K. Schum)种子购自江苏兴隆种子公司。阿特拉津原药(纯度≥ 97%)由山东农药研究所提供。本试验所用的其他化学试剂均为分析纯。
1.2 试验处理与幼苗培养狼尾草种子在常温条件下经蒸馏水浸泡4 h后,再用30%过氧化氢(V/V)对其进行消毒。上述种子在人工气候箱暗培养的条件下发芽过夜。将阿特拉津溶解于丙酮后,与适量的供试土壤(按质量比,土壤∶蛭石=3∶1)搅拌均匀,使供试土壤中阿特拉津的终浓度分别为0、5、10、20、50、100、200 mg·kg-1。静置于通风厨内待丙酮挥发完毕后,将各阿特拉津添加浓度处理的土壤平均分装于4个小型花盆中开展后续盆栽试验。选择发芽一致的狼尾草种子播种于上述含有不同浓度梯度的阿特拉津土壤中。幼苗培养过程中,定期浇Hoagland营养液使盆栽土壤含水量维持在土壤田间最大持水量的60%左右。幼苗在光照培养箱中,生长条件设置为:16 h光照/8 h黑暗培养,湿度为60%~70%,温度(27±1)℃/(20±1)℃(日/夜)[15]。培养28 d收获植物,用于狼尾草的生物量、根冠比、叶片叶绿素、丙二醛、游离脯氨酸含量的测定。
1.3 植物生物量的测定分别取狼尾草植株的地上部和地下部,在105 ℃条件下烘干至恒重,用于测定生物量。计算式如下:
狼尾草生物量(g 干重·株-1)=地上部生物量(干重)+地下部生物量(干重)
狼尾草根冠比=地下部生物量(干重)/地上部生物量(干重)
1.4 叶绿素含量测定供试植物叶片中叶绿素含量的测定采用乙醇-丙酮等量混合液法[16]。取待测叶片,用蒸馏水冲洗干净并擦干,将待测叶片切碎。准确称取0.5 g鲜叶碎片,放入具塞试管中,加乙醇-丙酮(1∶1,V/V)混合液25 mL,放入40 ℃的水浴锅中保温提取叶绿素直至叶片变成无色。冷却后,用上述乙醇-丙酮混合液重新定容至25 mL。以乙醇-丙酮混合液为空白对照,利用紫外分光光度计分别在663 nm和645 nm波长处检测样品提取液的吸光度。用下列公式计算叶绿素a和叶绿素b浓度:
叶绿素a浓度(mg·L-1)=12.7 OD663-2.69 OD645
叶绿素b浓度(mg·L-1)=22.9 OD645-4.68 OD663
1.5 叶片中丙二醛及脯氨酸含量的测定采用硫代巴比妥酸法测定供试植物叶片中丙二醛含量[17]。称取0.5 g鲜叶片,冰浴研磨匀浆后加入5 mL 5%硫代巴比妥酸摇匀,在沸水中煮沸提取,冷却、离心取上清液。以硫代巴比妥酸溶液为空白对照,利用紫外分光光度计分别在532、600 nm和450 nm波长处测定上清液的吸光值。MDA含量按下式计算:
CMDA(mmol·g-1 FW)=[6.452(OD532-OD600)-0.559OD450]×Vt/(Vs×FW)
式中:Vt为提取液总体积,mL;Vs为测定用提取液体积,mL;FW为样品鲜重,g。采用磺基水杨酸提取、酸性茚三酮染色法测定供试植物叶片中游离脯氨酸含量[18]。称取0.5 g鲜叶片,加入5 mL 3%磺基水杨酸,在沸水浴中提取10 min,冷却至室温。吸取2 mL上述提取液,加入2 mL冰醋酸及2 mL 2.5%酸性茚三酮,于沸水浴中加热30 min,冷却后加5 mL甲苯充分振荡,以萃取红色物质,静止分层取上清液。以甲苯为空白对照,利用紫外分光光度计于520 nm波长处测定上清液的吸光度值。通过标准曲线计算脯氨酸含量。脯氨酸含量按下式计算:
CPro(μg·g-1 FW)=X×VT /(FW×VS)
式中:X为在标准曲线中获得的2 mL测定液中脯氨酸含量;VT为提取液的总体积;VS为测定时用的提取液体积;FW为样品鲜重,g。 1.6 数据处理本研究所有数据均以平均值±标准差(mean±SD)的形式表示。借助SPSS 19.0 软件的方差分析功能,利用Duncan方法对不同处理间的数据进行显著性分析(P < 0.05)。采用Origin 9.0软件作图。
2 结果与分析 2.1 狼尾草生物量对不同浓度阿特拉津胁迫的响应供试植物狼尾草在不同浓度梯度阿特拉津胁迫水平条件下生长28 d后的生物量如图 1所示。结果表明:随着阿特拉津胁迫浓度的逐渐增大,狼尾草生物量呈逐渐下降的趋势,表现出明显的剂量-效应关系。低浓度(≤ 50 mg·kg-1)胁迫条件下,狼尾草生物量与对照处理相比差异不显著(P>0.05),其生物量保持在0.019~0.029 g干重·株-1之间,且长势很好、叶片保持鲜绿。但当阿特拉津浓度≥ 100 mg·kg-1时,胁迫处理供试植物的生物量下降至0.013~0.008 5 g 干重·株-1,与对照组相比均呈现显著降低(P < 0.05),同时出现长势矮小,叶片萎蔫等不良症状。
|
| 不同小写字母表示各处理间差异显著P < 0.05,n=4。下同Different letters show significant differences (P < 0.05) between different treatments,n=4.The same below 图 1 阿特拉津对狼尾草生物量的影响 Figure 1 Influence of atrazine on P.americanum L.(cv.K.Schum) biomass |
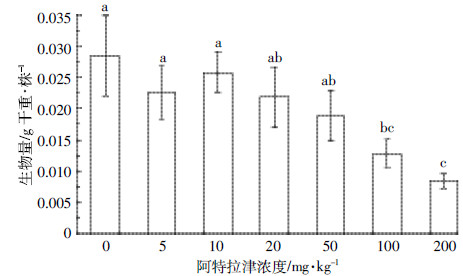
狼尾草种植28 d后,各污染胁迫处理条件下,其根冠比情况如图 2所示。在阿特拉津胁迫浓度为0~100 mg·kg-1范围内对供试植物根冠比影响不明显(P>0.05),根冠比保持在0.13~0.12之间。随着阿特拉津胁迫浓度进一步增加,狼尾草根冠比开始降低。阿特拉津浓度为200 mg·kg-1处理的根冠比与对照组相比显著降低(P < 0.05),为0.08,降幅达38.46%,说明高浓度阿特拉津对狼尾草地下部生长的抑制比地上部强。
|
| 图 2 阿特拉津对狼尾草根冠比的影响 Figure 2 Influence of atrazine on root/shoot ratios of P.americanum L.(cv.K.Schum) |
不同浓度梯度阿特拉津污染胁迫水平条件下,狼尾草叶片中叶绿素含量变化情况如图 3所示。各污染处理供试植物叶片中叶绿素a、叶绿素b和叶绿素(a+b)含量分别在20.90~21.81、5.84~6.32 mg·g-1 FW和26.73~28.13 mg·g-1 FW的区间变化。统计分析结果表明:阿特拉津胁迫浓度在0~200 mg·kg-1范围内,狼尾草叶片中三种形态的叶绿素含量与空白处理相比变化差异不显著,说明此浓度不能显著抑制狼尾草叶片中叶绿素的合成。

|
| 图 3 阿特拉津对狼尾草叶绿素含量的影响 Figure 3 Influence of atrazine on chlorophyll content of P.americanum L.(cv.K.Schum) leaves |
不同浓度阿特拉津胁迫条件下,狼尾草叶片中丙二醛(MDA)含量变化如图 4所示。低浓度阿特拉津(≤50 mg·kg-1)胁迫水平条件下,在培养期内狼尾草叶片中丙二醛含量与空白处理相比下降了13.35%~16.39%,但上述变化与空白处理相比未达到统计学显著差异水平。随着阿特拉津胁迫浓度的进一步升高,狼尾草叶片内MDA含量开始增加。当阿特拉津浓度为100 mg·kg-1时,狼尾草叶片中MDA的积累量达到最高值,其含量与对照组相比增加了46.14%,并达到了显著性差异水平。

|
| 图 4 阿特拉津对狼尾草叶片中丙二醛含量的影响 Figure 4 Influence of atrazine on MDA content of P.americanum L.(cv.K.Schum) leaves |
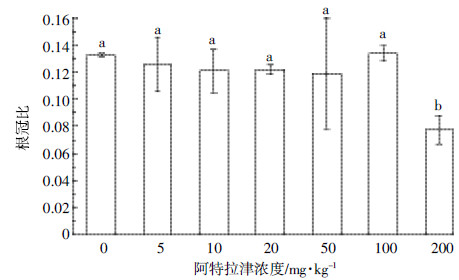
不同浓度阿特拉津胁迫条件下,狼尾草叶片中脯氨酸含量变化如图 5所示。随着阿特拉津浓度的增加,狼尾草叶片中脯氨酸含量逐渐升高,当阿特拉津胁迫浓度达到5 mg·kg-1时,狼尾草叶片中脯氨酸含量与空白处理相比开始出现统计学显著升高趋势。当土壤中阿特拉津浓度继续增加至100 mg·kg-1时,脯氨酸含量达到最大值(39.38 μg·g-1 FW),与对照处理相比增加了67.59%,说明胁迫浓度在5~100 mg·kg-1范围内时可显著增加狼尾草叶片中脯氨酸的合成。随着胁迫浓度进一步增加,狼尾草叶片中脯氨酸的含量略有下降,其与空白处理相比差异亦未达到显著性水平。
|
| 图 5 阿特拉津对狼尾草叶片中脯氨酸含量的影响 Figure 5 Influence of atrazine on proline content of P.americanum L.(cv.K.Schum) leaves |
除草剂阿特拉津因具有成本低、除草效果好等优势在保障粮食生产方面发挥着重要的作用。但随着有关阿特拉津生态毒理效应研究的不断深入,已有研究表明:除草剂阿特拉津不但对其目标杂草具有良好的防除效果,同时也会通过增加植物体内活性氧自由基(ROS)的数量进而对非目标植物产生氧化损伤,特别是对一些具有经济价值的作物,如水稻、大豆等的生长造成不良影响。因此,更加全面地了解其生态毒理效应并减少其对生物,特别是植物的危害受到了广泛的关注。植物修复是当前一种普遍认可的有机污染以及重金属污染土壤修复技术,而筛选并获取对目标污染物具有良好耐受能力的植物品种,同时较为全面地掌握所筛选的抗性植物对于污染物的耐受阈值,是开展后续有关污染土壤植物修复的关键环节。本研究以大多数情况下自然污染土壤中阿特拉津含量低于10 mg·kg-1[4]为基础,深入探讨了供试植物在更大范围浓度梯度的变化,在阿特拉津污染土壤(人为拌土)和空白处理(自然污染土壤)下,考察狼尾草典型生理生化指标对阿特拉津胁迫的响应规律。
植物在环境胁迫条件下生物量的大小可以直观反映其对环境胁迫的耐受能力的强弱,生物量越大说明植物忍受环境胁迫的能力越强[19]。图 1的结果表明仅当阿特拉津胁迫浓度≥ 100 mg·kg-1时,才能对狼尾草的生物量表现出显著性的抑制作用,说明土壤中阿特拉津含量小于100 mg·kg-1时,对狼尾草的生长没有明显的抑制作用。Wang 等[20]研究了丁草胺胁迫对黑麦草幼苗生物量的影响,发现仅5 mg·L-1的丁草胺就会显著降低黑麦草的生物量。上述结果反映出狼尾草具有较好的阿特拉津耐受能力。
根冠比是植物地下部与地上部干重的比值,适宜的根冠比有助于植物进行光合作用及吸收营养成分。研究植物在受到环境胁迫过程中其根冠比的变化情况,可以在一定程度上比较出植物地上部分和地下部分对环境胁迫的耐受或敏感程度差异。本研究发现:200 mg·kg-1阿特拉津胁迫显著降低了狼尾草的根冠比,说明此胁迫条件下,狼尾草的根系受到了更为严重的影响,也可以反映狼尾草的根系较叶部对阿特拉津胁迫更为敏感,推测其原因主要是由于阿特拉津通过根部吸收进入到狼尾草体内,因而阿特拉津对于狼尾草根部的胁迫要更为直接。另外,与上述研究结果相似,Wang等[20]研究了丁草胺胁迫对黑麦草幼苗的影响,结果表明黑麦草的根部对丁草胺的毒性更敏感。此外,张坤[21]研究阿特拉津对皇竹草的生物量抑制没有选择性,对地上和地下部分都存在一定的抑制作用,说明不同植物对除草剂胁迫的响应规律与耐受力不同。同时,不同植物各部位对除草剂的敏感性或耐受性存在着较为明显的差异。
有关植物逆境生理方面的研究表明,逆境条件下,植物体内活性氧自由基的数量会发生变化,导致膜脂过氧化增加并伴随着MDA含量升高、原生质膜透性增大,最终使植物受到损伤[22, 23]。因此,MDA含量经常被用来反映植物细胞膜受逆境环境损伤程度的大小[24]。本研究发现:狼尾草叶片内MDA含量在低浓度阿特拉津(≤ 50 mg·kg-1)胁迫28 d后有小幅度下降的趋势,但变化不明显。这可能是由于轻度污染胁迫激活了狼尾草体内的抗氧化防御系统,进而降低阿特拉津胁迫对其造成的氧化损伤,并最终表现为狼尾草体内MDA含量小幅下降。上述发现和推断与杨卫东等[25]研究的Cd抗性植物——旱柳体内MDA含量在Cd污染胁迫条件下也能够维持相对稳定的结果一致。另外,随着阿特拉津污染胁迫浓度的进一步增加(100 mg·kg-1),狼尾草体内MDA含量较空白处理相比显著升高,说明此时阿特拉津已对狼尾草造成膜质过氧化损伤。这一结果与前文中阿特拉津胁迫浓度≥ 100 mg·kg-1时狼尾草生物量受到显著抑制的研究结果相吻合,同时说明狼尾草对阿特拉津的抗性也存在一定的耐受阈值。这表明:通过考察逆境条件下植物体内丙二醛含量可以作为抗性植物筛选考察的关键指标之一。
本实验研究了不同浓度阿特拉津胁迫条件下狼尾草植物叶片中脯氨酸含量。脯氨酸不仅是一种必需氨基酸,而且也是在响应各种环境胁迫条件下会产生的一种重要的抗氧化剂,在环境胁迫条件下植物会通过增加其体内脯氨酸含量,进而激活多种生理和分子响应,如调节细胞渗透压,清除活性氧自由基,保持膜的完整性以及抗氧化酶和蛋白质的稳定性等,最终使其耐受逆境环境胁迫[26, 27, 28]。狼尾草体内脯氨酸含量的增加可能与阿特拉津胁迫下诱导的氧化损伤产生的膜质过氧化有关。因此,脯氨酸的积累可以作为狼尾草在阿特拉津胁迫下的响应指标之一。
4 结论(1)供试植物狼尾草在≤50 mg·kg-1阿特拉津污染土壤中生长良好。当胁迫浓度≥100 mg·kg-1时,生物量受到显著抑制。根冠比在200 mg·kg-1污染水平下与对照组相比才达到显著性差异水平,说明供试植物狼尾草具有阿特拉津耐受能力。但根部受阿特拉津胁迫较叶部更为敏感。
(2)狼尾草叶片中叶绿素含量对阿特拉津胁迫不敏感,其在0~200 mg·kg-1污染水平下与空白处理相比未发生显著性变化。
(3)高浓度阿特拉津(≥100 mg·kg-1)胁迫才会导致叶片中MDA含量的积累,且与对照组相比达到显著性水平;随着阿特拉津胁迫浓度的增加,狼尾草叶片中脯氨酸积累性也随之增加,当阿特拉津胁迫浓度为100 mg·kg-1时,脯氨酸含量积累量达到最大。
| [1] | Moore M T, Kröger R. Effect of three insecticides and two herbicides on rice(Oryza sativa) seedling germination and growth[J]. Archives of Environmental Contamination and Toxicology, 2010, 59(4):574-581. |
| [2] | Shu F. Prediction and analysis of pesticide consumption in China[J]. Plant Protection Science, 2009, 29:40-42. |
| [3] | 李宏园, 马 红, 陶 波. 除草剂阿特拉津的生态风险分析与污染治理[J]. 东北农业大学学报, 2006, 37(4):552-556.LI Hong-yuan, MA Hong, TAO Bo. The ecological risk analysis and pollution control of herbicide atrazine[J]. Journal of Northeast Agricultural university, 2006, 37(4):552-556. |
| [4] | Mandelbaum R T, Wackett L P, Allan D L. Mineralization of the s-triazine ring of atrazine by stable bacterial mixed cultures[J]. Applied and Environmental Microbiology, 1993, 59(6):1695-1701. |
| [5] | Besplug J, Filkowski J, Burke P, et al. Atrazine induces homologous recombination but not point mutation in the transgenic plant-based biomonitoring assay[J]. Archives of Environmental Contamination and Toxicology, 2004, 46(3):296-300. |
| [6] | Lu Y C, Yang S N, Zhang J J, et al. A collection of glycosyltransferases from rice(Oryza sativa) exposed to atrazine[J]. Gene, 2013, 531(2):243-252. |
| [7] | Chapin R E, Stevens J T, Hughes C L. Atrazine:Mechanisms of hormonal imbalance in femole SD rats[J]. Funda Appl Toxicol, 1996, 29(1):1-17. |
| [8] | 尤民生, 刘 新. 农药污染的生物降解与生物修复[J]. 生态学杂志, 2004, 23(1):73-77.YOU Min-sheng, LIU Xin. Biodegradation and bioremediation of pesticide pollution[J]. Journal of Ecology, 2004, 23(1):73-77. |
| [9] | 黄 艺, 姜学艳, 陶 澍. 菌根真菌对土壤有机污染物的生物降解[J]. 土壤与环境, 2002, 11(3):221-226.HUANG Yi, JIANG Xue-yan, TAO Shu. Mycorrhizal fungi on soil organic pollutants biodegradation[J]. Soils and Environment, 2002, 11(3):221-226. |
| [10] | 沈德中. 污染土壤的植物修复[J]. 生态学杂志, 1998, 17(2):59-64, 49.SHEN De-zhong. Phytoremediation of contaminated soils[J]. Journal of Ecology, 1998, 17(2):59-64, 49. |
| [11] | Alkorta I, Garbisu C. Phytoremediation of organic contaminants in soils[J]. Bioresource Technology, 2001, 79(3):273-276. |
| [12] | Singh N, Megharaj M, Kookana R S, et al. Atrazine and simazine degradation in Pennisetum rhizosphere[J]. Chemosphere, 2004, 56(3):257-263. |
| [13] | Arthur E L, Perkovich B S, Anderson T A, et al. Degradation of an atrazine and metolachlor herbicide mixture in pesticide-contaminated soils from two agrochemical dealerships in Iowa[J]. Water, Air, and Soil Pollution, 2000, 119(1-4):75-90. |
| [14] | Ma Y X, Zhang Y, Du J, et al. Research on three resistant plants remediating atropine contaminated soil[J]. Procedia Environmental Sciences, 2012, 12:238-242. |
| [15] | Dutilleul C, Garmier M, Noctor G, et al. Leaf mitochondria modulate whole cell redox homeostasis, set antioxidant capacity, and determine stress resistance through altered signaling and diurnal regulation[J]. The Plant Cell Online, 2003, 15(5):1212-1226. |
| [16] | Lichtenthaler H K. Chlorophylls and carotenoids:Pigments of photosynthetic biomembranes[J]. Methods Enzymol, 1987, 148:350-382. |
| [17] | Chen Y, Wu C, Zhang H, et al. Empirical estimation of pollution load and contamination levels of phthalate esters in agricultural soils from plastic film mulching in China[J]. Environmental Earth Sciences, 2013, 70(1):239-247. |
| [18] | Shevyakova N I, Bakulina E A, Kuznetsov V V. Proline antioxidant role in the common ice plant subjected to salinity and paraquat treatment inducing oxidative stress[J]. Russian Journal of Plant Physiology, 2009, 56(5):663-669. |
| [19] | 杜中军, 翟 衡, 罗新书, 等. 苹果砧木耐盐性鉴定及其指标判定[J]. 果树学报, 2002, 19(1):4-7.DU Zhong-jun, ZHAI Heng, LUO Xin-shu, et al. Salt resistance identification of apple root stock and the determination of its indicators[J]. Journal of Fruit Science, 2002, 19(1):4-7. |
| [20] | Wang S R, Li H S, Lin C X. Physiological, biochemical and growth responses of Italian ryegrass to butachlor exposure[J]. Pesticide Biochemistry and Physiology, 2013, 106:21-27. |
| [21] | 张 坤. 阿特拉津对皇竹草生长和活性氧代谢的影响[D]. 昆明:云南农业大学, 2012.ZHANG Kun. Atrazine's influence on Pennisetum hydridum growth and active oxygen metabolism[D]. Kunming:Yunnan Agricultural University, 2012. |
| [22] | 陆新华, 孙德权, 叶春海, 等. 低温胁迫下菠萝幼苗生长与生理特性变化[J]. 西北植物学报, 2010, 30(10):2054-2060.LU Xin-hua, SUN De-quan, YE Chun-hai, et al. Pineapple seedling growth and physiological characteristics changes under low temperature stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(10):2054-2060. |
| [23] | 马玉华, 王永红, 王 荔, 等. 高温胁迫对苹果叶片膜脂过氧化及抗坏血酸的影响[J]. 贵州农业科学, 2010, 38(8):176-178, 183.MA Yu-hua, WANG Yong-hong, WANG Li, et al. High temperature stress's influence on apple leaf membrane lipid peroxidation and ascorbic acid[J]. Guizhou Agricultural Science, 2010, 38(8):176-178, 183. |
| [24] | 张志安, 张美善, 蔚荣海. 植物生理学实验指导[M]. 北京:中国农业技术出版社, 2004:138-141.ZHANG Zhi-an, ZHANG Mei-shan, WEI Rong-hai. Plant physiology experiment instruction[M]. Beijing: China's Agricultural Technology Press, 2004:138-141. |
| [25] | 杨卫东, 陈益泰. 镉胁迫对旱柳细胞膜透性和抗氧化酶活性的影响[J]. 西北植物学报, 2008, 28(11):2263-2269.YANG Wei-dong, CHEN Yi-tai. Effects of cadmium stress on plants cell membrane permeability and activity of antioxidant enzymes[J]. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(11):2263-2269. |
| [26] | Ashraf M, Foolad M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany, 2007, 59(2), 206-216. |
| [27] | Alia, Pardha Saradhi P. Proline accumulation under heavy metal stress[J]. Journal of Plant Physiology, 1991, 138(5):554-558. |
| [28] | Gadallah M A A. Effects of proline and glycine betaine on Vicia fabaresponses to salt stress[J]. Biologia Plantarum, 1999, 42(2):247-249. |
 2015, Vol. 34
2015, Vol. 34