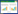文章信息
- 龚双姣, 王萌, 龙奕, 刘珊珊, 田斌, 马陶武
- GONG Shuang-jiao, WANG Meng, LONG Yi, LIU Shan-shan, TIAN Bin, MA Tao-wu
- 沉积物中人工纳米颗粒对BDE-47生态毒性的影响
- Impact of Engineered Nanoparticles on Ecotoxicity of BDE-47 in Sediments
- 农业环境科学学报, 2015, 34(11): 2089-2096
- Journal of Agro-Environment Science, 2015, 34(11): 2089-2096
- http://dx.doi.org/10.11654/jaes.2015.11.008
-
文章历史
- 收稿日期: 2015-05-21
人工纳米颗粒(Engineered nanoparticles,NPs)由于具有独特的性质而被大量地生产并广泛用于各种消费品、工业产品、保健技术和环境保护等领域[1]。通过人工纳米材料的直接使用、含有纳米材料产品的使用、以及经由污水处理、垃圾焚烧、填埋和回收等过程,NPs会不可避免地释放到环境中,这已成为基本的科学共识[2]。目前,NPs可能已经大范围地进入环境中,从而导致生物受到NPs的暴露,NPs的潜在环境和人类健康风险正日益成为人们关注的重要问题[3]。然而,由于人们对NPs潜在环境风险认识的不足,目前尚没有任何国家建立针对人工纳米材料的生产、运输、使用、销售、处置和风险管理的法律法规。金属氧化物纳米颗粒和碳纳米管(Carbon nanotubes,CNTs)分别是当前第二和第三大生产和使用的人工纳米颗粒,用途非常广泛[4]。现有研究显示,某些金属氧化物纳米颗粒(如TiO2纳米颗粒)和CNTs本身的生态毒性风险似乎并不大,但由于具有很高的吸附能力和在环境中广泛分布,它们会成为环境中持久性有机污染物的良好载体[5, 6, 7, 8]。有机污染物被NPs吸附后其生物有效性和毒性都会发生改变,因此了解NPs与共存有机污染物的相互作用对于合理评价NPs和共存有机污染物的潜在生态风险显得尤为重要。
从环境化学的角度,关于NPs和共存有机污染物相互作用的研究已有很多报道[5, 6, 9, 10, 11]。从生态毒理学角度研究NPs和共存有机污染物相互作用的潜在后果也有一些报道,但大多是基于水介质的[12, 13, 14],基于沉积物的报道则很少[15],而且仅限于河口沉积物。目前,在淡水沉积物中NPs对持久性有机污染物生态毒性影响的研究还未见报道。沉积物是水生态系统中各种有机污染物的受体[16],它同样也是NPs的最终沉积库,底栖动物是NPs和有机污染物复合污染的主要生态风险受体[17]。多溴联苯醚(PBDEs)是典型的持久性有机污染物(POPs),PBDES主要用作阻燃剂,在众多的PBDE同系物中,2,2′,4,4′-四溴联苯醚(BDE-47)约占PBDE总量的70%[18],也是毒性最强的[19]。
铜锈环棱螺(Bellamya aeruginosa)是我国淡水生态系统中具有重要生态价值的腹足类软体动物[20],是进行淡水沉积物生态毒理学研究的重要候选物种[21]。本研究通过向人工沉积物中添加非毒性浓度的不同管径多壁碳纳米管(Multi-walled carbon nanotubes,MWCNTs)和两种金属氧化物纳米颗粒(Al2O3-NPs、TiO2-NPs)以及不同浓度BDE-47,利用铜锈环棱螺进行沉积物慢性生物毒性测试,测定其肝胰脏中抗氧化防御系统关键指标——超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽-S-转移酶(Glutathione-S-transferase,GST)活性和脂质氧化损伤终产物丙二醛(Malondialdehyde,MDA)含量的变化,探讨沉积物中非毒性浓度MWCNTs和金属氧化物纳米颗粒对BDE-47生态毒性的影响,以期为合理评价NPs的环境风险提供科学依据。
1 材料与方法 1.1 实验材料实验所用动物为实验室人工驯化培养的铜锈环棱螺,培养方法见Ma等[21],暴露实验选用的铜锈环棱螺为成年同龄个体,壳长(20.98±1.75) mm、体重(2.13±0.38) g。实验所用沉积物为采自湖南吉首德夯自然保护区内的无污染土壤制作的人工沉积物,采集与处理方法见Ma等[21]。经分析测定,该人工沉积物的总有机碳(TOC)4.8%,pH8.01,总氮(TN)987 mg·kg-1,总磷(TP)1145 mg·kg-1,重金属Cr、Ni、Cu、Zn、Cd、Pb的含量分别为58.62、32.14、16.22、111.36、0.35、25.26 mg·kg-1,均低于淡水沉积物质量指南中的生物毒性阈值效应浓度[22];未检测到多溴联苯醚类化合物。
1.2 仪器与试剂电感耦合等离子体发射光谱仪(ICP-OES,iCAP6300 Radial,ThermoFisher Scientific,USA);TGL-16M台式高速冷冻离心机(长沙平凡);UV-757CRT紫外可见分光光度计(上海精科);数显恒温水浴锅(上海星江仪器有限公司);扫描电镜(日本日立SU8020);电动搅拌机(酒思JS-601);玻璃匀浆器。
两种管径大小的多壁碳纳米管(北京德科岛金科技有限公司):小管径8~15 nm,长度0.5~2 μm,纯度95%,比表面积>233 m2·g-1;大管径20~30 nm,长度0.5~2 μm,纯度95%,比表面积>110 m2·g-1。三氧化二铝纳米颗粒(Al2O3-NPs,北京博宇高科新材料技术有限公司):粒径13 nm,纯度99.9%;二氧化钛纳米颗粒(TiO2-NPs,北京博宇高科新材料技术有限公司):粒径10 nm,纯度99.9%。四种纳米颗粒的扫描电镜照片如图 1所示。2,2′,4,4′-四溴联苯醚(BDE-47),分子式C12H6Br4O,CAS# 5436-43-1,纯度98.5%,购自AccuStandard公司;蛋白酶抑制剂苯甲基磺酰氟(PMSF)购自Genview公司;考马斯亮蓝-G250、盐酸羟胺、黄嘌呤、黄嘌呤氧化酶、谷脱甘肽、1-氯-2,4-二硝基苯(CDNB)、硫代巴比妥酸,均购自南京建成生物工程研究所;蛋白酶抑制剂苯甲磺酰氟,Genview公司;蔗糖、Tris、EDTA-Na2及其他试剂均为国产分析纯。
|
| 图 1 多壁碳纳米管(A:管径8~15 nm;B:管径20~30 nm)、三氧化二铝纳米颗粒(C)和二氧化钛纳米颗粒(D)的扫描电镜照片 Figure 1 Scanning electron micrographs of multi-walled carbon nanotubes (A:tube diameter 8~15 nm;B:tube diameter 20~30 nm),Al2O3-NPs (C),and TiO2-NPs (D) |
实验设计:共设1个空白对照组和15个处理组,每个处理3个重复,即BDE-47单独处理组(100、500、2000 ng·g-1)[23];两种管径(8~15 nm和20~30 nm)的MWCNTs无毒性浓度(10 mg·g-1)[11]单独处理组;两种管径的MWCNTs分别与不同浓度BDE-47的联合处理组;Al2O3-NPs、TiO2-NPs的无毒性添加浓度(5 mg·g-1)[24, 25]单独及分别与不同浓度BDE-47的组合处理。
沉积物加标处理:参照王萌等[26]的方法进行加标处理,先加纳米颗粒,再加BDE-47。每个处理组称取过100目尼龙筛的干沉积物1800 g,按照实验设计分别加入所需数量的纳米颗粒干粉,放入搅拌机中连续搅拌1 h,然后转入预先备好的洁净带盖小塑料桶中。用丙酮配置10 mg·mL-1的BDE-47储备液,将之前混匀的沉积物与所需数量的BDE-47储备液按1∶1的体积比进行混合(不同浓度处理组中BDE-47储备液体积不足部分以去离子水补充),对纳米颗粒单独处理组则直接用去离子水进行混合,然后用干净的小木铲搅拌至少24 h。空白对照组沉积物除不加纳米颗粒外,按相同方式处理。沉积物加标处理完成后在通风橱中室温静置14 d,期间每隔3 d对加标沉积物充分搅拌1次,以使加标沉积物达到理化平衡[27]。
暴露实验:按马陶武等[28]的方法进行暴露实验。先将处理好的加标沉积物加到体积为4 L的玻璃测试缸中,按沉积物与上覆水1∶4的体积比,加入去离子水,然后将测试缸置于一个水浴控温的有机玻璃容器中,静置3 d。将所选实验螺随机分组,放入每个测试缸中,每缸12只,以静水充氧的方式暴露21 d,光照周期为12 h(白昼)/12 h(黑暗),水温为(24±1)℃,对每个测试缸加盖尼龙网,中间留一个直径为5 cm的圆孔,以供喂食。每3 d更新1次上覆水并投喂少许观赏鱼饵料(三元牌),及时捞出死亡个体。暴露结束后,对于每个实验螺,先轻轻用钳子夹破螺尖,用镊子取出消化腺,分离肝胰脏并称重,置液氮中保存备测。在整个暴露实验期间,每个测试缸中螺的存活率都在90%以上,符合国际通行的沉积物毒性测试标准。
1.4 肝胰脏中SOD、MDA和GST的测定将肝胰脏样品放入10 mL玻璃匀浆管中,按1∶9(m∶V)的比例加入含0.000 1 mol·L-1 EDTA-2Na、0.01 mol·L-1蔗糖和0.8%NaCl的 Tris-HCl匀浆缓冲液(0.01 mol·L-1、pH=7.4),同时加入蛋白酶抑制剂PMSF溶液(在匀浆缓冲液中的浓度为0.001 mol·L-1)。冰浴研磨匀浆后转入0.5 mL离心管,于4 ℃、2500 r·min-1离心10 min,先取上清液20 μL(即浓度为10%的匀浆上清液),用匀浆缓冲液稀释到1%,用于测定SOD活性;再取上清液220 μL,用于测定GST活性;剩余的匀浆液在10 000 r·min-1继续离心20 min,取上清液,稀释到1%,用于测定MDA含量。
采用羟胺法测定SOD活性,在550 nm下测吸光值,定义为1 mg蛋白在1 mL反应液中SOD抑制率达到50%时所对应的SOD量为1个酶活力单位(U),以U·mg-1蛋白表示;采用CDNB法测定GST活性,在412 nm下测吸光度,定义为1 mg蛋白在25 ℃反应1 min,扣除非酶促反应,浓度降低1 μmol·L-1为1个酶活力单位,以U·mg-1蛋白表示;采用硫代苯巴比妥酸(TBA)比色法测定MDA含量,在532 nm下测吸光值,以nmol·mg-1蛋白表示;采用考马斯亮蓝染色法(在595 nm下测吸光值)测定组织蛋白含量。
1.5 统计分析实验数据采用SPSS 20.0进行统计分析。对实验数据先进行正态分布检验,然后利用单因素方差分析法(ANOVA)和多重比较检验法(LSD)进行组间差异显著性检验,差异显著性水平为0.05。
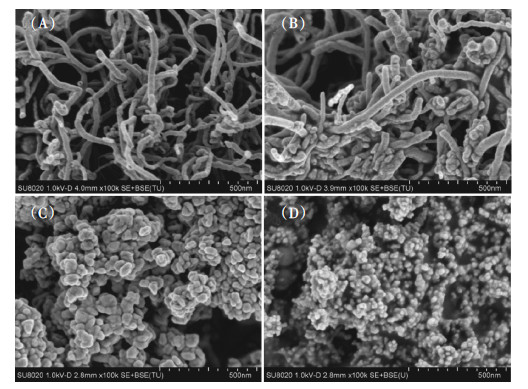
2 结果与分析 2.1 不同管径MWCNTs存在时BDE-47对铜锈环棱螺肝胰脏SOD、MDA和GST的影响不同管径MWCNTs和不同浓度BDE-47加标沉积物21 d暴露后铜锈环棱螺肝胰脏3种氧化胁迫生物标志物的变化如图 2所示。
|
| 不同处理间无相同字母表示差异显著,P < 0.05。下同Bars labeled with different letters differ significantly,P < 0.05.The same below 图 2 不同管径MWCNTs和不同浓度BDE-47加标沉积物21 d暴露后铜锈环棱螺肝胰脏的SOD (A)活性、MDA (B)含量和GST (C)活性的变化 Figure 2 Hepatopancreatic SOD (A) activities and MDA (B) levels and GST (C) activities in Bellamya aeruginosa following 21-d exposure to sediments spiked with BDE-47 and/or MWCNTs |
由图 2A可知,在BDE-47单独处理组,SOD活性随着BDE-47浓度的升高表现出先上升后下降的变化趋势。与空白对照组相比,低浓度(100 ng·g-1)BDE-47对SOD活性没有影响,中等浓度(500 ng·g-1)BDE-47显著增加SOD活性(上升约32%),高浓度(2000 ng·g-1)BDE-47则显著降低SOD活性(下降约22%)。两种管径MWCNTs单独处理均不影响SOD活性。在MWCNTs与BDE-47联合处理组,与相应的BDE-47单独处理组相比,小/大管径MWCNTs与低浓度BDE-47联合处理均不影响SOD活性,与中等浓度BDE-47联合处理则显著降低SOD活性(分别下降约19%和9%),与高浓度BDE-47联合处理则大幅提高SOD活性(分别升高约114%和76%),很显然,小管径MWCNTs与BDE-47联合处理对SOD活性的影响大于大管径MWCNTs与BDE-47联合处理。
由图 2B可知,在BDE-47单独处理组,MDA含量随着BDE-47浓度的升高而增加。与空白对照组相比,低浓度(100 ng·g-1)BDE-47对MDA含量没有影响,中、高浓度(500、2000 ng·g-1)BDE-47显著提高MDA含量(分别上升约17%和57%)。在MWCNTs与BDE-47联合处理组,与相应的BDE-47单独处理组相比,小/大管径MWCNTs与低浓度BDE-47联合处理均不影响MDA含量,与中、高浓度BDE-47联合处理均显著降低MDA含量,且不同管径MWCNTs处理之间无差异,MDA含量均分别下降约9%和22%。
由图 2C可知,无论是无MWCNTs还是有MWCNTs处理,GST活性均随BDE-47浓度的升高而显著下降。在MWCNTs与BDE-47联合处理组,与相应的BDE-47单独处理组相比,小/大管径MWCNTs与低浓度BDE-47联合处理均不影响GST活性,与中、高浓度BDE-47联合处理GST活性均显著升高,而且不同管径MWCNTs处理之间无差异,GST活性分别升高约34%和18%。
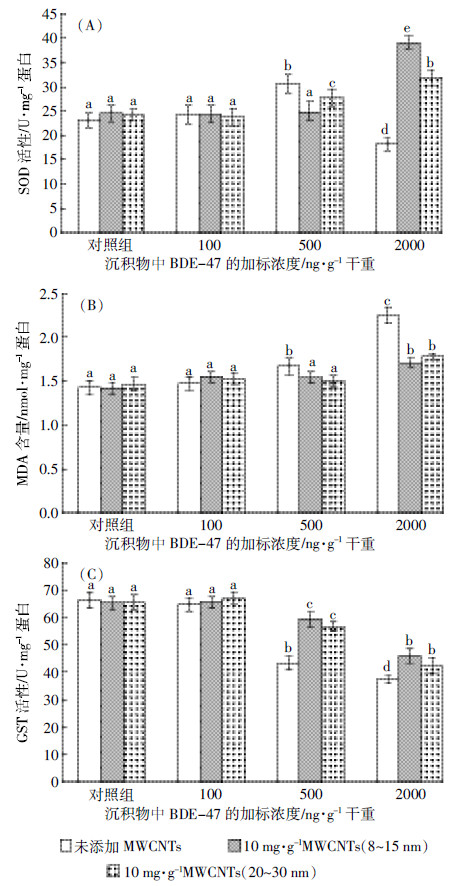
2.2 Al2O3-NPs和TiO2-NPs存在时BDE-47对铜锈环棱螺肝胰脏SOD、MDA和GST的影响Al2O3-NPs、TiO2-NPs分别与不同浓度BDE-47加标沉积物21 d暴露后铜锈环棱螺肝胰脏3种氧化胁迫生物标志物的变化如图 3所示。
|
| 图 3 Al2O3-NPs和TiO2-NPs分别与不同浓度BDE-47加标沉积物21 d暴露后铜锈环棱螺肝胰脏的SOD (A)活性、MDA (B)含量和GST (C)活性的变化 Figure 3 Hepatopancreatic SOD (A) activities and MDA (B) levels and GST (C) activities in Bellamya aeruginosa following 21-d exposure to sediments spiked with BDE-47 and/or Al2O3-NPs or TiO2-NPs |
由图 3A可知,BDE-47单独处理组的SOD活性的变化趋势与图 1基本一致。在非毒性浓度的金属氧化物纳米颗粒与BDE-47联合处理组,SOD活性均随BDE-47浓度的升高而显著下降。与相应的BDE-47单独处理组相比,Al2O3-NPs和TiO2-NPs分别与低浓度BDE-47联合处理均不影响SOD活性,分别与中、高浓度BDE-47联合处理则显著降低SOD活性(Al2O3-NPs分别导致下降约38%和19%;TiO2-NPs分别导致下降约46%和33%),而且均显著低于对照组,非毒性浓度TiO2-NPs与BDE-47联合处理对SOD活性的影响大于非毒性浓度Al2O3-NPs。
由图 3B可知,BDE-47单独处理组和金属氧化物纳米颗粒与BDE-47联合处理组的MDA含量均随BDE-47浓度的升高而显著升高。在联合处理组中,与相应的BDE-47单独处理组相比,仅TiO2-NPs与高浓度BDE-47联合处理引起MDA含量显著升高(上升约22%),而Al2O3-NPs与不同浓度BDE-47联合处理均不影响MDA含量。
由图 3C可知,BDE-47单独处理组和金属氧化物纳米颗粒与BDE-47联合处理组的GST活性均随BDE-47浓度的升高总体上表现出下降趋势。在联合处理组中,与相应的BDE-47单独处理组相比,Al2O3-NPs和TiO2-NPs分别与低浓度BDE-47联合处理均不影响GST活性,与中、高浓度BDE-47联合处理均显著降低GST活性(Al2O3-NPs分别导致下降约11%和13%;TiO2-NPs分别导致下降约22%和32%),而且均显著低于对照组;非毒性浓度TiO2-NPs与BDE-47联合处理对GST活性的影响大于非毒性浓度Al2O3-NPs。
3 讨论生物组织细胞中抗氧化防御系统的关键酶、脂质过氧化产物以及解毒酶类常被用作指示生物机体受到污染胁迫的敏感生物标志物[29, 30]。当生物体受到外源性污染物胁迫时组织细胞中会产生过多的活性氧自由基(ROS),超氧化物歧化酶(SOD)作为抗氧化防御系统的关键酶对于消除细胞中多余ROS(特别是O-2·)起到重要作用,轻微胁迫会诱导SOD活性升高,起到保护作用,但胁迫超过一定限度会破坏细胞抗氧化系统的平衡,从而抑制SOD的作用,造成SOD活性下降,SOD活性的变化是指示生物体受到外源性化学物质氧化胁迫的重要标志[31]。丙二醛(MDA)是ROS攻击生物膜中多不饱和脂肪酸引发脂质过氧化作用后的产物,MDA含量的变化间接反应生物膜受到ROS损伤的程度,因此MDA含量的变化可以当作细胞氧化损伤的生物指示[30]。在生态毒理学研究中,常将SOD和MDA结合起来测定,SOD反映机体消除ROS的能力,MDA反映机体细胞受ROS攻击的严重程度。谷胱甘肽-S-转移酶(GST)是动物肝脏重要的Ⅱ相解毒酶,可以对各种脂溶性污染物进行生物转化以防止细胞膜受到脂质过氧化损伤[32]。总之,SOD、MDA、GST可以作为淡水螺类受污染胁迫的有效生物标志物[30, 33]
已有一些研究显示,沉积物或土壤介质中的CNTs可降低有机污染物的毒性。例如:沉积物中较高浓度(10 mg·g-1)的SWCNT可以降低PCBs对两种河口底栖动物(Americamysis bahia和Ampelisca abdita)的毒性[15];土壤中MWCNTs的存在显著降低五氯酚钠对赤子爱胜蚓(Eisenia fetida)的毒性[34]。本研究显示,沉积物中BDE-47单独作用下,低浓度(100 ng·g-1)BDE-47对铜锈环棱螺肝胰脏SOD活性、MDA含量和GST活性没有影响,500 ng·g-1的BDE-47显著增加SOD活性和MDA含量,同时降低GST活性,2000 ng·g-1的BDE-47则显著降低SOD活性、显著升高MDA含量,同时降低GST活性。这说明沉积物中较高浓度的BDE-47对铜锈环棱螺肝胰脏造成明显的氧化胁迫甚至氧化损伤。与BDE-47单独作用相比,两种管径的MWCNTs与较高浓度BDE-47联合作用下,肝胰脏SOD活性显著提高,MDA含量显著降低,GST活性显著上升,说明两种管径MWCNTs都显著降低了BDE-47对铜锈环棱螺的毒性。因此,本研究结果与前人基于沉积物或土壤介质的研究结论是一致的。很多研究表明在土壤或沉积物介质中CNTs可以降低共存有机污染物的生物积累。Ferguson等[9]研究发现无毒性浓度的SWCNTs可以显著降低疏水性有机污染物在海生多毛类搓稚虫(Streblospio benedicti)体内的生物积累;Petersen等[10]的研究发现土壤中无毒性浓度的CNTs显著减少芘在赤子爱胜蚓(Eisenia foetida)体内生物积累;Xia等[11]观察到沉积物中MWCNTs显著降低全氟化合物在底栖动物羽摇蚊幼虫(Chironomus plumosus)体内的生物积累;Shen等[35]观察到一定浓度的MWCNTs降低羽摇蚊对PAH的吸收。因此,沉积物或土壤中CNTs的存在所引起的共存有机污染物生物积累的降低可能是导致其毒性降低的直接原因。然而共存有机污染物生物积累降低的原因可能是复杂的:一方面,有机污染物被CNTs吸附后造成其在沉积物间隙水中的浓度大幅降低从而减少生物积累;另一方面,CNTs吸附有机污染物后可能极大地促进了有机污染物的降解,导致CNTs与污染物的复合物被生物摄取的数量大大降低。Shrestha等[36]的研究证实了这一点,当土壤中MWCNTs浓度较高时芘的生物降解作用增强,在本研究中,后者可能是MWCNTs降低BDE-47对铜锈环棱螺毒性的重要原因。
本研究表明,就SOD活性的变化而言,小管径MWCNTs的影响大于大管径MWCNTs,但就MDA含量和GST活性的变化而言,两种管径MWCNTs的影响无差异。这说明在相同MWCNTs浓度情况下,SOD对MWCNTs与BDE-47联合毒性的指示作用比MDA和GST更为灵敏,同时说明沉积物小管径MWCNTs对有机污染物毒性的影响稍大于大管径MWCNTs。这是因为小管径MWCNTs具有更大的表面积,更大的吸附容量[7],Xia等[11]的研究指出沉积物中小管径(10 nm)MWCNTs可以显著降低全氟化合物在羽摇蚊幼虫(Chironomus plumosus)体内的生物积累,进一步证明了这一点。
到目前为止,有关沉积物中金属氧化物纳米颗粒对有机污染物生态毒性影响的研究还未见报道。本研究显示,沉积物中非毒性浓度的Al2O3-NPs和TiO2-NPs对低浓度(100 ng·g-1)BDE-47的毒性没有影响,但显著增加较高浓度(500、2000 ng·g-1)BDE-47对铜锈环棱螺的毒性,金属氧化物纳米颗粒在一定程度上会增强共存有机污染物的毒性,我们推断金属氧化物纳米颗粒吸附共存有机污染物后并不能促进有机污染物的降解,二者的复合物被生物摄取后在消化道中大量释放,增加生物积累,导致毒性增强。这与CNTs与共存有机污染物相互作用的情况可能不同。本研究还显示,非毒性浓度TiO2-NPs对BDE-47毒性的影响略大于非毒性浓度Al2O3-NPs,这与两种纳米颗粒的粒径不同有关,本研究采用的TiO2-NPs粒径小于Al2O3-NPs。
4 结论两种管径大小的MWCNTs不影响低浓度(100 ng·g-1)BDE-47对铜锈环棱螺的毒性,但显著降低较高浓度(500、2000 ng·g-1)BDE-47对铜锈环棱螺的毒性,且小管径MWCNTs对BDE-47毒性的影响稍大于大管径MWCNTs。Al2O3-NPs和TiO2-NPs对低浓度BDE-47的毒性没有影响,但可显著增加较高浓度BDE-47对铜锈环棱螺的毒性,TiO2-NPs对BDE-47毒性的影响略大于Al2O3-NPs。因此,沉积物中不同类型的纳米颗粒对有机污染物生态毒性的影响存在明显的差异。
| [1] | Savolainen K, Alenius H, Norppa H, et al. Risk assessment of engineered nanomaterials and nanotechnologies:A review[J]. Toxicology, 2010, 269(2/3):92-104. |
| [2] | Gottschalk F, Nowack B. The release of engineered nanomaterials to the environment[J]. Journal of Environmental Monitoring, 2011, 13(5):1145-1155. |
| [3] | Scown T M, van Aerle R, Tyler C R. Review:Do engineered nanoparticles pose a significant threat to the aquatic environment?[J]. Critical Reviews in Toxicology, 2010, 40(7):653-670. |
| [4] | Woodrow Wilson. International center for Scholar//Nano-Technology Consumer Products Inventory[EB/OL].[2015-05]. http://www. nanotechproject. org/inventories/consumer/. |
| [5] | Wang X, Lu J, Xu M, et al. Sorption of pyrene by regular and nanoscaled metal oxide particles:Influence of adsorbed organic matter[J]. Environmental Science & Technology, 2008, 42(19):7267-7272. |
| [6] | Yang K, Xing B. Sorption of phenanthrene by humic acid-coated nanosized TiO2 and ZnO[J]. Environmental Science & Technology, 2009, 43(6):1845-1851. |
| [7] | Sun K, Zhang Z, GAO B, et al. Adsorption of diuron, fluridone and norflurazon on single-walled and multi-walled carbon nanotubes[J]. Science of the Total Environment, 2012, 439:1-7. |
| [8] | Velzeboer I, Kwadijk C J, Koelmans A A. Strong sorption of PCBs to nanoplastics, microplastics, carbon nanotubes, and fullerenes[J]. Environmental Science & Technology, 2014, 48(9):4869-4876. |
| [9] | Ferguson P L, Chandler G T, Templeton R C, et al. Influence of sediment-amendment with single-walled carbon nanotubes and diesel soot on bioaccumulation of hydrophobic organic contaminants by benthic invertebrates[J]. Environmental Science & Technology, 2008, 42(10):3879-3885. |
| [10] | Petersen E J, Pinto R A, Landrum P F, et al. Influence of carbon nanotubes on pyrene bioaccumulation from contaminated soils by earthworms[J]. Environmental Science & Technology, 2009, 43(11):4181-4187. |
| [11] | Xia X, Chen X, Zhao X. Effects of carbon nanotubes, chars, and ash on bioaccumulation of perfluorochemicals by Chironomus plumosus Larvae in sediment[J]. Environmental Science & Technology, 2012, 46(22):12467-12475. |
| [12] | Zhu X, Zhou J, Cai Z. TiO2 nanoparticles in the marine environment:Impact on the toxicity of tributyltin to abalone(Haliotis diversicolor supertexta)embryos[J]. Environmental Science & Technology, 2011, 45(8):3753-3758. |
| [13] | Canesi L, Frenzilli G, Balbi T, et al. Interactive effects of n-TiO2 and 2, 3, 7, 8-TCDD on the marine bivalve Mytilus galloprovincialis[J]. Aquatic Toxicology, 2014, 153:53-65. |
| [14] | Campos-Garcia J, Martinez D S T, Alves O L, et al. Ecotoxicological effects of carbofuran and oxidised multiwalled carbon nanotubes on the freshwater fish Nile tilapia:Nanotubes enhance pesticide ecotoxicity[J]. Ecotoxicology and Environmental Safety, 2015, 111:131-137. |
| [15] | Parks A N, Chandler G T, Portis L M, et al. Effects of single-walled carbon nanotubes on the bioavailability of PCBs in field-contaminated sediments[J]. Nanotoxicology, 2014, 1(8S):111-117. |
| [16] | Rakowska M, Kupryianchyk D, Harmsen J, et al. In situ remediation of contaminated sediments using carbonaceous materials[J]. Environmental Toxicology and Chemistry, 2012, 31(4):693-704. |
| [17] | Baun A, Hartmann N, Grieger K, et al. Ecotoxicity of engineered nanoparticles to aquatic invertebrates:A brief review and recommendations for future toxicity testing[J]. Ecotoxicology, 2008, 17(5):387-395. |
| [18] | Miao J, Pan L, Zhang W, et al. Identification of differentially expressed genes in the digestive gland of manila clam Ruditapes philippinarum exposed to BDE-47[J]. Comparative Biochemistry and Physiology:Toxicology & Pharmacology, 2014, 161:15-20. |
| [19] | McDonald T A. Perspective on the potential health risks of PBDEs[J]. Chemosphere, 2002, 46(5):745-755. |
| [20] | 陈其羽, 宋宝贵. 铜锈环棱螺繁殖和生长的初步研究[J]. 水生生物学学报, 1975, 5(4):519-534.CHEN Qi-yu, SONG Bao-gui. A preliminary study on reproduction and growth of the snail Bellamya aeruginosa(Veeve)[J]. Acta Hydrobiologica Sinica, 1975, 5(4):519-534. |
| [21] | Ma T, Gong S, Zhou K, et al. Laboratory culture of the freshwater benthic gastropod Bellamya aeruginosa(Reeve) and its utility as a test species for sediment toxicity[J]. Journal of Environmental Sciences, 2010, 22(2):304-313. |
| [22] | MacDonald D D, Ingersoll C G, Berger T A. Development and evaluation of consensus-based sediment quality guidelines for freshwater ecosystems[J]. Archives of Environmental Contamination and Toxicology, 2000, 39(1):20-31. |
| [23] | 周 科, 马陶武, 朱 程, 等. 2, 2', 4, 4'-四溴联苯醚(BDE-47)污染沉积物对铜锈环棱螺肝胰脏的SOD、CAT和EROD活性的影响[J]. 环境科学学报, 2010, 30(8):1666-1673.ZHOU Ke, MA Tao-wu, ZHU Cheng, et al. Effects of 2, 2', 4, 4'-tetrabromodiphenyl ether(BDE-47)-contaminated sediments on SOD, CAT, and EROD activities in the hepatopancreas of Bellamya aeruginosa[J]. Acta Scientiae Circumstantiae, 2010, 30(8):1666-1673. |
| [24] | Musee N, Oberholster P J, Sikhwivhilu L, et al. The effects of engineered nanoparticles on survival, reproduction, and behaviour of freshwater snail, Physa acuta(Draparnaud, 1805)[J]. Chemosphere, 2010, 81(10):1196-1203. |
| [25] | Stanley J K, Coleman J G, Weiss Jr C A W, et al. Sediment toxicity and bioaccumulation of nano and micron-sized aluminum oxide[J]. Environmental Toxicology and Chemistry, 2010, 29(2):422-429. |
| [26] | 王 萌, 马陶武, 龙 奕, 等. 腐植酸作用下沉积物中纳米氧化铜对铜锈环棱螺生态毒性的影响[J]. 生态毒理学报, 2014, 9(4):803-808.WANG Meng, MA Tao-wu, LONG Yi, et al. Impacts of humic acid on ecotoxicity of CuO nanoparticle in Bellamya aeruginosa under the sediment scenario[J]. Asian Journal of Ecotoxicology, 2014, 9(4):803-808. |
| [27] | Simpson S L, Angel B M, Jolley D F. Metal equilibration in laboratory-contaminated(spiked) sediments used for the development of whole-sediment toxicity tests[J]. Chemosphere, 2004, 54(5):597-609. |
| [28] | 马陶武, 王 萌, 彭巾英, 等. 铜锈环棱螺HSP70对Cd和BDE-47胁迫的响应敏感性[J]. 重庆师范大学学报(自然科学版), 2014, 31(6):22-28.MA Tao-wu, WANG Meng, PENG Jin-ying, et al. Response sensitivity of HSP70 in Bellamya aeruginosa exposed to cadmium and BDE-47[J]. Journal of Chongqing Normal University(Natural Science), 2014, 31(6):22-28. |
| [29] | Barata C, Varo I, Navarro J C, et al. Antioxidant enzyme activities and lipid peroxidation in the freshwater cladoceran Daphnia magna exposed to redox cycling compounds[J]. Comparative Biochemistry and Physiology Part C:Pharmacology Toxicology and Endocrinology, 2005, 140(2):175-86. |
| [30] | Ma J, Zhou C, Li Y, et al. Biochemical responses to the toxicity of the biocide abamectin on the freshwater snail Physa acuta[J]. Ecotoxicology and Environmental Safety, 2014, 101:31-35. |
| [31] | Livingstone D R. Oxidative stress in aquatic organisms in relation to pollution and aquaculture[J]. Revue de Medecine Veterinaire, 2003, 154:427-430. |
| [32] | Van der Oost R, Beyer J, Vermeulen N P E. Fish bioaccumulation and biomarkers in environmental risk assessment:A review[J]. Environmental Toxicology and Pharmacology, 2003, 13(2):57-149. |
| [33] | Li X L, Li L, Luan T G, et al. Effects of landfill leachate effluent and bisphenol A on glutathione and glutathione-related enzymes in the gills and digestive glands of the freshwater snail Bellamya purificata[J]. Chemosphere, 2008, 70(10):1903-1909. |
| [34] | Zhang L, Hu C, Wang W, et al. Acute toxicity of multi-walled carbon nanotubes, sodium pentachlorophenate, and their complex on earthworm Eisenia fetida[J]. Ecotoxicology and Environmental Safety, 2014, 103:29-35. |
| [35] | Shen M, Xia X, Wang F, et al. Influences of multiwalled carbon nanotubes and plant residue chars on bioaccumulation of polycyclic aromatic hydrocarbons by Chironomus plumosus larvae in sediment[J]. Environmental Toxicology and Chemistry, 2012, 31(1):202-209. |
| [36] | Shrestha B, Anderson T A, Acosta-Martinez V, et al. The influence of multiwalled carbon nanotubes on polycyclic aromatic hydrocarbon(PAH) bioavailability and toxicity to soil microbial communities in alfalfa rhizosphere[J]. Ecotoxicology and Environmental Safety, 2015, 116:143-149. |
 2015, Vol. 34
2015, Vol. 34