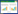文章信息
- 王文立, 孔维栋, 曾辉
- WANG Wen-li, KONG Wei-dong, ZENG Hui
- 土壤微生物对增温响应的Meta分析
- A Meta-analysis of Responses of Soil Microbes to Warming
- 农业环境科学学报, 2015, 34(11): 2169-2175
- Journal of Agro-Environment Science, 2015, 34(11): 2169-2175
- http://dx.doi.org/10.11654/jaes.2015.11.019
-
文章历史
- 收稿日期: 2015-04-27
2. 中国科学院青藏高原研究所, 北京 100085
2. Institute of Tibetan Plateau Research, Chinese Academy of Sciences, Beijing 100085, China
土壤微生物主要包括细菌、真菌、放线菌三大类群[1],是土壤的重要组成部分,也是土壤物质循环和能量流动的主要参与者[2]。作为生态系统的分解者,它们通过调控有机质分解和植物所需养分的可利用性来影响陆地生态系统的物质循环[3],进而影响土壤形成、养分转化等生态学过程[4, 5]。温度是影响土壤微生物活性的重要因素,土壤温度升高将使土壤微生物的生物量、活性和结构发生明显改变[6, 7],而土壤微生物对升温的响应也是生态系统反馈过程中的重要环节。研究全球变暖条件下土壤微生物群落变化对评价全球碳氮循环具有重要意义。目前,关于增温对土壤微生物的影响的研究大部分采用模拟增温的方法[8],关注点集中在土壤微生物群落结构和土壤微生物活性方面[9],包括生物量、组成、结构、酶活性的变化等。国内外已有大量在不同试验地点、针对不同生态系统进行的相关研究[10, 11],也有人做过关于全球变暖背景下土壤微生物响应的定性综述工作[12, 13, 14],但鲜有针对已有增温试验的定量评价。定量研究增温对土壤微生物的影响,对于深入理解土壤碳氮循环过程及其对气候变化的响应十分重要。
Meta分析是一种定量综合研究结果的统计方法,能够将若干独立研究的统计结果进行综合分析[15],尤其适合于大尺度生态现象的研究[16]。1998年,彭少麟等[17]首次将Meta分析引入国内生态学领域。本文使用Meta分析方法,对2009—2015年间的野外增温控制试验所取得的数据进行整合分析,重点回答以下三个问题:(1)增温对土壤中细菌、真菌生物量及土壤微生物碳氮量的影响;(2)试验地点气候条件(年均温、年均降水量)及生态系统类型对土壤微生物增温响应的影响;(3)增温时间和幅度对微生物增温响应的影响。
1 材料与方法 1.1 数据收集为了减少试验方法不同引起的误差,所收集数据全部源自增温处理的野外原位试验,不包括进行了土壤移动的移植模拟增温试验。为了减小土地利用情况如耕地、放牧等复杂因素的影响,简化除增温之外的其他因素,保证所选数据做Meta分析的统计学意义,分析所采集数据多来自自然或人类干扰相对较少的样地。收集的研究结果具有独立性,且所收集的各试验测量指标一致。
本文收集的原始数据包括进行野外增温试验的地理位置、年均温、年均降水量、生态系统类型、加热方法、增温程度、微生物类别(包括细菌和真菌,由磷酸脂肪酸PLFA生物标记法测得)、微生物碳氮(由熏蒸法测得)量等,均来自中国知网(CNKI)和ISI Web of knowledge检索平台2009—2015年2月间已发表的研究论文。为保证所收集数据的有效性,本次Meta分析只针对取样深度0~10 cm的表层土,少数案例将0~5 cm和5~10 cm分开测定,本研究取0~5 cm的数值。最后得到来自35例[8, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51]试验期达一年以上的长期野外增温控制试验数据,涉及生态系统类型有森林、湿地、草原、干草原、高山草甸、冻原等。
1.2 效应大小的度量标准采用反应比(lnR)作为Meta分析效应大小的度量标准[13, 52, 54],此指标反映了增温处理对土壤微生物变化的相对大小,计算公式为:
lnR=ln(Xe /Xc)
方差为:
V(lnR)=[Se2/(Ne Xe2)]+[(Sc2/(Nc Xc2)]
其中:Xe和Xc分别为试验组和对照组的平均值;Se和Sc分别为试验组和对照组的标准差;Ne和Nc分别为试验组和对照组的样本数。该指标是Hedges在1999年提出的一个综合衡量指标[53]。如果增温对土壤微生物有提高作用,则有lnR>0;如果增温处理对土壤微生物有抑制作用,则有lnR<0。lnR的平均值和方差由MetaWin 2.1(http://www.metawinsoft.com)分析得出。
1.3 数据分析用MetaWin 2.1对连续变量(试验地年均温、年均降水量、试验增温时间和增温幅度)和分类变量(生态系统类型)进行基于随机效应模型的检验。用SPSS 19.0进行相关性分析。
2 结果与分析 2.1 升温对土壤微生物的影响根据数据的完整程度对所收集的96组数据进行分类,可分为18组土壤细菌对增温的响应数据、16组土壤真菌对增温的响应数据、38组土壤微生物碳对增温的响应数据以及24组土壤微生物氮对增温的响应数据。
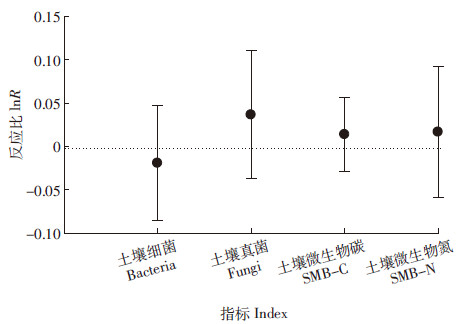
18组土壤细菌对增温的响应数据Meta分析结果中,有9组增温处理对土壤微生物的生物量有促进作用,平均反应比lnR=-0.019(图1),即平均细菌量有降低趋势;16组土壤真菌对增温的响应数据Meta分析结果中,有9组增温处理对土壤微生物的生物量有促进作用,平均反应比lnR=0.037(图1),即平均真菌量有升高趋势;38组土壤微生物碳对增温的响应数据Meta分析结果中,有17组增温处理对土壤微生物碳有促进作用,平均反应比lnR=0.014(图1),即平均微生物碳有升高趋势;24组土壤微生物氮对增温的响应数据Meta分析结果中,有10组增温处理对土壤微生物的生物量有促进作用,平均反应比lnR=0.017(图1),即平均微生物氮有升高趋势。
|
| 图 1 不同指标对增温的响应 Figure 1 Responses of different indices to warming |
试验地年均温(MAT)、年均降水量(MAP)、增温时间和增温幅度为本次Meta分析所选取的连续变量,各连续变量的变化范围和平均值如表1所示。
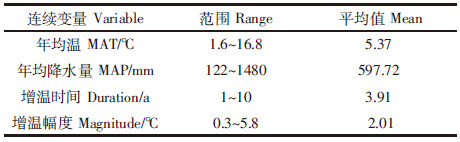
考虑到不同试验地增温实验的差异性,本次Meta分析选用了基于随机效应模型的检验,以各连续变量作为分层依据对土壤细菌量、土壤真菌量、土壤微生物碳及土壤微生物氮基于增温处理的反应比进行异质性检验,得到检验结果如表2所示。
由表2可以看到,土壤微生物碳作为评价指标时,以年均降水量多少作为分层依据,分层后异质性Q检验有统计学意义,即增温处理中土壤微生物碳的变化受到试验点年均降水量的影响。土壤微生物氮作为评价指标时,以年均温高低、年均降水量多少及增温大小作为分层依据,分层后的异质性Q检验有统计学意义,即增温处理中土壤微生物氮的变化受到试验点年均温、年均降水量及增温幅度的影响。
对分层后异质性Q检验具有统计学意义的各土壤微生物量指标和相应的连续变量进行相关性分析,得到土壤微生物碳和试验地年均降水量在0.01水平上显著相关(P=0.007),且随着试验地年均降水量的升高土壤微生物碳反应比有增高趋势(图2)。
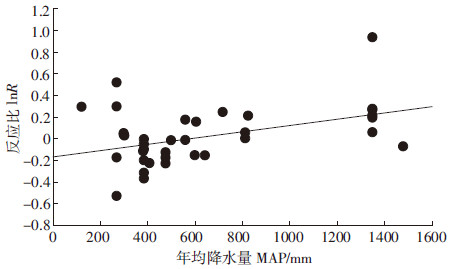
|
| 图 2 年平均降水量与土壤微生物碳反应比 Figure 2 Mean annual precipitation(酝粤孕)葬灶凿lnR of SMB-C |
由表2可见,土壤微生物碳与增温幅度异质性检验结果呈边缘相关(P=0.07),对土壤微生物碳和试验增温幅度进行相关性分析,得到土壤微生物碳和增温幅度在0.05水平上显著相关(P=0.024),且随试验地年均降水量的升高其反应比有增高趋势(图3)。
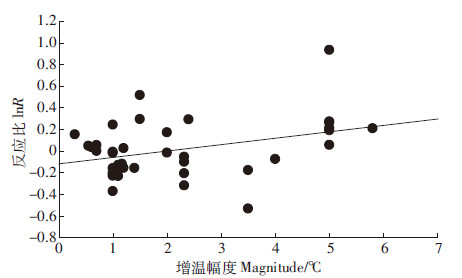
|
| 图 3 增温幅度与土壤微生物碳反应比 Figure 3 Warming magnitude and lnR of SMB-C |
对土壤微生物氮作为评价指标的情况进行相关性检验后发现土壤微生物氮与试验点年均温、年均降水量及增温幅度在0.05水平上不显著,即增温处理中土壤微生物氮的变化受到试验点年均温、年均降水量及增温幅度的影响,但不呈线性相关关系。
2.3 分类变量与土壤微生物指标的关系以生态系统类型为分类变量对4组不同评价指标的数据进行基于随机效应模型的检验,由MetaWin 2.1得到999次循环随机检验的异质性检验结果(0.05水平)如下:除土壤微生物碳P=0.017(95%置信区间:0.014~0.18),以生态系统类型作为分层依据分层后异质性Q检验有统计学意义,受到生态系统类型的影响外,土壤微生物氮及土壤微生物碳的其他指标异质性检验结果在0.05水平均不显著,即受生态系统类型的影响不大。
3 讨论 3.1 土壤微生物对增温响应的影响在野外控制试验中,增温引起的土壤微生物的变化结果各异,有些试验中增温对土壤微生物产生了显著影响[8, 33],有些则影响微弱或几乎不存在[28, 31, 32, 45]。增温对土壤微生物的影响效果主要体现在以下几方面:微生物的生物量[39],微生物生长速率[38],微生物结构[36, 40],微生物碳氮量[42, 44]。 有研究表明,与氮添加、水分调控、昼夜对比等相比,增温所引起的土壤微生物状况的变化具有较低的显著性[27, 38, 51],或相比于单独作用的结果,增温与其他因子共同作用会导致土壤微生物更显著的响应[40]。
大量研究表明,增温能提高土壤呼吸速率,影响土壤的固碳潜力,加快土壤微生物的生长;温度升高会增强土壤微生物活性,加速土壤有机质降解速率和土壤无机氮的释放[12],适当的增温会引起土壤微生物碳氮含量的增高[27, 36]。本文使用增温控制试验的数据(2009—2015年初发表的数据)进行系统分析后也得出增温提高了土壤微生物碳氮量及土壤真菌量这一类似结论。
在此次Meta分析中,增温提高了土壤中的真菌量,降低了细菌量。这可能与真菌本身的结构特征有关:真菌的营养体为丝状体,相比于细菌对增温引起的水分和温度胁迫更具有抵抗能力。Niu等[55]认为温度上升会不利于细菌生长但有利于真菌增长,并改变土壤中微生物群落结构。增温引起土壤微生物生物量减少与试验地微生物的种类有关,一部分试验地微生物对升温有规避行为[56],细菌生物量的下降与细胞膜特性的改变以及微生物在增温压力下的死亡有关[9],如革兰氏阴性细菌对温度的敏感性较大,增温会影响其生长或导致死亡[57]。仅在增温处理有利于减缓自然环境对微生物造成的生长压力时温度的增高才对微生物显得比较重要,包括引起微生物数量的增多[39]。
现有的测量土壤微生物生物量的方法主要有熏蒸法和磷酸脂肪酸(PLFA)法,土壤微生物群落组成复杂,熏蒸法可测定土壤中整体微生物量,而PLFA法是利用不同菌源脂肪酸来代表的特定菌群生物量,二者之间存在微生物学意义上的差异,因此在说明土壤微生物量时,两种方法相结合进行会更加全面[58]。
3.2 气候条件及生态系统类型对土壤微生物增温响应的影响在水热因素对土壤微生物碳氮量影响的研究中,由于研究区域、研究方法不同,研究结果差异较大。Blankinship等[13]对2009年之前有关增温、升高二氧化碳浓度以及改变降水的控制试验进行分析后提出,增温在低年均温和低年均降水量的试验地更容易引起土壤微生物的生物量和丰富度的变化,且增温对寒冷和干旱条件下土壤微生物的作用更显著。不同年均温和年降水量条件下土壤微生物的原始类型以及增温对土壤水分含量的影响不同,可能也会影响土壤微生物对增温的响应。
此次Meta分析中,相比于土壤微生物碳,土壤微生物氮受试验地年均温的影响更显著。24组土壤微生物氮的研究数据年均温变化范围在-11.6~9.3 ℃之间,平均温度1.72 ℃,年均温普遍较低,增温引起土壤微生物活性的增强,加大了土壤有机质降解速率,提高了土壤微生物氮含量。38组土壤微生物碳的研究数据平均年均温为3.56 ℃,增温在不同年均温试验地之间引起的差距不及土壤微生物氮大,土壤微生物碳受试验地年均温的影响不显著。土壤微生物碳氮在不同年均温水平下对增温的响应也和土壤微生物碳氮本身的性质有关,Contin等[59]对草原土壤在不同温度下进行增温培养发现,不同温度的土壤微生物生物量碳增温后没有显著差异。
降水量直接影响土壤水分含量,土壤水分又直接影响土壤气体交换、微生物养分供应和温度。降水量会直接或间接影响氮的吸收利用率,从而影响植物和微生物的生长,在半干旱生态系统中尤其显著[60],微生物氮可用于满足雨季后植物对氮的需求,其储存量与降水量有一定关系[61]。此次Meta分析土壤微生物碳氮在增温条件下的响应受试验地年均降水量的影响印证了上述观点。分析得出土壤微生物碳含量在增温条件下的变化与年均降水量显著正相关,在野外增温试验中,增温引起土壤水分的降低,进而影响微生物的生长和活性,年均降水量越大的地方由于增温引起的土壤水分含量下降对微生物生长造成的负面影响越小,微生物由于温度升高引起的生物量增加越显著(图2)。李世清等[62]对黄土高原红油土的研究发现,当土壤水分小于10.87%时,水分对土壤微生物氮影响显著。
生态系统对土壤微生物增温响应的影响主要体现在水热条件及植被类型上。植被类型的影响主要指其地上部分生物量的差异,土壤微生物会受到作为碳源基质的植物凋落物和土壤有机质的数量和质量的影响[63],土壤微生物碳所受的这种影响比土壤微生物氮及土壤中细菌、真菌要大。在此次Meta分析所收集的土壤微生物碳数据中,湿地、森林生态系统土壤微生物碳对增温呈现正响应,即温度升高土壤微生物碳增加;草原、干草原、高山草甸生态系统对增温呈现负响应,即温度升高土壤微生物碳减少。湿地、森林生态系统土壤水分充足,有机质含量丰富,相比于草原、干草原和高山草甸更有利于适当增温后土壤微生物的生长。
不同试验地的细菌和真菌的种类、数量不同,且取决于多种复杂因素[55],因此,相比于土壤微生物碳和土壤微生物氮这两个代表更大整体情况的指标,土壤细菌和真菌对增温的响应没有表现出与试验地气候条件及生态系统类型的相关性。
3.3 增温时间和增温幅度对土壤微生物增温响应的影响短期增温会提高土壤微生物活性和土壤异养呼吸速率,温度的升高在短时间内刺激土壤呼吸产生大量CO2;随着增温时间的延长,土壤微生物活性和呼吸会对温度变化表现出一定的适应和驯化现象,从而降低或缓和陆地生态系统对全球变暖的正反馈效应[64, 65]。但在此次Meta分析中,增温时间并未在土壤细菌、真菌量,土壤微生物碳和土壤微生物氮四个指标上体现其显著影响,可能与实验收集数据增温时间跨度(1~10 a)相对较小有关。
通过对2009—2015年初发表的野外原位增温试验数据的分析,发现试验增温幅度影响土壤微生物氮对增温的响应结果,且与土壤微生物碳对增温的响应呈正相关(图3)。Wu等[66]对高山草甸土在10~40 ℃的不同温度梯度下微生物对升温的响应进行研究发现,增温幅度的不同导致了土壤微生物结构和功能的差异以及对碳利用模式的改变。在5~30 ℃的增温梯度下对土壤进行培养后发现土壤中细菌生长速率和矿化速度均随温度增加而增加[67]。此次Meta分析所收集数据增温幅度在0.3~5.8 ℃范围内,平均增温2.01 ℃,属于“适度”增温的情况,温度升高有利于土壤中微生物的生长,影响了土壤微生物氮的增温响应,并且随着增温幅度的增加土壤微生物碳对增温的正响应增大。而由于不同试验地细菌和真菌对温度的敏感程度不同,细菌和真菌对增温的响应并未表现出与增温幅度在统计学意义上的显著关系。
生态系统作为一个复杂系统,其结构和功能往往受水热因子与土壤等环境因素的综合作用,全球变暖和干旱的关系以及衡量尺度成为当今的一个讨论热点[68]。除野外原位试验外,室内控制条件下的增温培育实验对增温影响效果同样具有较好的模拟作用;涉及增温与其他因子如耕种、放牧以及施肥等交互作用的试验对土壤微生物增温响应的模拟更为全面,但为了减少不同处理以及过多因子对增温的影响,这些试验均未选进本次Meta分析,虽然这些试验对于理解土壤微生物对气候变化的响应和反馈也十分重要。此外,由于收集原始数据量的限制,未能进行对土壤关键理化性质与土壤微生物增温响应的分析,但土壤自身理化性质如土壤有机碳氮含量等对土壤微生物亦有较大影响。
4 结论(1)模拟增温提高了土壤微生物碳(平均提高1.4%)、土壤微生物氮(平均提高1.7%)和土壤真菌量(平均提高3.7%),土壤细菌量(平均降低1.9%)在模拟增温后则有降低趋势。
(2)增温处理中土壤微生物碳的变化受试验点年均降水量和生态系统类型的影响,且与试验地年均降水量及增温幅度具有正相关关系;土壤微生物氮的变化受试验点年均温、年均降水量及增温幅度的影响。
| [1] | Fierer N, Strickland M S, Liptzin D, et al. Global patterns in belowground communities[J]. Ecology Letters, 2009, 12(11):1238-1249. |
| [2] | Trudell S A, Rygiewicz P T, Edmonds R L. Patterns of nitrogen and carbon stable isotope ratios in macrofungi, plants and soils in two old-growth conifer forests[J]. New Phytologist, 2004, 164(2):317-335. |
| [3] | Zhang W, Parker K M, Luo Y Q, et al. Soil microbial responses to experimental warming and clipping in a tallgrass prairie[J]. Global Change Biology, 2005, 11(2):266-277. |
| [4] | Margesin R, Jud M, Tscherko D, et al. Microbial communities and activities in alpme and subalpine soils[J]. Microbiological Ecology, 2009, 67(2):208-218. |
| [5] | Zhang J Q, Han S J, Zhou Y M. Microbial activity in a temperate forest soil as affected by elevated atmospheric CO2[J]. Pedosphere, 2010, 20(4):427-435. |
| [6] | Sheik C S, Beasley W H, Elshahed M S, et al. Effect of warming and drought on grassland microbial communities[J]. ISME Journal, 2011, 5(10):1692-1700. |
| [7] | Castro H F, Classen A T, Austin E E, et al. Soil microbial community responses to multiple experimental climate change drivers[J]. Applied and Environmental Microbiology, 2010, 76(4):999-1007. |
| [8] | Haugwitz M S, Bergmark L, Priemé A, et al. Soil microorganisms respond to five years of climate change manipulations and elevated atmospheric CO2 in a temperate heath ecosystem[J]. Plant and Soil, 2014, 374(1/2):211-222. |
| [9] | Andresen L C, Dungait J A J, Bol R, et al. Bacteria and fungi respond differently to multifactorial climate change in a temperate heathland, traced with 13C-glycine and FACE CO2[J]. PLoS one, 2014, 9(1):e85070. |
| [10] | Haugwitz M S, Bergmark L, Priemé A, et al. Soil microorganisms respond to five years of climate change manipulations and elevated atmospheric CO2 in a temperate heath ecosystem[J]. Plant and Soil, 2014, 374(1/2):211-222. |
| [11] | Xu G, Jiang H, Zhang Y B, et al. Effect of warming on extracted soil carbon pools of abies faxoniana forest at two elevations[J]. Forest Ecology and Management, 2013, 310:367-365. |
| [12] | 沈菊培, 贺纪正. 微生物介导的碳氮循环过程对全球气候变化的响应[J]. 生态学报, 2011, 31(11):2957-2967.SHEN Ju-pei, HE Ji-zheng. Responses of microbes-mediated carbon and nitrogen cycles to global climate change[J]. Acta Ecologica Sinica, 2011, 31(11):2957-2967. |
| [13] | Blankinship J C, Niklaus P A, Hungate B A. A meta-analysis of responses of soil biota to global change[J]. Oecologia, 2011, 165(3):553-565. |
| [14] | Wood T E, Cavaleri M A, Reed S C. Tropical forest carbon balance in a warmer world:A critical review spanning microbial-to ecosystem-scale processes[J]. Biological Reviews, 2012, 87(4):912-927. |
| [15] | Werf E V. Lack's clutch size hypothesis:An examination of the evidence using meta-analysis[J]. Ecology, 1992, 73(5):1699-1705. |
| [16] | Bender D J, Contreras T A, Fahrig L. Habitat loss and population decline:A meta-analysis of the patch size effect[J]. Ecology, 1998, 79(2):517-533. |
| [17] | 彭少麟, 唐小焱. Meta分析及其在生态学上的应用[J]. 生态学杂志, 1998, 17(5):75-79.PENG Shao-lin, TANG Xiao-yan. Meta-analysis and its application in ecology[J]. Chinese Journal of Ecology, 1998, 17(5):75-79. |
| [18] | 衡 涛, 吴建国, 谢世友, 等. 高寒草甸土壤碳和氮及微生物生物量碳和氮对温度与降水量变化的响[J]. 中国农学通报, 2011, 27(3):425-430.HENG Tao, WU Jian-guo, XIE Shi-you, et al. The responses of soil C and N, microbial biomass C or N under alpine meadow of Qinghai-Tibet plateau to changing in temperature and precipitation[J]. Chinese Agricultural Science Bulletin, 2011, 27(3):425-430. |
| [19] | 熊 沛, 徐振锋, 林 波, 等. 岷江上游华山松林冬季土壤呼吸对模拟增温的短期响应[J]. 植物生态学报, 2010, 34(12):1369-1376.XIONG Pei, XU Zhen-feng, LIN Bo, et al. Short-term response of winter soil respiration to simulated warming in a Pinus armandii plantation in the upper reaches of Minjiang River, China[J]. Chinese Journal of Plant Ecology, 2010, 34(12):1369-1376. |
| [20] | 李 娜, 王根绪, 高永恒, 等. 模拟增温对长江源区高寒草甸土壤养分状况和生物学特性的影响研究[J]. 土壤学报, 2010, 47(6):1214-1224.LI Na, WANG Gen-xu, GAO Yong-heng, et al. Effect of simulated warming on soil nutrient status and biological characteristics of alpine meadow in the source region of the Yangtze River[J]. Acta Pedologica Sinica, 2010, 47(6):1214-1224. |
| [21] | Streit K, Hagedorn F, Hiltbrunner D. Soil warming alters microbial substrate use in alpine soils[J]. Global Change Biology, 2014, 20:1327-1338. |
| [22] | Shen R C, Xu M, Chi Y G, et al. Soil microbial responses to experimental warming and nitrogen addition in a temperate steppe of Northern China[J]. Pedosphere, 2014, 24(4):427-436. |
| [23] | Wang H, Li H Y, Zhang Z J, et al. Linking stoichiometric homeostasis of microorganisms with soil phosphorus dynamics in wetlands subjected to microcosm warming[J]. PLoS one, 2014, 9(1):e85575. |
| [24] | Jing X, Wang Y, Chung H, et al. No temperature acclimation of soil extracellular enzymes to experimental warming in an alpine grassland ecosystem on the Tibetan Plateau[J]. Biogeochemistry, 2014, 117(1):39-54. |
| [25] | Weedon J T, Aerts R, Kowalchuk G A, et al. No effects of experimental warming but contrasting seasonal patterns for soil peptidase and glycosidase enzymes in a sub-arctic peat bog[J]. Biogeochemistry, 2014, 117(1):55-66. |
| [26] | Rousk J, Smith A R, Jones D L. Investigating the long-term legacy of drought and warming on the soil microbial community across five European shrubland ecosystems[J]. Global Change Biology, 2013, 19(12):3872-3884. |
| [27] | Zhang X M, Zhang G M, Chen Q S, et al. Soil bacterial communities respond to climate changes in a temperate steppe[J]. PLoS one, 2013, 8(11):e78616. |
| [28] | Zhang N L, Liu W X, Yang H J, et al. Soil microbial responses to warming and increased precipitation and their implications for ecosystem C cycling[J]. Oecologia, 2013, 173(3):1125-1142. |
| [29] | Schaeffer S M, Sharp E, Schimel J P, et al. Soil-plant N processes in a High Arctic ecosystem, NW Greenland are altered by long-term experimental warming and higher rainfall[J]. Global change biology, 2013, 19(11):3529-3539. |
| [30] | Sistla S A, Schimel J P. Seasonal patterns of microbial extracellular enzyme activities in an arctic tundra soil:Identifying direct and indirect effects of long-term summer warming[J]. Soil Biology and Biochemistry, 2013, 66:119-129. |
| [31] | Zhou X Q, Chen C R, Wang Y F, et al. Soil extractable carbon and nitrogen, microbial biomass and microbial metabolic activity in response to warming and increased precipitation in a semiarid Inner Mongolian grassland[J]. Geoderma, 2013, 206:24-31. |
| [32] | Li Q, Bai H H, Liang W J, et al. Nitrogen addition and warming independently influence the belowground micro-food web in a temperate steppe[J]. PLoS one, 2013, 8(3):e60441. |
| [33] | Dennis P G, Newsham K K, Rushton S P, et al. Warming constrains bacterial community responses to nutrient inputs in a southern, but not northern, maritime Antarctic soil[J]. Soil Biology and Biochemistry, 2013, 57:248-255. |
| [34] | Hayden H L, Mele P M, Bougoure D S, et al. Changes in the microbial community structure of bacteria, archaea and fungi in response to elevated CO2 and warming in an Australian native grassland soil[J]. Environmental Microbiology, 2012, 14(12):3081-3096. |
| [35] | Deslippe J R, Hartmann M, Simard S W, et al. Long-term warming alters the composition of Arctic soil microbial communities[J]. FEMS Microbiology Ecology, 2012, 82(2):303-315. |
| [36] | Fu G, Shen Z X, Zhang X Z, et al. Response of soil microbial biomass to short-term experimental warming in alpine meadow on the Tibetan Plateau[J]. Applied Soil Ecology, 2012, 61:158-160. |
| [37] | Rousk J, Frey S D, Bååth E. Temperature adaptation of bacterial communities in experimentally warmed forest soils[J]. Global Change Biology, 2012, 18(10):3252-3258. |
| [38] | Shi F S, Chen H, Chen H F, et al. The combined effects of warming and drying suppress CO2 and N2O emission rates in an alpine meadow of the eastern Tibetan Plateau[J]. Ecological Research, 2012, 27(4):725-733. |
| [39] | Gutknecht J L M, Field C B, Balser T C. Microbial communities and their responses to simulated global change fluctuate greatly over multiple years[J]. Global Change Biology, 2012, 18(7):2256-2269. |
| [40] | Zelikova T J, Housman D C, Grote E E, et al. Warming and increased precipitation frequency on the Colorado Plateau:Implications for biological soil crusts and soil processes[J]. Plant and Soil, 2012, 355(1-2):265-282. |
| [41] | Song B, Niu S, Zhang Z, et al. Light and heavy fractions of soil organic matter in response to climate warming and increased precipitation in a temperate steppe[J]. PLoS one, 2012, 7(3):e33217. |
| [42] | Zhang N L, Xia J Y, Yu X J, et al. Soil microbial community changes and their linkages with ecosystem carbon exchange under asymmetrically diurnal warming[J]. Soil Biology and Biochemistry, 2011, 43(10):2053-2059. |
| [43] | Rui Y C, Wang S P, Xu Z H, et al. Warming and grazing affect soil labile carbon and nitrogen pools differently in an alpine meadow of the Qinghai-Tibet Plateau in China[J]. Journal of Soils and Sediments, 2011, 11(6):903-914. |
| [44] | Schindlbacher A, Rodler A, Kuffner M, et al. Experimental warming effects on the microbial community of a temperate mountain forest soil[J]. Soil Biology and Biochemistry, 2011, 43(7):1417-1425. |
| [45] | Papanikolaou N, Britton A J, Helliwell R C, et al. Nitrogen deposition, vegetation burning and climate warming act independently on microbial community structure and enzyme activity associated with decomposing litter in low-alpine heath[J]. Global Change Biology, 2010, 16(11):3120-3132. |
| [46] | Xu Z F, Wan C, Xiong P, et al. Initial responses of soil CO2 efflux and C, N pools to experimental warming in two contrasting forest ecosystems, Eastern Tibetan Plateau, China[J]. Plant and Soil, 2010, 336(1/2):183-195. |
| [47] | Allison S D, McGuire K L, Treseder K K. Resistance of microbial and soil properties to warming treatment seven years after boreal fire[J]. Soil Biology and Biochemistry, 2010, 42(10):1872-1878. |
| [48] | Nie M, Pendall E, Bell C, et al. Positive climate feedbacks of soil microbial communities in a semi-arid grassland[J]. Ecology Letters, 2013, 16(2):234-241. |
| td> | |
| [49] | Andresen L C, Michelsen A, Jonasson S, et al. Glycine uptake in heath plants and soil microbes responds to elevated temperature, CO2 and drought[J]. Acta Oecologica, 2009, 35(6):786-796. |
| [50] | Rinnan R, Stark S, Tolvanen A. Responses of vegetation and soil microbial communities to warming and simulated herbivory in a subarctic heath[J]. Journal of Ecology, 2009, 97(4):788-800. |
| [51] | Liu W X, Zhang Z, Wan S Q. Predominant role of water in regulating soil and microbial respiration and their responses to climate change in a semiarid grassland[J]. Global Change Biology, 2009, 15(1):184-195. |
| [52] | Treseder K K. A meta-analysis of mycorrhizal responses to nitrogen, phosphorus, and atmospheric CO2 in field studies[J]. New Phytologist, 2004, 164(2):347-355. |
| [53] | Hedges L V, Gurevitch J, Gurtis P S. The meta-analysis of response ratios in experimental ecology[J]. Ecology, 1999, 80(4): 1150-1156. |
| [54] | De Graaff M A, Van Groenigen K J, Six J, et al. Interactions between plant growth and soil nutrient cycling under elevated CO2:A meta-analysis[J]. Global Change Biology, 2006, 12(11):2077-2091. |
| [55] | Niu S, Wu M, Han Y, et al. Water-mediated responses of ecosystem carbon fluxes to climatic change in a temperate steppe[J]. New Phytologist, 2008, 177(1):209-219. |
| [56] | Briones M J I, Ineson P, Heinemeyer A. Predicting potential impacts of climate change on the geographical distribution of enchytraeids:A meta-analysis approach[J]. Global Change Biology, 2007, 13(11):2252-2269. |
| [57] | Gray S B, Classen A T, Kardol P, et al. Multiple climate change factors interact to alter soil microbial community structure in an old-field ecosystem[J]. Soil Science Society of America, 2011, 75:2217-2226. |
| [58] | 毕明丽, 宇万太, 姜子绍, 等. 利用PLFA 方法研究不同土地利用方式对潮棕壤微生物群落结构的影响[J]. 中国农业科学, 2010, 43(9):1834-1842.BI Ming-li, YU Wan-tai, JIANG Zi-shao, et al. Study on the effects of different land use patterns on microbial community structure in aquic brown soil by utilizing PLFA method[J]. Scientia Agricultura Sinica, 2010, 43(9):1834-1842. |
| [59] | Contin M, Corcimaru S, De Nobili M, et al. Temperature changes and the ATP concentration of the soil microbial biomass[J]. Soil Biology and Biochemistry, 2000, 32(8):1219-1225. |
| [60] | Weltzin J F, Loik M E, Schwinning S, et al. Assessing the response of terrestrial ecosystems to potential changes in precipitation[J]. Bioscience, 2003, 53:941-952. |
| [61] | Mauritz M, Cleland E, Merkley M, et al. The influence of altered rainfall regimes on early season N partitioning among early phenology annual plants, a late phenology shrub, and microbes in a semi-arid ecosystem[J]. Ecosystems, 2014, 17(8):1354-1370. |
| [62] | 李世清, 任书杰, 李生秀. 土壤微生物体氮的季节性变化及其与土壤水分和温度的关系[J]. 植物营养与肥料学报, 2004, 10(1):18-23.LI Shi-qing, REN Shu-jie, LI Sheng-xiu. Seasonal change of soil microbial biomass and the relationship between soil microbial biomass and soil moisture and temperature[J]. Plant Nutrition and Fertilizer Science, 2004, 10(1):18-23. |
| [63] | Wall D H, Moore J C. Interactions underground:Soil biodiversity, mutualism, and ecosystem processes[J]. BioScience, 1999, 49(2):109-117. |
| [64] | Rustad L, Campbell J, Marion G, et al. A meta-analysis of the response of soil respiration, net nitrogen mineralization, and aboveground plant growth to experimental ecosystem warming[J]. Oecologia, 2001, 126(4):543-562. |
| [65] | Melillo J M, Steudler P A, Aber J D, et al. Soil warming and carbon-cycle feedbacks to the climate system[J]. Science, 2002, 298(5601):2173-2176. |
| [66] | Wu J, Xiong J, Hu C, et al. Temperature sensitivity of soil bacterial community along contrasting warming gradient[J]. Applied Soil Ecology, 2015, 94:40-48. |
| [67] | Bárcenas-Moreno G, Gómez-Brandón M, Rousk J, et al. Adaptation of soil microbial communities to temperature:Comparison of fungi and bacteria in a laboratory experiment[J]. Global Change Biology, 2009, 15(12):2950-2957. |
| [68] | Steven S, Fu Q. A drier future?[J]. Science, 2014, 343(6172):737-739. |
 2015, Vol. 34
2015, Vol. 34