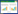文章信息
- 李炳智, 朱江
- LI Bing-zhi , ZHU Jiang
- 1,1,1-三氯乙烷和1,4-二噁烷复合污染地下水的超声协同降解研究
- Degradation of 1,1,1-Trichloroethane and 1,4-Dioxane Co-existed in Groundwater by Ultrasonics-Oxidant Systems
- 农业环境科学学报, 2015, 34(11): 2183-2189
- Journal of Agro-Environment Science, 2015, 34(11): 2183-2189
- http://dx.doi.org/10.11654/jaes.2015.11.021
-
文章历史
- 收稿日期: 2015-05-25
挥发性氯代溶剂是全球地下水中检出率最高的一类污染物,其主要作为清洗剂、金属脱脂剂等被大规模生产和应用[1, 2],可追溯的生产、使用史长达30年之久。由于在长期的氯代溶剂[尤其1,1,1-三氯乙烷(TCA)]生产过程中以环醚1,4-二 烷(1,4-D)作为稳定剂,比如商业化TCA通常含有2%~8%(质量百分比)的1,4-D[3],所以存在氯代溶剂污染的地下水通常亦伴有1,4-D污染[4, 5]。但很长一段时间以来,在一些氯代溶剂污染场地调查中传统上并未将1,4-D列为关注污染物;另外,由于1,4-D检测方法的限制,忽视了对其调查及修复;而一旦将1,4-D作为场地地下水关注污染物,原有仅针对氯代溶剂的场地修复设计需做重大调整[6]。直至2012年,美国空军(US Air Force,USAF)相关污染场地的报告方凸显地下水环境1,4-D和氯代溶剂复合污染问题的重要性[7, 8]。
烷(1,4-D)作为稳定剂,比如商业化TCA通常含有2%~8%(质量百分比)的1,4-D[3],所以存在氯代溶剂污染的地下水通常亦伴有1,4-D污染[4, 5]。但很长一段时间以来,在一些氯代溶剂污染场地调查中传统上并未将1,4-D列为关注污染物;另外,由于1,4-D检测方法的限制,忽视了对其调查及修复;而一旦将1,4-D作为场地地下水关注污染物,原有仅针对氯代溶剂的场地修复设计需做重大调整[6]。直至2012年,美国空军(US Air Force,USAF)相关污染场地的报告方凸显地下水环境1,4-D和氯代溶剂复合污染问题的重要性[7, 8]。
氯代溶剂(如TCA)长期接触可引起肝脏、神经系统及人体循环系统疾病,因此美国EPA设定饮用水中TCA最高污染水平为0.2 mg·L-1,我国也将TCA列入“水中优先控制污染物”名单[9]。1,4-D是一种潜在的人类致癌物[10],目前美国联邦政府尚未制定强制性1,4-D最高污染水平(MCL),但美国EPA已给出饮用水中二 烷的健康咨询值(3 μg·L-1)。
烷的健康咨询值(3 μg·L-1)。
对于1,4-D污染的地下水,由于其具有良好的水溶性(4.31×105 mg·L-1)和稳定的杂环结构,常规地下水修复处理技术包括空气吹脱、炭吸附和生物处理对其去除效果均欠佳;一些以强氧化性自由基(氧化电位大于2.0 V)产生为特征的高级氧化工艺(Fenton试剂、UV/H2O2、O3/H2O2、过硫酸盐和超声等)对其降解效果虽显著,但成本较高[5, 11, 12, 13, 14]。对于氯代溶剂污染地下水,潜力较大的修复技术主要包括渗透反应墙(PRB-ZVI)、原位化学氧化(ISCO)、原位化学还原(ISCR)、微生物强化降解(Enhanced Bioremediation)及基于监测的自然衰减(Monitored Natural Attenuation)等[15, 16]。对于二者伴生的地下水污染修复问题,国内外相关研究甚少。国外已有研究主要关注TCA及其代谢污染物对1,4-D生物降解的影响[17],以及TCE伴生1,4-D污染地下水的生物降解潜力[8],国内这方面的研究工作尚属空白。因此,亟需开发一种经济、高效、绿色和快速的技术来修复二者复合污染的地下水。
过硫酸盐(PS)活化高级氧化技术是一类新兴的有机物污染场地化学修复技术,由于固体PS易存储、运输,稳定性和水溶性好以及成本相对低廉的特点[18],在国内外环境修复领域受到广泛关注。PS在热、光、过渡金属、碱、微波、超声等条件下可活化产生强氧化性的硫酸根自由基(SO4-·,Eh =2.6 V),理论上可降解大部分有机污染物[19, 20, 21, 22, 23, 24, 25]。尽管PS活化高级氧化技术在TCA污染地下水修复方面已有相关室内模拟试验研究,但该技术对TCA和1,4-D复合污染地下水的修复效能尚无量化评价研究。
鉴此,本文以典型场地TCA和1,4-D复合污染地下水为研究对象,在既有超纯水背景优化工况参数基础上,尝试性开展超声辅助氧化剂技术异位修复复合污染地下水特性研究,旨在为这一新型技术在氯代烃污染地下水修复技术应用方面积累试验参数和提供实践指导。
1 材料和方法 1.1 材料和试验用水1,1,1-三氯乙烷(纯度99.5%)、1,4-D(纯度99%)、Na2S2O8(纯度98.0%)、NaCl(纯度99.5%)、Na2SO3(98%)、HNO3(A.R.,65%~68%)和NaOH(A.R.,96%)均购自上海晶纯试剂有限公司。其他试剂均为分析纯。
试验所用污染地下水取自某污染场地地下水监测井(约-1.0 m),主要氯代烃污染物为TCA(约30 mg·L-1)和1,4-D(约30 mg·L-1),pH8.2,水温25 ℃,电导率1480 μS·cm-1,溶解氧(DO)0.80 mg·L-1,氧化还原电位(ORP)-155 mV,NO3- 0.21 mg·L-1,SO24- 1.0 mg·L-1,Cl- 375.0 mg·L-1,TOC 36.3 mg·L-1,Mn 310.0 mg·L-1,Fe2+ 0.075 mg·L-1,PO34- 0.8 mg·L-1,S2- 0.022 mg·L-1。场地内浅层地下水流向总体上为由东南流向西北,场地低于地表60 m内的地层分别为填土、粉质粘土/粘土质粉砂、砂质粉土、浑浊的淤泥质粘土、淤泥质粘土、粉质粘土和砂质粉土。微水试验表明,粘土质粉砂层水力传导系数介于1.25×10-7~2.56×10-4 cm·s-1之间。粉质材料(粘土质粉砂或砂质粉土)的水力传导系数比底部的粘土材料(粉质粘土或粘土)高出一到两个数量级,而相同粉质层内的水平水力传导系数为纵向水力传导系数的1.2~4.5倍。粉质层水平和纵向水力传导系数之间的差异通常比粘土材料的小。由于地下水表观呈棕黄色且含悬浮固体较多,为便于分析测试和排除干扰,地下水经0.22 μm膜抽滤后备用。进行试验前再添加TCA和1,4-D污染物至初始检测浓度,并使之充分溶解,现配现用。
1.2 试验方案试验开始前配制污染物母液,用移液枪移取既定体积的TCA和1,4-D至容量瓶内,用地下水加满、定容,瓶塞处分别用聚四氟乙烯膜和封口膜密封,1400 r·min-1磁力搅拌30 min,待污染物完全溶解后,静置、备用。
试验用超声反应系统由超声发生器、超声换能器及40 mL吹扫反应瓶组成。超声发生器频率为400 kHz,输出功率为0~100 W可调(中科院东海声学研究所),400 kHz超声发生器超声密度为2.67 W·cm-2。声空化反应在一个开放的不锈钢圆盘(直径8 cm)上进行,圆盘底部直接与换能器相连,在连接部位采用聚四氟乙烯O型圈密封。圆盘置于水浴系统中,反应温度控制在(25±2)℃,反应在带有聚四氟乙烯膜衬垫盖的玻璃瓶(体积约42 mL)内进行。试验开始时,先将既定体积PS母液注入反应瓶,然后迅速移入既定体积污染物母液,再用地下水充满后立即旋紧瓶盖,快速倒置摇匀后置于不锈钢圆盘上。开启超声发生器,反应计时开始,在不同时间用注射器抽取1 mL水样进行分析。所有试验中,反应溶液均为现场配制,每组试验设置3个重复,试验结果取平均值,用SPSS14.0统计软件对实验结果进行统计,P值小于0.05。
1.3 分析项目与方法TCA和1,4-D定量分析采用P&T-GC。吹扫捕集条件为:吹扫温度20 ℃,吹扫流量40 mL·min-1,吹扫时间11 min。GC分析条件为:样品进样量1.0 μL,进样口温度240 ℃,分流比20∶1,色谱柱DB-VRX(60 m×0.25 mm×1.4 μm),柱流量5 mL·min-1。程序升温:45 ℃保持10 min,以12 ℃·min-1升温到190 ℃,保留2 min,再以6 ℃·min-1升温到225 ℃,保留1 min。检测器FID,氢气流量 40 mL·min-1,空气流量 400 mL·min-1,检测器温度300 ℃。
经过不同处理后的地下水急性毒性测试方法采用国家标准水质急性毒性的测定——发光细菌法(GB/T 15441—1995)。分析前,样品先按化学剂量反应系数添加亚硫酸钠以除掉样品中残余的氧化剂。样品的毒性效应量化为EC50值(15 ℃曝露15 min 导致发光强度降低50%时的有毒物浓度,以污染地下水的百分含量表示)。pH值采用DELTA 320酸度计(Mettler-Toledo,瑞士)进行测量。
2 结果与讨论 2.1 不同体系修复预研究根据超纯水背景得出的优化试验条件,首先研究了室温25 ℃、初始pH值8.2时污染地下水在不同修复体系单独超声(US)、US+H2O2(H2O2/1,4-D摩尔比200∶1)、US+PS(PS/1,4-D摩尔比200∶1)和US+PS+H2O2(H2O2和PS与1,4-D摩尔比均为200∶1)时对复合污染物的去除情况,如图1和图2所示。

|
| 图 1 不同体系对污染地下水中TCA 的降解 Figure 1 TCA degradation in contaminated groundwater by different treatments |
|
| 图 2 不同体系对污染地下水中1,4-D 的降解 Figure 2 1,4-D degradation in contaminated groundwater by different treatments |
由图1可知,上述四个反应体系250 min内TCA基本降解完毕,其中US+PS+H2O2体系的降解效果最佳,200 min左右已完全降解,其浓度(Ct/mg·L-1)衰减较好地遵从二次多项式:
Ct=0.000 05 t2-0.110 8 t+ 22.365(R2=0.967)
不同于TCA的降解,1,4-D降解速率较为缓慢,即使降解效果最佳的US+PS+H2O2体系,其240 min后降解率仅为33%左右,远低于TCA的降解率。从1,4-D和TCA与自由基(·OH、SO4-·)的二级反应速率常数(表1)来看,前者与自由基反应速率常数远高于后者,就这一角度而言,1,4-D的降解速率应快于TCA,但试验结果却与此相反。这一现象只能从污染物不同的降解机理角度来解释:TCA易挥发,其热解反应占比较大,而1,4-D与水混溶、不易挥发,热解反应占比较小[26]。由此可以推测,TCA绝大部分在空化泡内或空化泡-溶液交界面处进行热解反应,而1,4-D的降解大部分在液相本体内进行,小部分在空化泡内或空化泡-溶液交界面处进行热解反应。
 |
需要指出的是,在H2O2和PS与1,4-D摩尔比均为20∶1时,两种污染物均无明显降解,可能与地下水中天然存在的还原性物质(Naturally Present Reduced Species,NPRS)有关,它们含量的多寡取决于污染场地特殊的水文地质条件。在用氧化剂对污染土壤和地下水进行修复时,它们往往会消耗相当一部分的氧化剂,这部分氧化剂被称为“Natural Oxidant Demand(NOD)”[31]。NOD的测定一般按照标准的流程来进行。由此推测,地下水中NPRS通过与目标污染物竞争PS和(或)体系产生的自由基,从而使得PS消耗量大幅增加,由超纯水背景10∶1剧增到200∶1,反应时间倍增(从50 mg·L-1的2 h延长至30 mg·L-1的4 h,甚至更久),进而使后期修复成本大幅增加。
由上述试验结果可知,超声与氧化剂的协同技术与单一超声或单一过硫酸盐氧化相比,可以更为经济、高效地同时去除TCA和1,4-D,而且可以在常温常压下进行,比较安全环保,设备简单、易于操作。更重要的是,这种技术可以在超声空化气泡内、空化气泡和液相界面、液相本体内三个反应位对挥发性污染物、半挥发性污染物和难挥发性污染物分别进行降解和破坏,因而其针对的污染物频谱范围宽。从经济性角度而言,单一AOPs的处理成本往往高于耦合的AOPs[32],且过硫酸盐和其他ISCO技术的耦合是未来发展的方向之一[33]。从氧化能力来看,过硫酸盐和H2O2协同超声的高级氧化技术不仅可以产生选择性的强氧化性的硫酸根自由基(SO4-·),还能生成非选择性的羟基自由基(HO·),能够充分发挥两种自由基的协同效应。综上认为,超声与氧化剂的协同降解工艺具有良好的应用前景。
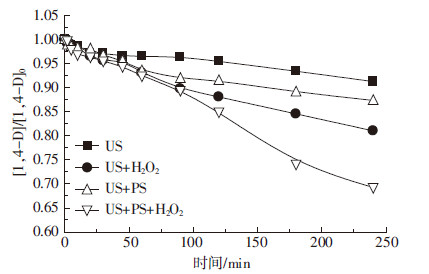
2.2 PS剂量的再优化在温度25 ℃、H2O2/1,4-D=200∶1、污染地下水初始pH值8.2、TCA和1,4-D初始浓度均为30 mg·L-1、超声频率400 kHz、超声强度2.67 W·cm-2、功率100 W时,通过试验进一步研究PS剂量变化对目标污染物去除的影响,结果如图3和图4所示。随PS与1,4-D摩尔比从50∶1增至1000∶1时,TCA去除率并没有单调增大(图3),当摩尔比超过200∶1时,继续增大PS剂量对TCA去除率改善不显著。不同于TCA,1,4-D去除率随PS剂量增大而增大(图4)。综合两种污染物去除效果,暂定摩尔比1000∶1为较佳的PS投加剂量。

|
| 图 3 PS 剂量变化对TCA 去除的影响 Figure 3 Effects of persulfate doses on removal of TCA |
|
| 图 4 PS 剂量变化对1,4-D 去除的影响 Figure 4 Effects of persulfate doses on removal of 1,4-D |
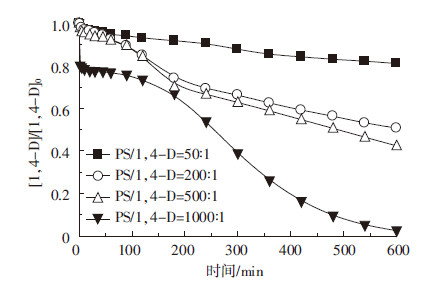
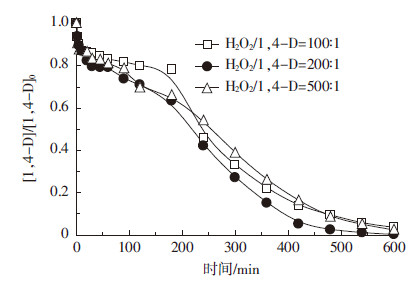
在温度25 ℃、PS/1,4-D=1000∶1、污染地下水初始pH值8.2、TCA和1,4-D初始浓度均为30 mg·L-1、超声频率400 kHz、超声强度2.67 W·cm-2、功率100 W时,H2O2与1,4-D摩尔比改变对两种污染物去除情况的结果如图5和图6所示。随着H2O2/1,4-D摩尔比从100∶1逐渐增大到500∶1,TCA降解速率呈现先增大后减小的趋势,且摩尔比为200∶1时降解效果较好(图5)。而随着H2O2浓度增大,对1,4-D的降解影响变化较小(图6)。推测原因可能是:当H2O2浓度逐渐增大时,由此产生的HO·数量增加[34],而当自由基数量超过一定的阈值后,会产生自由基之间的相互终止反应(式1和式2)[35],使得自由基的利用率降低,导致污染物的去除率不升反降。
|
| 图 5 H2O2剂量变化对TCA 去除的影响 Figure 5 Effects of H2O2 doses on removal of TCA |
|
| 图 6 H2O2剂量变化对1,4-D 去除的影响 Figure 6 Effects of H2O2 doses on removal of 1,4-D |
超声波在媒质中传播是依靠媒质中质点振动进行的,各振动质点并不随着波的传播面而向前移动,沿波动方向传播的只是能量。在这个过程中,媒质将会产生各种物理效应,包括机械效应、热效应和空化效应。热效应是由于媒质吸收了超声能量引起温度升高,使超声能量转换为热能。超声频率越高,媒质吸收能量越显著。
本研究中,大部分超声试验都在恒温环境下进行,主要依靠外部循环水的持续流动使超声反应保持近似恒温。但现场原位中试放大时,超声时间较长可能致水温急剧上升,从而对反应器本身造成损害。通常情况下,液面必须浸没超声换能器上表面,而且换能器所处水温不宜超过60 ℃,以免对内部器件造成不利影响。为此,试验对比研究了恒温(25 ℃)与否对污染物的去除差异,并对非恒温时水温进行了实时监测和记录。试验结果如图7所示。

|
| 图 7 超声装置恒温和变温对目标污染物去除的影响 Figure 7 Effects of reaction temperature on removals of contaminants |
由图7可知,与恒温25 ℃相比,非恒温加快了污染物的去除,完全去除耗时分别缩短约1 h和3 h,而且随超声时间延长,体系水温逐渐上升,由最初的25 ℃增加至10 h时约60 ℃。这可能是由PS热活化引起的。有研究表明,PS在35~130 ℃范围内会发生分解生成强氧化性的硫酸根自由基[34, 36, 37, 38, 39]。随着温度的升高,PS能活化产生更多的硫酸根自由基,从而加大TCA的去除效率。温度对热活化PS氧化TCA有较大影响,20 ℃时TCA基本没有降解,30 ℃时10 h去除率为68.4%,40 ℃时8 h去除率为99.4%,50 ℃时2 h去除率为99.0% [40]。
通过上述试验可知,随着反应进行,超声发生器内部温度会逐渐升高。鉴于试验使用超声发生器功率较小、温升较慢,但如在污染场地进行中试放大应用时,温升将变得愈加显著,灵活掌握超声时间、适时作降温处理就显得尤为必要。
2.5 污染地下水修复前后急性毒性变化研究人员通常以目标污染物的去除性能来评价某种工艺或者技术的优劣。但在实际污染地下水的修复时,仅考虑目标污染物的去除显然是不够的,其在降解过程中会逐渐转化为一系列降解产物,实时地追踪它们的归趋转化对于现有的试验条件极具挑战性。可行的替代方法是,在考虑目标污染物的去除性能以外,还须关注修复后水质的安全性。因此,试验考察了污染地下水处理前后的生物急性毒性分析。
生物急性毒性分析采用Biotox®细菌发光分析技术,以明亮发光杆菌Photobacterium phosphoreum T3 小种(中科院南京土壤研究所提供)发光强度的抑制进行量化。试验结果如图8所示。
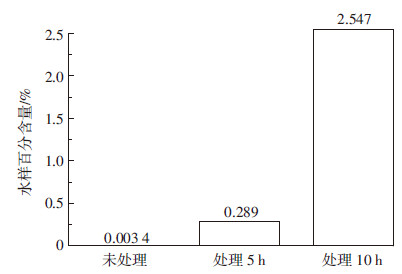
|
| 图 8 耦合体系处理5 h、10 h前后污染地下水 水质急性毒性的变化 Figure 8 Changes of acute toxicity of contaminated groundwater treated by integrated process for different intervals |
由图8可知,污染地下水经耦合体系处理5、10 h后,在目标污染物已被完全去除(约6 h 和10 h)前提下,其急性毒性效应大幅下降,推测可能是TCA和1,4-D被转化为具有较低毒性的产物,反应停止时毒性抑制效应分别降低了98.81%(5 h)和99.87%(10 h),表明有毒物质在·OH、SO4-·等自由基以及超声局部高温高压效应下得到了降解,并转化为低毒性或无毒物质。这一结果说明,耦合体系能够明显地降低氯代烃类化合物-TCA污染地下水对好氧微生物的抑制效应,是一种有前途的修复氯代烃污染地下水并使其脱除毒性的方法。
3 结论(1)在室温25 ℃、初始pH值8.2、氧化剂/1,4-D摩尔比200∶1、超声频率400 kHz、强度2.67 W·cm-2和功率100 W条件下,某TCA和1,4-D复合污染地下水经4种体系处理4 h,其中“US+PS+H2O2”协同体系降解效果最佳,TCA可完全去除,1,4-D去除率仅为33%;但氧化剂/1,4-D摩尔比为20∶1时两种污染物无明显降解现象。
(2)PS/1,4-D摩尔比为200∶1时,TCA去除效果较佳,继续加大PS投量对TCA去除无重大影响,而对1,4-D影响较大,较佳摩尔比为1000∶1。
(3)H2O2/1,4-D摩尔比从100∶1增大至500∶1时,对TCA去除效果影响较1,4-D大,较佳摩尔比为200∶1。
(4)非恒温条件耦合体系温度由初始25 ℃升至约60 ℃(10 h),目标污染物去除加快,可比恒温条件TCA和1,4-D完全降解所需时间分别缩短约1 h和3 h,推测热活化PS分解生成硫酸根自由基是主要原因。
(5)TCA污染地下水经协同体系异位修复5 h和10 h后,目标污染物分别在6 h和10 h被完全去除,其急性毒性抑制效应分别降低了98.81%和99.87%。
| [1] | Stroo H F, Unger M, Ward C H, et al. Remediating chlorinated solvent source zones[J]. Environmental Science & Technology, 2003, 37(11):224A-230A. |
| [2] | Moran M J, Zogorski J S, Squillace P J. Chlorinated solvents in groundwater of the United States[J]. Environmental Science & Technology, 2007, 41(1):74-81. |
| [3] | Mohr T K G, Stickney J A, DiGuiseppi W H. Environmental investigation and remediation:1, 4-dioxane and other solvent stabilizers[M]. Boca Raton, FL: CRC Press, 2010. |
| [4] | Jackson R E, Dwarkanath V. Chlorinated decreasing solvents:Physical-chemical properties affecting aquifer contamination and remediation[J]. Groundwater Monitoring & Remediation, 1999, 19(4):102-110. |
| [5] | Zenker M J, Borden R C, Barlaz M A. Occurrence and treatment of 1, 4-dioxane in aqueous environments[J]. Environmental Engineering Science, 2003, 20(5):423-432. |
| [6] | Treatment technologies for 1, 4-dioxane:Fundamentals and field applications, EPA Office of Solid Waste and Emergency Response[R]. EPA 542-R-06-009, 2006. |
| [7] | Anderson R, Anderson J K, Bower P A. Co-occurrence of 1, 4-dioxane with trichloroethylene in chlorinated solvent groundwater plumes at US Air Force installations:Fact or fiction[J]. Integrated Environmental Assessment and Management, 2012, 8(4):731-737. |
| [8] | Chiang S Y D, Mora R, Diguiseppi W H, et al. Characterizing the intrinsic bioremediation potential of 1, 4-dioxane and trichloroethene using innovative environmental diagnostic tools[J]. Journal of Environmental Monitoring, 2012, 14(9):2317-2326. |
| [9] | 王 昭, 石建省, 张兆吉, 等. 我国"水中优先控制有机物"对地下水污染的预警性研究[J]. 水资源保护, 2009, 25(1):90-94.WANG Zhao, SHI Jian-sheng, ZHANG Zhao-ji, et al. Groundwater contamination risk assessment:A Chinese list of preferred controlled organic pollutants in water[J]. Water Resources Protection, 2009, 25(1):90-94. |
| [10] | Stickney J A, Sager S L, Clarkson J R, et al. An updated evaluation of the carcinogenic potential of 1, 4-dioxane[J]. Regulatory Toxicology and Pharmacology, 2003, 38(2):183-195. |
| [11] | Diguiseppi W, Whitesides C. Treatment options for remediation of 1, 4-dioxane in groundwater[J]. Environmental Engineer:Applied Research and Practice, 2007, 2:1-7. |
| [12] | Son H S, Kim S K, Im J K, et al. Effect of bulk temperature and frequency on the sonolytic degradation of 1, 4-dioxane with Fe0[J]. Industrial & Engineering Chemistry Research, 2011, 50(9):5394-5400. |
| [13] | Kwon S C, Kim J Y, Yoon S M, et al. Treatment characteristic of 1, 4-dioxane by ozone-based advanced oxidation[J]. Journal of Industrial and Engineering Chemistry, 2012, 18(6):1951-1955. |
| [14] | Shin J, Lee Y C, Ahn Y, et al. 1, 4-dioxane degradation by oxidation and sonication in the presence of different-sized ZVI in open-air system[J]. Desalination and Water Treatment, 2012, 50(1/3):102-114. |
| [15] | 陈梦舫, 骆永明, 宋 静, 等. 场地含水层氯代烃污染物自然衰减机制与纳米铁修复技术的研究进展[J]. 环境监测管理与技术, 2011, 23(3):85-89.CHEN Meng-fang, LUO Yong-ming, SONG Jing, et al. Natural attenuation mechanisms and the status of nano-iron technology for the remediation of chlorinated solvents in groundwater[J]. The Administration and Technique of Environmental Monitoring, 2011, 23(3):85-89. |
| [16] | 张凤君, 王斯佳, 马 慧, 等. 三氯乙烯和四氯乙烯在土壤和地下水中的污染及修复技术[J]. 科技导报, 2012, 30(18):65-72.ZHANG Feng-jun, WANG Si-jia, MA Hui, et al. Contaminations and remediation technologies of trichloroethylene and perchloroethylene in the soil and groundwater:A review[J]. Science & Technology Review, 2012, 30(18):65-72. |
| [17] | Mahendra S, Grostern A, Alvarez-Cohen L. The impact of chlorinated solvent co-contaminants on the biodegradation kinetics of 1, 4-dioxane[J]. Chemosphere, 2013, 91(1):88-92. |
| [18] | Lee Y C, Lo S L, Chiueh P T, et al. Microwave-hydrothermal decomposition of perfluorooctanoic acid in water by iron-activated persulfate oxidation[J]. Water Research, 2010, 44(3):886-892. |
| [19] | Gu X, Lu S, Li L, et al. Oxidation of 1, 1, 1-trichloroethane stimulated by thermally activated persulfate[J]. Industrial & Engineering Chemistry Research, 2011, 50(19):11029-11036. |
| [20] | Furman O S, Teel A, Watts R J. Mechanism of base activation of persulfate[J]. Environmental Science & Technology, 2010, 44(16):6423-6428. |
| [21] | Yang S, Wang P, Yang X, et al. A novel advanced oxidation process to degrade organic pollutants in wastewater:Microwave-activated persulfate oxidation[J]. Journal of Environmental Sciences, 2009, 21(9):1175-1180. |
| [22] | Lin Y T, Liang C, Chen J. Feasibility study of ultraviolet activated persulfate oxidation of phenol[J]. Chemosphere, 2011, 82(8):1168-1172. |
| [23] | Yan J, Lei M, Zhu L, et al. Degradation of sulfamonomethoxine with Fe3O4 magnetic nanoparticles as heterogeneous activator of persulfate[J]. Journal of Hazardous Materials, 2011, 186(2):1398-1404. |
| [24] | Chen W S, Su Y C. Removal of dinitrotoluenes in wastewater by sono-activated persulfate[J]. Ultrasonics Sonochemistry, 2012, 19(4):921-927. |
| [25] | Li B, Li L, Lin K, et al. Removal of 1, 1, 1-trichloroethane from aqueous solution by a sono-activated persulfate process[J]. Ultrasonics Sonochemistry, 2013, 20(3):855-863. |
| [26] | Stefan M I, Bolton J R. Mechanism of the degradation of 1, 4-dioxane in dilute aqueous solution using the UV/hydrogen peroxide process[J]. Environmental Science & Technology, 1998, 32(11):1588-1595. |
| [27] | Beltran F J, Gonzalez M, Acedo B, et al. Contribution of free radical oxidation to eliminate volatile organochlorine compounds in water by ultraviolet radiation and hydrogen peroxide[J]. Chemosphere, 1996, 32(10):1949-1961. |
| [28] | Getoff N. Advancements of radiation induced degradation of pollutants in drinking and waste water[J]. Applied Radiation and Isotopes, 1989, 40(7):585-594. |
| [29] | Tratnyek P, Powell J, Waldemer R. Improved understanding of in situ chemical oxidation contaminant oxidation kinetics[R]. Oregon Health & Science University. SERDP Project ER-1289, Final report, 2007. |
| [30] | Huie R E, Clifton C L, Kafafi S A. Rate constants for hydrogen abstraction reactions of the sulfate radical, SO4-:Experimental and theoretical results for cyclic ethers[J]. Journal of Physics Chemistry, 1991, 95:9336-9340. |
| [31] | Mumford K G, Thomson N R, Allen-King R M. Bench-scale investigation of permanganate natural oxidant demand kinetics[J]. Environmental Science & Technology, 2005, 39(8):2835-2840. |
| [32] | Mahamuni N N, Adewuyi Y G. Advanced oxidation processes(AOPs)involving ultrasound for waste water treatment:A review with emphasis on cost estimation[J]. Ultrasonics Sonochemistry, 2010, 17(6):990-1003. |
| [33] | Tsitonaki A, Petri B, Crimi M, et al. In situ chemical oxidation of contaminated soil and groundwater using persulfate:A review[J]. Critical Reviews in Environmental Science and Technology, 2010, 40(1):55-91. |
| [34] | House D A. Kinetics and mechanisms of oxidation by peroxydisulfate[J]. Chemical Reviews, 1962, 62(3):185-203. |
| [35] | Ji Y, Ferronato C, Salvador A, et al. Degradation of ciprofloxacin and sulfamethoxazole by ferrous-activated persulfate:Implications for remediation of groundwater contaminated by antibiotics[J]. Science of the Total Environment, 2014, 472:800-808. |
| [36] | Cho J, Fiacco R J, Brown A, et al. Evaluation of technologies for in situ remediation of 1, 1, 1-trichloroethane[C]//Proceedings of the Third International Conference on Remediation of Chlorinated and Recalcitrant Compounds Monterey, CA. Gavaskar A R, Chen A S C, eds. Columbus, Ohio:Battelle Press. 2002. |
| [37] | Huang K C, Couttenye R A, Hoag G E. Kinetics of heat-assisted persulfate oxidation of methyl tert-butyl ether(MTBE)[J]. Chemosphere, 2002, 49(4):413-420. |
| [38] | Peyton G R. The free-radical chemistry of persulfate-based total organic carbon analyzers[J]. Marine Chemistry, 1993, 41(1-3):91-103. |
| [39] | Tsitonaki A. Treatment trains for the remediation of aquifers contaminated with MTBE and other xenobiotic compounds[D]. Technical University of Denmark, Department of Environmental Engineering. 2008. |
| [40] | 顾小钢, 吕树光, 邱兆富, 等. 热活化过硫酸钠处理水溶液及泥浆系统中1, 1, 1-三氯乙烷的研究[J]. 环境科学学报, 2012, 32(6):1374-1380.GU Xiao-gang, LÜ Shu-guang, QIU Zhao-fu, et al. Oxidation of 1, 1, 1-trichloroethane in aqueous and slurry systems by thermally activated persulfate[J]. Acta Scientiae Circumstantiae, 2012, 32(6):1374-1380. |
 2015, Vol. 34
2015, Vol. 34