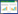文章信息
- 陈银萍, 蘧苗苗, 苏向楠, NGABIRE Maurice, 杨志娟, 杨述文, 摆玉林
- CHEN Yin-ping, QU Miao-miao, SU Xiang-nan, NGABIRE Maurice, YANG Zhi-juan, YANG Shu-wen, BAI Yu-lin
- 外源一氧化氮对镉胁迫下紫花苜蓿幼苗活性氧代谢和镉积累的影响
- Effect of Exogenous Nitric Oxide on Active Oxygen Metabolism and Cadmium Accumulation in Alfalfa Seedlings Under Cadmium Stress
- 农业环境科学学报, 2015, 34(12): 2261-2271
- Journal of Agro-Environment Science, 2015, 34(12): 2261-2271
- http://dx.doi.org/10.11654/jaes.2015.12.003
-
文章历史
- 收稿日期: 2015-06-24
近几十年来,随着全球人口的快速膨胀、工农业生产的快速发展,大量的重金属排放给环境和人类的健康带来了极大的危害[1],也使得土壤重金属污染成为日益严重和亟待解决的环境问题[2]。长期大量施用含镉(Cd)化肥、污水灌溉、矿物开采和加工以及大气沉降等因素,使得农田土壤Cd污染越来越严重,过量Cd不但会损害植物细胞,影响植物的细胞代谢、形态结构及生长发育,对植物造成严重的毒害效应,还会随着食物链进行累积,最终损害人类自身的健康和发展[3, 4]。因此,探讨植物Cd胁迫的解毒机理对农业的可持续发展具有重要意义。
紫花苜蓿(Medicogo sativa L.)是多年生草本植物,其根系比较发达、枝叶茂盛、适应性较强、产草量高,在牧草业被认为是牧草之最[5],其品质与产量的好坏对畜牧业影响重大。紫花苜蓿对重金属的抗性比较强,并且具有很好的吸收富集能力,其中对Cd的吸收系数最大,已有研究证明紫花苜蓿对Cd污染土壤的修复能力最好[6]。紫花苜蓿幼苗抗氧化系统的作用能力在低剂量Cd胁迫下升高,而在高剂量Cd作用下则下降,表明膜脂过氧化程度加剧,活性氧(ROS)过量积累是Cd伤害紫花苜蓿幼苗和其生物量下降的主要原因[7]。
一氧化氮(NO)是一种新的植物生长调节信号分子,广泛参与植物各种生理过程的调节,尤其在植物生长发育[8]及其对干旱胁迫[9]、热胁迫[10]、盐胁迫[11]及紫外辐射[12]等逆境的响应中起着重要的作用。已有研究表明,NO也参与植物对各种重金属胁迫的信号应答。硝普钠(Sodium nitro-prusside,SNP,一种外源NO供体)预处理能减轻Cd、Pb胁迫对羽扇豆(Lupinus micranthus)根生长的抑制作用[13],缓解Cd胁迫对辣椒(Capsicum annuum)和蚕豆(Vicia faba)等幼苗的伤害[14, 15],缓解Cd对水稻(Oryza sativa)的伤害[16],缓解Mn对甘菊(Matricaria chamomilla)的伤害[17],减少水稻幼苗对Cd的积累[18],也参与调节Cd诱导绿藻(Coccomyxa subellipsoidea)的生理和代谢变化[19]。研究表明,作为重要的信号分子,NO在植物生长发育及其对逆境的响应等方面起着重要的调节作用,能够使非生物胁迫条件下的植物生长发育免受ROS的伤害,且其效应与植物细胞的生理条件及NO处理浓度有关。但NO并非越多越好,过量的NO与超氧阴离子经过一系列反应最终产生过氧亚硝酸(HOONO),HOONO具有很强的氧化性,能够损坏生物大分子,对植物体产生毒性,所以植物体内ROS和NO含量的关系对植物的正常生存非常重要[20]。
鉴于外源NO对Cd胁迫下紫花苜蓿幼苗生理特性影响及NO缓解Cd胁迫伤害的机理还不十分清楚,本研究以紫花苜蓿幼苗为材料,通过分析外源NO对Cd胁迫下紫花苜蓿幼苗叶、茎和根中膜脂过氧化、抗氧化酶系统、渗透调节物质和Cd含量的影响,探讨NO在植物重金属Cd胁迫响应中的作用及其机理,旨在分析外源NO在缓解Cd胁迫对紫花苜蓿幼苗生长损害的机理和作用,为探索Cd胁迫下紫花苜蓿的损伤、诱发防卫机制及紫花苜蓿用于修复重金属污染的土壤等方面提供一定的科学依据。
1 材料与方法 1.1 材料和试剂本实验选择‘甘农三号’紫花苜蓿种子(购自甘肃省农业科学研究院)。NO供体SNP(Na2[Fe(CN)5NO]·2H2O)购自Sigma公司,先用蒸馏水配成1000 μmol·L-1的母液,4 ℃ 保存,使用时按SNP浓度0、50、100、200、300、400、500、1000 μmol·L-1稀释。Cd胁迫处理用CdCl2·2.5 H2O(国药试剂),其他试剂均为国产分析纯。
1.2 实验设计选取均匀饱满的紫花苜蓿种子,采用热水浸泡法以提高种子发芽率,即将种子在 50~60 ℃ 蒸馏水中浸泡 30 min,取出晾干后播种。将处理后的种子以蛭石为栽培介质,种植于高度15 cm、口径20 cm 的塑料花盆中,共 45 盆,在室外小型温棚中培养,用 1/2 浓度Hoagland′s营养液每天浇灌。培养 20 d 左右,选择长势一致的幼苗将其全部小心地移植到高度4 cm、口径 3 cm 的塑料网杯中,于 120 mm 口径的玻璃培养皿中用 1/2 浓度Hoagland′s营养液培养,每个培养皿放置 5 个塑料小杯,每个小杯 10~15 株幼苗,每天更换营养液。2~3 d 后将玻璃培养皿分成 9 组,每组含 6 个玻璃培养皿,进行Cd胁迫和SNP处理。处理前首先设一系列CdCl2和SNP浓度梯度,进行 1/2 Hoagland′s营养液水培预处理紫花苜蓿幼苗 4 d,根据幼苗的生长情况筛选出 0.5 mmol·L-1 CdCl2为Cd胁迫浓度,0~1000 μmol·L-1为SNP处理浓度。
以浇 10 mL Hoagland′s营养液为对照(CK),共 9 个处理分别为:CK(SNP0+Cd0)、0 μmol·L-1(SNP0+Cd0.5)、50 μmol·L-1(SNP50+Cd0.5)、100 μmol·L-1(SNP100+Cd0.5)、200 μmol·L-1(SNP200+Cd0.5)、300 μmol·L-1(SNP300+Cd0.5)、400 μmol·L-1(SNP400+Cd0.5)、500 μmol·L-1(SNP500+Cd0.5)、1000 μmol·L-1(SNP1000+Cd0.5)。为了保证处理浓度的稳定性,处理期间每 2 d 更换 1 次营养液。实验设 3 次重复。水培 5 d 后,分别对叶、茎、根进行混合取样,测定相关指标。
1.3 测定方法 1.3.1 粗酶液的制备分别剪取各处理紫花苜蓿幼苗叶、茎和根 0.5 g 置于预冷的研钵中,加入 50 mmol·L-1 pH7.8 的磷酸缓冲液 5 mL(内含2%聚乙烯吡咯烷酮)研磨匀浆,于4 ℃、10 000 r·min-1 离心 0.5 h,上清即为酶粗提液[21]。
1.3.2 超氧化物歧化酶(SOD)活性的测定利用SOD 对氮蓝四唑(NBT)的光抑制作用来测定[21]。在试管中分别加入不同体积的 0.05 mol·L-1磷酸缓冲液(pH7.8)、0.13 mol·L-1 Met 溶液、0.75 mmol·L-1 NBT溶液、0.1 mmol·L-1 EDTA-Na2溶液、0.02 mmol·L-1核黄素溶液、粗酶液和蒸馏水,混匀后把其中一支(对照管)遮光,与其他试管同时置于 4000 lx 的日光灯下反应 20 min,用黑布罩上各管终止反应。然后以遮光的对照管作为空白调零,在 560 nm 波长下测定各管的吸光度。
1.3.3 过氧化物酶(POD)活性的测定利用愈创木酚法测定[21]。取粗酶液 0.5 mL 于试管中,加入 0.05 mol·L-1磷酸缓冲液(pH7.8)1.5 mL,25 mmol·L-1愈创木酚 0.5 mL,0.2 mol·L-1 H2O2 0.5 mL,摇匀立即计时 3 min,每隔 1 min 读数1次,以0.5 mL 0.05 mol·L-1磷酸缓冲液替代粗酶液470 nm 波长下调零。
1.3.4 抗坏血酸氧化酶(APX)活性的测定利用紫外分光光度法测定[21]。取粗酶液0.05 mL 于试管中,加入反应混合液2.9 mL(含50 mmol·L-1 Tris-HCl缓冲液、0.1 mmol·L-1 EDTA、0.1 mmol·L-1 H2O2,pH7.0),0.05 mL 30 mmol·L-1 AsA溶液(启动反应),使用石英比色杯,用蒸馏水调零,在290 nm波长下测吸光度,每隔0.5 min读数 1 次,直至3.5 min。
1.3.5 谷胱甘肽还原酶(GR)活性的测定利用紫外分光光度法测定[21]。取粗酶液0.2 mL 于试管中,加入反应混合液2.65 mL(含50 mmol·L-1 Tris-HCl缓冲液、0.1 mmol·L-1 EDTA、5 mmol·L-1 MgCl2,pH7.5),0.1 mL 5 mmol·L-1 GSSG溶液,0.05 mL 3 mmol·L-1 NADPH溶液(启动反应),使用石英比色杯,用蒸馏水调零,在340 nm波长下测吸光度,每隔0.5 min读数 1 次,直至3.5 min。
1.3.6 丙二醛含量(MDA)测定利用硫代巴比妥酸法测定[22]。取粗酶液1 mL 于试管中,加入0.5%硫代巴比妥酸 2 mL 混匀,沸水浴 20 min后立即放于冰水浴中,冷却后 3000 r·min-1离心10 min,于532、600、450 nm 比色,以0.5%硫代巴比妥酸为空白。
1.3.7 相对电导率(REC)测定利用电导率仪法测定[23]。称取叶、茎和根鲜样 0.15 g,置于含 15 mL 蒸馏水(测定本电导率为R0)的具塞试管中,并让材料完全浸在水中(室温 180 r·min-1振荡 24 h 叶片完全沉浸),用电导率仪测定电导率R1;然后将试管转入沸水浴中煮沸 15 min(放入盛有热水的烧杯中加热1 h左右),冷却至 25 ℃后再次测定电导率R2。
1.3.8 可溶性蛋白(SP)测定利用紫外分光光度法测定[23]。分别称取叶、茎和根 0.2 g,用 5 mL 蒸馏水或缓冲液研磨成匀浆,3000 r·min-1离心10 min,取上清液 1.0 mL,根据蛋白质浓度,用 0.1 mol·L-1 pH7.0 磷酸缓冲液适当稀释后,测定280、 260 nm 波长处吸光度,以pH7.0磷酸缓冲液为空白调零。
1.3.9 脯氨酸(Pro)测定利用酸性茚三酮比色法测定[23]。分别称取叶、茎和根 0.2 g,剪碎,加 8 mL 3%的磺基水杨酸在沸水浴中提取 10 min,冷却后 4000 r·min-1 离心10 min,吸取 2 mL 上清液于另一干净的带玻璃球塞试管中,再加入 2 mL蒸馏水,2 mL 冰醋酸及 4 mL 酸性茚三酮试剂,在沸水浴中加热 60 min,冷却后加入 5 mL 甲苯,摇荡 0.5 min 充分混合、避光静置充分分层(4 h),轻轻吸取上层脯氨酸红色甲苯溶液于 520 nm 波长处测吸光度,以甲苯为空白对照。
1.3.10 类胡萝卜素(Car)测定利用紫外分光光度法测定[23]。分别称取叶和茎 0.2 g,加少量石英砂和碳酸钙粉及 2 mL 95% 乙醇,研磨至组织匀浆变白,再用 6 mL 乙醇分 3 次 洗入 10 mL 离心管中,静止 3~5 min,4000 r·min-1离心 10 min,上清液转入 25 mL 棕色容量瓶中用95%的乙醇定容,测定665、649、 470 nm 波长处吸光度,以95%乙醇为空白对照。
1.3.11 过氧化氢(H2O2)测定利用硫代巴比妥酸法测定[24]。分别称取叶、茎和根 0.5 g,加 6 mL 4 ℃下预冷的丙酮和少许石英砂研磨成匀浆,3000 r·min-1离心 10 min,用移液管吸取样品上清液 1 mL,分别加入 0.1 mL 5%的硫酸钛和0.2 mL 浓氨水,待沉淀形成后 3000 r·min-1离心10 min,沉淀用丙酮反复洗涤 3~5 次,直到去除植物色素,向洗涤后的沉淀中加入 5 mL 2 mol·L-1的硫酸,待沉淀完全溶解后,转入 10 mL 容量瓶中定容,于 415 nm 波长处测吸光度。
1.3.12 超氧阴离子(O2-·)测定利用羟胺氧化法测定[25]。分别称取叶、茎和根 0.2 g,加入 3 mL 65 mmol·L-1 磷酸钾缓冲液(pH7.18)及少许石英砂研磨成匀浆,10 000 r·min-1离心 15 min,取上清液并定容至 3 mL,此液即为植物 O2-·提取液。分别取 65 mmol·L-1磷酸钾缓冲液 0.15 mL加入试验组、对照组和空白调零组,其中试验组和空白调零组均加入 10 mmol·L-1盐酸羟胺 0.11 mL(对照组用0.11 mL蒸馏水取代),摇匀,25 ℃水浴加热 10 min,向试验组和对照组分别加入上清液 0.15 mL(空白调零组用 0.15 mL 65 mmol·L-1磷酸钾缓冲液取代),摇匀,25 ℃ 水浴 20 min,分别加入 58 mmol·L-1磺胺 1 mL,摇匀,再加入 7 mmol·L-1 A-萘胺1 mL,摇匀,25 ℃ 水浴 20 min,加入等体积(3 mL)色素萃取液三氯甲烷,并于10 000 r·min-1离心 3 min,取粉红色水相(上层)测得 530 nm 波长下吸光度。
1.3.13 植株Cd含量测定植物样品采用硝酸-高氯酸消煮,用美国Nicolet公司的220型火焰原子吸收分光光度计测定[26]。
1.4 数据分析采用Excel 2007进行数据处理和图表绘制,采用3次重复的平均值±标准偏差表示。用SPSS 19.0软件进行单因素方差分析、多重比较(LSD最小显著差数法)、相关性和逐步回归分析。
2 结果与分析 2.1 外源NO对镉胁迫下紫花苜蓿幼苗膜脂过氧化的影响植物细胞遭受逆境后,其选择透过性就会改变或丧失,细胞内物质大量外渗,从而引起组织浸泡液的电导率变化,通过测定外渗电导率的变化,就可以反映出膜的伤害程度。Cd胁迫下,紫花苜蓿幼苗叶和根中REC较对照显著升高(P < 0.05),表明Cd胁迫使叶和根细胞膜受到严重伤害。1000、500、400 μmol·L-1 SNP处理分别使Cd胁迫下叶、茎和根中REC显著降低并达到最低值(P < 0.05),表明SNP可以在一定程度上缓解Cd胁迫对细胞膜造成的伤害(图 1A )。

|
| 图中不同小写字母表示各处理间差异显著(P < 0.05)。下同 Different letters indicate significant differences between different treatments(P < 0.05). The same below. 图 1 外源NO 对Cd 胁迫下紫花苜蓿幼苗叶、茎、根中相对电导率和MDA、O2-·、H2O2含量的影响 Figure 1 Effects of NO on REC,MDA,O2-·and H2O2 in leaves,stems and roots of alfalfa seedlings under Cd stress |
MDA 是膜脂过氧化的最终分解产物,是植物细胞膜质过氧化程度的体现,其含量高说明植物细胞膜脂过氧化程度高,细胞膜受到的伤害严重[27]。Cd胁迫下,叶、茎、根中MDA含量均显著升高(P < 0.05),表明Cd胁迫使叶、茎、根细胞发生了膜脂过氧化。不同浓度SNP处理均能降低MDA含量,其中300、200 μmol·L-1处理分别使叶和茎中的MDA含量最低(P < 0.05),低浓度SNP处理使根中MDA含量显著降低(P < 0.05),而高浓度SNP处理使MDA含量有所升高,但总体没有超过Cd胁迫而未施SNP处理的程度,表明SNP可以在一定程度上缓解由Cd胁迫引起的膜脂过氧化(图 1B )。
同样地,Cd胁迫下,紫花苜蓿幼苗叶、茎和根中O2-·含量显著升高(P < 0.05),根中H2O2含量显著升高(P < 0.05)。300 μmol·L-1 SNP处理使叶和根中、400 μmol·L-1 SNP处理使茎中O2-·含量降至最低(P < 0.05),500 μmol·L-1 SNP处理使叶和茎中H2O2含量最低(P < 0.05),低浓度SNP处理使根中H2O2含量显著降低。虽然高浓度SNP处理使根中H2O2含量有所升高,但总体没有超过Cd胁迫而未施SNP处理的程度(图 1C 、图 1D),300 μmol·L-1处理使根中H2O2含量最低(P < 0.05)。这表明重金属Cd胁迫致使紫花苜蓿幼苗体内O2-·和H2O2等活性氧含量上升,导致并加剧了细胞膜脂过氧化;膜脂过氧化导致MDA的积累和细胞电解质外渗,从而使植物器官的REC升高。而一定浓度的SNP处理能在一定程度上降低Cd胁迫下紫花苜蓿幼苗体内O2-·和H2O2含量,相应地MDA含量和REC降低,缓解了活性氧引起的细胞膜脂过氧化,减轻了细胞膜受伤害程度。
2.2 外源NO对镉胁迫下紫花苜蓿幼苗抗氧化酶活性的影响植物在重金属胁迫下,会发生膜脂过氧化,为缓解和防御膜脂过氧化,植物体内的抗氧化酶系统被启动,以清除活性氧,保证自身内环境平衡。SOD是生物体内O2-·的清除剂,SOD清除O2-·的同时会产生H2O2,而POD主要酶促H2O2降解成H2O,从而减少有害物质对细胞的损伤[14]。APX也是清除H2O2的主要酶类,它可以催化H2O2还原为H2O[7]。GR利用还原型辅酶Ⅱ(NADPH)的电子将氧化型谷胱甘肽(GSSG)还原为还原型谷胱甘肽(GSH),使细胞内GSH保持在还原状态,在维持AsA-GSH循环的有效运行及氧化胁迫的响应中具有重要作用[7]。
与CK相比,Cd胁迫使紫花苜蓿幼苗叶和茎中SOD活性分别增强了4.28%和11.23%(P < 0.05)。SNP处理对叶中SOD活性影响不显著(P>0.05),低浓度SNP处理使茎和根中SOD活性增强,100 μmol·L-1处理使茎和根中SOD活性达到最高(P < 0.05),而高浓度SNP处理则降低了SOD活性(图 2A )。相似地,Cd胁迫使紫花苜蓿叶中POD活性增强了17.01%(P < 0.05)。不同浓度SNP处理均能增强Cd胁迫下紫花苜蓿幼苗POD活性(图 2B ),其中100 μmol·L-1处理使叶中、400 μmol·L-1处理使茎和根中POD活性达到最高(P < 0.05)。Cd胁迫下,叶、茎和根中APX活性均增强,其中根中增强了56.25%(P < 0.05)。不同浓度SNP处理均能增强Cd胁迫下紫花苜蓿幼苗APX活性(图 2C ),其中50 μmol·L-1处理使叶、茎和根中APX活性均达到最高(P < 0.05)。Cd胁迫下,茎中GR活性增强了13.07%(P < 0.05),根中则降低了12.94%(P < 0.05)。不同浓度SNP处理也能增强Cd胁迫下紫花苜蓿幼苗GR活性,其中,100 μmol·L-1处理使叶和茎中、500 μmol·L-1处理使根中(P < 0.05)GR活性分别达到最高(图 2D )。以上结果表明外施NO供体SNP 能够显著提高植株SOD、POD、APX和GR活性,增强了其对O2-·和H2O2的清除能力,在清除H2O2 的过程中,POD和APX 与SOD 协同作用,共同保护植物不受过多活性氧的伤害。
|
| 图 2 外源NO 对Cd 胁迫下紫花苜蓿幼苗叶、茎、根中SOD、POD、APX、GR活性的影响 Figure 2 Effects of NO on activities of SOD,POD,APX and GR in leaves,stems and roots of alfalfa seedlings under Cd stress |
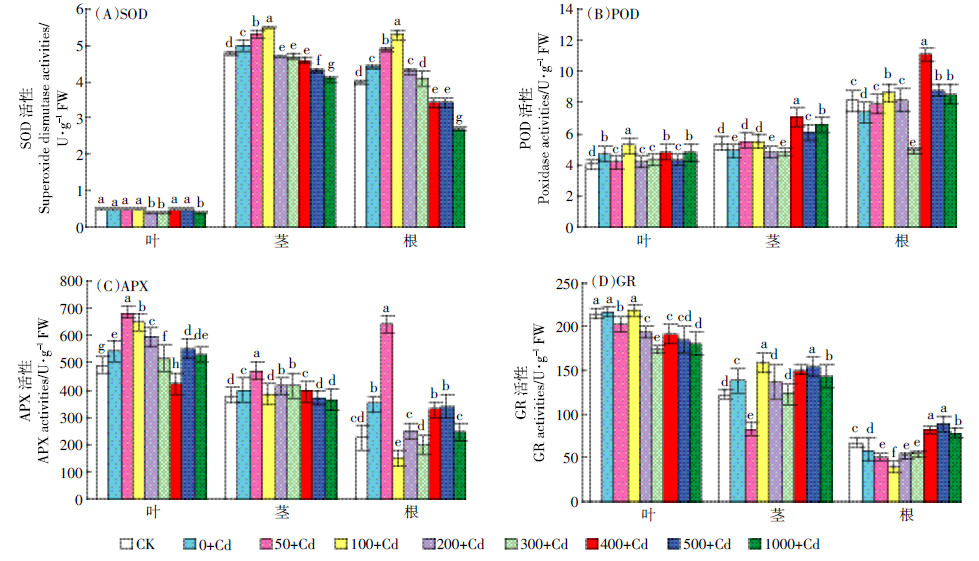
植物体内清除活性氧、保护细胞的系统除SOD、POD、APX、GR等抗氧化酶外,还有Pro、SP和Car等渗透调节物质。Pro在稳定生物大分子结构、降低细胞酸性、解除氨毒以及作为能量库调节细胞氧化还原势等方面起重要作用,Car则可以清除逆境或衰老过程中累积的自由基、活性氧[15]。Cd胁迫引起了叶、茎和根中Pro含量的显著增加(P < 0.05)。低浓度SNP处理后进一步促进了Pro的积累(图 3A ),其中,400 μmol·L-1处理使叶和根中、100 μmol·L-1处理使茎中Pro含量达到最大值(P < 0.05)。
|
| 图 3 外源NO 对Cd 胁迫下紫花苜蓿幼苗叶、茎、根中脯氨酸、可溶性蛋白、类胡萝卜素含量的影响 Figure 3 Effects of NO on content of proline,soluble protein and carotenoid in leaves,stems and roots of alfalfa seedlings under Cd stress |
与Pro类似,Cd胁迫引起了叶、茎中SP含量和叶中Car含量的显著增加(P < 0.05),不同浓度SNP均能提高Cd胁迫下紫花苜蓿幼苗SP和Car含量,其中,400 μmol·L-1处理使叶中、50 μmol·L-1处理使根中SP(图 3B)含量分别达到最高(P < 0.05),200、300 μmol·L-1处理使叶和茎中Car(图 3C)含量最高(P < 0.05)。由此可以看出SNP对Cd胁迫的缓解作用是显著的。
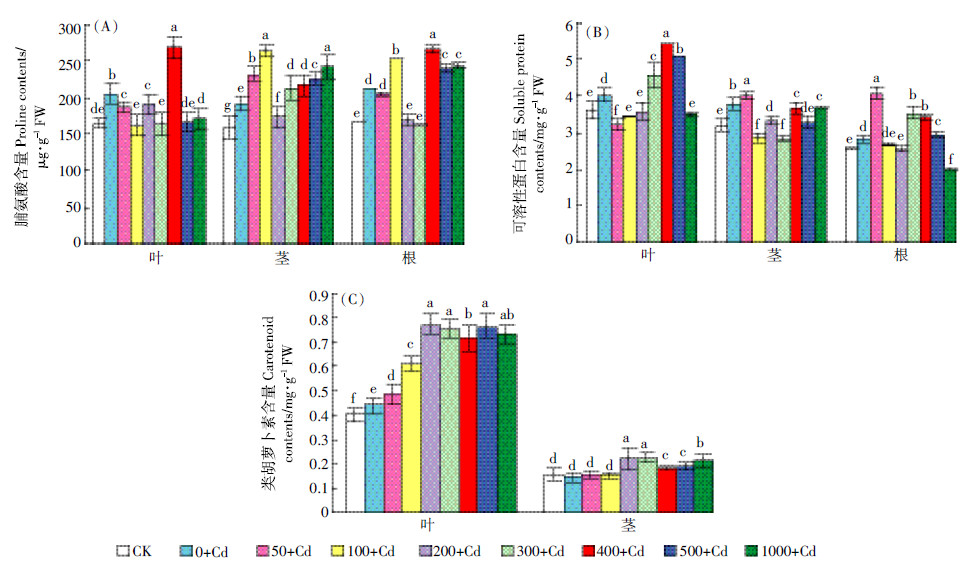
2.4 外源NO 对镉胁迫下紫花苜蓿幼苗重金属镉含量的影响Cd胁迫下,紫花苜蓿幼苗叶、茎和根中Cd含量显著增加(P < 0.05),与CK相比分别增加了4755%、5596%和1158%。不同浓度SNP均能降低Cd胁迫下紫花苜蓿幼苗Cd含量,呈现低浓度降低,高浓度升高的趋势,但总体没有超过Cd胁迫而未施SNP处理下的Cd含量。其中,200μmol·L-1处理使叶和茎中、100μmol·L-1处理使根中Cd含量最低(P < 0.05),与Cd胁迫而未施SNP处理相比分别降低了86.56%、93.50%和11.46%(图 4)。
|
| 图 4 外源NO 对Cd 胁迫下紫花苜蓿幼苗叶、茎、根中Cd 含量的影响 Figure 4 Effects of NO on Cd content in leaves,stems and roots of alfalfa seedlings under Cd stress |
叶中Cd含量与H2O2和O2-·极显著正相关(P < 0.001),表明Cd的积累导致了活性氧的产生;与POD、APX、GR、SOD正相关,表明Cd的积累诱导了抗氧化酶系统以清除活性氧;与渗透调解物质Pro、SP负相关,与Car极显著负相关(P < 0.001),表明渗透调解物质的形成减少了Cd的积累;与SNP负相关,表明外源NO能减缓Cd的积累。而SNP与MDA、H2O2、O2-·负相关,与REC极显著负相关(P < 0.01),与SP、Car、POD正相关,表明SNP能通过增强抗氧化酶活性和增加渗透调解物质的含量来减少活性氧的形成,缓解Cd胁迫对叶片的膜脂过氧化损伤,并减少Cd在叶中的积累。逐步回归分析结果如下:
Y=116.444-187.345X1-0.205X2+13.361X3+4.509X4
其中Y为Cd含量,X1为Car,X2为Pro,X3为POD,X4为O2-·。相关性分析结果相同(表 1)。
 |
茎中Cd含量与活性氧产生、渗透调解物质、抗氧化酶及SNP的相关性均不显著(P>0.05)。根中与叶中相似,逐步回归分析的结果为:
Y=889.147-37.542X1+6.373X2
其中Y为Cd含量,X1为SOD,X2为O2-·。逐步回归分析结果与相关性分析结果相同,表明Cd的积累导致了O2-·的产生,诱导了SOD活性的增强以清除O2-·,缓解Cd胁迫对根的膜脂过氧化损伤,并减少Cd在根中的积累(表 1)。
3 讨论Cd胁迫下,Cd2+进入植物细胞后能够结合酶活性中心或蛋白巯基,取代蛋白反应中心的Ca2+、Mg2+、Fe2+等必需金属,向细胞中释放自由离子,引起氧化胁迫和膜脂过氧化,导致膜结构的损伤[27]。Cd也能刺激脂氧合酶和NADPH氧化酶活性升高,使细胞内O2-·和H2O2等活性氧生成增加,从而导致细胞内活性氧水平升高。低浓度Cd胁迫下植物体内SOD、APX、CAT等抗氧化酶活性均受到抑制,但随着胁迫时间延长,这些抗氧化酶活性又逐渐恢复甚至升高。H2O2作为信号分子,其积累也能够诱导CAT和APX基因的表达,激活细胞的抗氧化系统,如芦苇(Phragmites australis)在Cd胁迫时叶片SOD活性随Cd浓度的增加而增强[28],观光木(Michelia odora)在Cd胁迫时POD活性随着Cd浓度的增加而增强[29]。本研究中Cd胁迫下紫花苜蓿叶、茎、根部位REC变化大,MDA、H2O2含量和O2-·产生速率都显著增加,Cd含量同样显著增加,与尹国丽等[7]的研究结果一致,说明Cd胁迫使紫花苜蓿叶、茎、根细胞膜系统发生了膜脂过氧化。但是,Cd胁迫下生成的O2-·和H2O2等活性氧作为信号分子,其积累能够诱导CAT和APX基因的表达,激活细胞的抗氧化系统。本研究中,Cd胁迫下SOD、POD、APX和GR等抗氧化酶的活性增强,Pro、SP和Car等渗透调解物质的含量均增加,说明紫花苜蓿通过增强抗氧化酶活性,提高渗透调节物质含量来缓解Cd胁迫引起的膜脂过氧化,降低MDA含量和REC,从而能较好地维持细胞膜的稳定性,提高对Cd胁迫的抗性。相关性和逐步回归分析的结果进一步证实了这一研究结果。
已有研究表明,NO可以很快消除由胁迫引起的超氧阴离子以及脂质自由基,使对植物产生损害作用的ROS过程减缓,进而促使抗氧化系统迅速启动,如25、100 μmol·L-1 SNP诱导Pb胁迫下小麦幼苗叶中CAT活性增强[30],100 μmol·L-1 SNP处理明显缓解了Pb胁迫对玉米幼苗生长的抑制作用,促进了幼苗Pro和SP含量的积累[31]。本研究中,Cd处理诱导了茎和根中SOD、叶中POD、叶和茎中GR及叶、茎、根中APX 活性和Pro、SP、Car等渗透调解物质含量的提高,表明SOD、POD、APX、GR及Pro、SP、Car对Cd胁迫导致的紫花苜蓿活性氧伤害具有保护作用。而施加SNP后,进一步提高了茎和根中SOD及叶、茎、根中POD、APX和GR活性,Pro、SP、Car含量也显著提高,表明SNP释放的NO作为信号分子,一方面能够调节ROS代谢进而清除O2-·,阻断ROS参与的伤害效应[32];另一方面NO能诱导防御基因的表达,增强抗氧化酶的活性,增加Pro、SP及Car含量,可以在一定程度上直接清除Cd胁迫产生的活性氧,阻止其在紫花苜蓿体内的积累[33, 34]。
不同浓度的SNP对紫花苜蓿叶、茎和根中抗氧化酶的影响不尽相同,如100 μmol·L-1 SNP处理显著增强幼苗SOD活性,显著增强叶和茎中GR活性,而显著降低根中GR活性等。与本研究结果类似,Kopyra等[13]研究表明,用外源NO预处理1 d 可显著提高Cd胁迫下羽扇豆根尖CAT和SOD活性,而王松华等[35]的研究结果则表明外源NO能够提高Cd胁迫下绿豆幼苗根尖APX和SOD活性,降低POD活性。这种差异可能与Cd胁迫过程中SOD、POD、APX和GR在膜脂过氧化过程中所起的作用不同有关,也可能与NO在信号传导过程中不同的酶所在的位置有关。现已知道,NO可通过直接与CAT、APX、POD等抗氧化酶类中血红素铁结合来调节它们的活性,也可作为信号分子通过cGMP途径或与信号分子H2O2、SA协同作用等多种途径对抗氧化酶类进行调节[14]。
外源NO浓度过高对生物体也具有毒害作用,NO对植物体的生理生化代谢具有双重性影响,低浓度(0.05、0.1、0.2 mmol·L-1)SNP处理能降低小麦叶片中H2O2和MDA含量,而高浓度(0.5 mmol·L-1)SNP处理则增加其含量,低浓度(0.2、0.5 mmol·L-1)SNP能促进杨树叶片的光合作用,高浓度(1.2 mmol·L-1)SNP则明显抑制其光合作用[36]。本研究结果表明,低浓度NO(50、100、200、300、400 μmol·L-1)处理能缓解Cd胁迫诱导的氧化损伤对紫花苜蓿细胞膜造成的伤害;高浓度NO(500、1000 μmol·L-1)处理则无缓解作用,甚至与Cd共同诱导氧化损伤,证明了NO对植物作用的双重性。NO对Cd胁迫的抗逆性是一个复杂的过程,与很多生理生化过程和信号传递都有关系。所以,利用生物化学、基因工程等手段准确探明NO在紫花苜蓿抗逆性过程中的机理,是需要进一步研究的课题。
前期研究中,对外源NO在减缓重金属胁迫对植物危害方面的研究较少,而关于重金属胁迫下植物对外源NO响应的研究也鲜见报道。本试验中,Cd胁迫既导致了紫花苜蓿叶中活性氧的产生,也诱导了抗氧化酶系统清除活性氧,增加了渗透调解物质Pro和SP,特别是Car的形成,同时Cd的积累与SNP负相关,表明外源NO能减缓Cd的积累,而SNP与MDA、H2O2和O2-·负相关,特别是与REC极显著负相关,与SP、Car、POD正相关,表明SNP能通过增强抗氧化酶活性和增加渗透调解物质的含量来减少活性氧的形成,缓解Cd胁迫对叶片的膜脂过氧化损伤,并减少Cd在叶中的积累。逐步回归分析的结果表明Car、Pro、POD和O2-·是影响叶中Cd含量的主要因素。同样,逐步回归分析的结果表明SOD和O2-·是影响根中Cd含量的主要因素。但由于根是Cd最先接触和被吸收的部位,只有低浓度(50 μmol·L-1)的SNP处理降低了根中Cd含量,其余浓度SNP均显著增加了根中Cd含量。这与冉烈等[37]和Xiong等[8]的研究一致,表明作为植物信号分子的NO,浓度过高或过低都不能使信号物质起作用,只有适宜的浓度才能起到最佳的生物学效应,但与张义凯等[38]的研究结果不一致,具体原因有待从分子水平上进一步研究。
4 结论100 μmol·L-1 SNP 降低Cd胁迫下紫花苜蓿幼苗叶片和茎REC、MDA含量、O2-·产生速率,增加抗氧化酶活性和渗透调节物质的含量,降低Cd积累量;400 μmol·L-1 SNP可以降低Cd胁迫下紫花苜蓿幼苗根中REC、MDA含量和O2-·产生速率,增加抗氧化酶活性和渗透调节物质的含量,降低Cd积累量。Cd胁迫下一定浓度的外源SNP处理可以有效提高紫花苜蓿对Cd的耐受性,使Cd对紫花苜蓿的毒害得到一定程度的缓解。
| [1] | Xu X H, Zhao Y C, Zhao X T, et al. Sources of heavy metal pollution in agricultural soils of a rapidly industrializing area in the Yangtze Delta of China[J]. Ecotoxicology and Environmental Safety, 2014, 108:161-167. |
| [2] | 高 岚, 李泽琴, 李国臣. 土壤重金属污染植物修复研究动态[J]. 作物杂志, 2011(5):12-15. GAO Lan, LI Ze-qin, LI Guo-chen. Phytoremediation of heavy metal pollution[J]. Crops, 2011(5):12-15. |
| [3] | 冯世静, 杨途熙, 张艳军, 等. 镉胁迫对杨树光合特性的影响[J]. 农业环境科学学报, 2013, 32(3):539-547. FENG Shi-jing, YANG Tu-xi, ZHANG Yan-jun, et al. Effects of cadmium on photosynthetic gas exchange and chlorophyll fluorescence of two species of poplar[J]. Journal of Agro-Environment Science, 2013, 32(3):539-547. |
| [4] | 王新新, 吴 亮, 朱生凤, 等. 镉胁迫对碱蓬种子萌发及幼苗生长的影响[J]. 农业环境科学学报, 2013, 32(2):238-243. WANG Xin-xin, WU Liang, ZHU Sheng-feng, et al. Effects of cadmium stress on seed germination and seedling growth of Suaeda glauca[J]. Journal of Agro-Environment Science, 2013, 32(2):238-243. |
| [5] | 徐苏凌, 方 勇, 邢承华. 镉胁迫对紫花苜蓿生长及结瘤的影响[J]. 江西农业大学学报, 2008, 30(6):1049-1053. XU Su-ling, FANG Yong, XIN Cheng-hua. Effects of cadmium stress on seedling growth and nodulation of alfalfa[J]. Acta Agriculturae Universitatis Jiangxiensis, 2008, 30(6):1049-1053. |
| [6] | 王 新, 贾永锋. 紫花苜蓿对土壤重金属富集及污染修复的潜力[J]. 土壤通报, 2009, 40(4):932-935. WANG Xin, JIA Yong-feng. Heavy metals accumulation and phytoremediation of alfalfa in contaminated soil[J]. Chinese Journal of Soil Science, 2009, 40(4):932-935. |
| [7] | 尹国丽, 师尚礼, 寇江涛, 等. Cd胁迫对紫花苜蓿种子发芽及幼苗生理生化特性的影响[J]. 西北植物学报, 2013, 33(8):1638-1644. YIN Guo-li, SHI Shang-li, KOU Jiang-tao, et al. Seed germination and physiological and biochemical characteristics of alfalfa under cadmium stress[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(8):1638-1644. |
| [8] | Xiong J, Lu H, Lu K, et al. Cadmium decreases crown root number by decreasing endogenous nitric oxide, which is indispensable for crown root primordia initiation in rice seedlings[J]. Planta, 2009, 230(4): 599-610. |
| [9] | Arasimowicz J M, Floryszak W J, Kubiś J. Involvement of nitric oxide in water stress-induced responses of cucumber roots[J]. Plant Science, 2009, 177(6):682-690. |
| [10] | Song L L, Ding W, Shen J, et al. Nitric oxide mediates abscisic acid induced thermotolerance in the calluses from two ecotypes of reed under heat stress[J]. Plant Science, 2008, 175(6):826-832. |
| [11] | Zheng C F, Jiang D, Liu F L, et al. Exogenous nitric oxide improves seed germination in wheat against mitochondrial oxidative damage induced by high salinity[J]. Environmental and Experimental Botany, 2009, 67(1):222-227. |
| [12] | An L Z, Liu Y H, Zhang M X, et al. Effects of nitric oxide on growth of maize seedling leave in the presence or absence of ultraviolet-b radiation[J]. Journal of Plant Physiology, 2005, 162(3):317-326. |
| [13] | Kopyra M, Gwóz'dz E A. Nitric oxide stimulates seed germination and counteracts the inhibitory effect of heavy metals and salinity on root growth of Lupinus luteus[J]. Plant Physiology and Biochemistry, 2003, 41(11/12):1011-1017. |
| [14] | 陈世军, 张明生, 韦美玉. SNP处理的辣椒幼苗对Cd2+胁迫的生理响应[J]. 植物生理学通讯, 2009, 45(3):229-232. CHEN Shi-jun, ZHANG Ming-sheng, WEI Mei-yu. Physiological response of Capsicum frutescens L. var. longum bailey seedling with SNP to Cd2+ stress[J]. Plant Physiology Communications, 2009, 45(3):229-232. |
| [15] | 李 源, 魏小红, 朱 蕾, 等. 外源NO和H2O2对镉胁迫下蚕豆种子萌发及幼苗生长的保护效应[J]. 安徽农业科学, 2009, 37(11):4942-4944, 4959. LI Yuan, WEI Xiao-hong, ZHU Lei, et al. Protective effects of NO and H2O2 on seed germination and seedling growth of horsebean under Cd stress[J]. Journal of Anhui Agricultural Science, 2009, 37(11):4942-4944, 4959. |
| [16] | Prerna S, Kavita S. Evidences for reduced metal-uptake and membrane injury upon application of nitric oxide donor in cadmium stressed rice seedlings[J]. Plant Physiology and Biochemistry, 2014, 83:180-184. |
| [17] | Jozef K, Petr B, Josef H, et al. Manganese-induced oxidative stress in two ontogenetic stages of chamomile and amelioration by nitric oxide[J]. Plant Science, 2014, 215-216:1-10. |
| [18] | He J Y, Ren Y F, Chen X L, et al. Protective roles of nitric oxide on seed germination and seedling growth of rice(Oryza sativa L.) under cadmium stress[J]. Ecotoxicology and Environmental Safety, 2014, 108:114-119. |
| [19] | Jozef K, Bořivoj K, Petr B, et al. Nitric oxide donor modulates cadmium-induced physiological and metabolic changes in the green alga Coccomyxa subellipsoidea[J]. Algal Research, 2015, 8:45-52. |
| [20] | Ina S, Shekhawat G S. Nitric oxide(NO) in alleviation of heavy metal induced phytotoxicity and its role in protein nitration[J]. Nitric Oxide, 2013, 32:13-20. |
| [21] | 李忠光, 李江鸿, 杜朝昆, 等. 在单一提取系统中同时测定五种植物抗氧化酶[J]. 云南师范大学学报:自然科学版, 2002, 22(6):44-48. LI Zhong-guang, LI Jiang-hong, DU Chao-kun, et al. Simultaneous measurement of five antioxidant enzyme activities using a single extraction system[J]. Journal of Yunnan Normal University, 2002, 22(6):44-48. |
| [22] | 樊怀福, 郭世荣, 焦彦生, 等. 外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响[J]. 生态学报, 2007, 27(2):546-553. FAN Huan-fu, GUO Shi-rong, JIAO Yan-sheng, et al. The effects of exogenous nitric oxide on growth, active oxygen metabolism and photosynthetic characteristics in cucumber seedlings under NaCl stress[J].Acta Ecologica Sinica, 2007, 27(2):546-553. |
| [23] | 李合生, 孙 群, 赵世杰, 等. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000:164-261. LI He-sheng, SUN Qun, ZHAO Shi-jie, et al. The principle and technology of plant physiology and biochemistry experiment[M]. Beijing:Higher Education Press, 2000:164-261. |
| [24] | 张小莉, 王鹏程, 宋纯鹏. 植物细胞过氧化氢的测定方法[J]. 植物学报, 2009, 44(1):103-106. ZHANG Xiao-li, WANG Peng-cheng, SONG Chun-peng. Methods of detecting hydrogen peroxide in plant cells[J]. Chinese Bulletin of Botany, 2009, 44(1):103-106. |
| [25] | 李忠光, 龚 明. 植物中超氧阴离子自由基测定方法的改进[J]. 云南植物研究, 2005, 27(2):211-216. LI Zhong-guang, GONG Ming. Improvement of measurement method for superoxide anion radical in plant[J]. Acta Botanica Yunnanica, 2005, 27(2):211-216. |
| [26] | 陈春强, 李明顺, 赖燕平. 火焰原子吸收光谱法测定锰矿恢复区植物中重金属[J]. 环境监测管理与技术, 2009, 21(3):48-49. CHEN Chun-qiang, LI Ming-shun, LAI Yan-ping. Determination of manganese ore recovery of heavy metals in plants by flame atomic absorption spectrometry[J]. Administration and Technique of Environmental Monitoring, 2009, 21(3):48-49. |
| [27] | 朱涵毅, 陈益军, 劳佳丽, 等. 外源NO对镉胁迫下水稻幼苗抗氧化系统和微量元素积累的影响[J]. 生态学报, 2013, 33(2):603-609. ZHU Han-yi, CHEN Yi-jun, LAO Jia-li, et al. The effect of exogenous nitric oxide on activities of antioxidant enzymes microelements accumulation of two rice genotypes under cadmium stress[J]. Acta Ecologica Sinica, 2013, 33(2):603-609. |
| [28] | 李丽锋, 卢 佳, 苏芳莉. 镉(Cd)胁迫对芦苇叶片SOD、POD活性影响及动力学分析[J]. 沈阳农业大学学报, 2014, 45(3):326-330. LI Li-feng, LU Jia, SU Fang-li. Effect of cadmium stress on SOD/POD activitied in reed leaf and their dynamic models[J]. Journal of Shenyang Agricultural University, 2014, 45(3):326-330. |
| [29] | 廖克波, 刘昆成, 谢安德, 等. 镉胁迫对观光木幼苗生理特性的影响[J]. 广东农业科学, 2012(5), 47-49. LIAO Ke-bo, LIU Kun-cheng, XIE An-de, et al. Influence of Cd stress on the physiological characteristics of Tsoonpiodenron odorum Chun seedlings[J]. Guangdong Agricultural Science, 2012(5):47-49. |
| [30] | 魏学玲, 史如霞, 贾凌云, 等. 外源一氧化氮对Pb胁迫下小麦种子萌发及幼苗生理特性的影响[J]. 植物研究, 2011, 31(1):34-39. WEI Xue-ling, SHI Ru-xia, JIA Ling-yun, et al. Effects of nitric oxide on seed germination and physiological characteristics of wheat seedlings under lead stress[J]. Bulletin of Botanical Research, 2011, 31(1):34-39. |
| [31] | 王 芳, 张晓燕, 曹廷俊, 等. 外源一氧化氮对Pb胁迫下玉米的缓解作用[J]. 干旱地区农业研究, 2014, 32(4):24-30. WANG Fang, ZHANG Xiao-yan, CAO Ting-jun, et al. Mitigative effects of exogenous nitric oxide on Pb2+ stress in maize seedlings[J]. Agricultural Research in the Arid Areas, 2014, 32(4):24-30. |
| [32] | 陈银萍, 张满效, 陈 拓, 等. NO在植物生长发育和环境胁迫响应中的作用[J], 生态科学, 2007, 26(2):176-180. CHEN Yin-ping, ZHANG Man-xiao, CHEN Tuo, et al. Role of nitric oxide in plant development and stress responses[J]. Ecological Science, 2007, 26(2):176-180. |
| [33] | 李 源, 李金娟, 魏小红. 镉胁迫下蚕豆幼苗抗氧化能力对外源NO和H2O2的响应[J]. 草业学报, 2009, 18(6):186-191. LI Yuan, LI Jin-juan, WEI Xiao-hong. Responses of antioxidative capability in horsebean seedling to NO and H2O2 under Cd stress[J]. Acta Prataculturae Sinica, 2009, 18(6):186-191. |
| [34] | 宋 敏, 徐文竞, 彭向永, 等. 外源脯氨酸对镉胁迫下小麦幼苗生长的影响[J]. 应用生态学报, 2013, 24(1):129-134. SONG Min, XU Wen-jing, PENG Xiang-yong, et al. Effects of exogenous proline on the growth of wheat seedlings under cadmium stress[J]. Chinese Journal of Applied Ecology, 2013, 24(1):129-134. |
| [35] | 王松华, 周正义, 陈庆榆, 等. 外源一氧化氮对镉胁迫下绿豆幼苗根尖抗氧化酶的影响[J]. 激光生物学报, 2007, 16(1):62-67. WANG Song-hua, ZHOU Zheng-yi, CHEN Qing-yu, et al. Effects of exogenous nitric oxide on antioxidant enzymes responses of root tips in the mung bean seedlings under cadmium stress[J]. Acta Laser Biology Sinica, 2007, 16(1):62-67. |
| [36] | 张绪成, 上官周平, 高世铭. NO对植物生长发育的调控机制[J]. 西北植物学报, 2005, 25(4):812-818. ZHANG Xu-cheng, SHANGGUAN Zhou-ping, GAO Shi-ming. Regulation mechanism of nitric oxide to plant growth and development[J]. Acta Botanica Boreali-Occidentalia Sinica, 2005, 25(4):812-818. |
| [37] | 冉 烈, 李会合, 田秀英. 外源NO对镉胁迫下东南景天生长和镉累积的影响[J]. 中国农学通报, 2012, 28(19):60-64. RAN Lie, LI Hui-he, TIAN Xiu-ying. Effects of exogenous nitric oxide on growth and cadmium accumulation in Sedum alfredii Hance under Cd stress[J]. Chinese Agricultural Science Bulletin, 2012, 28(19):60-64. |
| [38] | 张义凯, 崔秀敏, 杨守祥, 等. 外源NO对镉胁迫下番茄活性氧代谢及光合特性的影响[J]. 应用生态学报, 2010, 21(6):1432-1438. ZHANG Yi-kai, CUI Xiu-ming, YANG Shou-xiang, et al. Effects of exogenous nitric oxide on active oxygen metabolism and photosynthetic characteristics of tomato seedlings under cadmium stress[J]. Journal of Applied Ecology, 2010, 21(6):1432-1438. |
 2015, Vol. 34
2015, Vol. 34