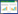文章信息
- 谭印月, 徐坚, 顾雪元, 王晓蓉, 童非, 谢锦宇, 姜洋
- TAN Yin-yue, XU Jian, GU Xue-yuan, WANG Xiao-rong, TONG Fei, XIE Jin-yu, JANG Yang
- 环丙沙星在黑土及其组分中的吸附行为及铜和钙的影响
- Soil Components and Cu2+ and Ca2+ Effects on Ciprofloxacin Adsorption by Black Soil
- 农业环境科学学报, 2015, 34(12): 2287-2294
- Journal of Agro-Environment Science, 2015, 34(12): 2287-2294
- http://dx.doi.org/10.11654/jaes.2015.12.006
-
文章历史
- 收稿日期: 2015-06-24
2. 南京大学金陵学院, 南京 210089
2. Nanjing University Jinling College, Nanjing 210089, China
环境中的抗生素(Antibiotics)污染问题近年来受到了广泛关注。如在美国50%~70%的地表水中检测出了抗生素[1]。抗生素在中国的使用量远高于大多数国家[2],最近调查报告显示,2013年中国抗生素总使用量约为16.2万t,其中52%为兽用抗生素,此用量比美国和英国的用量分别高出10倍和300倍[3]。抗生素可随畜禽粪便、制药废水等多种途径进入环境,其环境行为取决于土壤的物理化学性质、土壤类型和其他环境因素。吸附/解吸行为是抗生素在环境中的关键行为之一,决定了其生物有效性、环境中的迁移和降解速率[4]。
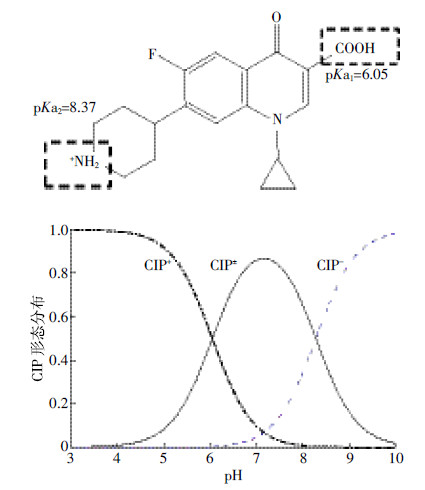
氟喹诺酮类抗生素(FQs)是目前使用较多的抗生素之一,主要通过抑制细菌DNA解旋酶而影响细菌的DNA复制过程。环丙沙星(CIP)是目前世界上应用最广泛的第二代FQs抗生素,它为两性物质,含羧基和胺基等多种官能团(图 1),可通过多种机制吸附于天然土壤表面,容易在土壤表面积累且迁移性小[5, 6, 7, 8]。由于天然土壤组成较复杂,含有黏土矿物、氧化物和土壤有机质等,在CIP的吸附过程中相互影响,彼此贡献,使吸附机制往往难以解释。
土壤环境中重金属-抗生素复合污染时有发生,早就有研究表明FQs能与金属阳离子形成稳定络合物[9]。以前的研究表明二价金属的存在可以提高土壤中FQs的持留,如Pei等[10]发现pH>6.0时 Cu2+明显增加了CIP在蒙脱土上的吸附,并认为这源于Cu2+的“桥联”效应。但这种金属的影响作用是否存在于天然土壤中尚不清楚。
本研究采用批量吸附实验考察了CIP在天然土壤上的吸附行为,通过去除土壤不同组分,探究了土壤主要组分(有机质、铁氧化物、黏土矿物)在吸附CIP过程中的作用特征以及贡献量。另一方面,由于Cu2+与CIP的络合能力较强,Ca2+是土壤中普遍存在的碱土金属,本文还分别考察了Cu2+和Ca2+对CIP在土壤上吸附的影响。研究结果将有助于更好地理解和评价CIP在污染土壤/水界面上的分布规律。
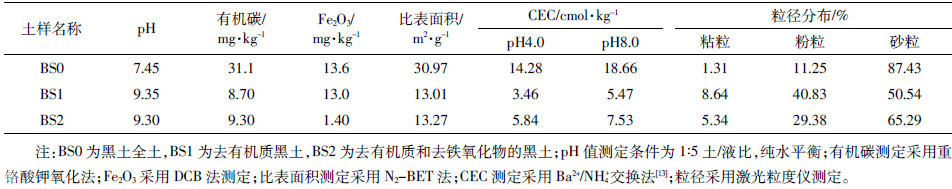
1 材料与方法 1.1 供试土壤实验采集的土壤来自黑龙江省五常市,取自0~20 cm土层,土样经自然风干,去掉植物残体和石块后过2 mm筛备用。土壤经测试分析均不含抗生素药物。供试土样的理化性质见表 1。为了更好地了解测试土壤的组分对抗生素吸附的贡献情况,本研究对采集的黑土进行了以下处理。
(1)去除有机质[11]:称取60 g供试土壤于2 L烧杯中,加入300 mL pH为8.0的1 mol·L-1 NaOCl溶液,室温下搅拌6 h,然后于2000×g下离心30 min,倾去上清液,此方法重复5次,最后一次处理后的土样用超纯水反复清洗去除多余的盐,冷冻干燥后备用,所获样品为BS1。由于此处理方法在室温下进行,对土壤中无定型铁氧化物结构的影响较H2O2热处理法小[11],可最大限度地保持土壤矿物表面性质。本研究比较了两种处理方法对土壤有机质的去除效果,发现本方法与H2O2热处理法效果相当。
(2)去除铁氧化物[12]:称取30 g上述去除有机质后冻干的样品于2 L塑料烧杯中,加入75 mL 0.28 mol·L-1柠檬酸钠和0.10 mol·L-1碳酸氢钠缓冲液,置于水浴锅中70 ℃水浴,2 h后加入1.5 g连二亚硫酸钠,用玻璃棒剧烈搅拌5 min后静置0.5 h,最后在2000×g转速下离心30 min,去掉上清液,用超纯水反复清洗去除多余的盐,冷冻干燥后备用,所获样品为BS2。
1.2 化学试剂环丙沙星CIP(纯度>98%)购自Sigma-Aldrich公司,贮藏于-20 ℃下备用。硝酸盐(铜、钙、钠)均为优级纯,购自国药集团化学试剂公司。乙腈为色谱纯。
1.3 实验方法 1.3.1 环丙沙星吸附动力学实验吸附实验参照OECD批量平衡方法进行[14]。设定悬浮浓度为2 g·L-1,即分别称取土样(BS0、BS1、BS2)0.02 g于25 mL离心管中,加入9 mL 0.01 mol·L-1 NaNO3背景溶液和1 mL 200 mg·L-1 CIP储备液(实验现用现配),CIP初始浓度均为 20 mg·L-1(0.06 mmol·L-1),用微量0.1 mol·L-1 HNO3溶液和0.1 mol·L-1 NaOH溶液调节pH至6。所有的玻璃管用锡箔纸包裹以避免光照带来的CIP降解,并置于25 ℃恒温振荡箱190 r·min-1平衡,分别在反应0.5、1、1.5、2、5、11、24、34、48、56、72 h时取样,以3000 r·min-1的转速离心10 min,取上清液过0.22 μm尼龙滤膜(实验前测试了CIP通过滤膜的回收率大于95%),用HPLC测定上清液中CIP的含量,由加入的CIP总浓度与滤液中的浓度之差得到CIP的吸附量。为了避免除土样吸附CIP外由其他因素造成的CIP减少而带来的实验误差,本实验设计了空白样品(无土样)的标准曲线,同其他实验样品同条件同时进行。
1.3.2 环丙沙星等温吸附实验实验方法与动力学实验类似。CIP的初始浓度范围为5~100 mg·L-1(0.015~0.3 mmol·L-1),以0.01 mol·L-1 NaNO3为背景溶液,pH 调节为6.0±0.2,平衡24 h后离心过滤,用HPLC测定CIP浓度,每个浓度设两个平行。
1.3.3 pH对CIP吸附的影响实验过程同动力学实验相似。CIP初始浓度为20 mg·L-1(0.060 mmol·L-1),背景电解液为0.01 mol·L-1 NaNO3,用0.1 mol·L-1 HNO3溶液和0.1 mol·L-1 NaOH溶液调节pH从3至9,平衡24 h后,立即测定悬浮液pH值,然后离心并过滤,用HPLC测定上清液CIP浓度。
1.3.4 Cu2+和Ca2+对CIP吸附的影响CIP初始浓度为20 mg·L-1(0.060 mmol·L-1),Cu2+和Ca2+的加入浓度与CIP的摩尔浓度相同,背景电解液为0.01 mol·L-1 NaNO3,用0.1 mol·L-1 HNO3溶液和0.1 mol·L-1 NaOH溶液调节pH从3至9,实验步骤与上述pH的影响实验一致。用HPLC测定上清液CIP浓度,同时用AAS测定上清液中金属Cu2+和Ca2+的浓度。
1.4 相关计算公式Langmuir公式: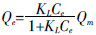 式中:Qe为单位质量的吸附剂表面吸附CIP的量,mol·kg-1;Qm为CIP在吸附剂表面的最大吸附能力,mol·kg-1;Ce为平衡溶液中CIP的浓度,mol·L-1;KL是Langmuir常数,L·mol-1,与吸附容量有关。
式中:Qe为单位质量的吸附剂表面吸附CIP的量,mol·kg-1;Qm为CIP在吸附剂表面的最大吸附能力,mol·kg-1;Ce为平衡溶液中CIP的浓度,mol·L-1;KL是Langmuir常数,L·mol-1,与吸附容量有关。
吸附系数Kd(L·kg-1)为CIP在固相中的浓度(Qe,mol·kg-1)和水相中平衡浓度(Ce,mol·L-1)的比值:

CIP在黑土及其组分中的吸附动力学过程主要分为快速反应和慢速平衡过程(图 2)。在刚加入不到0.5 h的时间里,反应非常迅速,几乎是瞬间完成,来不及检测反应过程;反应进行1 h后,吸附量达到总吸附量的80%左右,与文献中报道的四环素、CIP在土壤以及黏土矿物表面的反应过程相似[15, 16, 17]。由于反应初期,土壤中有效吸附点位最多,随着CIP吸附增加,有效吸附点位逐渐被CIP“占领”,吸附过程受阻并趋于平衡。

|
| 图 2 CIP 在黑土及其组分表面(BS0、BS1 和BS2)的吸附动力学曲线 Figure 2 Kinetics of CIP adsorption on black soil(BS0)and its components(BS1 and BS2) |
为确保吸附达到平衡,避免振荡时间过长带来CIP的降解,选择24 h作为后期CIP吸附实验的平衡时间。
2.2 土壤组分对CIP吸附等温线的影响CIP在黑土及其组分中的吸附等温线如图 3所示。在pH6.0条件下,三条曲线均表现出非线性特征,可采用Langmuir模型进行拟合(R2≥ 0.95),拟合参数见表 2。
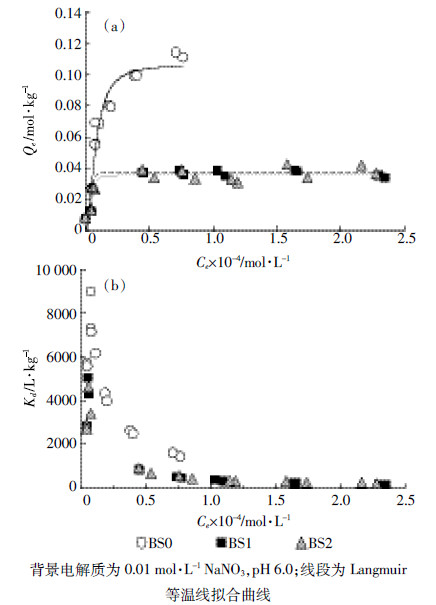
|
| 图 3 CIP在黑土及其组分表面吸附等温线(a)及其吸附分配常数曲线(b) Figure 3 Adsorption isotherms(a)and partition coefficient curves(b)of CIP on black soil and its components at pH 6 and 0.01 mmol·L-1 NaNO3 |
 |
由图 3a可以看出,在加入的CIP初始浓度较低时( < 0.06 mmol·L-1),三种土样(BS0、BS1、BS2)对CIP的吸附能力没有明显差别,可能是由于前期三种土样表面都有足够的点位用于CIP的吸附。随着CIP初始浓度的增加,三条曲线出现拐点,逐渐对CIP的吸附达到饱和状态,BS0、BS1、BS2对CIP吸附的分配系数Kd值最大分别为9008、5063、4583 L·kg-1 (图 3b),最大吸附量Qm分别为0.133、0.036 1、0.037 4 mol·kg-1。这说明黑土全土(BS0)对CIP的吸附容量远高于其他两种处理后的土样(BS1、BS2)。许多研究报道,CIP吸附于不同的土壤中,其Kd值范围为400~50 000 L·kg-1[18, 19, 20, 21, 22, 23],Kd值的变化范围往往与不同地区土壤的不同组分有关[16]。
与BS1和BS2相比,BS0富含有机质,对CIP的吸附量比其他两种土样最多可高出1.5倍,说明土壤有机质对CIP的吸附起到重要作用。但有机质对FQs吸附的影响还存在争议:Vasudevan等[23]观察到沙星在去除有机质的土壤上的吸附增加了,并认为是有机质阻碍了FQs在黏土表面有效位点的吸附;而Yan 等[24]发现腐植酸(HA)的存在明显促进诺氟沙星和环丙沙星在两种土壤表面的吸附能力,HA浓度越高吸附越强烈。
本实验发现,去除土壤有机质后CIP的最大吸附量降低了73%,说明土壤有机质对CIP在土壤中的持留有较大贡献,同时发现土壤的CEC降低了76%(pH=4),比表面积也相应降低了58%左右。推测土壤有机质是CIP在土壤中持留主要的汇,可能是因为CIP通过与土壤有机质官能团之间的静电引力及氢键等相互作用所致。Aristilde 等[25]通过能量最小化和分子动力学分析了CIP与天然有机质的络合过程,认为CIP两性分子可与有机质中去质子化的官能团发生静电作用,同时有机质通过其内部H键断裂来相应改变其亲水和疏水区域,从而加强与CIP分子的H键联系;另一方面,CIP还能与有机质中带有 Mg2+和Fe2+等阳离子的官能团反应形成“有机质-metal-CIP”的三元络合物来强化吸附。对于土壤有机质而言,除了静电引力外,土壤有机质中的芳香结构和H键的供质子部位也提供了很好的H键形成环境,使得CIP在土壤有机质上的Kd值可达1.6×106~3.0×106 L·kg-1[25]。因此,土壤有机质是CIP在黑土中持留的主要汇。
尽管去除土壤有机质后土样的吸附容量降低了73%,但土样仍然对CIP有一定的持留作用(图 3a)。去除土壤有机质后,土样的主要成分为土壤矿物(BS1),其中起主要作用的为土壤黏土矿物和氧化物,而BS2中又进一步去除了土壤中的铁氧化物。我们之前的研究结果显示[26],CIP在土壤铁氧化物表面可以通过表面络合作用被吸附,且这种吸附受pH和离子强度的强烈影响。但从图 3a可以看出,去除铁氧化物后,土样对CIP吸附容量几乎没有变化。这可能是由于铁氧化物在黑土中所占的比重很小(1.36%),在黑土吸附CIP中的作用相对微弱;更主要的是因为CIP在铁氧化物表面的分配比黏土矿物小得多。如文献报道CIP在黏土矿物上的Kd值为1000~25 000 L·kg-1[27],而在水合铁氧化物表面的Kd值为200~2000 L·kg-1[28]。我们之前的研究发现CIP在针铁矿表面的Kd值仅为241~935 L·kg-1[26]。
根据以前的土壤矿物分析发现,黑土经去有机质和铁氧化物后BS2的主要组分为硅酸盐黏土矿物和石英砂,而文献中报道纯砂对CIP的吸附能力非常弱,最大Kd值为1.5 L·kg-1[29],图 3b中CIP在BS2的最大Kd值为4583 L·kg-1,说明硅酸盐黏土矿物是主要的贡献者。早在1997年就有人发现FQs抗生素易吸附于黏土矿物表面[21],XRD光谱揭示FQs可插层进入蒙脱土的层间[30],其主要机制可能是阳离子交换作用,因此吸附能力大小与黏土的阳离子交换量(CEC)有关;对于非膨胀性的黏土矿物(如高岭石),吸附主要发生在高岭土表面而非内层[10, 31],同时微量热和红外测定法证实了二者存在静电反应,CIP分子的-COOH上的C-OH峰消失,且C=O伸缩振动强度与位置发生改变,认为CIP的羧基与黏土矿物表面的可变电荷发生了强烈的反应[16, 21]。因此,除了土壤有机质,土壤中硅酸盐黏土矿物也对CIP的吸附有重要的贡献,相对而言,铁氧化物的贡献较小。
2.3 环境因素的影响 2.3.1 pH值和土壤组分对CIP吸附的影响图 4a显示pH对CIP在三种土样上吸附的影响。总体来看,pH值对CIP在土壤及其组分上的吸附Kd值均存在强烈的影响:在pH为3~6时,CIP在BS0上Kd值变化不大,当pH>6后开始下降;对BS1和BS2而言,Kd随着pH先升高,在pH 5左右时达到最大,然后随着pH升高而迅速下降。
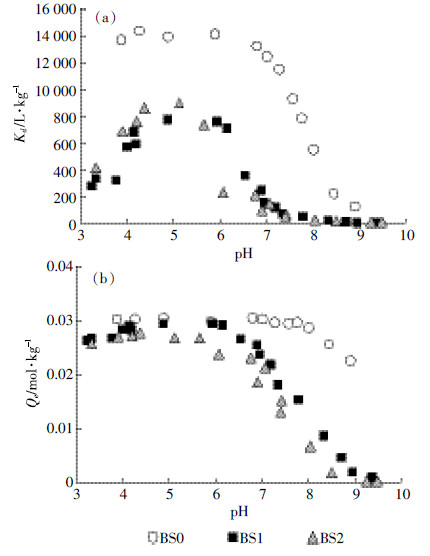
|
| 图 4 pH 对CIP在黑土及其组分表面吸附的影响 Figure 4 Effects of pH on CIP adsorption on black soil and its components |
pH影响CIP的吸附可能与CIP分子形态有关(图 1):在pH < 6时,CIP主要带正电荷,而在pH为6~8.3时为两性分子,因此低pH值条件下有利于CIP通过阳离子交换及静电引力吸附在土壤黏土矿物和有机质中,同时随pH增大,土壤胶体表面负电荷增加,与带负电的CIP形成静电斥力,使得CIP的吸附快速下降。
BS0与BS1、BS2组分相比,含有更多的土壤有机质,因此两者吸附曲线的主要差异应该来源于土壤有机质,结果显示pH对CIP在有机质中的吸附有较大影响,也间接说明CIP在土壤有机质中的主要持留机制为静电引力而非单纯的疏水性分配。去除有机质后,BS1和BS2中对CIP吸附的主要贡献组分是黏土矿物。文献表明,CIP在黏土矿物上的主要吸附机制为阳离子交换反应[16, 30],因此吸附量随pH增大而下降(图 4a)。但从不同pH条件下的Kd值可以看出,CIP在BS1和BS2中最大分配比出现在pH5左右(图 4b),此结果与CIP在美国某农田土壤表面的结果类似[20],可能是由于土壤中其他阳离子与CIP+竞争的结果。需要注意的是,当pH < 5时,CIP随pH下降而降低的程度实际并不明显(图 4b),由于Kd值为CIP在固/液相间的分配比,而此条件下液相中CIP浓度很低,液相中浓度的轻微变化会导致Kd值发生较大改变(图 4a)。
2.3.2 Cu2+和Ca2+对CIP吸附的影响Cu2+和Ca2+对三种处理的黑土上CIP吸附的影响结果如图 5和图 6所示。
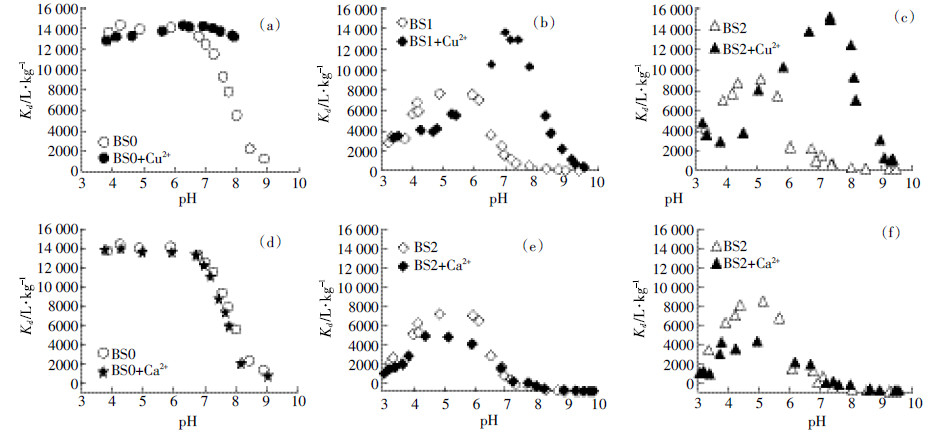
|
| 图 5 金属离子Cu2+和Ca2+对CIP在黑土及其去有机质和铁氧化物样品(BS0、BS1、BS2)表面吸附的影响 Figure 5 Effects of Cu2+ and Ca2+ on CIP adsorption on black soil and its components in 0.01 mol·L-1 NaNO3 |

|
| 图 6 Cu2+和Ca2+存在下CIP的吸附等温线 Figure 6 Adsorption isotherms of CIP with and without Cu or Ca presence at pH 6.0 and 0.01 mol·L-1 NaNO3 |
Cu2+的存在显著影响了CIP的吸附,且影响的程度随pH而改变。对于BS0而言,Cu2+存在下在一定pH范围内显著地增大CIP的Kd值(图 5a)。从图 5a中可以明显看出当pH>7时的促进作用,但当pH为3~6时,Cu2+似乎对CIP的吸附无影响(图 5a中两条线在pH为3~6时几乎重合),可能是因为此pH条件下的CIP几乎已被全部吸附,所以Cu2+的作用不明显。但从吸附等温线结果来看(图 6),当CIP浓度增加时,Cu2+会表现出明显的促进作用。Guaita等[32]也发现铜能够促进氟甲喹在一种碱性土壤上的吸附,通过XAS和FTIR光谱分析,他们推测是由于形成“土壤-Cu-氟甲喹”的三元络合物,考虑到土壤的组成,这部分吸附点位可能来源于土壤有机质或者黏土矿物。
Cu2+对CIP在BS1和BS2上的Kd值受pH的强烈影响:当pH在4~5时,Cu2+轻微抑制了CIP的吸附;当pH增加时,Cu2+表现出明显的促进作用,并将最大Kd值对应的pH值从pH 5左右移到pH 7.5左右;当pH > 8时,Kd值则在一个pH单位内迅速下降至几乎为零。Pei等[10]研究了Cu2+对诺氟沙星在蒙脱石上吸附的影响,也发现在pH4.5左右Cu2+会抑制诺氟沙星的吸附,推测可能是Cu2+与诺氟沙星竞争蒙脱石表面的阳离子交换点位的结果。当pH为7和9时,他们发现Cu2+显著促进了诺氟沙星在蒙脱石上的吸附,可能原因是Cu2+沙星络合物较沙星两性分子更易被黏土吸附,也可能是Cu2+先吸附在蒙脱石表面而充当“桥键”的作用。他们通过EXAFS光谱研究发现,在pH 7时,“蒙脱石-诺氟沙星-Cu”和“蒙脱石-Cu-诺氟沙星”两种三元表面体系共存于蒙脱石表面,而在pH 9时,表面主要以“蒙脱石-Cu-诺氟沙星”三元体系为主。同时,他们的研究发现pH 7和pH 9的Kd值相比,从73 g·L-1下降为23 g·L-1,与本研究结果一致。推测原因可能是当pH > pKa2后,诺氟沙星分子带负电荷,被从带负电荷的黏土表面解吸下来。
相对而言,同浓度的Ca2+对CIP的Kd值影响较小或少量抑制(图 5d~图 5f)。虽然Ca2+对CIP在BS0上的吸附几乎无影响,但由吸附等温线(图 6)可知,Ca2+的存在仍促进其吸附,只是效果明显弱于Cu2+。另外,Ca2+部分抑制了CIP在pH 5左右的Kd值(BS1为91%左右,BS2为90%左右,图 5e、图 5f所示。这显示,Ca2+对CIP在土壤有机质中吸附的影响较小。而对于黏土矿物而言,Ca2+可与CIP共同竞争黏土矿物表面的阳离子交换点位,从而抑制其吸附(图 5e、图 5f),如Chen等[29]发现Ca2+存在时,CIP在砂子表面的吸附能力降低。这可能是由于Ca2+与CIP存在竞争吸附。
2.4 CIP对Cu2+吸附的影响研究结果发现,不仅Cu2+对CIP的吸附有影响,CIP在一定条件下也影响着Cu2+的吸附。由图 7可知,CIP明显提高了pH为3~7时Cu2+在BS0表面的吸附。这可能是由于Cu2+与CIP分子形成Cu(CIP±)2+和Cu(CIP±)2+2络合物,增强了Cu2+的亲脂性,进而增加了Cu2+在土壤有机质中的吸附。另一方面,酸性条件下CIP可优先吸附于土壤中,与Cu2+形成“土壤-CIP-Cu”三元表面络合物从而促进Cu2+的吸附[10]。我们前面的研究发现CIP对Cu2+在针铁矿表面的吸附无影响,因此推测CIP在酸性条件下促进Cu2+的吸附主要是来自于土壤有机质和黏土矿物的贡献。这进一步说明CIP与Cu2+之间存在较强的相互作用,并影响了彼此的吸附行为。

|
| 图 7 CIP对Cu2+吸附于黑土及其组分表面的影响 Figure 7 Effect of CIP on Cu2+ adsorption on black soil and its components at pH 3~10 in 0.01 mol·L-1 NaNO3 |
(1)土壤有机质对CIP持留的贡献最大,其次为黏土矿物,再次为铁氧化物。
(2)CIP在土壤中的吸附随pH值的增大而降低。
(3)Cu2+在一定pH范围内促进CIP在黑土BS0上的吸附,尤其是碱性条件能显著增加CIP的持留。Cu2+对CIP在BS1和BS2上的吸附随pH值升高表现为先竞争抑制后显著促进的作用。Ca2+的影响主要表现为竞争抑制。
(4)CIP可促进酸性条件下土壤对Cu2+的吸附。
| [1] | Kolpin D W, Meyer M T, Barber L B, et al. A national reconnaissance for antibiotics and hormones in streams of the United States[C]//SETAC 21st Annual Meeting in North America, Nashville, TN, 2000. |
| [2] | Wang N, Guo X, Shan Z, et al. Prioritization of veterinary medicines in China's environment[J]. Human and Ecological Risk Assessment:An International Journal, 2014, 20(5):1313-1328. |
| [3] | Kim K R, Owens G, Kwon S I, et al. Occurrence and environmental fate of veterinary antibiotics in the terrestrial environment[J]. Water, Air & Soil Pollution, 2011, 214(1-4):163-174. |
| [4] | 俞 慎, 王 敏, 洪有为. 环境介质中的抗生素及其微生物生态效应[J]. 生态学报, 2011, 31(15):4437-4446. YU Shen, WANG Min, HONG You-wei. Antibiotics in environmental matrices and their effects on microbial ecosystems[J]. Acta Ecologica Sinica, 2011, 31(15):4437-4446. |
| [5] | Zhang J, Dong Y. Effect of low-molecular-weight organic acids on the adsorption of norfloxacin in typical variable charge soils of China[J]. Journal of Hazardous Materials, 2008, 151(2):833-839. |
| [6] | Zhang H, Huang C H. Adsorption and oxidation of fluoroquinolone antibacterial agents and structurally related amines with goethite[J]. Chemosphere, 2007, 66(8):1502-1512. |
| [7] | Karthikeyan K G. Interaction of tetracycline with aluminum and iron hydrous oxides[J]. Environmental Science & Technology, 2005, 39(8):2660-2667. |
| [8] | Gu C, Karthikeyan K G, Sibley S D, et al. Complexation of the antibiotic tetracycline with humic acid[J]. Chemosphere, 2007, 66(8):1494-1501. |
| [9] | Turel I, Bukovec N, Farkas E. Complex formation between some metals and a quinolone family member(ciprofloxacin)[J]. Polyhedron, 1996, 15(2):269-275. |
| [10] | Pei Z, Shan X Q, Kong J, et al. Coadsorption of ciprofloxacin and Cu(Ⅱ) on montmorillonite and kaolinite as affected by solution pH[J]. Environmental Science & Technology, 2009, 44(3):915-920. |
| [11] | Kaiser K, Guggenberger G. Mineral surfaces and soil organic matter[J]. European Journal of Soil Science, 2003, 54(2):219-236. |
| [12] | Mehra O P, Jackson M L. Iron oxide removal from soils and clays by a dithionite-citrate system buffered with sodium bicarbonate[C]//National conference on clays and clays minerals, 1958, 7:317-327. |
| [13] | OECD O. Guidelines for the Testing of Chemicals. Adsorption/desorption using a batch equilibrium method OECD Test Guideline, 2000. |
| [14] | Zhao Y P, Tong F, Gu X Y, et al. Insights into tetracycline adsorption onto goethite:Experiments and modeling[J]. Science of the Total Environment, 2014, 470:19-25. |
| [15] | Wang C J, Li Z, Jiang W T. Adsorption of ciprofloxacin on 2:1 dioctahedral clay minerals[J]. Applied Clay Science, 2011, 53(4):723-728. |
| [16] | Chang P H, Jean J S, Jiang W T, et al. Mechanism of tetracycline sorption on rectorite[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2009, 339(1):94-99. |
| [17] | 崔 皓, 王淑平. 环丙沙星在潮土中的吸附特性[J]. 环境科学, 2012, 33(8):2895-2900. CUI Hao, WANG Shu-ping. Adsorption characteristics of ciprofloxacin in ustic cambosols[J]. Environmental Science, 2012, 33(8):2895-2900. |
| [18] | Carrasquillo A J, Bruland G L, MacKay A A, et al. Sorption of ciprofloxacin and oxytetracycline zwitterions to soils and soil minerals:Influence of compound structure[J]. Environmental Science & Technology, 2008, 42(20):7634-7642. |
| [19] | Cordova-Kreylos A L, Scow K M. Effects of ciprofloxacin on salt marsh sediment microbial communities[J]. The ISME Journal, 2007, 1(7):585-595. |
| [20] | MacKay A A, Seremet D E. Probe compounds to quantify cation exchange and complexation interactions of ciprofloxacin with soils[J]. Environmental Science & Technology, 2008, 42(22):8270-8276. |
| [21] | Nowara A, Burhenne J, Spiteller M. Binding of fluoroquinolone carboxylic acid derivatives to clay minerals[J]. Journal of Agricultural and Food Chemistry, 1997, 45(4):1459-1463. |
| [22] | Uslu M Ö, Yediler A, Balcıoğlu I A, et al. Analysis and sorption behavior of fluoroquinolones in solid matrices[J]. Water, Air, and Soil Pollution, 2008, 190(1-4):55-63. |
| [23] | Vasudevan D, Bruland G L, Torrance B S, et al. pH-dependent ciprofloxacin sorption to soils:Interaction mechanisms and soil factors influencing sorption[J]. Geoderma, 2009, 151(3):68-76. |
| [24] | Yan W, Zhang J, Jing C. Adsorption of Enrofloxacin on montmorillonite:Two-dimensional correlation ATR/FTIR spectroscopy study[J]. Journal of Colloid and interface Science, 2013, 390(1):196-203. |
| [25] | Aristilde L, Sposito G. Binding of ciprofloxacin by humic substances:A molecular dynamics study[J]. Environmental Toxicology and Chemistry, 2010, 29(1):90-98. |
| [26] | Tan Y Y, Guo Y, Gu X Y, et al. Effects of metal cations and fulvic acid on the adsorption of ciprofloxacin onto goethite[J]. Environmental Science and Pollution Research, 2015, 22(1):609-617. |
| [27] | Wang C J, Li Z, Jiang W T, et al. Cation exchange interaction between antibiotic ciprofloxacin and montmorillonite[J]. Journal of Hazardous Materials, 2010, 183(1):309-314. |
| [28] | Gu C, Karthikeyan K G. Sorption of the antimicrobial ciprofloxacin to aluminum and iron hydrous oxides[J]. Environmental Science & Technology, 2005, 39(23):9166-9173. |
| [29] | Chen H, Ma L Q, Gao B, et al. Effects of Cu and Ca cations and Fe/Al coating on ciprofloxacin sorption onto sand media[J]. Journal of Hazardous Materials, 2013, 252:375-381. |
| [30] | Wu Q, Li Z, Hong H, et al. Adsorption and intercalation of ciprofloxacin on montmorillonite[J]. Applied Clay Science, 2010, 50(2):204-211. |
| [31] | Li Z, Hong H, Liao L, et al. A mechanistic study of ciprofloxacin removal by kaolinite[J]. Colloids and Surfaces B:Biointerfaces, 2011, 88(1):339-344. |
| [32] | Guaita D P, Sayen S, Boudesocque S, et al. Copper(Ⅱ) influence on flumequine retention in soils:Macroscopic and molecular investigations[J]. Journal of Colloid and Interface Science, 2011, 357(2):453-459. |
 2015, Vol. 34
2015, Vol. 34