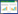文章信息
- 王义祥, 叶菁, 肖生美, 翁伯琦
- WANG Yi-xiang, YE Jing, XIAO Sheng-mei, WENG Bo-qi
- 铺料厚度对双孢蘑菇栽培过程酶活性和CO2排放的影响
- Effects of Substrate Thickness on CO2 Emissions and Enzyme Activities of Substrates During Agaricus bisporus Cultivation
- 农业环境科学学报, 2015, 34(12): 2418-2425
- Journal of Agro-Environment Science, 2015, 34(12): 2418-2425
- http://dx.doi.org/10.11654/jaes.2015.12.023
-
文章历史
- 收稿日期: 2015-06-02
双孢蘑菇[Agaricus bisporus(Lange)Sing.]又称蘑菇、双孢菇等,在分类学上隶属于真菌门(Eumycota)、担子菌纲(Basidinmyeetes)、无隔担子菌亚纲(Homobasidiae)、伞菌目(Agarieales)、蘑菇科(Agarieaceae)、蘑菇属(Agaricus),是栽培地域最广、生产规模最大、产量最多的一种著名食用菌,其产量约占世界食用菌产量的40%,也是我国目前出口量最大、创汇最多的食用菌产品[1]。人工栽培双孢蘑菇的主要原材料为畜禽粪便、秸秆和加工业的废弃物等。双孢蘑菇可将这些农业的废料分解转化为可供人们食用的菇体蛋白和碳水化合物等营养成分,在农业生态链中起到了实现生产者(绿色植物)和消费者(人类、动物)之间物质、能量循环的纽带作用,有利于减少环境污染[2]。2013年我国双孢蘑菇总产量为237.73万吨,总产量较高,但单产较低,仅为发达国家平均单产的1/3~1/4[3],如何进一步提高双孢蘑菇的物质转化效率,在倡导节能减排的时代显得尤为重要。
培养料是双孢蘑菇生长好坏的前提,选择好的配方,进行科学堆制,提高其转化率,是双孢蘑菇高产、稳产的基础。为此,许多学者从培养基种类、碳源种类、氮源种类、碳氮比、pH、温度、光照和无机盐种类与浓度等对双孢蘑菇的菌丝生长和产量影响做了大量的研究工作[4, 5, 6, 7]。另外,培养料的栽培厚度也是影响双孢蘑菇产量的重要因素。目前生产上培养料厚度在10~30 cm之间,通常认为料厚营养充足、产量高,料薄虽可早采菇,但产量低,有关铺料厚度对双孢蘑菇物质转化效率的影响仍缺乏科学数据证明。双孢蘑菇作为一种草腐真菌,其生长发育过程实际上是由菌丝体分泌胞外酶(纤维素酶、木质素酶等)到基质中,将培养基内较复杂的大分子聚合物(如纤维素、半纤维素、木质素、淀粉、果胶等)分解为葡萄糖、木糖、阿拉伯糖等被菌体吸收利用,同时还伴随着菌体呼吸作用向外界排放CO2,因此胞外酶的活跃程度与食用菌的生长发育以及生物量息息相关[8]。了解双孢蘑菇胞外酶活性大小及动态变化,有助于了解其在不同生长发育阶段对培养料中的纤维素、半纤维素、木质素、淀粉等大分子营养成分的降解过程。
羧甲基纤维素酶是纤维素酶系的重要组分。朱轶群研究表明,羧甲基纤维素酶的活性同培养基质中纤维素的降解速度和香菇子实体产量有关,酶活性越大,培养基质中纤维素降解速度越快,香菇子实体产量越高[9]。木聚糖酶是半纤维素酶系中主要的一种酶,其酶活的变化可比较客观地反映半纤维素酶活性的变化[10]。Ahlawat 等以草菇不同菌株为试验材料,研究发现木聚糖酶活性在合成培养中对草菇产量十分关键[11]。李晓博等研究发现,在培养料发酵与双孢蘑菇生长发育期间半纤维素酶活性的变化与半纤维素的降解速率正相关,即酶活性高降解速率快,酶活性低降解速率慢;同时还选用了不同培养料来栽培双孢蘑菇,结果发现采用稻草的产量是最高的[12]。淀粉在淀粉酶的作用下水解成麦芽糖及少量糊精,也可发生酸性水解成为葡萄糖,变成食用菌可以吸收利用的营养。因此,本研究通过设置不同铺料厚度的双孢蘑菇栽培实验,比较其对双孢蘑菇子实体产量的影响,并连续测定分析不同阶段培养料CO2排放通量以及羧甲基纤维素酶、木聚糖酶和淀粉酶活性的变化,拟寻找实现CO2减排和提高物质转化效率的最佳铺料厚度,为双孢蘑菇的高效栽培和节能减排提供科学依据和最优参数。
1 材料与方法 1.1 供试菌株供试菌株为双孢蘑菇As2796(Agaricus Bisporus As2796),来源于福建省农业科学院食用菌研究所。
1.2 培养料配方培养料配方为稻草50.45%,鸡粪17.8%,牛粪20.77%,棉饼肥1.49%,尿素0.59%,石膏8.9%。培养料的基础理化性质见表 1。
试验在福建省农业科学院农业生态研究所的人工气候室内进行,共设4个处理,即铺料厚度分别为10 cm、15 cm、20 cm和25 cm,每个处理重复3次。将已经过二次发酵的培养料装入50 cm(长度)×50 cm(宽度)×30 cm(高度)的培养箱中,培养箱的顶端有密封水槽,每个处理均保持一致的堆积密度(0.176 g·cm-3),具体用量见表 2。待菌丝长满培养料料层时进行覆土。土壤为稻田土,风干后打碎成0.5~1.5 cm的小颗粒,过3 mm筛,用0.1%、pH 10左右的石灰水润湿24 h后,再用同样的石灰水将土壤含水量调至18.4%,pH为8.16。4个处理的覆土厚度均为3.0 cm,然后按常规方法进行出菇管理。
分别于接种后的第5、10、15、20、30、35、45、50、60 d采集培养料样品。采集样品时首先将培养箱表面的土壤移去,然后用无菌剪刀剪取一个宽度3 cm左右的断面,四分法采集混合样品用于酶活、pH和含水率的测定。同时在出菇阶段,采集子实体样品,测定其鲜重及含水率。
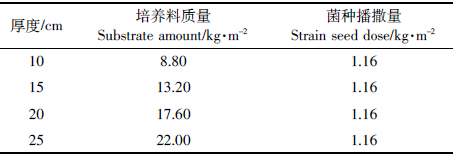
1.5 测定内容及方法CO2排放通量测定:分别于接种后的第5、10、15、20、30、35、45、50、60 d采用静态箱气相色谱法测定培养料的CO2排放速率[13],测定时间为早上9:00至第2 d早上6:00,每3 h测定1次。测定时将气体采集箱(长50 cm×宽50 cm×高50 cm)的开口端置于培养箱的密封水槽内,并向密封水槽内注水以防止培养箱和采集箱的接触处漏气。在气体采集箱的上部装有2个小风扇,用于采气时混合箱内气体,箱子侧面安装有电源插头以及温度和气体样品接口。密封后立即用60 mL的注射器抽取60 mL气体,此后每隔10 min采集样品1次,在30 min钟内采样4次,抽气的同时准确记录采样时间。同时记录箱内气温(Ti)、箱外气温(T0)、采样完成后迅速移开采样箱。试验结束后立即用安捷伦7890A气相色谱仪分析样品的CO2浓度。CO2排放通量的计算公式为:
式中:F为被测气体排放通量,mg·m-2·h-1;ρ为标准状态下被测气体的密度,g·L-1;H为采样箱高度,cm;p为采样时的气压,bar;T为箱内平均气温,℃;t为采样时间,min;dCt /dt为采集箱内被测气体体积混合比浓度变化率,μL·L-1·min-1。
然后根据不同处理单位面积培养料的质量将CO2排放速率换成单位质量培养料CO2的排放速率。
酶活性测定:取培养料2.5 g,加入25 mL蒸馏水,25 ℃浸提4 h,过滤,取上清液,得粗酶液,用于酶活测定。羧甲基纤维素酶、半纤维素酶和淀粉酶活性的测定采用文献[14]的方法。
pH值采用1∶10料水比pH计测定;有机碳含量采用重铬酸钾-外加热法测定;全氮采用凯氏定氮法测定[15];培养料含水率的测定采用烘干称重法。
1.6 数据处理利用Microsoft Excel 2003和SPSS软件进行数据处理与统计分析,多重比较采用LSD法。
2 结果 2.1 铺料厚度对子实体产量和绝对生物学效率的影响4个处理双孢蘑菇五潮菇总产量(鲜重)分别为4.18 、4.62 、5.36 、5.61 kg·m-2(表 3),且4个处理间的差异均达到极显著水平(P<0.01)。绝对生物学效率以10 cm处理最高,分别比15、20 cm和25 cm处理高43.98%、49.68%和71.09%,且其与15、20、25 cm处理间的差异达到极显著水平(P<0.01)。25 cm处理绝对生物学效率比15 cm和20 cm处理低15.84%和12.51%,其与15 cm、20 cm处理间的差异达显著性水平(P<0.05)。
 |
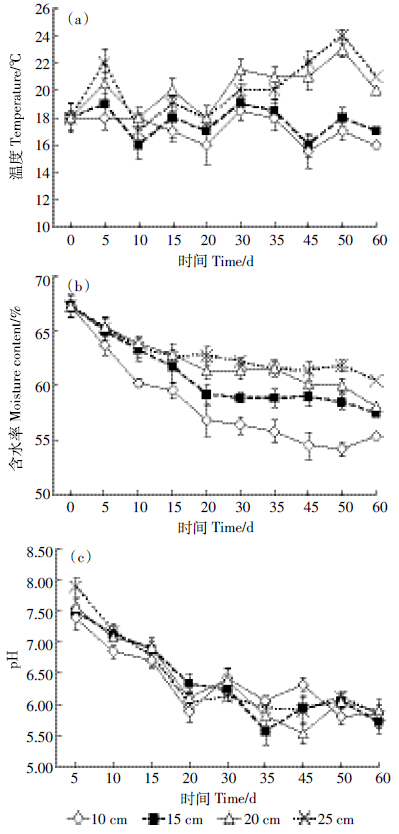
由图 1(a)可见,双孢蘑菇生长期间培养料温度呈现波动性变化,20 cm处理温度比10 cm和15 cm处理平均高17.27%和14.07%,25 cm处理温度比10 cm和15 cm处理平均高17.45%和14.12%,但各处理间的差异不显著。图 1(b)显示,在双孢蘑菇生长过程中培养料的含水率呈现逐渐下降的趋势,其中20 cm(13.66%)和25 cm(10.16%)处理的下降幅度低于10 cm(17.72%)和15 cm(14.59)处理,且20 cm和25 cm处理与10 cm和15 cm处理间均存在显著性差异(P<0.05)。从图 1(c)可知,在双孢蘑菇生长过程中培养料的pH值呈不断下降的趋势。同一时期,4个处理pH值之间存在一定差异性,但处理间的差异不显著。就总体变化趋势而言,在菌丝生长阶段(前15 d),4个处理培养料pH下降幅度较大,25 cm处理pH值从7.34左右下降到6.12左右,下降了16.62%,15 cm处理下降了14.99%,10 cm和20 cm处理下降了12%左右;在出菇阶段(35 d以后),4个处理培养料pH值下降的幅度变得较小,基本维持在5.5~5.9之间。
|
| 图 1 铺料层厚度对培养料温度、含水率和pH 的影响 Figure 1 Effects of stacking thickness on temperature,moisture content and pH of substrate |
图 2显示,4个处理羧甲基纤维素酶活性变化趋势基本一致,均出现两个酶活峰值,第一个峰值出现在15 d,第二个峰值在50 d左右,且第一个峰值显著低于第二个峰值。在第一个峰值点,20 cm处理的酶活性显著高于其他3个处理;10 cm和15 cm处理第二个峰值接近,且与20 cm和25 cm处理间存在显著性差异(P<0.05)。在菌丝生长结束时(15 d),20 cm处理的羧甲基纤维素酶活性最高,分别比10 cm、15 cm、25 cm处理高135.7%、104.6%和97.6%,且与它们间的差异达显著性水平(P<0.05)。

|
| 图 2 铺料层厚度对羧甲基纤维素酶活性的影响 Figure 2 Effect of substrate thickness on carboxymethyl cellulase activity |
图 3显示,在菌丝生长阶段(前15 d),20 cm和25 cm处理的木聚糖酶活性迅速升高,显著高于10 cm和15 cm处理,但随着栽培时间的延长(20 d后),10 cm和15 cm处理的木聚糖酶活性迅速增加,高于20 cm和25 cm处理。就动态变化而言,4个处理培养料木聚糖酶活性均出现2个峰值,第一个峰值出现在菌丝生长后期(15 d),第二个峰值在子实体形成阶段,20 cm处理的第一个峰值高于第二个峰值,而其他处理均为第二个峰值高于第一个峰值。4个处理木聚糖酶活性第一个峰值出现的时间基本一致,但随着铺料厚度的增加,25 cm处理木聚糖酶活性第二个峰值出现的时间后延。
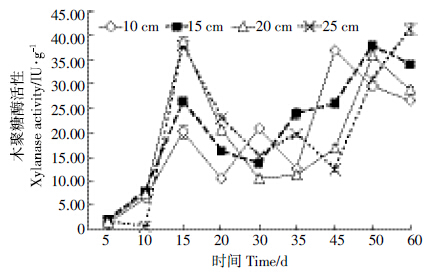
|
| 图 3 铺料层厚度对木聚糖酶活性的影响 Figure 3 Effect of substrate thickness on xylanase activity |
由图 4可知,与羧甲基纤维素酶和木聚糖酶活性的变化相比,淀粉酶活性变化有所不同。在出菇之前,各处理淀粉酶的活性相对较低,在45 d后淀粉酶活性迅速增加。整个培养期间,20 cm处理淀粉酶的平均活力为2.33 IU·g-1,分别比10 cm(1.86 IU·g-1)、15 cm(1.95 IU·g-1)和25 cm(1.77 IU·g-1)处理高25.0%、19.4%和31.7%,且与10 cm和25 cm处理间的差异达显著性水平(P<0.05)。
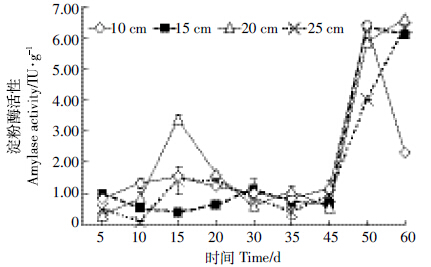
|
| 图 4 铺料层厚度对淀粉酶活性的影响 Figure 4 Effect of substrate thickness on amylase activity |
由图 5可知,在培养初期、覆土期和出菇期,4个处理CO2排放速率的日变化虽有一定波动,但无显著差异。由图 5还可以看出,不同培养时期培养料CO2排放速率存在一定差异。培养初期4个处理CO2排放速率介于18.45~21.40 mg·g-1·s-1之间,覆土期介于39.84~67.59 mg·g-1·s-1之间,而出菇期CO2排放速率(37.60~70.59 mg·g-1·s-1)与覆土期相差不大。在覆土期和出菇期,4个处理间CO2平均排放速率存在显著性差异(P<0.05)。
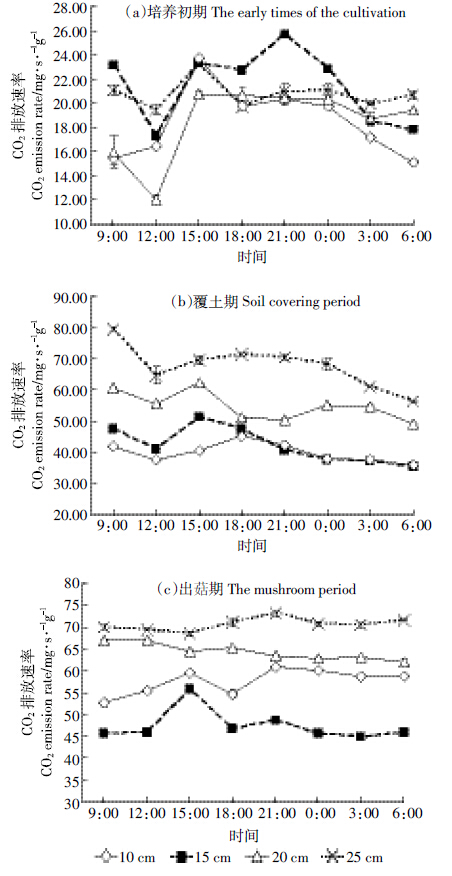
|
| 图 5 铺料层厚度对CO2日排放速率的影响 Figure 5 Effect of substrate thickness on daily CO2 emission rate |
图 6显示,从培养开始,CO2排放速率逐渐升高,菌丝爬土期达到最高点,随后下降,到子实体开始形成时(30 d),CO2排放速率再一次升高,并且在出菇阶段出现峰值,不过第二个峰值小于第一个峰值。4个处理CO2排放速率的第一个峰值大小依次为20 cm>25 cm>10 cm>15 cm,且各处理间差异显著(P<0.05)。25 cm处理平均排放速率为50.39 mg·g-1·s-1,分别比10 cm、15 cm和20 cm处理高19.3%、18.7%和11.4%,且25 cm处理与10 cm、15 cm、20 cm处理间的差异达显著性水平(P<0.05)。

|
| 图 6 铺料层厚度对CO2排放速率的影响 Figure 6 Effect of substrate thickness on CO2 emission rate |
将CO2排放速率与酶活性、pH值、含水率及碳氮比进行相关性分析,结果见表 4。培养料CO2排放速率与培养料pH、含水率、羧甲基纤维素酶活性间有显著的相关性,与木聚糖酶活性间有极显著的相关性。羧甲基纤维素酶、木聚糖酶和淀粉酶活性之间亦存在极显著正相关性。
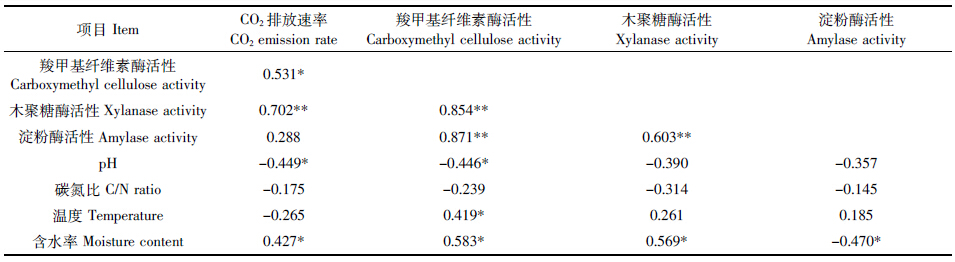 |
在双孢蘑菇生长中,适宜的培养料配方、厚度等因素对其产量和生物学效率的影响至关重要。本研究结果表明,随着培养时间的延长,培养料的pH值表现为降低的趋势。这是由于在双孢蘑菇生长过程中,由菌体新陈代谢产生有机酸(如醋酸、琥珀酸、草酸等)导致培养料pH值下降,但不同铺料厚度处理间没有显著性差异。高淑敏研究表明,在铺料密度相同的情况下,较厚的料层比较薄的料层其单位面积能生产更多重量的蘑菇[16]。本研究结果与其一致,随着铺料厚度的增加,双孢蘑菇子实体总产量呈现增加的趋势,说明铺料厚度大,营养充足,产量高;但其绝对生物学效率表现为降低的趋势,表明铺料厚度增加,双孢蘑菇对物质的转化效率降低。铺料厚度影响到双孢蘑菇的生产成本和产出,因此应在充分权衡产量收益和成本支出的基础上选取科学的铺料厚度。在综合考虑子实体产量和绝对生物学效率的基础上,本研究中以20 cm铺料厚度效果较佳。
3.2 铺料厚度对酶活性的影响在双孢蘑菇栽培过程中,各种酶活性的变化与C、N等基础物质的代谢和木质素、纤维素、半纤维素的降解密切相关,分析相关酶的活力可间接反映微生物的代谢活性和酶特定底物的变化情况。本研究结果表明,不同处理羧甲基纤维素酶、木聚糖酶活性总体呈“双峰”型变化趋势,第一个峰值出现在菌丝生长后期(15 d),第二个峰值在子实体形成阶段。这是因为在菌丝生长期,双孢蘑菇首先利用单糖、有机酸、醇类等不需酶解作用可直接为食用菌细胞吸收的小分子碳源,随着菌丝生长对碳源需求量增大,菌丝细胞可向其生长环境中分泌胞外酶以降解利用大分子碳源,羧甲基纤维素酶、木聚糖酶出现小的活性高峰[17]。在子实体的生长发育期,随着子实体生长迅速,大量物质向子实体转化,分解过程加快,培养基中双孢蘑菇分泌的胞外酶活性增大,满足子实体生长对碳、氮源的需求,促进子实体的生长发育。这与王南等的研究结果一致[18]。就铺料厚度的影响而言,20 cm铺料厚度处理的羧甲基纤维素酶、木聚糖酶和淀粉酶活性均显著高于10 cm、15 cm和25 cm处理。这是因为铺料厚度增加,相应的用料量也大,养分供应充足,菌丝生长旺盛;但铺料过厚,发菌导致较厚的铺料透气性变差,不利于菌丝的生长发育[16]。此外,温度、pH和水分是影响食用菌生长发育的重要环境因子。已有研究表明,食用菌在菌丝阶段和子实体阶段均有一定pH和温度范围,而且每一种酶都有其最适pH值和温度,pH值过高或过低都会影响酶的活力,甚至导致新陈代谢的减慢或停止[19]。何华奇等[20]在含水量对大球盖菇菌丝生长影响的研究中发现,含水量低的培养料中菌丝长势较弱,菌丝稀疏,生长无力,而含水量高的培养料中菌丝长势较强,菌丝洁白,浓密,生长旺盛。本研究结果发现,羧甲基纤维素酶、木聚糖酶和淀粉酶活性与培养料含水率之间存在显著的相关性,不同铺料厚度处理之间培养料温度和pH值间的差异不显著。铺料厚度过低不利于培养料水分的保持,因而认为水分可能是影响酶活性的重要因素。
3.3 铺料厚度对CO2排放通量的影响食用菌生长环境内CO2排放主要来源于其本身的呼吸代谢和培养料的分解,而前者所占比例较大[21]。杨婕等对3种担子菌菌丝体呼吸速率规律的研究表明,菌丝呼吸速率与菌丝生长时期密切相关,表现为随菌丝生长呼吸速率呈单调上升趋势[22]。本研究结果表明,在双孢蘑菇栽培的培养初期、覆土期和出菇期,CO2排放速率均没有明显的日变化,但CO2排放通量随着栽培时间的延长呈现“双峰”型的变化规律,出现差异的原因可能是两者采用的菌种和栽培管理方法不同。另外,前者仅测定了菌丝生长期,而本研究测定时期包括菌丝生长期、覆土期和出菇期等三个阶段。本研究CO2排放通量的第一个峰值出现菌丝爬土期,第二峰值出现在出菇阶段,与酶活性的变化规律相似,但两者峰值出现的时间点不同。这可能是因为酶活性的峰值与菌体生物量呈正相关[23],而CO2排放通量除了与菌体生物量相关外[24],还受菌体生物活性的影响。倪新江等研究认为,不同食用菌对培养料的呼吸消耗不仅取决于胞外酶活性的大小,还与其酶解产物能否及时与酶分离等许多其他因素有关[25]。因此,有关培养料CO2排放通量及其与胞外酶之间相关作用的关系还有待深一步研究。目前国内外有关双孢蘑菇生长中CO2浓度范围有不少研究,但很少有研究关注到铺料厚度对培养料CO2排放通量的影响。魏润黔等研究表明,蘑菇菌丝的呼吸与培养温度和水分有密切关系。培养温度越高、培养料水分越多,菌丝呼吸量就越大[26]。本研究结果表明,随着铺料厚度的增加,单位重量培养料CO2排放速率呈现增加的趋势,与上述物质转化效率降低的结果一致。相关分析表明,CO2排放通量与培养料含水率、羧甲基纤维素酶和木聚糖酶活性之间存在显著的相关性。
4 结论双孢蘑菇栽培过程中CO2排放通量和羧甲基纤维素酶、木聚糖酶活性均呈现“双峰”型变化趋势,第一个峰值出现在菌丝生长后期,第二个峰值在子实体形成阶段。随着铺料厚度的增加,双孢蘑菇子实体产量和单位重量培养料CO2排放通量呈现增加的趋势,而绝对生物学效率呈现降低的趋势,羧甲基纤维素酶、木聚糖酶活性表现为先减后增的趋势,其中以20 cm铺料厚度处理最高。
| [1] | 汪 茜, 吴圣进, 韦仕岩, 等. 不同培养条件对双孢蘑菇菌丝生长的影响[J]. 南方农业学报, 2012, 43(2):217-222. WANG Qian, WU Sheng-jin, WEI Shi-yan, et al. Effects of different culture conditions on mycelium growth of Agaricus bisporus[J]. Journal of Southern Agriculture, 2012, 43(2):217-222. |
| [2] | 李晓博. 双袍蘑菇(Agaricus bisporus)生产对农业有机废弃物的降解利用研究[D]. 吉林农业大学硕士学位论文, 2008. LI Xiao-bo. Studies on the degradation and utilization of Agaricus bisporus production on agricultural organic waste[D]. Master degree thesis of Jilin Agricultural University, 2008. |
| [3] | 《2012-2016年中国双孢菇行业市场发展趋势及投资规划分析报告》[EB/OL].[2012]. http://www. 51report. com/research/3003684. html. 《The development trend and investment plan of Agaricus bisporus industry in 2012-2016, China》[EB/OL].[2012]. http://www.51report.com/research/3003684.html. |
| [4] | Sanchez J E, Royse D J. Adapting substrate formulas used for shiitake for production of brown Agaricus bisporus[J]. Bioresource Technology, 2001, 77(1):65-69. |
| [5] | Weil D A, Beelman R B, Beyer D M. Manganese and other micronutrient additions to improve yield of Agaricus bisporus[J]. Bioresource Technology, 2006, 97(8):1012-1017. |
| [6] | Diamantopoulou P, Philippoussis A. Production attributes of Agaricus bisporus white and off-white strains and the effect of calcium chloride irrigation on productivity and quality[J]. Scientia Horticulturae, 2001, 91(3/4):379-391. |
| [7] | 陈 茜, 王建立, 郭亚萍, 等. 不同培养料配方对双孢蘑菇产量的影响[J]. 中国农学通报, 2014, 30(4):185-189. CHEN Qian, WANG Jian-li, GUO Ya-ping, et al. Effect of different substrate formula on yield of Agaricus bisporus[J]. Chinese Agricultural Science Bulletin, 2014, 30(4):185-189. |
| [8] | 兰瑞芳, 林少琴, 林玉满. 杏鲍菇漆酶的生物学特性[J]. 食用菌学报, 2002, 9(2):l4-16. LAN Rui-fang, LIN Shao-qin, LIN Yu-man. Biological characteristics of laccase from Pleurotus eryngii[J]. Acta Edulis Fungi, 2002, 9(2):l4-16. |
| [9] | 朱轶群. 生长调节剂对香菇不同品种菌丝生长和羧甲基纤维素酶活性的影响[J]. 河南农业科学, 1997(10):28-29. ZHU Yi-qun. Effects of growth regulators on the growth and carboxymethyl cellulose activity of Lentinula edodes Spawn[J]. Journal of Henan Agricultural Scineces, 1997(10):28-29. |
| [10] | 王孟兰, 赵 妍, 陈明杰, 等. 食用菌半纤维素酶系研究进展[J]. 生物学杂志, 2014, 31(1):64-67. WANG Meng-lan, ZHAO Yan, CHEN Ming-jie, et al. Research progress in hemicellulase of edible fungi[J]. Journal of Biology, 2014, 31(1):64-67. |
| [11] | Ahlawat O P, Gupta P, Dhar B L. Profile of the extracellular lignocellulolytic enzymes activities as a tool to select the promising strains of Volvariella volvacea(Bull. ex Fr. )sing.[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 48(3):389-396. |
| [12] | 李晓博, 李 晓, 李 玉. 双孢蘑菇生产中木质素、纤维素和半纤维素的降解及利用研究[J]. 食用菌, 2009(2):6-10. LI Xiao-bo, LI Xiao, LI Yu. Degradation and utilization of lignin, cellulose and hemicellulose in the production of Agaricus bisporus[J]. Edible Fungi, 2009(2):6-10. |
| [13] | 项虹艳, 朱 波, 王小国, 等. 蔬菜地CO2排放特征及其影响因素[J]. 生态环境, 2006, 15(1):71-73. XIANG Hong-yan, ZHU Bo, WANG Xiao-guo, et al. CO2 emissions and influencing factors from vegetable soil in the Chengdu Plain of Sichuan Basin[J]. Ecology and Environment, 2006, 15(1):71-73. |
| [14] | 王玉万, 王 云. 培养温度和侧耳子实体形成对胞外纤维分解酶活性的影响[J]. 微生物通报, 1991, 18(1):9-11. WANG Yu-wan, WANG Yun. Effect of temperature on extracellular enzyme activity of Pleurotus ostreatus[J]. Microbiology, 1991, 18(1):9-11. |
| [15] | 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社, 2000:30-34. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. Beijing:China Agricultural Press, 2000:30-34. |
| [16] | 高淑敏. 青海夏秋季双孢蘑菇生产不同用料量对产量影响的研究[J]. 青海农林科技, 2010(3):5-7. GAO Shu-min. Effect on yield of different cultivation material amount of white mushroom production in summer and autumn Qinghai[J]. Science and Technology of Qinghai Agriculture and Forestry, 2010(3):5-7. |
| [17] | 倪新江, 丁立孝, 冯志勇, 等. 灰树花生长发育过程中的几种胞外酶活性变化[J]. 微生物学杂志, 2001, 21(3):24-25. NI Xin-jiang, DING Li-xiao, FENG Zhi-yong, et al. Changes in several extracellular enzyme activity of Grifola frondosa during its growth and development[J]. Journal of Microbiology, 2001, 21(3):24-25. |
| [18] | 王 南, 沈 锋, 谭琦陈, 等. 柱状田头菇生长发育中9种胞外酶活性的测定[J]. 菌物系统, 2000, 19(4):540-546. WANG Nan, SHEN Feng, TAN Qi-chen, et al. Detecting in 9 extracellular enzyme activities of Agrocybe aegerita strains[J]. Mycosystema, 2000, 19(4):540-546. |
| [19] | 于海龙, 郭 倩, 杨 娟, 等. 环境因子对食用菌生长发育影响的研究进展[J]. 上海农业学报, 2009, 25(3):100-104. YU Hai-long, GUO Qian, YANG Juan, et al. Advance in researching the effects of environmental factors on growth and development of edible fungi[J]. Acta Agriculturae Shanghai, 2009, 25(3):100-104. |
| [20] | 何华奇, 曹 晖, 潘迎捷. 培养料含水量对大球盖菇菌丝生长的影响[J]. 安徽技术师范学院学报, 2004, 18(2):12-14. HE Hua-qi, CAO Hui, PAN Ying-jie. Effect on mycelial growth of stropharia rugoso-annulata cultivated in composts with different water content[J]. Journal of Anhui Technical Teachers College, 2004, 18(2):12-14. |
| [21] | 郭家选, 赵永厚, 沈元月. 几种食用菌菌丝呼吸生理的研究[J]. 中国生态农业学报, 2002, 10(3):74-75. GUO Jia-xuan, ZHAO Yong-hou, SHEN Yuan-yue. Studies on myceliai respiration of several kinds of edible fungi[J]. Chinese Journal of Eco-Agriculture, 2002, 10(3):74-75. |
| [22] | 杨 婕, 钟阳和. 担子菌菌丝体呼吸速率变化规律的研究[J]. 中国生态农业学报, 2003, 11(4):43-46. YANG Jie, ZHONG Yang-he. A study on the breath rate change of basidiomycetes at mycelial stage[J]. Chinese Journal of Eco-Agriculture, 2003, 11(4):43-46. |
| [23] | Claydon N, Allar M, Wood D A. Fruitbody biomass regulated production of extracellular endocellulase during periodic fruiting by Agaricus bisporus[J]. Transactions of the British Mycological Society, 1988, 90(1):85-90. |
| [24] | Hammond J B W, Nichols R. Carbohydrate metabolism in Agaricus bisporus sing.:Changes in nonstructural carbohydrates during periodic fruiting(flushing)[J]. New Phytologist, 1979, 83:723-730. |
| [25] | 倪新江, 李 洁, 初 洋, 等. 菌丝生长速度与呼吸消耗及胞外酶活性的关系[J]. 中国食用菌, 2010, 29(6):47-48. NI Xin-jiang, LI Jie, CHU Yang, et al. Correlations of mycelial growth rates and respiration consumption, extracellular enzyme activities[J]. Edible Fungi of China, 2010, 29(6):47-48. |
| [26] | 魏润黔, 何园素. 蘑菇菌丝呼吸与温度水分的关系[J]. 食用菌, 1979(1):21-23. WEI Rui-qian, HE Yuan-su. Relationship between temperature, moisture and mycelium respiration of mushroom[J]. Edible Fungi, 1979(1):21-23. |
 2015, Vol. 34
2015, Vol. 34