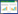文章信息
- 林晓燕, 曹赵云, 牟仁祥, 吴莉, 朱智伟, 陈铭学
- LIN Xiao-yan, CAO Zhao-yun, MOU Ren-xiang, WU Li, ZHU Zhi-wei, CHEN Ming-xue
- 两种基体改进剂在蔬菜样品农药残留基质效应中的补偿作用
- Compensation of Two Matrix Modifiers for Matrix Effect in Determination of Pesticide Residues in Vegetable Samples
- 农业环境科学学报, 2015, 34(12): 2439-2448
- Journal of Agro-Environment Science, 2015, 34(12): 2439-2448
- http://dx.doi.org/10.11654/jaes.2015.12.026
-
文章历史
- 收稿日期: 2015-06-16
农药残留检测是一项关系国计民生的大事,气相色谱-质谱联用具有快速、准确且能实现同时定性和定量的特点,目前被广泛用于农残检测分析[1, 2, 3, 4]。然而,气质联用分析中常存在着基质效应,即样品基质中的某些共提取物组分对待测物响应值的影响,严重的会影响检测结果的准确性[5],如甲胺磷、乙酰甲胺磷和氧乐果等基质敏感农药,往往检出限较高,回收率较低,难以满足痕量检测的要求。国内对基质效应的研究相对较少,国外在基质效应的研究中所采用的基质补偿方法主要有基质匹配标准溶液校正法、同位素内标法、多重净化法、标准加入法和加入分集体改进剂法等[6, 7, 8]。基质匹配标准溶液校正法是目前国际上公认的也是最常用的补偿基质效应的方法[7, 8, 9, 10],但由于该方法在实际样品检测中具有不含农药的空白基质难以获得、需要寻找与每种基质严格匹配的基质而增大工作量,以及更多的基质进入仪器中而增加仪器维护成本等缺点,不适用于多残留和大量样品的检测。
基体改进剂能有效地与待分析物竞争衬管中的活性位点,从而起到保护待测物不被进样口附近活性位点吸附的作用,近年来越来越多地用于对基质效应的补偿中[11]。当在纯溶剂标准溶液和样品溶液中加入相同量的基体改进剂时,它能同等程度地补偿标准溶液和样品溶液的基质效应,研究表明,L-古洛糖酸γ-内酯(AP)和D-山梨醇(SLC)具有良好的补偿作用[3, 12, 13]。仅从基质来讲,水果和蔬菜中的研究均有报道,但对蔬菜中的葱、姜、韭菜等复杂基质中基质补偿作用的研究鲜见报道。本文在已有文献研究基础上,采用乙腈提取及乙二胺基-N-丙基(PSA)分散净化的前处理方法,考察了AP和SLC这2种基体改进剂3种组合情况下在气相色谱串联质谱联用(GC-MS/MS)检测多种农药残留中的基质补偿效应。
1 材料与方法 1.1 仪器与试剂7890A-7000A气相色谱/三重四级杆质谱联用仪,配有EI源(美国 Aglient 公司);高速分散机(德国 IKA公司);漩涡振荡仪(德国 IKA公司);台式高速冷冻离心机(美国Thermo Fisher公司)。
乙腈(农残级,美国Tedia公司);硫酸镁(纯度大于97%,比利时ACROS公司);氯化钠(农残级,德国CNW公司);PSA和三官能十八烷基/硅胶基体(C18,粒径40 μm,美国Aglient公司);实验用水为Mili-Q高纯水。基体改进剂AP(纯度大于97%,比利时ACROS公司)和SLC(纯度大于98%,比利时ACROS公司)。基体改进剂溶液(10 g·L-1):称取 AP和SLC各100 mg分别置于10 mL容量瓶中,加入2 mL水使之溶解,然后用乙腈定容至10 mL,混匀,过0.22 μm有机滤膜,备用。
农药标准品(1000 mg·L-1,购自农业部环境保护科研监测所);农药标准品用丙酮∶甲苯=3∶7(V∶V)配成20 mg·L-1的混合标准储备液;将混合标准储备液用乙腈逐级稀释成浓度为2.5 mg·L-1及0.1 mg·L-1的标准工作溶液:①测定前将0.1 mg·L-1的上机工作液,按标准上机工作溶液∶基体改进剂溶液=10∶1(V∶V)加入基体改进剂溶液,混匀;②测定前将0.1 mg·L-1的上机工作液按标准工作溶液∶基体改进剂AP∶基体改进剂SLC=10∶0.5∶0.5(V∶V∶V)加入基体改进剂混合溶液,混匀。
1.2 样品前处理样品提取:称取25 g粉碎的均匀试样(精确到0.1 g)于250 mL离心管中,加入25 mL乙腈,在高速分散机中高速匀浆2 min,加入10 g无水硫酸镁和1 g氯化钠,在低速分散机中低速匀浆1 min(替代振摇步骤),离心力为2500×g离心3 min,使乙腈和水相分层(参考农业行业标准[14])。
样品净化:移取4 mL上层乙腈溶液于15 mL刻度离心管中,离心管中事先加入100 mg PSA和C18、1200 mg无水硫酸镁,涡旋混合1 min后,3000 r·min-1离心5 min(参考QuEChERS方法[2])。准确吸取0.8 mL乙腈溶液于进样瓶,并加入基体改进剂溶液0.08 mL,摇匀,待测,以不添加基体改进剂的样品作对照。
1.3 GC-MS/MS条件色谱条件:色谱柱HP-5MS(30 m×250 μm×0.25 μm);载气氦气;70 ℃ 保持2 min,15 ℃·min-1升到280 ℃,保持10 min后;运行:300 ℃,2 psi(1 psi=6.894 76 kPa),5 min;进样量2 μL,分流方式进样,分流比为5∶1;进样口温度250 ℃,压力32 psi;隔垫吹扫流速3 mL·min-1。反吹系统:限流器Agilent RS001(0.6 m×150 μm×0 μm),初始温度70 ℃,压力4 psi后,运行:300 ℃,60 psi,5 min。
质谱条件:碰撞气氦气流速2.25 mL·min-1;淬灭气氮气流速1.5 mL·min-1;电子攻击源(EI)70 eV;离子源温度230 ℃;四级杆温度150 ℃;GC-QQQ连接口温度280 ℃。
2 结果与讨论 2.1 基体改进剂的选择及前处理方法的选择基体改进剂的选择遵循一定的原则:①与待测物不发生反应;②对待测物的测定不产生干扰;③不污染和损害色谱系统,包括进样口、色谱柱和检测器等[15]。本研究选用的AP和SLC均满足上述原则,可用于基体改进剂对基质效应的补偿研究中。
本研究参照文献[2]、[14]、[16]进行样品的提取与净化,该方法只使用25 mL与本实验中各种农药均具良好溶解性的乙腈作为提取剂,试剂种类和用量均很少,且整个过程不浓缩不稀释,操作简捷,整个前处理过程及上机检测可在2 h内实现。满足农残分析过程污染少、成本低、简便快速、高效的实际要求。
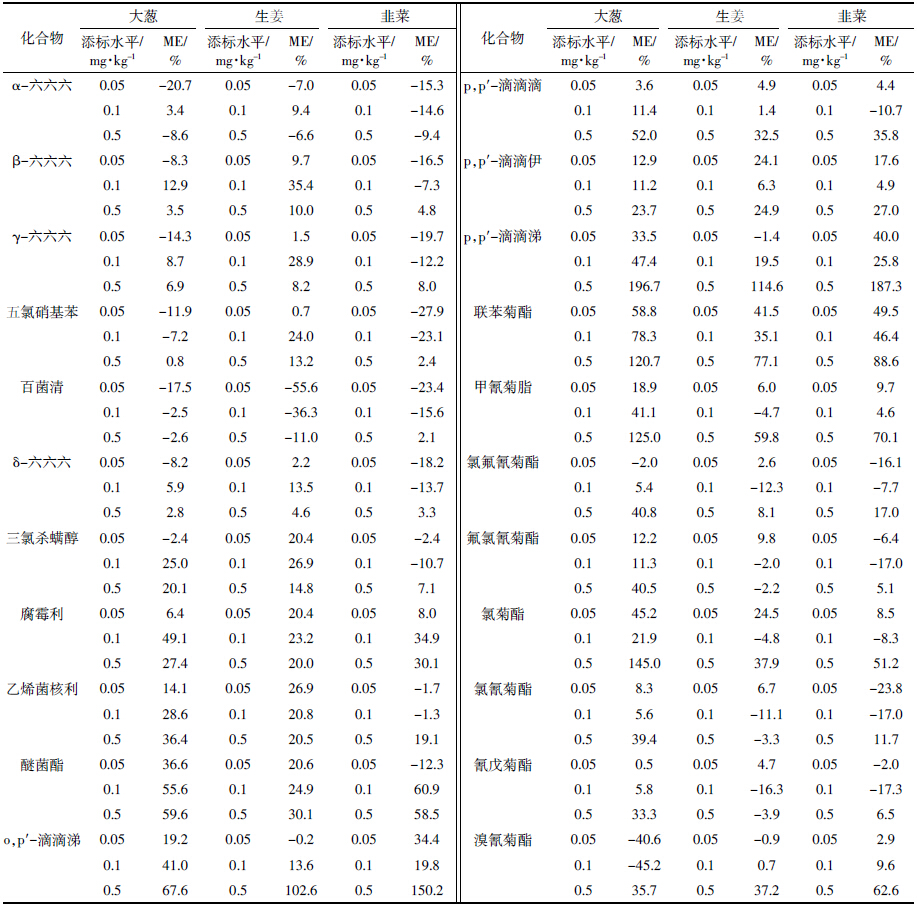
2.2 基体改进剂对色谱行为的影响 2.2.1 AP对有机磷农药色谱峰的影响在本研究中涉及到的有机磷农药中,甲胺磷、乙酰甲胺磷、氧乐果、乐果、甲基对硫磷、杀螟硫磷、马拉硫磷、水胺硫磷、三唑磷等农药在溶剂(乙腈)标样中表现为不出峰、峰形差或者响应低等(图 1)。分析保护剂能够与农药竞争气质联用中气相色谱系统的活性位点,且其竞争性越强,则基质敏感农药的峰形越好、峰高越高,说明该分析保护剂对基质效应的补偿能力越强,即对敏感农药的保护作用越强。如图 1所示,分析保护剂AP的加入能够明显改善上述较为敏感农药的色谱行为,使其响应值明显增大,峰形变好(变高、变窄),特别是对易被衬管和进样口吸附的极性农药(如甲胺磷、乙酰甲胺磷、氧乐果和乐果等)起到了很好的保护作用,与黄宝勇等[12]的报道一致。同时,加过AP的标样中各农药的响应值与基质配制的标样中各农药的响应值相当,说明基体改进剂的使用基本可以替代基质匹配标液,进行样品中农药的检测和定量。由此也说明,AP不但对敏感农药的基质补偿作用明显,而且不会影响非敏感农药的响应。因此,有机磷农药加入分析保护剂AP,能够实现对敏感农药的基质补偿和保持非敏感农药良好响应值的效果。
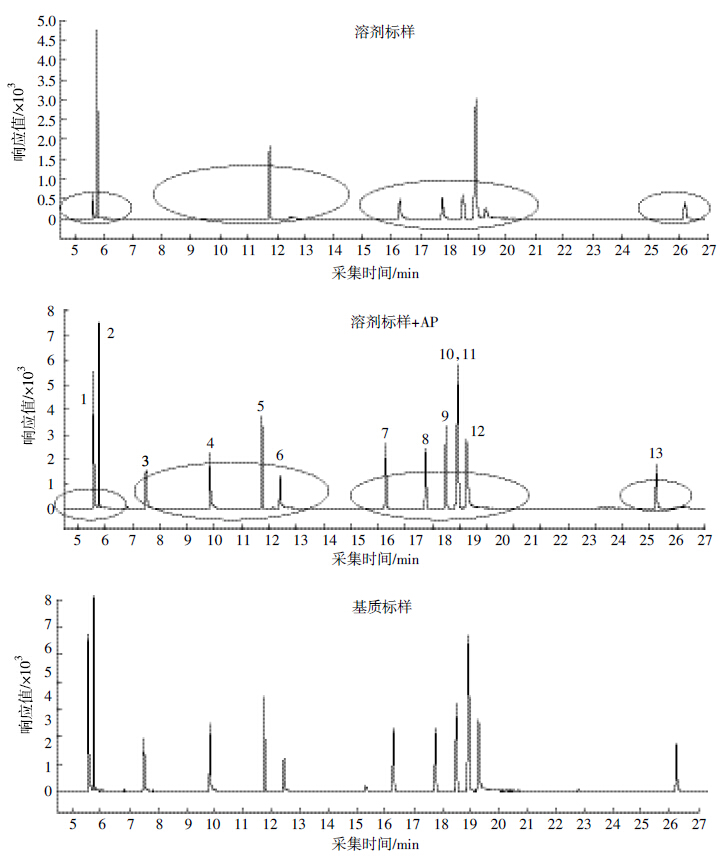
|
| 1:甲胺磷;2:敌敌畏;3:乙酰甲胺磷;4:氧乐果;5:甲拌磷;6:乐果;7:甲基对硫磷;8:杀螟硫磷;9:马拉硫磷; 10:毒死蜱;11:对硫磷;12:水胺硫磷;13:三唑磷 图 1 基体改进剂对有机磷农药色谱峰变化的影响 Figure 1 Effects of analyte protectant AP on peak shape and intensity of susceptible organophosphorus pesticide standards |
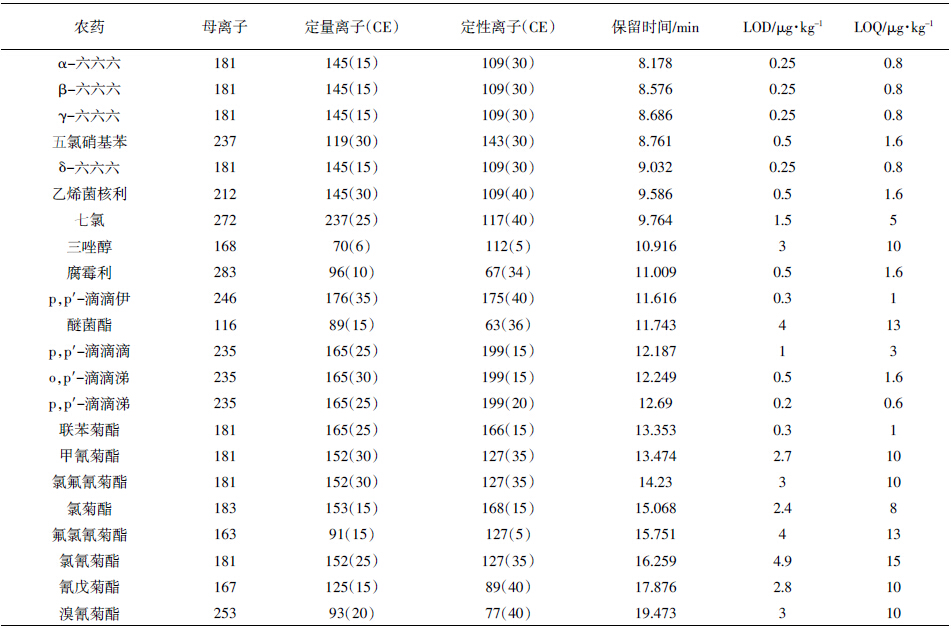
有机氯和菊酯类农药定量离子和定性离子见表 1。基体改进剂对有机氯和菊酯类农药色谱行为的影响试验,选择AP和SLC两种常用分析保护剂进行研究。图 2为乙腈配制的标样与同时添加AP+SLC、只添加SLC与只添加AP的标样中有机氯和菊酯类农药的色谱行为比较。由图 2可见,乙腈配制的标样(粉红色)中,某些农药的色谱峰响应值很低,峰形很差,峰宽很宽,AP和SLC的加入能明显改善其响应值和峰形,对大多数农药而言,单独加入AP或SLC的色谱峰行为稍有差异,但基本都优于乙腈标样色谱峰;同时加入等量AP和SLC,绝大多数农药的色谱行为都有明显的改善,说明同时添加AP+SLC对农药有较好的保护效果。
 |
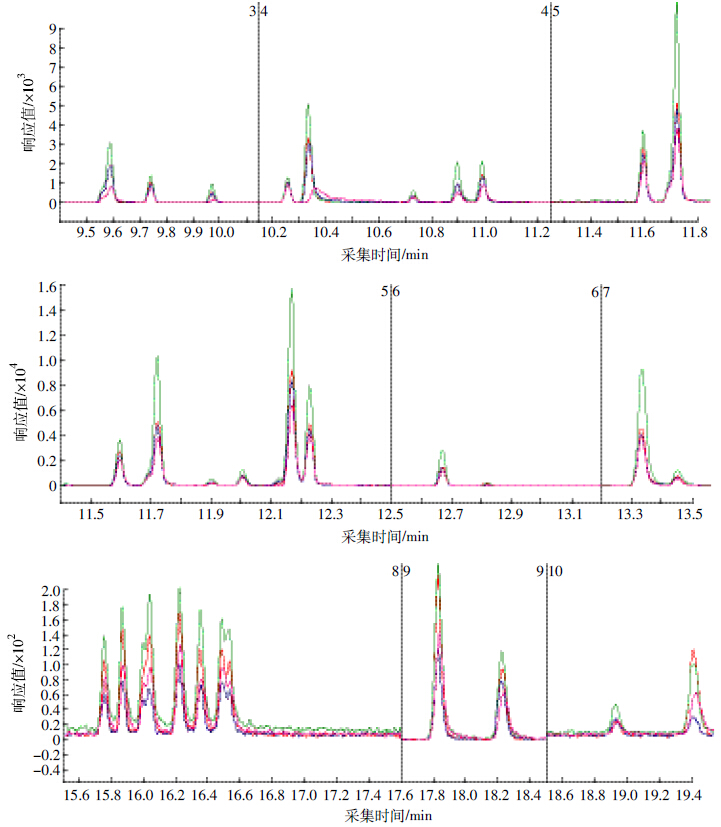
|
| 绿色:AP+SLC;红色:AP;粉红色:乙腈;蓝色:SLC Green:AP+SLC;red:AP;pink:acetonitrile;blue:SLC 图 2 加入基体改进剂前后的有机氯和菊酯类农药总离子流色谱图 Figure 2 Chromatogram of pyrethroid pesticides before and after additions of analyte protectants AP and SLC |
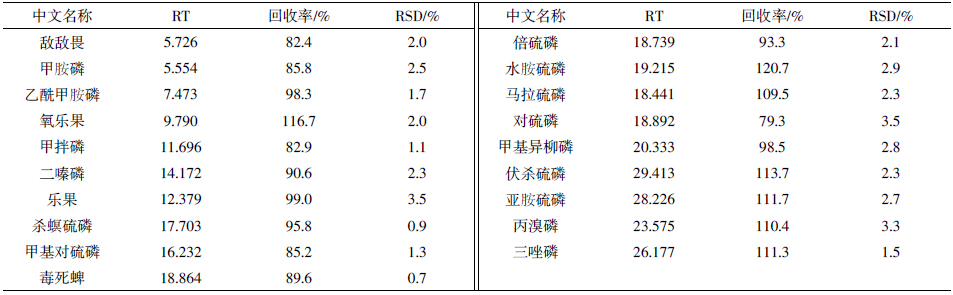
向豇豆样品中添加13种有机磷农药混合标样,制成0.1 mg·kg-1加标水平的样品,按本方法进行样品处理和测定,结果见表 2。取提取净化后的添标样品0.8 mL加入0.08 mL的AP,混匀后上机测定;上机标样也按此比例加入AP。由表 2可以看出,甲胺磷、乙酰甲胺磷和氧乐果等基质敏感农药的回收率为85.8%~116.7%,RSD 为1.7%~2.5%;非基质敏感农药的回收率82.4%~120.7%,RSD为0.7%~3.5%。可见,加入AP可有效地补偿气质联用法测定蔬菜中有机磷农药残留时的基质增强效应,较好的解决了豇豆中基质敏感农药测定时回收率偏大的问题。
 |
基质效应指样品中除待测物以外的其他基质成分对待测物测定值的影响,用ME表示。具体计算方法为[17]:
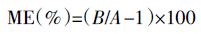
A为某种农药的基质配标峰面积;B为某种农药的纯溶剂标准溶液峰面积。当ME=0时,表示没有基质效应;当ME>0或者ME<0时,表示基质增强或者基质抑制效应。
表 3为大葱、生姜和韭菜在0.05、0.1、0.5 mg·kg-1 3个添标水平下的基质效应。由表 3可见,所有农药均表现出一定程度的基质增强或基质抑制效应。其中,多数农药以基质增强效应(ME>0)为主(0.5≤ME≤196.7),少数农药以基质抑制效应(ME<0)为主(-55.6≤ME≤-0.2);同种农药在不同基质中的基质效应不同,不同农药在同种基质中的基质效应也不尽相同。面对有机氯和菊酯类农药普遍存在基质效应的事实,采取添加基体改进剂的方式对基质效应进行补偿。
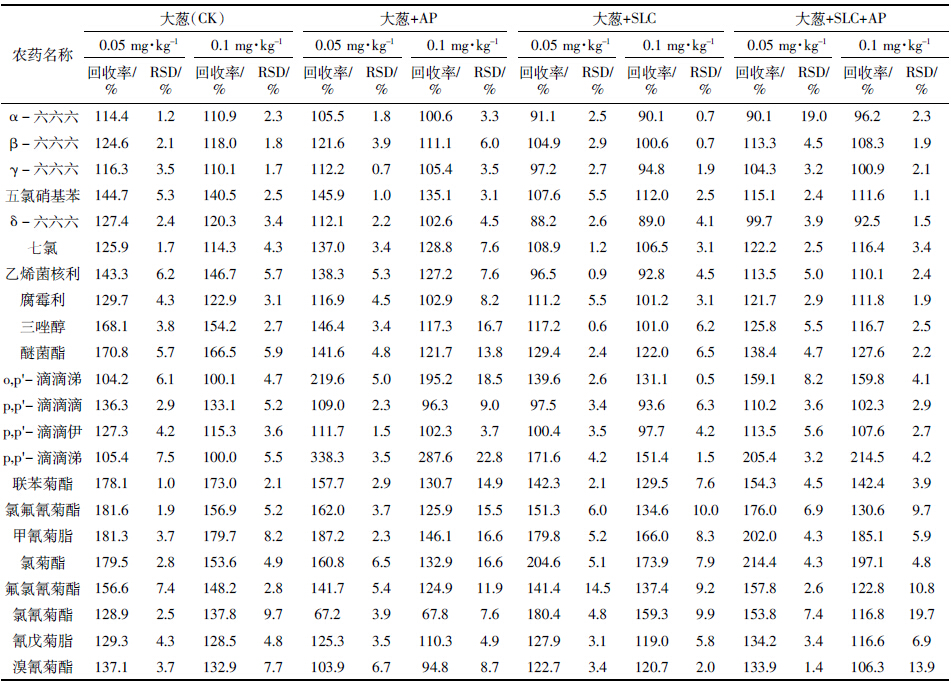
与许秀丽等[4]和黄宝勇等[12]的研究有所不同,本研究更加细化,除了考察基体改进剂对单一普通基质中基质效应的补偿作用,还着重考查了多种复杂基质(大葱、生姜和韭菜)中的基质补偿作用。3种蔬菜中22种农药的平均回收率和精密度结果见表 4、表 5和表 6。表 4表明,对于大多数农药来说,与未加基体改进剂的样品(CK)相比,3种基质中的有机氯和菊酯类农药的回收率偏高的问题有所缓解,基体改进剂对有机氯农药基质效应的补偿作用尤为明显。以大葱样品为例(表 4),对于有机氯农药(除o,p′-滴滴涕和p,p′-滴滴涕外),3个添标水平下的平均回收率基本上都控制在130%以下(RSD为0.6%~19.7%),大多数都在120%以内,基质补偿作用明显,且对于多数农药,以AP和SLC混合物的基质补偿作用更佳;对于回收率70%~130%之间的农药,基体改进剂的加入并未对其产生负面影响;0.1 mg·kg-1的添标水平回收率要好于0.05 mg·kg-1添标水平;3种配比的基体改进剂处理并未表现出明显差异。对于菊酯类农药(甲氰菊酯和氯菊酯除外)而言,0.1 mg·kg-1添标水平下,基体改进剂的加入能减少基质效应的影响,但具体是单一基体改进剂的补偿效果明显还是混合基体改进剂的补偿效果更明显,依农药性质不同而异。生姜(表 5)和韭菜(表 6)的总体情况与大葱相似。值得一提的是,表 6中存在较多回收率在200%左右的农药,可能的原因是韭菜样品本身色素含量较高,而本试验所采用的前处理方法相对简捷,对高含量色素的去除率不高,从而影响若干农药的回收率;也可能与个别农药自身的性质有关,如氯菊酯,在3种复杂基质中的回收率普遍偏高。此外,从另一个侧面反映出基体改进剂的加入对特殊基质中部分农药的基质效应改善不够理想,还需要进一步的研究。
 |
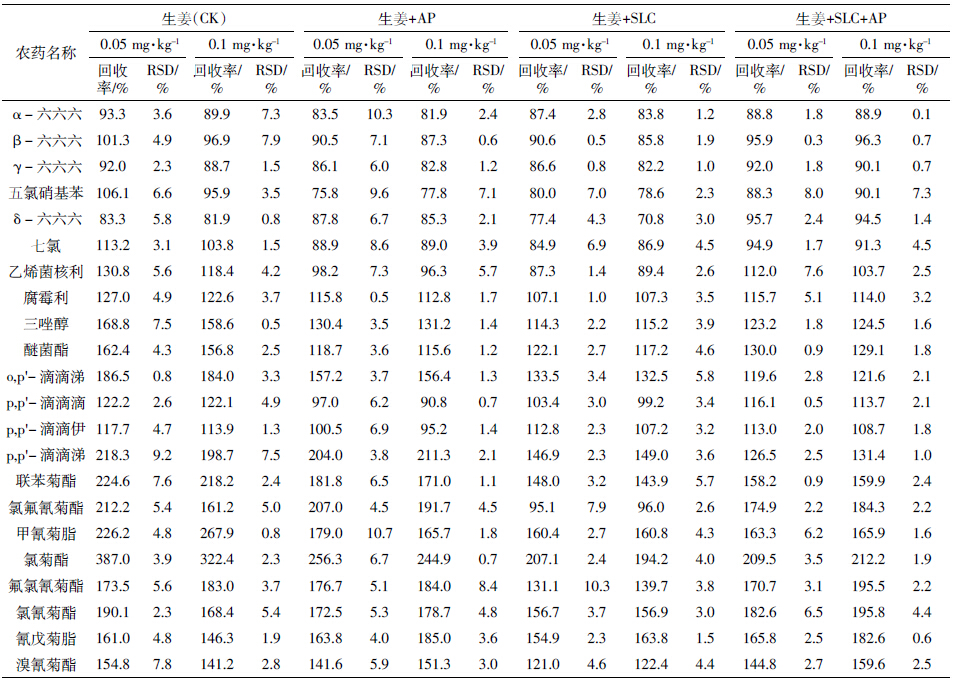 |
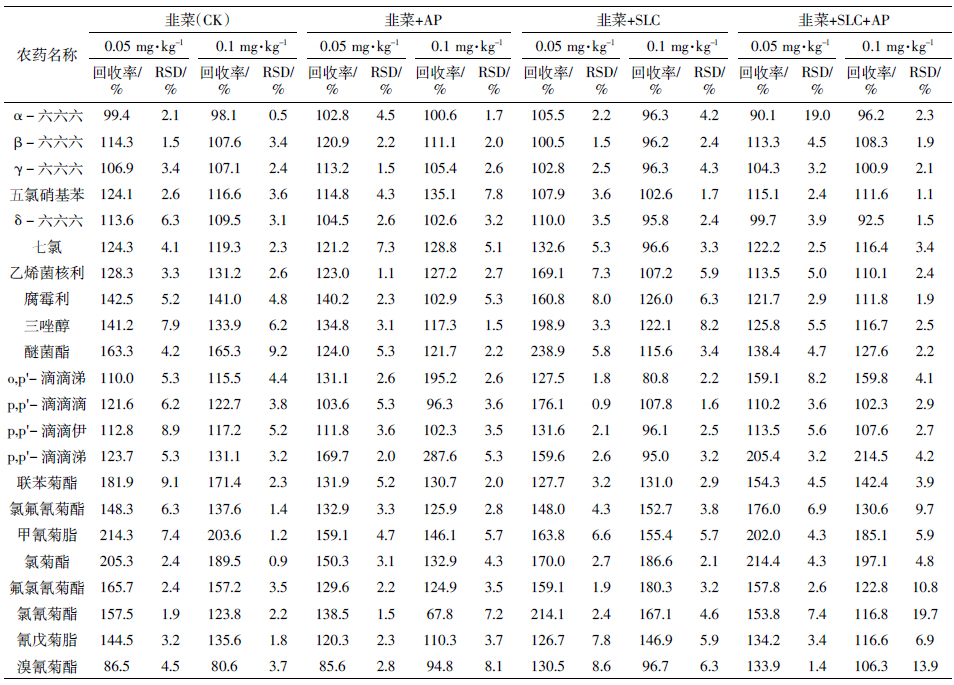 |
对于西红柿、黄瓜及大白菜等叶菜类样品,相对于葱、姜和韭菜等基质复杂的样品来说,其基质相对干净。因此,只考察了添加AP对0.05、0.1 mg·kg-1 2个添标水平的22种农药的平均回收率和精密度的影响(表 7)。由表 7可见,西红柿的添标回收率79.6%~121.4%,RSD为0.2%~15%;黄瓜的添标回收率85%~133.7%,RSD为1.6%~9.2%;大白菜的添标回收率70.4%~112.8%,RSD为1.3%~12.9%;三种菜中平均回收率基本都能满足70%~130%的回收率要求,并且大部分农药回收率能达到80%~120%。可见,AP的加入基本上都可以改善基质效应的影响,即加入分析保护剂AP的方法可以代替基质匹配校正方法。另外,(GC-MS/MS)的应用,能够做到一步到位,可以同时进行定性和定量,同一样品只需一次测定即可排除假阳性,与单级质谱相比,样品检测更快、灵敏度更高、定量更准确。
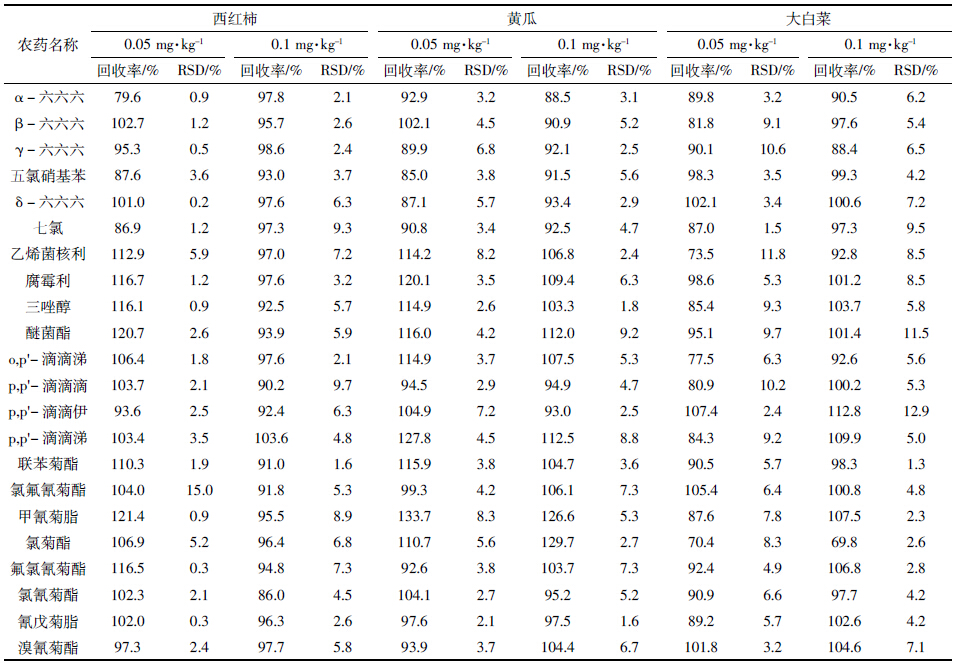 |
本研究采用2种分析保护剂3种组合分析了多种蔬菜样品中的43种农药及异构体化合物,对多数样品而言,获得了较好的补偿基质效果,除葱、姜、韭菜等复杂样品,AP的使用可以替代基质匹配标液进行样品中农药的检测和定量;所采用的样品前处理技术具有操作简便、分离效果好和成本低等特点,该技术可直接作为性质相似样品的前处理通用技术,同时也可为承担样品检测的社会实验室提供该样品前处理关键技术参考,简化样品前处理技术,提高工作效率;所建立的GC-MS/MS分析方法可同时进行定性和定量,样品检测更快、灵敏度更高、定量更准确,可在2 h内实现整个前处理过程及上机检测。该方法通过进一步的拓展研究,可用于蔬菜等农产品的质量安全监测分析,同时也可适用于专业检测机构、农产品和食品质量监督管理检验机构,是一种简捷、高效和高准确性的检测方法。
| [1] | Erney D R, Poole C F. A study of single compound additives to minimize the matrix induced chromatographic response enhancement observed in the gas chromatography of pesticide residues[J]. Journal of High Resolution Chromatography, 1993, 16:501-503. |
| [2] | Michelangelo A, Lehotay S J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “Dispersive Solid-Phase Extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2):412-431. |
| [3] | Anastassiades M, Maštovská K, Lehotay S J. Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides[J]. Journal of Chromatography A, 2003, 1015(1/2):163-184. |
| [4] | 许秀丽, 赵海香, 李 礼, 等. 分析保护剂补偿基质效应-气相色谱-质谱法快速测定水果中40种农药残留[J]. 色谱, 2012, 30(3):267-272. XU Xiu-li, ZHAO Hai-xiang, LI li, et al. Rapid determination of 40 pesticide residues in fruits using gas chromatography-mass spectrometry coupled with analyte protectants to compensate for matrix effects[J]. Chinese Journal of Chromatography, 2012, 30(3):267-272. |
| [5] | Hill A. Quality control procedures for pesticide residues analysis: Guidelines for residues monitoring in the European Union[S]. Brussels: European Commission, 1997. |
| [6] | Schenck F J, Lehotay S J.Does further clean-up reduce the matrix enhancement effect in gas chromatographic analysis of pesticide residues in food?[J]. Journal of Chromatography A, 2000, 868(1):51-61. |
| [7] | Zrostlíková J, Hajšlová J, Godula M, et al. Performance of programmed temperature vaporizer, pulsed splitless and on-column injection techniques in analysis of pesticide residues in plant matrices[J]. Journal of Chromatography A, 2001, 937(1/2):73-86. |
| [8] | Wylie P L, Uchiyama K. Improved gas chromatographic analysis of organophosphorus pesticides with pulsed splitless injection[J]. Journal of AOAC International, 1996, 79(2):571-577. |
| [9] | Sánchez-Brunete C, Albero B, Martín G, et al. Determination of pesticide residues by GC-MS using analyte protectants to counteract the matrix effect[J]. Analytical Sciences, 2005, 21(11):1291-1296. |
| [10] | Maštovská K, Lehotay S J, Anastassiades M, et al. Combination of analyte protectants to overcome matrix effects in routine GC analysis of pesticide residues in food matrixes[J]. Analytical Chemistry, 2005, 77(24):8129-8137. |
| [11] | Kirchner M, Húšková R, Matisová E, et al. Fast gas chromatography for pesticide residues analysis using analyte protectants[J]. Journal of Chromatography A, 2008, 1186(1/2):271-280. |
| [12] | 黄宝勇, 潘灿平, 王一茹, 等. 气质联机分析蔬菜中农药多残留及基质效应的补偿[J]. 高等学校化学学报, 2006, 27:227-232. HUANG Bao-yong, PAN Can-ping, WANG Yi-ru, et al. Rapid determination of pesticide multiresidues in vegetable by gas chromatography-mass spectrometry and compensation for matrix effect with protectants[J]. Chemical Journal of Chinese Universities, 2006, 27:227-232. |
| [13] | Cajka T, Mastovská K, Lehotay S J, et al. Use of automated direct sample introduction with analyte protectants in the GC-MS analysis of pesticide resides[J]. Journal of Separation Science, 2005, 28:1048-1060. |
| [14] | 刘潇威,买光熙,李凌云,等. NY/T 761-2008 蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定[S]. 北京:中华人民共和国农业部, 2008. LIU Xiao-wei, MAI Guang-xi, LI Ling-yun, et al. NY/T 761-2008 Pesticide multiresidue screen methods for determination of organophosphorus pesticides, organochlorine pesticides, pyrethroid pesticides and carbamate pesticedes in vegetables and fruits[S]. Beijing: Ministry of Agriculture of the People's Republic of China, 2008. |
| [15] | 陈铭学, 朱智伟, 应兴华, 等. L-古洛糖酸γ-内酯对蔬菜中有机磷农药残留测定基质效应的补偿作用研究[J]. 分析测试学报, 2011, 30(8):922-926. CHEN Ming-xue, ZHU Zhi-wei, YING Xing-hua, et al. Study on the overcoming matrix effects of L-gulonic acid γ-lactonein GC analysis of organophosphorus pesticide residues in vegetable[J]. Journal of Instrumental Analysis, 2011, 30(8):922-926. |
| [16] | Štajnbaher D, Zupančič-Kralj L. Multiresidue method for determination of 90 pesticides in fresh fruits and vegetables using solid-phase extraction and gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2003, 1015:185-198. |
| [17] | Chambers E, Wagrowski-Diehl D M, Lu Z L, et al. Systematic and comprehensive strategy for reducing matrix effects in LC/MS/MS analyses[J]. Journal of Chromatography B, 2007, 852(1/2):22-34. |
 2015, Vol. 34
2015, Vol. 34