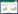文章信息
- 刘耀明,余志涛,朱文雅,李亚红,郭亚平,张建珍,吴海花,马恩波
- LIU Yao-ming, YU Zhi-tao, ZHU Wen-ya, LI Ya-hong, GUO Ya-ping, ZHANG Jian-zhen, WU Hai-hua, MA En-bo
- 三种重金属对中华稻蝗金属硫蛋白基因表达的影响
- Effects of Three Heavy Metals on mRNA Expressions of Two Metallothioneins in Oxya chinensis
- 农业环境科学学报, 2015, 34(2): 227-232
- Journal of Agro-Environment Science, 2015, 34(2): 227-232
- http://dx.doi.org/10.11654/jaes.2015.02.004
-
文章历史
- 收稿日期:2014-10-13
2. 山西大学生命科学学院, 太原 030006;
3. 农业有害生物综合治理山西省重点实验室, 太原 030006;
4. 山西省农业科学院植物保护研究所, 太原 030032
2. School of Life Science, Shanxi University, Taiyuan 030006, China;
3 Shanxi Key Laboratory of Integrated Pest Management in Agriculture, Shanxi University, Taiyuan 030006, China;
4. Institute of Plant Protection, Shanxi Academy of Agriculture Science Research, Taiyuan 030032, China
重金属污染是近年来重要的生态环境安全问题之一,在发展中国家重金属污染问题尤为突出,其中以镉的污染最为典型[1].含重金属岩石的暴露,金属矿产的开发,工业产品的报废等工业来源的重金属镉随雨水或工业用水排入土壤中;以施用含磷肥、农药、污泥农用等农业来源的重金属镉带入农田,特别是稻田生态系统,进而通过食物链对人类的生存和健康造成严重影响[2].2009年Zhuang等[3]报道,我国水稻主产区稻田土壤中铜(Cu)、锌(Zn)和镉(Cd)的含量(502、498、3.92 mg·kg-1)已分别超过国家二级环境标准(GB 15618-1995)10、2.5、13倍.镉作为非必需金属对生物具有毒害作用,人体摄入过量的镉可破坏体内金属平衡,同时对神经系统、消化系统、免疫系统和内分泌系统等带来损害,甚至导致死亡[4],铜和锌虽然是生物体的必需微量金属,但摄入量超过生物体需求量之后,也会对生物体造成不同程度的损害[5].
金属硫蛋白(Metallothioneins,MTs)是一类普遍存在于生物体内的富含高半胱氨酸且分子量较小的金属结合蛋白.1957年Marghoshes和Vallee首次发现并成功分离马肾中一种镉结合蛋白[6],随后在多种动物、植物和微生物中开展了MT的分子特性和功能的研究[7].近年来的研究发现MT可被多种金属离子诱导,其独特的分子结构如Cys-X-Cys 或Cys-X-Y-Cys使其对金属和自由基具有高度的亲和力,可结合细胞内的有害金属从而保护生物体免受重金属的毒害和氧化损伤[8].MT作为一类应激蛋白,在昆虫体内的基本功能是结合并调节铜和锌等微量必需金属的稳态,同时对镉和汞等有害重金属进行解毒.镉被认为是潜在的MT诱导剂,当镉进入体内后,MT首先通过螯合作用形成镉-MT复合物来隔离镉并保护组织免受镉的损害.锌和铜被认为是天然的诱导剂,这可能与锌参与多种生理功能有关,研究发现铜、银、铬和铅等多种重金属对MT都有诱导作用[9].总之,MT的生物学功能包括维持必需金属的稳态,对金属离子的代谢解毒以及清除自由基等[7].
目前有关MT结构和功能的研究主要集中于少数模式动物、水生动物、植物和微生物中,在昆虫中只有对双翅目和弹尾目少数类群个别物种的研究报道,如黑腹果蝇Drosophila melanogaster[10]、跳虫Orchesella cincta[11]、冈比亚按蚊Anopheles gambiae[12]、埃及伊蚊Aedes aegypti[13]等,而在直翅目昆虫中尚未见有关MT的研究报道.中华稻蝗是一种重要的农业害虫,广泛分布于我国水稻种植区,主要以水稻叶片为食,可导致水稻减产.重金属对水稻田的污染是我国土壤污染的突出问题,重金属通过食物链由土壤转移到水稻植株和稻米中,最终威胁人类健康.本课题组克隆获得中华稻蝗两个MT基因,并分析了MT基因的分子特性及其在体内的表达模式[14].本文以中华稻蝗为研究对象,经镉、铜和锌3种不同重金属(微量必需金属和微量非必需金属)诱导后,分析其MT基因在生殖系统和运动系统的表达变化,从而探讨MT基因对重金属代谢解毒的分子机制. 1 材料与方法 1.1 供试昆虫
本文所用试虫为中华稻蝗成虫.中华稻蝗5龄若虫于2013年7月采集于山西省太原市晋源区晋祠镇稻田,将其分装于纱笼(60 cm × 30 cm × 30 cm)并置于昆虫饲养室内于室温下用新鲜芦苇和玉米叶饲养,实验室内湿度保持在75%~85%,饲养至羽化为成虫后第3 d开始进行实验处理. 1.2 实验处理及取样
本文采用3种不同重金属对中华稻蝗成虫进行急性处理,根据本实验室前期测得3种不同重金属对中华稻蝗的半致死浓度值(CdCl2 3.48 mmol·L-1、CuCl2 17.61 mmol·L-1、ZnSO4 26.09 mmol·L-1),以半致死浓度为最高浓度,下设3个不同浓度,3种金属的处理浓度分别为:CdCl2 0.87、1.74、2.61、3.48 mmol·L-1;CuCl2 8.79、11.73、14.67、17.61 mmol·L-1; ZnSO4 15.65、19.13、22.61、26.09 mmol·L-1.以注射蒸馏水为对照.用微量注射器将重金属溶液从成虫腹部第3~4腹节注射入体腔血淋巴中,48 h后将虫体置于冰上进行解剖,分别取精巢、卵巢和肌肉并迅速置于液氮中.每个重金属浓度设置3个生物学重复,每个重复分别注射雌雄虫各10头,所有样品均置于-80 ℃冰箱内保存备用. 1.3 总RNA提取和DNA合成
RNA提取前,将研钵和玻璃匀浆器清洗后用锡箔纸包裹,经180 ℃烘烤3 h,冷却后使用.提取时将不同组织样品先置于盛有液氮的研钵内迅速研磨成粉末,取适量粉末于盛有1 mL RNAiso Plus(TaKaRa,Japan)的匀浆器内,置于冰浴中匀浆.总RNA提取使用试剂盒(TaKaRa,Japan),按照说明书进行操作.提取完毕后,经1%琼脂糖电泳检测RNA的质量,同时使用微量核酸定量仪(NanoDrop 2000 UV-Vis Spectrophotometer,Thermo,USA)定量.取2 μg RNA采用反转录试剂盒(M-MLV Reverse Transcriptase,Promega,USA)反转录为cDNA. 1.4 中华稻蝗2个MT基因表达量的检测
以cDNA为模板,用特异性引物进行实时定量检测(RT-qPCR),引物序列见表 1.RT-qPCR使用96孔板在实时定量PCR仪(ABI 7300 Real-Time PCR system,Applied Biosystems,USA)上进行,以β-actin为内参基因.本文采用20 μL体系:10 μL SYBR Green Real-time PCR Master Mix(TaKaRa,Japan),0.4 μL正反引物,2 μL经过20倍稀释的cDNA,6.4 μL DEPC水.反应程序为:95 ℃-15 s、95 ℃-15 s、60 ℃-31 s,共40个循环,2个MT基因使用相同程序.
本文中所有样品及检测过程均设置3个生物学重复,每个重复20头虫体.实时定量过程中设置2个技术重复,实验数据采用2-ΔΔCt法分析,经ANOVA和Tukey′s HSD test(P<0.05)数据统计后,使用Sigma plot 12.0(Systat Software,Inc.,USA)作图. 2 结果 2.1 镉对中华稻蝗3种器官组织OcMT的影响
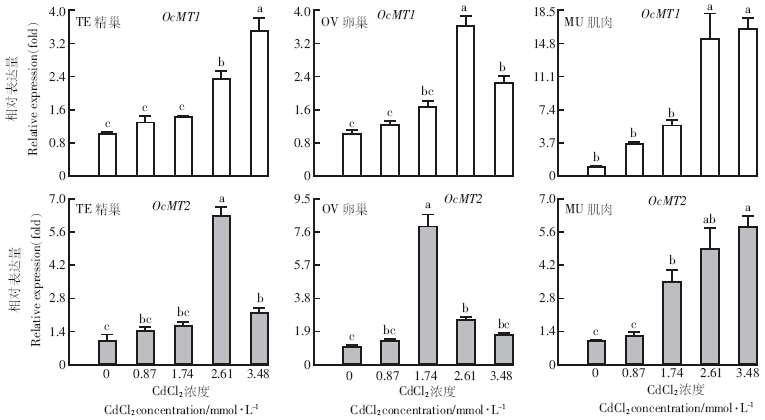
如图 1所示,经不同浓度Cd处理中华稻蝗成虫后,在精巢、卵巢和肌肉中的OcMT1均被诱导,在卵巢中随着Cd浓度的升高,OcMT1的表达呈现先上升后下降的趋势,在Cd浓度为2.61 mmol·L-1时表达水平最高,之后有所下降,在肌肉中上调表达16.2倍.OcMT2在精巢中表达水平最高时Cd浓度为2.61 mmol·L-1,在卵巢中其最高表达水平出现在Cd浓度为1.74 mmol·L-1时,在更高Cd浓度时表达水平有所下降;OcMT2在肌肉中的表达水平随Cd浓度的升高而上调.
|
| 图中数值为算术平均数±标准误,不同小写字母表示不同浓度间差异性显着(P<0.05).下同 图 1 不同浓度镉对中华稻蝗2个金属硫蛋白在3种器官组织的诱导表达分析 Figure 1 Analysis of induced expressions of two OcMTs in three tissues of O. chinensis at different Cd concentrations |
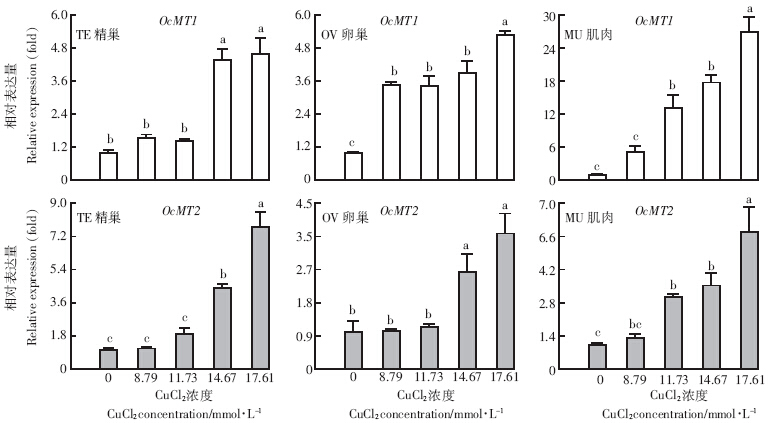
如图 2所示,经Cu处理后,中华稻蝗2个OcMT在3种器官组织中的变化趋势均随Cu浓度的升高而表达上调,呈浓度依赖效应.与对照组相比,OcMT1在肌肉中的诱导表达量最高,上调6~26倍;低浓度的Cu对精巢、卵巢及肌肉中的OcMT2无诱导效果,而2个高浓度(14.67、17.61 mmol·L-1)诱导后出现显着上调表达(P< 0.05),在精巢中的表达量高达3~7.5倍,在卵巢和肌肉中表达上调4~5倍.
|
| 图 2 不同浓度铜对中华稻蝗2个金属硫蛋白在3种器官组织的诱导表达分析 Figure 2 Analysis of induced expressions of two OcMTs in three tissues of O. chinensis at different Cu concentrations |
如图 3所示,经Zn处理后,中华稻蝗2个OcMT在3种器官组织中均有诱导表达作用,但不同浓度处理后2个OcMT在不同器官组织中变化趋势有所差异.与对照相比,在精巢和卵巢中,最低浓度的Zn(15.65 mmol·L-1)诱导OcMT1表达水平最高,分别上调72倍和25倍,之后随Zn浓度升高表达水平呈下调趋势;在肌肉中则随Zn浓度升高而逐渐上调,浓度为26.09 mmol·L-1时诱导高达47倍.OcMT2在3种器官组织中的表达水平随Zn浓度的升高而表达上调,呈剂量依赖性效应,与对照相比,在最高Zn浓度(26.09 mmol·L-1)时达到最高表达水平,表达水平上调4.5~12.5倍.
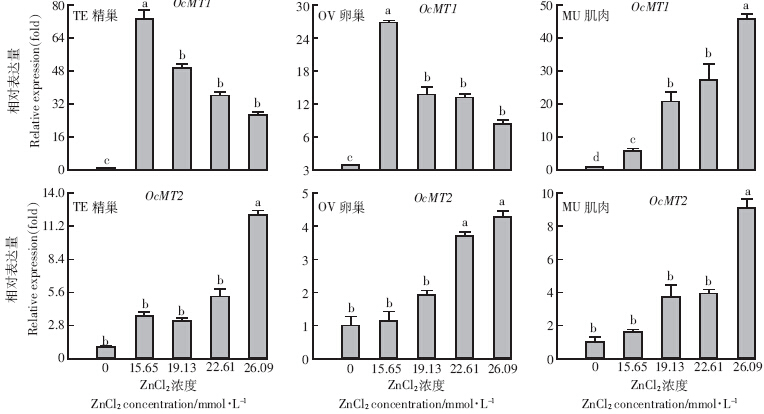
|
| 图 3 不同浓度锌对中华稻蝗2个金属硫蛋白在3种器官组织的诱导表达分析 Figure 3 Analysis of induced expressions of two OcMTs in three tissues of O. chinensis at different Zn concentrations |
本研究采用急性染毒探讨3种重金属对中华稻蝗MT表达的影响.结果表明,不同浓度金属均可诱导中华稻蝗2个MT基因表达.前期研究发现中华稻蝗MT基因在重金属Cd的解毒代谢中发挥重要作用[14].金属进入昆虫体内以后,可迅速启动特异的金属应答反应提高mRNA转录水平并合成MT蛋白,通过与金属离子形成复合物螯合金属,同时清除由此作用产生的自由基等最终达到解毒目的[15],或通过参与和介导一系列的酶促反应、信号传递和基因调节引起相关基因的表达变化,从而起到解毒作用维持生物体正常的生理活动[16].
本文研究结果显示不同金属对MT基因的诱导存在差异.这可能与不同金属的化学性质、生理功能以及所带电荷等相关,当金属进入生物体内由于破坏离子平衡,产生的氧化基团引起基因表达变化进而对金属解毒.Cd为非必需重金属,当Cd进入生物体内破坏离子平衡产生的氧化基团充当直接诱导剂引起基因水平的变化[15];Cu是生物体必需的微量金属,其平衡和稳态可维持生物体正常的生理活动,当体内的Cu过量时可引起相关基因表达的变化,如对维持必要金属稳态相关的MT基因和清除自由基相关的SOD和HSP等多种基因调节[17];Zn在生物体内具有特别重要的生理功能,是细胞内2700多种酶类的活性组件,这些酶中Zn不仅具有催化功能,还参与氧化还原反应的信号调节,从而维持金属稳态和自由基平衡[18].
本研究中经不同浓度的Cd急性处理后,2个OcMT在精巢、卵巢和肌肉中均出现显着上调表达,但在Cd作用下,MT基因在不同组织和器官中敏感性不同.在精巢和肌肉中2个MT基因均表现为上调表达.而在卵巢中,Cd的浓度低于1.74 mmol·L-1时,可以诱导MT2的表达,表明2个MT基因受到Cd的诱导作用;当卵巢中浓度高于1.74 mmol·L-1时,抑制了某些参与反应的酶的活性或者使组织器官产生不同程度损伤,导致MT2的表达急剧下降.Ren等[15]认为当小鼠生殖细胞中镉含量升高时,MT含量上升,细胞内的脂质过氧化被抑制,起到保护生殖的作用.在含镉土壤中生活的弹尾目跳虫(Orchesella cincta)体内,MT基因的表达水平随着土壤中镉含量的上升而升高,肌肉和中肠的上调尤为显着[19].当梭子蟹(Portunus trituberculatus)暴露在含Cd的水体环境中时,其MT基因在精巢、卵巢、鳃和肌肉中出现高表达[20].这可能是由于雌性生殖系统不仅产生卵子,受精卵也在雌性生殖系统中完成发育后产出体外,所以保护雌性生殖系统免受镉的损害将保证物种的繁衍,在生物进化中具有重要意义[21].
本文采用不同浓度Cu急性处理中华稻蝗,随着Cu浓度的升高,MT基因的表达水平也随之提高,2个MT基因的表达水平在3个组织器官中变化趋势均呈剂量依赖性上调.Cu诱导MT mRNA水平的升高,其机制可能是通过启动金属应答元件调控MT基因表达,通过基因调节mRNA水平参与螯合过量的Cu从而发挥解毒功能[22].在此过程中,Cu可能通过不同的途径和机制参与诱导MT的表达变化,实现对非必需重金属解毒和维持生物体内金属稳态的功能,或被MT蛋白螯合后储存Cu[23].如在昆虫和甲壳动物体内含Cu的血蓝蛋白(血青素)和呼吸蛋白中Cu是控制氧气输送的重要中心原件,在虾和蟹体内,Cu诱导MT的合成和降解均需血蓝蛋白的参与. Cu可诱导脊尾白虾(Exopalaemon carinicauda)鳃、卵巢、血淋巴和肌肉中MT显着上调表达[24],在此过程中Cu可与金属反应因子(Metal responsive element-binding transcriptions factors,MRTFs)作用,启动MT mRNA水平提高,合成的Cu-MT在细胞内被氧化为难溶的多聚体复合物而蓄积于溶酶体中,再以无毒聚合物的形态排出体外[25].
本研究中Zn处理后OcMT1在3种不同组织中mRNA转录水平显着上调表达,在精巢和卵巢中低浓度高表达,之后随浓度升高表达水平有所下降;OcMT2呈现剂量依赖效应.推测Zn可能通过多种调节机制诱导MT基因高表达来控制Zn的浓度,以保证机体不受高浓度Zn的毒害[26].在小鼠生殖系统内,MT对低浓度的Zn具有极高的敏感性,当持续高浓度的Zn作用时,机体可启动其他机制储存多余的Zn,MT基因表达水平不会继续升高[27].关于Zn对MT的诱导机制,目前普遍认为锌指结构结合到MT基因的效应原件(Metal responsive element,MRE)上,从而启动MT的表达[28],Zn可作为初级诱导物诱导MT的表达[29].在家兔体内Zn诱导的MT高表达除了防止过量Zn对生殖细胞的损伤外,还可有效缓解抗癌药物环磷酰胺(Cyclophosphamide,CP)导致的睾丸和生殖细胞的毒性损伤[30].总之,由于Zn在生物体内具有广泛生理学功能,其诱导基因表达和对过量金属的解毒机制具有多样化[27]. 4 结论
(1)3种重金属Cd、Cu和Zn均可诱导中华稻蝗OcMT1和OcMT2在精巢、卵巢和肌肉组织中上调表达.
(2)中华稻蝗2个MT基因在同一器官组织中对不同金属的反应不同,其中Zn的诱导作用最强.
| [1] | Li Z Y, Ma Z W, van der Kuijp T J, et al. A reviewof soil heavy metal pollution from mines in China:Pollution and health risk assessment[J]. Science of the Total Environment, 2014, 468-469:843-853. |
| [2] | 宋文恩, 陈世宝, 唐杰伟. 稻田生态系统中镉污染及环境风险管理[J]. 农业环境科学学报, 2014, 33(9):1669-1678. SONG Wen-en, CHEN Shi-bao, TANG Jie-wei. Cadmium pollution and its environmental risk management in rice ecosystem[J]. Journal of Agro-Environment Science, 2014, 33(9):1669-1678. |
| [3] | Zhuang P, Zou B, Li N Y, et al. Heavy metal contamination in soils and food crops around Dabaoshan mine in Guangdong, China:Implication for human health[J]. Environ Geochem Health, 2009b, 31(6):707-715. |
| [4] | Lynes M A, Hidalgo J, Devisscher L, et al. Metallothionein and stress combine to affect multiple organ systems[J]. Cell Stress and Chaperones, 2014, 19(5):605-611. |
| [5] | Chung R S, Howells C, Eaton E D, et al. The native copper- and zinc-binding protein metallothionein blocks copper-mediated Ab aggregation and toxicity in rat cortical neurons[J]. PLoS One, 2010, 5(8):e12030. |
| [6] | Margoshes M, Vallee B L. A cadmium protein from equine kidney cortex[J]. J Am Chem Soc, 1957, 79(17):4813-4814. |
| [7] | Klaassen C D, Liu J, Diwan B A. Metallothionein protection of cadmium toxicity[J]. Toxicology and Applied Pharmacology, 2009, 238(3):215-220. |
| [8] | Ruttkay-Nedecky B, Nejdl L, Gumulec J, et al. The role of metallothionein in oxidative stress[J]. Int J Mol Sci, 2013, 14(3):6044-6066. |
| [9] | Viarengo A, Burlando B, Cavaletto M, et al. Role of metallothionein against oxidative stress in the mussel Mytilus galloprovincialis[J]. Am J Physiol, 1999, 277:1612-1619. |
| [10] | Atanesyan L, Gunther V, Celniker S E, et al. Characterization of MtnE, the fifth metallothionein member in Drosophila[J]. J Biol Inorg Chem, 2011, 16(7):1047-1056. |
| [11] | Timmermans M J T N, Ellers J, Roelofs D, et al. Metallothionein mRNA expression and cadmium tolerance in metal-stressed and reference populations of the springtail Orchesella cincta[J]. Ecotoxicology, 2005, 14(7):727-739. |
| [12] | Mireji P O, Keating J, Hassanali A, et al. Expression of metallothionein and a-tubulin in heavy metal-tolerant Anopheles gambiae sensu stricto(Diptera:Culicidae)[J]. Ecotoxicology and Environmental Safety, 2010, 73(1):46-50. |
| [13] | Rayms-Keller A, McGaw M, Oray C, et al. Molecular cloning and characterization of a metal responsive Aedes aegypti intestinal mucin cDNA[J]. Insect Molecular Biology, 2000, 9(4):419-426. |
| [14] | Liu Y M, Wu H H, Kou L H, et al. Two metallothionein genes in Oxya chinensis:Molecular characteristics, expression patterns and roles in heavy metal stress[J]. PLoS One, 2014, 9(11): e112759. |
| [15] | Ren X Y, Zhou Y, Zhang J P, et al. Metallothionein gene expression under different time intesticular sertoli and spermato genic cells of rats treated with cadmium[J]. Reprod Toxicol, 2003, 17(2):219-227. |
| [16] | Moulis J M. Cellular mechanisms of cadmium toxicity related to the homeostasis of essential metals[J]. Biometals, 2010, 23(5):877-896. |
| [17] | Kang Y J. Metallothionein redox cycle and function[J]. Exp Biol Med(Maywood), 2006, 231(9):1459-1467. |
| [18] | Andreini C, Bertini I. A bioinformatics view of zinc enzymes[J]. J Inorg Biochem, 2012, 111:150-156. |
| [19] | Sterenborg I, Roelofs D. Field-selected cadmium tolerance in the springtail Orchesella cincta is correlated with increased metallothionein mRNA expression[J]. Insect Biochemistry and Molecular Biology, 2003, 33(7):741-747. |
| [20] | Xiang D F, Zhu J Q, Jin S, et al. Expression and function analysis of metallothionein in the testis of Portunus trituberculatus exposed to cadmium[J]. Aquatic Toxicology, 2013, 140-141:1-10. |
| [21] | Seren N, Glaberman S, Carretero M A, et al. Molecular evolution and functional divergence of the metallothionein gene family in vertebrates[J]. Journal of Molecular Evolution, 2014, 78(3-4):217-233. |
| [22] | Guirola M, Perez-Rafae S, Capdevila M, et al. Metal dealing at the origin of the Chordata phylum:The Metallothionein system and metal overload response in Amphioxu[J]. PloS One, 2012, 7(8):e43299. |
| [23] | 朱志兀, 姚 琳. 铜离子稳态平衡分子机理研究进展[J]. 生命科学, 2012, 24(8):847-857. ZHU Zhi-wu, YAO Li. Research progress in investigating the molecular mechanism of copper homeostasis[J]. Chinese Bulletin of Life Sciences, 2012, 24(8):847-857. |
| [24] | Zhang J Q, Wang J, Gui T S, et al. A copper-induced metallothionein gene from Exopalaemon carinicauda and its response to heavy metal ions international[J]. Journal of Biological Macromolecules, 2014, 70:246-250. |
| [25] | 陈 春, 周启星. 金属硫蛋白作为重金属污染生物标志物的研究进展[J]. 农业环境科学学报, 2009, 28(3):425-432. CHEN Chun, ZHOU Qi-xing. Reseaching advance in metallothionein and its biomarker of heavy metal contamination[J]. Journal of Agro-Environment Science, 2009, 28(3):425-432. |
| [26] | Sharif R, Thomas P, Zalewski P, et al. The role of zinc in genomic stability[J]. Mutat Res, 2012, 733(1-2):111-121. |
| [27] | Kelly E J, Quaife C J, Froelick G J, et al. Metallothionein I and II protect against zinc deficiency and zinc toxicity in mice[J]. J Nutr, 1996, 126(7):1782-1790. |
| [28] | Carpene E, Anddreani G, Isani G. Metallothione in functural and structural characteristics[J]. J Trace Elem Med Biol, 2007, 21(Suppl):35-39. |
| [29] | Roesijadi G. Metallthionein and its role in toxic metal regulation[J]. Comp Biochem PhyBiol C.Comp Pharmacol txicol Endocrinol, 1996, 113(2):117-123. |
| [30] | Maremanda K P, Khan S, Jena G. Zinc protects cyclophosphamide-induced testicular damage in rat:Involvement of metallothionein, tesmin and Nrf2[J]. Biochemical and Biophysical Research Communications, 2014, 445(3):591-596. |
 2015, Vol. 34
2015, Vol. 34