文章信息
- 宋玉芝,孔繁璠,王敏,张艳娜
- SONG Yu-zhi, KONG Fan-fan, WANG Min, ZHANG Yan-na
- 光照强度及附植藻类对狐尾藻生理指标的影响
- Effects of Light Intensity and Epiphytic Algae on Physiological Parameters of Myriophyllum spicatum
- 农业环境科学学报, 2015, 34(2): 233-239
- Journal of Agro-Environment Science, 2015, 34(2): 233-239
- http://dx.doi.org/10.11654/jaes.2015.02.005
-
文章历史
- 收稿日期:2014-09-22
2. 南京信息工程大学应用气象学院生态气象环境中心, 南京 210044;
3. 南京信息工程大学环境科学与工程学院, 南京 210044
2. International Center for Ecology, Meteorology and Environment(IceMe), School of Applied Meteorology, Nanjing University of Information Science & Technology, Nanjing 210044, China;
3. College of Environmental Science and Engineering, Nanjing University of Science Information & Technology, Nanjing 210044, China
近年来,沉水植物的恢复重建在富营养化水体的治理过程中得到越来越多的关注.作为水生生态系统的初级生产者,沉水植物通过光合作用产生O2,增加了水中溶解氧,促进有机污染物和某些还原性无机物的氧化分解,从而净化水质[1].同时,沉水植物的根茎叶还可以吸附和吸收水中的重金属及N、P等元素,其植株的存在则可沉降水体中的悬浮粒子.附植藻类和沉水植物同属于湖泊生态系统内的初级生产者,其生态位高度重叠,两者相互竞争水下光照、矿质营养元素和CO2等资源[2].但附植藻类常与周丛细菌及有机碎屑等一同组成沉水植物表面的覆盖物,影响其正常吸收,降低其生长速率,附植藻类的代谢产物还会对沉水植物产生一定毒害作用[3].此外,还有研究表明光照强度、温度、营养盐、底质等均对沉水植物的生长有显着影响,而光照强度普遍被认为是沉水植物存活和生长的限制因子[3, 4, 5],光照强度在一定程度上决定了沉水植物的分布、最大光合量子产量以及种群竞争的能力[6, 7],但附植藻类在不同光照强度下对沉水植物生长的影响尚无明确阐述.本研究选取太湖等富营养化湖泊中常见的沉水植物狐尾藻[8, 9]为研究对象,将生物因子与非生物因子相结合,探究光照强度及附植藻类对其生理的影响,这对认识浅水富营养化湖泊中沉水植物的衰退机制以及利用沉水植物在浅水富营养化湖泊中进行生态修复具有重要的理论和实践意义. 1 材料与方法 1.1 试验材料
试验用狐尾藻取自于溱湖国家湿地公园,选取长势良好的植株,截取顶枝(20 cm,外形基本一致)扦插到底部具有小孔的塑料杯中,每个塑料杯在种植前铺上8 cm厚洗净的沙子,每杯种5株狐尾藻.把栽有植株的塑料杯均匀地放入大棚的塑料箱(30 cm×40 cm×50 cm)中,每箱移入15只杯子,并向箱中注入40 L的自来水.附植藻类来源于太湖沉水植物,用于分离附植藻类的植株先用去离子水轻轻冲洗,再用软毛刷刷洗植株表面,收集刷洗液及软毛刷冲洗液定容备用.备用液一部分用于藻源,接种到附植藻类处理组中,另一部分用鲁哥试剂固定用来鉴定附植藻类属种.
经偏光显微镜NIKON LV100POL鉴定,用于试验的附植藻类共3门11属,包括蓝藻门的隐杆藻、微囊藻、色球藻、鱼腥藻、念珠藻;硅藻门的直链藻、小环藻、脆杆藻、舟形藻、桥弯藻;绿藻门的小球藻. 1.2 试验设计
2012年9月10日,向栽种狐尾藻的塑料箱中加入配制好的氮(NH4+∶NO3-=1∶1)、磷(NaH2PO4)营养盐溶液,TN浓度为4.5 mg·L-1,TP浓度为0.45 mg·L-1.狐尾藻适应培养一周后开始处理,附植藻类处理组每箱加入4 g(鲜重)附着物,含0.4 μg·g-1(以Chla计)的附植藻类;对照组未添加藻类,并在每个塑料箱中放入25只萝卜螺(每个约0.2 g)来控制附植藻类的生长.试验设置3个光强梯度(10%自然光、50%自然光和100%自然光),光照强度的处理方式采用遮阳网遮阳.试验共6个处理,每个处理设置3个重复.为保持试验期间各处理组水体的营养盐浓度,每3 d测一次水体的TN、TP浓度并补充营养盐溶液.为了控制浮游藻类,试验期间每3 d将培养液以虹吸的方式更换1/2.处理后第7 d开始采样,以后每7 d采一次,每次从各处理组中的各重复中随机选取3株狐尾藻,用于其生理指标的测定,所得数据取平均值用于统计分析.实验期间日最高温度为33 ℃,最低为14 ℃,每日11:00左右水面光照强度的变化范围为210.2~230.4 μmol·m-2·s-1(100%自然光),1层遮阳网下水面光照强度变化的范围为104.4~140.4 μmol·m-2·s-1(50%自然光),2层遮阳网下水面光照强度变化的范围为39.6~75.6 μmol·m-2·s-1(10%自然光). 1.3 测定方法
植株叶片叶绿素含量用每克叶片(鲜重)含叶绿素的毫克数表示,采用乙醇萃取分光光度计法测定[10];可溶性蛋白质含量用每克叶片(鲜重)可溶性蛋白的毫克数表示,采用紫外吸收法测定[11];MDA含量用每克叶片(鲜重)MDA毫克数表示,采用硫代巴比妥酸比色法测定[10];狐尾藻生物量用鲜重表示,采用称重法测定[12].SOD活性测定:使用pH7.8、50 mmol·L-1的磷酸缓冲液,在5.9 mL的反应体系(含130 mmol·L-1甲硫氨酸、750 μmol·L-1氮蓝四唑、100 μmol·L-1 EDTA和50 μmol·L-1核黄素)中加入0.1 mL的酶提取液启动反应,在光照培养箱中光照20 min,反应结束后测定560 nm处的光吸收,以不加酶提取液的处理组为对照,根据560 nm处的光吸收公式计算酶活性. 1.4 数据处理
采用Excel 2003和SPSS 17.0软件对所有数据进行统计分析,通过单因素方差分析、双因素方差分析和相关性处理等方法分析数据,利用Origin 8.5对数据进行图形处理. 2 结果与分析 2.1 光照强度及附植藻类对狐尾藻叶片叶绿素含量的影响
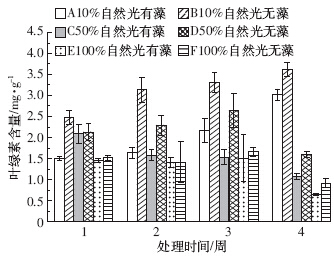
由图 1中的B、D、F组可以看出,狐尾藻叶片叶绿素含量随光照强度的增强而下降,不同光照强度之间存在极显着差异(P<0.01).随着试验的进行,10%自然光下狐尾藻叶片叶绿素含量呈逐步上升的趋势.50%自然光下叶绿素含量在试验的前3周缓慢增长,在试验末期开始下降,较前一周减少了39.5%.而在100%自然光下一直呈现较低的值,并在试验末期降到最低.
|
| 图 1 狐尾藻叶片叶绿素的含量 Figure 1 Chlorophyll content in leaves of M. spicatum |
通过对图 1中的A、B两组,C、D两组,E、F两组进行对比分析可知,同等光照条件下未添加附植藻类处理组的叶绿素含量高于添加附植藻类组.10%光强下,处理后各周未添加附植藻类处理组狐尾藻叶绿素含量分别是添加附植藻类处理组的1.65、1.92、1.53、1.2倍,且添加和未添加附植藻类两处理组狐尾藻叶绿素含量存在显着差异(P<0.05).50%光强下的无附植藻类处理组在试验第3周时狐尾藻叶绿素含量达到最大,是有附植藻类处理组的1.73倍,并在试验末期降到最低,较前一周下降了39.8%.100%光强下狐尾藻叶绿素含量在添加和未添加附植藻类处理组中差别不大,并均随试验的进行而下降.
通过双因素方差分析可知,不同强度的光照(P<0.01)、有无附植藻类(P<0.05)以及两者的交互作用(P<0.05)均对狐尾藻叶片叶绿素含量有显着影响.这说明,弱光(10%自然光)且无附植藻类的条件有利于狐尾藻叶绿素含量的增长.在100%自然光下有附植藻类处理组胁迫最强,植物叶绿素含量最低,此环境条件可能对狐尾藻光合作用影响较大. 2.2 光照强度及附植藻类对狐尾藻叶片抗氧化保护酶(SOD)活性的影响
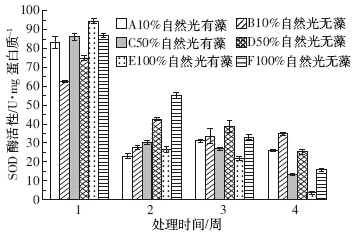
由图 2中的B、D、F组可以看出,狐尾藻叶片SOD活性在试验初期随光照强度的增强而增强,试验末期又随光照强度的增强而降低.所有处理组均在试验第1周达到最大值,第2周迅速下降.10%、50%、100%自然光下狐尾藻SOD活性在第2周分别较前1周下降了56.2%、43.1%、36.5%.在10%和50%自然光下狐尾藻SOD活性随试验进行趋于稳定,而在100%自然光下则一直呈下降的趋势.
|
| 图 2 狐尾藻叶片SOD的活性 Figure 2 SOD activity in leaves of M. spicatum |
通过对图 2中的A、B两组,C、D两组、E、F两组对比分析可知,除第1周外,同等光照条件下未添加附植藻类处理组的狐尾藻的SOD活性高于添加附植藻类组.试验末期3组光强下无藻组SOD活性分别是有藻组的1.35、1.91、4.46倍.10%自然光下的无藻组SOD活性最强,100%自然光下的有藻组SOD活性最弱,两处理组在试验末期相差9.89倍.
通过双因素方差分析可得,不同强度的光照、有无附植藻类以及两者的交互作用均对狐尾藻叶片SOD活性有显着影响(P<0.05),其中光照强度的影响达到极显着水平(P<0.01).SOD是活性氧清除系统中第一个发挥作用的抗氧化酶[13],在植物体受到胁迫或损伤时,SOD活性会发生相应变化[14].试验初期各处理组均启动了活性氧清除系统,但此时狐尾藻叶片SOD活性在100%自然光下的有藻组最高,作为对胁迫的响应,SOD活性增强来抵御外界环境对植物体的伤害,达到保护植物组织的目的.随时间延长这种胁迫不断加强,狐尾藻体内自由基的累积超过了SOD的清除能力,导致其受到了膜脂过氧化的伤害,进而使酶遭受不可逆破坏.试验末期狐尾藻叶片SOD活性在100%自然光下有附植藻类处理组降到最低.而在50%和10%自然光下,随试验的进行SOD活性在有藻和无藻组均趋于稳定,50%自然光下的有藻组稍低于其他处理组. 2.3 光照强度及附植藻类对狐尾藻叶片可溶性蛋白的影响
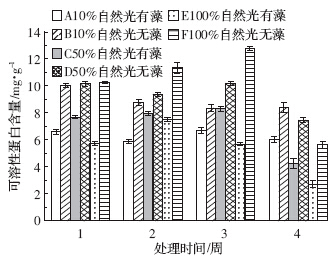
由图 3中的B、D、F组可以看出,狐尾藻叶片可溶性蛋白含量在实验初期随光照强度的增强而上升,试验末期又随光照强度的增强而下降.10%自然光下的可溶性蛋白含量变化较为稳定,50%和100%自然光下的可溶性蛋白含量在试验的第3周达到最大,在试验末期有较大幅度的下降,分别较前一周下降了26.6%和55.9%.
|
| 图 3 狐尾藻叶片可溶性蛋白的含量 Figure 3 Soluble protein content in leaves of M. spicatum |
通过对图 3中A、B两组,C、D两组,E、F两组对比分析可得,同等光照条件下未添加附植藻类处理组狐尾藻可溶性蛋白含量始终高于添加附植藻类的处理组.试验末期10%、50%、100%自然光下的未添加附植藻类处理组可溶性蛋白含量分别是有附植藻类处理组的1.39、1.75、2.07倍.50%自然光下的有附植藻类处理组可溶性蛋白含量在试验的前3周高于10%和100%自然光下的有附植藻类处理组,试验末期迅速下降.而100%自然光下有附植藻类处理组的可溶性蛋白含量在试验的第3周就开始下降,末期降至最低值.
通过双因素方差分析可知,不同强度的光照对狐尾藻叶片可溶性蛋白含量无显着影响(P>0.05),有无附植藻类以及两者的交互作用均对狐尾藻叶片可溶性蛋白有显着影响(P<0.05),其中附植藻类的影响达到极显着水平(P<0.01).试验的前3周,附植藻类对狐尾藻的胁迫不断增强,至第3周可溶性蛋白含量开始下降.作为对环境胁迫的响应,可溶性蛋白含量不断增强,以提高植物的抗逆性.但环境胁迫超过了植物的耐受极限,蛋白水解,可溶性蛋白含量开始下降,植物细胞受损.狐尾藻在100%自然光下有附植藻类处理组受胁迫最严重,其叶片可溶性蛋白含量最低. 2.4 光照强度及附植藻类对狐尾藻叶片丙二醛(MDA)含量的影响
由图 4中的B、D、F组可以看出,试验初期狐尾藻叶片MDA含量在不同光照强度下均处于较低水平.10%自然光下的MDA含量在整个试验中较为稳定,始终保持较低水平.50%自然光下狐尾藻MDA含量在试验的前3周较低,试验末期迅速增加,是初期的3.83倍.100%光强下狐尾藻MDA含量则随试验进行呈逐步上升的趋势,在试验末期急剧升高,分别是末期10%和50%自然光的6.14倍和2.34倍.
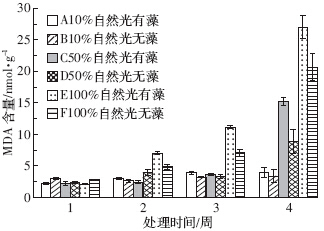
|
| 图 4 狐尾藻叶片MDA的含量 Figure 4 MDA content in leaves of M. spicatum |
通过对图 4中A、B两组,C、D两组、E、F两组对比分析可知,试验初期同等光照条件下添加和未添加附植藻类处理组狐尾藻MDA含量无显着差异(P>0.05),无附植藻类处理组略高于附植藻类处理组.随时间的变化添加附植藻类处理组狐尾藻MDA含量逐渐高于未添加附植藻类处理组.试验末期10%、50%、100%自然光下附植藻类处理组狐尾藻MDA含量分别是无附植藻类处理组的1.16、1.72、1.31倍.
通过双因素方差分析可知,有无附植藻类对狐尾藻叶片丙二醛含量无显着影响(P>0.05),不同强度的光照以及两者的交互作用均对狐尾藻叶片丙二醛含量有显着影响(P<0.05),其中光照强度的影响大于两者的交互作用.狐尾藻在10%自然光下,有附植藻类处理组狐尾藻MDA含量高于无附植藻类处理组,但没有达到显着水平(P>0.05),且有无附植藻类处理组狐尾藻MDA含量均较低.50%自然光在试验末期对狐尾藻胁迫加强,特别是在添加附植藻类的处理组.而狐尾藻叶片组织在100%自然光下的有附植藻处理组MDA含量均高于其他处理组,并在试验末期达到最大. 。 3 讨论
沉水植物对浅水富营养化湖泊的修复能力主要由太阳能来驱动,通过植物叶片的光合作用释放O2,增加水中溶解氧,促进有机污染物和某些还原性无机物的氧化分解,从而达到净化水质的目的[15].光合作用还提供了植物吸收水体中磷所必需的能量,反过来又促进了光合产物和能量在光合组织和非光合组织中的传递[16].沉水植物光合速率与叶绿素含量有显着相关性[12],对于同一种植物在相同的发育阶段,叶绿素含量多少可反应植物光合作用受外界因子影响的大小.已有研究[4, 16]表明狐尾藻最低可耐受的光照强度约为27 μmol·m-2·s-1 ,低于此光强将无法生长,也不利于叶绿素的合成.本试验的最低光强设置为10%自然光,而实验期间中午11:00左右两层遮阳网下水面光照强度的变化范围为39.6~75.6 μmol·m-2·s-1,由此可见本文设置的最低光强高于狐尾藻能耐受的最低光强.本实验中10%自然光下平均每株狐尾藻鲜重在试验末期较试验初期增加了1.86 g,说明实验所处理的最低光强能满足狐尾藻生长需要,并与所观测的狐尾藻生理指标的变化规律相吻合.本试验结果表明,狐尾藻叶绿素含量在10%自然光下最高,随光照强度的增强狐尾藻叶片叶绿素含量下降.在自然界的湖泊中,狐尾藻属于常见的沉水植物,比较适应弱光的环境.本试验50%自然光及100%自然光对狐尾藻来说可能太强,不利于叶绿素的合成.姜宏波等[17]在实验室条件下研究光照强度对鼠尾藻生长的影响,也发现叶绿素含量随光照强度的增加而显着下降;苏文华等[4]也发现狐尾藻等沉水植物的光合作用表现出强光抑制的现象;Ramus等[18]和林贞贤等[19]也得到相似的结果.此外,本研究还发现同等光照条件下,未添加附植藻类处理组狐尾藻叶绿素含量显着高于添加附植藻类组(P<0.05).这说明附植藻类对沉水植物狐尾藻叶绿素含量产生影响,进而影响其光合作用.宋玉芝等[20]研究马来眼子菜和穗花狐尾藻在去除附着生物前后的光合参数变化时发现,附着生物明显降低了沉水植物的光合作用,与本文研究结果是一致的.
植物在进化过程中形成了一套完整的抵抗外界不良因素的抗氧化酶系统[16].当植物短期处于逆境中时,会启动抗氧化保护酶系统,使酶活性增强以清除过多自由基,保护植物组织;但当胁迫作用过强或时间延长就会使抗氧化保护酶系统受损,酶活性下降,植物体抗氧胁迫能力减弱,不能抵御胁迫带来的伤害,植物出现衰老或死亡的现象[21, 22, 23].当植物体受到胁迫或损伤时,SOD活性会首先发生相应变化.在胁迫对细胞膜的损伤超过保护酶系统的防御值时,导致膜脂过氧化作用加强,MDA就是膜脂过氧化最终分解的产物,其含量可反映植物遭受胁迫伤害的程度[24].王爱国等[25]的研究表明,MDA数值的高低可表示细胞膜脂过氧化程度的大小及植物体逆境条件下耐受的强弱,MDA升高通常是植物细胞膜发生严重氧化损伤的标志.植物体内的可溶性蛋白大多是参与各种代谢的酶类,史玉炜等[26]认为其含量会随外界胁迫的增强而增加,是植物抗逆性的重要指标,与植物体代谢和衰老有密切关系.
本试验结果表明,狐尾藻叶片SOD活性和可溶性蛋白含量先随光照强度的增强而上升,试验末期又随光照强度的增强而下降.在整个试验期间,10%自然光下(39.6~75.6 μmol·m-2·s-1)狐尾藻叶片SOD活性、可溶性蛋白含量以及MDA含量始终保持较稳定的值,说明在10%自然光下,狐尾藻能进行正常的生理代谢活动.50%自然光下(104.4~140.4 μmol·m-2·s-1)狐尾藻叶片SOD活性、可溶性蛋白含量在试验的前3周缓慢增长,在试验末期迅速下降,MDA含量在试验的前3周较低,末期有较大幅度的上升,表明试验初期狐尾藻已受到环境的胁迫,抗氧化酶系统启动,保护植物体不受外界环境的伤害,狐尾藻仍在正常生长,但随时间的推移胁迫逐渐显现.而100%自然光下狐尾藻叶片SOD活性和可溶性蛋白含量随试验的进行呈下降的趋势,MDA含量一直在上升,说明狐尾藻在100%自然光下已受严重胁迫.本实验中100%自然光下每株狐尾藻鲜重在试验末期较试验初期降低了0.68 g,也说明100%自然光强已严重影响了狐尾藻的正常生长.本试验结果还表明,同等光照条件下未添加附植藻类处理组的SOD活性、可溶性蛋白含量始终高于添加附植藻类的处理组,而MDA含量则是添加附植藻类处理组高于未添加附植藻类处理组.这表明,附植藻类的存在可能直接对狐尾藻生理产生不利影响,进而影响狐尾藻的叶绿素含量.这一推测与本试验附植藻类存在降低狐尾藻叶绿素含量这一结果相吻合.实际上,附植藻类存在于植株表面,可能通过遮荫作用导致到达植物表面光强过低以及阻碍沉水植物对无机碳的吸收等对沉水植物产生不利的影响[27, 28].此外,附植藻类还会在沉水植物表面形成一个高氧、高pH、低二氧化碳的环境,进而影响沉水植物光合作用,甚至会产生一定毒害作用[29, 30, 31, 32, 33, 34, 35].通过双因素方差分析可以看出,光照强度、附植藻类以及两者的交互作用均对狐尾藻生长有显着影响,但光照强度对狐尾藻生理的影响达到极显着水平. 。 4 结论
(1)光照强度、附植藻类以及两者的交互作用均对狐尾藻生理有显着影响(P<0.05).
(2)狐尾藻叶片叶绿素含量随光照强度的增强而下降,MDA含量随光照强度的增强而增加,SOD活性及可溶性蛋白含量则表现为先随光照强度的增强而上升,试验末期又随光照强度的增强而下降.
(3)附植藻类均对沉水植物产生一定的伤害,膜脂化程度增加,表现为附植藻类处理组植物的MDA含量高于控制附植藻类处理组,与此同时抗氧酶(SOD)活性减弱,植物叶片叶绿素含量降低.
(4)狐尾藻在100%自然光下(210.2~230.4 μmol·m-2·s-1)有藻环境中的生理活动受到胁迫最严重,而10%自然光下(39.6~75.6 μmol·m-2·s-1)无附植藻类的环境有利于狐尾藻生理代谢.
| [1] | 牛淑娜, 张沛东, 张秀梅. 光照强度对沉水植物生长和光合作用影响的研究进展[J]. 现代渔业信息, 2011, 26(11):9-12. NIU Shu-na, ZHANG Pei-dong, ZHANG Xiu-mei. Research progress in the effect of light intensity on the growth and photosynthesis of submerged aquatic vegetation[J]. Modern Fisheries Information, 2011, 26(11):9-12. |
| [2] | 李 强. 环境因子对沉水植物生长发育的影响机制[D]. 南京:南京师范大学, 2007. LI Qiang. Influence mechanism of environment factors on the growth and development of submerged macrophytes[D]. Nanjing:Nanjing Normal University, 2007. |
| [3] | 王 华, 逄 勇, 马 璇, 等. 沉水植物生长影响因子研究进展[J]. 生态学报, 2008, 28(8):3958-3968. WANG Hua, PANG Yong, MA Xuan, et al. Research progress on influencing of environmental factors on the growth of submersed macrophytes[J]. Acta Ecologica Sinica, 2008, 28(8):3958-3968. |
| [4] | 苏文华, 张光飞, 张云孙, 等. 5种沉水植物的光合特征[J]. 水生生物学报, 2004, 28(4):391-395. SU Wen-hua, ZHANG Guang-fei, ZHANG Yun-sun, et al. The photosynthetic characteristics of five submerged aquatic plants[J]. Acta Hydrobiologica Sinica, 2004, 28(4):391-395. |
| [5] | 苏胜齐, 姚维志. 沉水植物与环境关系评述[J]. 农业环境保护, 2002, 21(6):570-573. SU Sheng-qi, YAO Wei-zhi. A brief review on mutual relationship between submerged macrophytes and environment[J]. Agro-environmental Protection, 2002, 21(6):570-573. |
| [6] | 吴明丽, 李叙勇. 光衰减及其相关环境因子对沉水植物生长影响研究进展[J]. 生态学报, 2012, 32(22):7202-7212. WU Ming-li, LI Xu-yong. Research progress on influencing of light attenuation and the associated environmental factors on the growth of submersed aquatic vegetation[J]. Acta Ecologica Sinica, 2012, 32(22):7202-7212. |
| [7] | 苏睿丽, 李 伟. 沉水植物光合作用的特点与研究进展[J]. 植物学通报, 2005, 22(增刊):128-138. SU Rui-li, LI Wei. Advances in research on photosynthesis of submerged macrophytes[J]. Chinese Bulletin of Botany, 2005, 22(Suppl):128-138. |
| [8] | 赵海超, 王圣瑞, 杨苏文, 等. 两种底质对狐尾藻生长和生理指标的影响[J]. 生态环境学报, 2010, 19(1):40-44. ZHAO Hai-chao, WANG Sheng-rui, YANG Su-wen, et al. Effect of two sediments on growth and physiological indexes of Myriophyllum Spicatum[J]. Ecology and Environmental Sciences, 2010, 19(1):40-44. |
| [9] | 张饮江, 刘小培, 金 晶, 等. 沉水植物对水体净化的研究进展[J]. 科技导报, 2012, 30(27):72-79. ZHANG Yin-jiang, LIU Xiao-pei, JIN Jing, et al. Research progress in submerged plant for purifying water quality[J]. Science & Technology Review, 2012, 30(27):72-79. |
| [10] | 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2007. LI He-sheng. The principle and technology of plant physiology and biochemistry experiment[M]. Beijing:Higher Education Press, 2007. |
| [11] | 陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社, 2002. CHEN Jian-xun, WANG Xiao-feng. Experimental guide of plant physiology[M]. Guangzhou:South China University of Technology Press, 2002. |
| [12] | 黎慧娟, 倪乐意. 浮游绿藻对沉水植物苦草生长的抑制作用[J]. 湖泊科学, 2007, 19(2):111-117. LI Hui-juan, NI Le-yi. The effects of chlorophyta on the growth of submersed macrophyte Vallisneria natans:A laboratory experiment[J]. Journal of Lake Science, 2007, 19(2):111-117. |
| [13] | 马旭俊, 朱大海. 植物超氧化物歧化酶(SOD)的研究进展[J]. 遗传, 2003, 25(2):225-231. MA Xu-jun, ZHU Da-hai. Functional roles of the plant superoxide dismutase[J]. Hereditas, 2003, 25(2):225-231. |
| [14] | 李 佩, 谢从新, 何绪刚, 等. 水体营养水平及附植藻类对苦草生长的影响[J]. 渔业现代化, 2012, 39(1):11-17. LI Pei, XIE Cong-xin, HE Xu-gang, et al. Effects of water nutritional condition and epiphytic algae on the growth of Vallisneria natans[J]. Fishery Modernization, 2012, 39(1):11-17. |
| [15] | 欧克芳, 林 鸿, 陈桂桥, 等. 沉水植物的特点及其应用[J]. 安徽农业科学, 2008, 36(17):7210-7211, 7221. OU Ke-fang, LIN Hong, CHEN Gui-qiao, et al. Characteristics of submerged plant and its application[J]. Journal of Anhui Agricultural Sciences, 2008, 36(17):7210-7211, 7221. |
| [16] | 邹丽莎, 聂泽宇, 姚笑颜, 等. 富营养化水体中光照对沉水植物的影响研究进展[J]. 应用生态学报, 2013, 24(7):2073-2080. ZOU Li-sha, NIE Ze-yu, YAO Xiao-yan, et al. Effects of light on submerged macrophytes in eutrophic water:Research progress[J]. Chinese Journal of Applied Ecology, 2013, 24(7):2073-2080. |
| [17] | 姜宏波, 田相利, 董双林, 等. 温度和光照强度对鼠尾藻生长和生化组成的影响[J]. 应用生态学报, 2009, 20(1):185-189. JIANG Hong-bo, TIAN Xiang-li, DONG Shuang-lin, et al. Effects of temperature and light intensity on the growth and biochemical composition of Sargassum thunbergii[J]. Chinese Journal of Applied Ecology, 2009, 20(1):185-189. |
| [18] | Ramus J, Beale S I, Mauzerall D, et al. Changes in photosynthetic pigment concentration in seaweeds as a function of water depth[J]. Marine Biology, 1976, 37(2):223-229. |
| [19] | 林贞贤, 宫相忠, 李大鹏. 光照和营养盐胁迫对龙须菜生长及生化组成的影响[J]. 海洋科学, 2007, 31(11):22-26. LIN Zhen-xian, GONG Xiang-zhong, LI Da-peng. Effects of light and the stress of nutrients deficiency on the growth and levels of chemical constituents of Gracilaria lemaneiformis[J]. Marine Sciences, 2007, 31(11):22-26. |
| [20] | 宋玉芝, 黄 瑾, 秦伯强. 附着生物对太湖常见的两种沉水植物快速光曲线的影响[J]. 湖泊科学, 2010, 22(6):935-940. SONG Yu-zhi, HUANG Jin, QIN Bo-qiang. Effects of epiphyte on the rapid light curves of two submerged macrophytes in Lake Taihu[J]. Journal of Lake Science, 2010, 22(6):935-940. |
| [21] | 潘 琦, 宋祥甫, 邹国燕, 等. 不同温度对沉水植物保护酶活性的影响[J]. 生态环境学报, 2009, 18(5):1881-1886. PAN Qi, SONG Xiang-fu, ZOU Guo-yan, et al. Effect of temperature on the activities of antioxidative enzymes of submerged macrophytes[J]. Ecology and Environmental Sciences, 2009, 18(5):1881-1886. |
| [22] | Wilson D O, Mcdonald N B. The lipid-peroxidation model of seed aging[J]. Seed Science and Technology, 1996, 14(2):269-300. |
| [23] | 易现峰, 杨月琴, 贲桂英. 浅析植物抗氧化的物质基础[J]. 青海师范大学学报:自然科学版, 1999, 1:40-47. YI Xian-feng, YANG Yue-qin, BEN Gui-ying. Simple analysis on the basis of antioxidation of plants[J]. Journal of Qinghai Normal University(Natural Science), 1999, 1:40-47. |
| [24] | 赵风斌. 富营养化水体中常见沉水植物恢复重建影响因子研究[D]. 上海:上海海洋大学, 2012. ZHAO Feng-bin. The research on influence factors of common submerged macrophytes restoration in eutrophication water[D]. Shanghai:Shanghai Ocean University, 2012. |
| [25] | 王爱国, 邵从本, 罗广华. 丙二醛作为植物脂质过氧化指标的探讨[J]. 植物生理学通讯, 1986, 28(3):84-90. WANG Ai-guo, SHAO Cong-ben, LUO Guang-hua. Inquiry into malondialdehyde as index of peroxidation of plant lipids[J]. Plant Physiology Communications, 1986, 28(3):84-90. |
| [26] | 史玉炜, 王燕凌, 李文兵, 等. 水分胁迫对刚毛柽柳可溶性蛋白、可溶性糖和脯氨酸含量变化的影响[J]. 新疆农业大学学报, 2007, 30(2):5-8. SHI Yu-wei, WANG Yan-ling, LI Wen-bing, et al. Effects of water stress on soluble protein, soluble sugar and proline content in Tamarix hispida[J]. Journal of Xinjiang Agricultural University, 2007, 30(2):5-8. |
| [27] | Liboriussen L. Production, regulation and ecophysiology of periphyton in shallow freshwater lake[D]. Denmark:National Environmental Research Institute, 2003, 11-14. |
| [28] | Irfanullah H M, Moss B. Factors influencing the return of submerged plants to a clear-water, shallow temperate lake[J]. Aquatic Botany, 2004, 80(3):177-192. |
| [29] | 谭海剑. 附植生物对沉水植物的影响研究进展[J]. 广州环境科学, 2008, 23(3):25-28. TAN Hai-jian. Research progress on the effect of epiphyton on submerged macrophytes[J]. Guangzhou Environment Sciences, 2008, 23(3):25-28. |
| [30] | Roberts E, Kroker J, Körner S, et al. The role periphyton during the recolonization of a shallow lake with submerged macrophytes[J]. Hydrobiologia-The Hague, 2003, 506-509(1-3):525-530. |
| [31] | 陈 灿, 张 浏, 赵兴青, 等. 不同营养状态下附生藻类对菹草叶片光合机能的影响[J]. 湖泊科学, 2007, 19(4):485-491. CHEN Can, ZHANG Liu, ZHAO Xing-qing, et al. The effect of epiphytic algae on the photosynthetic function of Potamogeton crispus in different nutrition conditions[J]. Journal of Lake Science, 2007, 19(4):485-491. |
| [32] | Burkholder J M, Wetzel R G. Epiphytic alkaline phosphatase on natural and artificial plants in an oligotrohpic lake:Re-evaluation of the role of macrophytes as phosphorus source for epiphytes[J]. Limnology and Oceanography, 1990, 35(3):736-747. |
| [33] | 宋玉芝, 秦伯强, 高 光, 等. 附着生物对沉水植物伊乐藻生长的研究[J]. 生态环境, 2007, 16(6):1643-1647. SONG Yu-zhi, QIN Bo-qiang, GAO Guang, et al. Effect of periphyton on the growth of Elodea nuttalii[J]. Ecology and Environment, 2007, 16(6):1643-1647. |
| [34] | Quinlan E L, Phlips E, Donnelly K A, et al. Primary producers and nutrient loading in Silver Springs, FL, USA[J]. Aquatic Botany, 2008, 88(3):247-255. |
| [35] | Deborah K P, Suzanne N, Levine M B. Measurements of phosphorus uptake by macrophytes and epiphytes from the LaPlatte River(VT) using 32P in stream microcosms[J]. Freshwater Biology, 1998, 39(2):285-299. |
 2015, Vol. 34
2015, Vol. 34