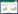文章信息
- 刘柿良,杨容孑,马明东,蒋潘,赵燕
- LIU Shi-liang, YANG Rong-jie, MA Ming-dong, JIANG Pan, ZHAO Yan
- 土壤镉胁迫对龙葵(Solanum nigrum L.)幼苗生长及生理特性的影响
- Effects of Soil Cadmium on Growth and Physiological Characteristics of Solanum nigrum L. Plants
- 农业环境科学学报, 2015, 34(2): 240-247
- Journal of Agro-Environment Science, 2015, 34(2): 240-247
- http://dx.doi.org/10.11654/jaes.2015.02.006
-
文章历史
- 收稿日期:2014-08-17
土壤Cd污染已成为国内外普遍关注的问题.质膜是重金属进入植物体引起胁迫响应的原初部位[1],研究表明Cd胁迫不但诱导质膜过氧化、积累活性氧(ROS),影响抗氧化物质,而且改变膜组成和流动性,干扰电荷平衡和 H+流动[2].P 型 ATP 酶是质膜上由 ATP 驱动可被磷酸化的阳离子泵,在离子运输(H+-ATP酶)、信号转导(Ca2+-ATP酶)等方面作用显着[3].Burzyński 等[4]研究发现,100 μmol·L-1 Cd处理玉米(Zea mays)根系18 h,其质膜H+-ATP酶活性增强.Cd处理3 d的黄瓜(Cucumis sativus)根系也可观察到质膜H+-ATP酶活性升高[2]; 而长时间(7 d)高浓度Cd(100 μmol·L-1)处理却限制其活性[5].各异的研究结果使得ATP 酶活性在重金属诱导下的认识尚未统一.过量Cd胁迫会影响植物对氮(N)、磷(P)、钾(K)和微量元素的吸收、转运与分配[6, 7],如对于洋甘菊(Matricaria chamomilla)[8]、苜蓿(Medicago truncatula)[9]和水稻(Oryza sativa)[10],Cd胁迫能改变其对土壤营养元素的吸收和积累.但植物为适应土壤环境变化,能主动调节养分需求从而调整体内元素丰度.对重金属耐性的研究在不同植物间难以得到一致结果,而用同一植物不同部位对重金属敏感性的比较研究可避免物种差异带来的影响[6].
龙葵(Solanum nigrum)是我国新近发现的Cd超积累植物[11],研究其对Cd的耐性机制对植物修复技术的深入探讨意义重大.Wei等[11]认为,Cd主要富集在龙葵叶片,添加 25 mg·kg-1时茎和叶中 Cd 含量分别为103.8、124.6 mg·kg-1;Wang等[12]发现 Cd 浓度小于12 mg·kg-1 时,龙葵叶片 N 代谢水平正常; Sun 等[13]报道龙葵叶片中总 Cd 和水溶性 Cd 量与其叶片中乙酸和柠檬酸含量正相关.关于 Cd 对龙葵养分代谢及其质膜 ATP 酶的影响研究还未见报道.因此,本研究以龙葵为试验材料,采用盆栽试验研究 Cd 胁迫对龙葵幼苗养分吸收、质膜过氧化及质膜 ATP 酶影响,掌握超积累植物对重金属 Cd 胁迫的抗氧化特性,以及N、P、K吸收和质膜 ATP 酶的调控机理,探讨超积累植物龙葵的耐镉机制. 1 材料与方法 1.1 供试材料 供试龙葵种子由北京医科院药用植物研究所提供.试供土样取自四川农业大学成都校区周边自然土壤[黄壤(紫色土),即园土],其中不含腐叶根,采样深度为表层0~20 cm;发酵土由成都温江花木交易中心提供.试剂氯化镉(CdCl2·2.5H2O)为分析纯. 1.2 试验方法 2013年6月中旬,将采集的园土自然风干并捣碎、剔除杂物,研磨后过5 mm筛.按 1∶1(W/W)将发酵土和园土均匀混合成种植土,添加少量多菌灵并在干燥的实验室堆积静置45 d.然后将种植土(干土)按每盆 5.00 kg 装入带托盘塑料花盆(下口径 20 cm,上口径30 cm,高25 cm).将装有种植土的花盆置于实验大棚,加入不含Cd等干扰物质的清水,控制土壤含水量为田间持水量的60%.种植土(园土+发酵土)的基本理化性质为:pH6.8,全氮(N) 0.73 g·kg-1,全磷(P) 0.38 g·kg-1,全钾(K) 3.76 g·kg-1,有机碳(C) 32.92 g·kg-1,总 Cd 0.419 mg·kg-1.
2013 年 8月15日,将龙葵种子消毒后播种于穴盘.待幼苗长出4 片真叶时,挑选健壮且长势一致的龙葵植株移栽至塑料花盆,每盆3 株,种植深度1.5~2.0 cm.精心养护管理,视植株的生长情况浇水,浇水时将溢出的水倒回盆内.若盆内有杂草,应及时拔下并放回盆中,以减少水分与养分的流失.为避免其他物质影响结果,试验中不喷施农药与追施化肥.该试验大棚中透光率为 80%,温度(26±3)℃,室内外温度接近,平均相对湿度约为70%.
植株恢复生长后,于2013年9月29日开始Cd 胁迫处理.根据国家土壤环境质量标准和四川盆地重金属污染发展概况[6, 7],以不添加Cd作为对照(0 mg·kg-1;CK),Cd处理水平为10、20、40、80、160 mg·kg-1(不含背景值,以Cd2+计),每处理5次重复,共35盆105株.按预先设置Cd水平向各盆添加 Cd:以分析纯氯化镉与蒸馏水配制成约500 mL 溶液均匀施入相应塑料盆中,将渗出液反复回收浇灌,直到Cd2+与土壤均匀混合.
2013年10月1日至12日上午9:00-11:00收获不同处理下的龙葵植株,根系在乙二胺四乙酸二钠溶液中(Na2-EDTA,20 mmol·L-1)浸泡 15 min 去除表面粘附离子,再用蒸馏水数次洗净,待测. 1.3 测定方法 1.3.1 生长指标与叶绿素含量的测定
选取不同处理下幼苗,利用 Li-3000C(Li-Cor,Lincoln,Nebraska,USA)便携式叶面积仪测定植株的叶长和叶宽;采用游标卡尺测量根长(主根长)、株高度、基径粗度,计算单株总叶数;参照李合生等[14]方法测定叶片叶绿素a(Chla)、b(Chlb)含量,计算总叶绿素(Chl)及叶绿素a/b(Chla/b).
将样品分为根、茎、叶与果实四部分(叶、茎为地上部;根为地下部),准确称鲜重.105 ℃ 烘箱内杀青30 min,再在75 ℃下烘干至恒重,计算单株根、茎、叶、果实及单株生物量. 1.3.2 自由基代谢指标与抗氧化酶(剂)的测定
采用Cakmak等[15]方法测定丙二醛(MDA)含量.参照 Patterson等[16]方法测定过氧化氢(H2O2)的含量.
参照李合生等[14]方法测定过氧化氢酶(CAT)活性(紫外吸收法),过氧化物酶(POD)活性(愈创木酚法)和超氧化物歧化酶(SOD)活性(氮蓝四唑光化还原法). 1.3.3 质膜 ATPase活性的测定
质膜分离参照Wang等[17]的方法并略加改动.取2.0 g样品加入2倍(W/V)体积预冷的磷酸盐缓冲液[Hepes-Tris 25 mmol·L-1,pH 7.6,甘露醇 250 mmol·L-1,EGTA 5.0 mmol·L-1,乙二胺四乙酸(EDTA)5.0 mmol·L-1,KCl 10 mmol·L-1,苯甲基磺酰氟(PMSF)2.0 mmol·L-1,1.5% 聚乙烯吡咯烷酮(PVP),0.5%牛血清蛋白(BSA),抗氧化剂(BHT) 5 μg·L-1,K2S2O5 5.0 mmol·L-1,二硫苏糖醇(DTT) 1.0 mmol·L-1],冰浴研磨.研磨液经 4 层纱布过滤,将滤液以13 000×g离心 30 min(4 ℃),取上清液 60 000×g离心30 min,弃上清液,将沉淀悬浮于 1.0 mL PBS(Hepes-Tris 2.5 mmol·L-1,pH 7.6,甘露醇 250 mmol·L-1,EDTA 1 mmol·L-1,DTT 1.0 mmol·L-1)中,置于不连续梯度蔗糖(45%、36% 和22%)中,经70 000×g离心2 h,36% 和 45% 间带溶液为质膜微囊,取出测定 ATPase 活性.质膜H+-ATPase活性测定采用 Wang 等[17]方法; 质膜 Ca2+-ATPase 活性测定参照缪颖等[18]的方法. 1.3.4 N、P和K 的测定
(1)植物组织中N、P和K 测定:将烘干至恒重的样品粉碎过60目筛,称取 0.5 g于消煮管中加H2SO4 8 mL,摇匀静置,用电炉消煮至溶液呈棕黑色,滴加30% H2O2数次(量逐减),消煮至溶液无色,冷却.煮液无损洗入100 mL容量瓶定容,澄清后供测定.
①蒸馏法测定全 N:吸取待测液10 mL于蒸馏管中.150 mL三角瓶中加2% H3BO3指示剂混合液5 mL于定氮仪冷凝管末端,管口置于H3BO3液面上4 cm.向馏室加入20 mL 10 mol·L-1 NaOH,馏出液体积约50 mL 时完毕.用5 mmol·L-1 H2SO4标液滴定馏出液由蓝绿至刚变为红紫色即可.
②钒钼黄比色法测定全 P:吸取待测液10 mL于50 mL容量瓶中,加2,6-二硝基酚指示剂,6 mol·L-1 NaOH 调pH至刚显黄色,加入钒钼酸铵试剂10 mL,用水定容,摇匀.15 min后分光光度计450 nm比色.
③火焰光度法测定全 K:吸取待测液10 mL于50 mL容量瓶,定容,摇匀,直接在火焰光度计上测定.
(2)土壤中N、P和K测定:
① 凯氏蒸馏法测定全 N:取风干磨细过60目筛土样 0.3 g于消煮管中加H2SO4 8 mL,摇匀静置.电炉消煮至溶液和土粒全变为灰白稍带绿色后,消煮1 h冷却,定氮仪蒸馏.
②氢氧化钠熔融法测定全 P和K:准确称取样品 0.25 g于镍坩埚,样品上平铺 2 g NaOH.于高温电炉升温至400 ℃时暂停15 min,后升至720 ℃保持15 min冷却.加80 ℃水10 mL待熔块溶解后无损失转入 100 mL容量瓶,3 mol·L-1 H2SO4溶液10 mL和水多次洗坩埚于容量瓶,冷却,定容.取测液10 mL于50 mL容量瓶,加入二硝基酚指示剂,并用10%Na2CO3溶液调至刚呈微黄.加入5 mL钼锑抗显色剂,摇匀,定容,静置30 min.分光光度计700 nm处比色. 1.3.5 Cd 的测定
(1)土壤Cd测定:取土样 0.5 g 于 30 mL聚四氯乙烯坩埚内,加10 mL 氟化氢(HF)和 5 mL HNO3-HClO4(3∶1,V/V)混合液,放置过夜,砂浴低温(100 ℃以下)消化1 h,升温(250 ℃以下)继续消化至 HClO4大量冒烟,加入5 mL HF和混合酸液,消化至HClO4大量冒烟至干,再加 5 mL HNO3消解至清亮透明.冷却定容至25 mL过滤.
(2)植株中Cd测定:称取0.1 g植物样品在电炉上碳化后,在550 ℃马福炉中干灰化6 h,5 mL 6 mol·L-1 HCl溶解,过滤,0.1 mol·L-1 HCl定容至 50 mL,测定Cd含量.
上述Cd 测定均采用原子吸收分光光度法(SHIMADZU AA-6300,Kyoto,Japan)测定. 1.4 数据分析
采用 SPSS 17.0软件统计分析,单因素方差分析(One-way ANOVA)和最小显着性差异法(LSD)检验,Microsoft Excel 2013制表作图.显着性水平设定为α=0.05.所有数据均为3次独立试验的平均值. 2 结果与分析 2.1 Cd对龙葵幼苗生长的影响
10 mg·kg-1 Cd处理下幼苗叶数、叶长、叶宽及叶柄长较CK分别提高20.2%、14.1%、11.7%和10.9%,且随着Cd浓度增大先升后降,叶数、叶长和叶宽在20 mg·kg-1处理时达到最大(表 1).根长随着Cd胁迫程度的增强而先升高后降低,10 mg·kg-1处理下根长达到最大,较CK处理升高22.3%,10~80 mg·kg-1处理间差异不显着(P>0.05).株高和基径粗作为植物生长重要指标,均随Cd胁迫浓度的增加先升后降.与CK处理相比,10 mg·kg-1处理下株高与其无明显差异,而基径粗则差异显着; 株高在20 mg·kg-1处理下达到最大,而基径粗在10 mg·kg-1处理时已达最大.
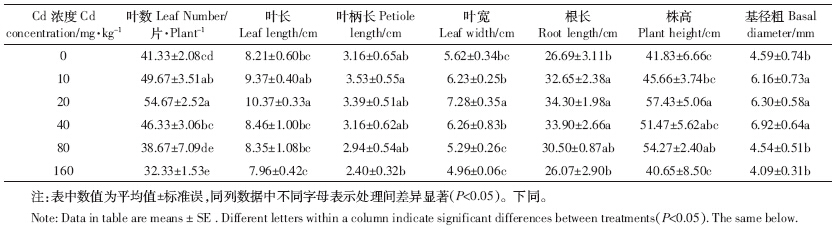
随着Cd胁迫浓度增加,根鲜重和根、茎、叶与植珠干重逐渐降低;茎、叶、果实和植株鲜重先升后降;而果实干重则在10 mg·kg-1处理降低显着,随后先升后降.与CK相比,低浓度Cd处理(10 mg·kg-1)茎和植株鲜重分别升高73.9%和23.9%,根鲜重和果实干重却显着降低8.2%和21.2%.茎、叶和植株鲜重在20 mg·kg-1下达最大,较CK分别升高97.5%、35.7%和46.6%,果实鲜重在40 mg·kg-1处理下达最大,较CK升高98.0%(表 2).
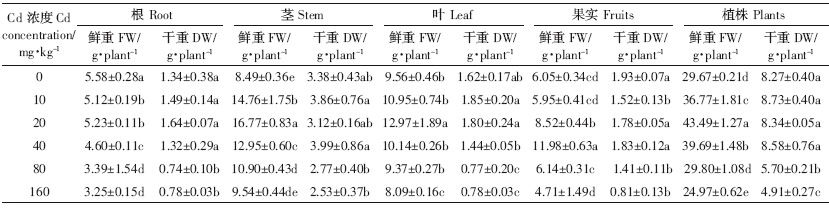 |
随着Cd胁迫浓度增大,Chla、Chlb和Chl含量先增后降,10 mg·kg-1处理下达到最高,160 mg·kg-1处理下最低(低于CK),而Chla/b变化趋势不一(表 3).10 mg·kg-1处理下,Chla、Chlb、Chl含量较CK处理分别提高18.2%、34.6%和23.0 %,Chla/b较CK显着降低13.0%.
 |
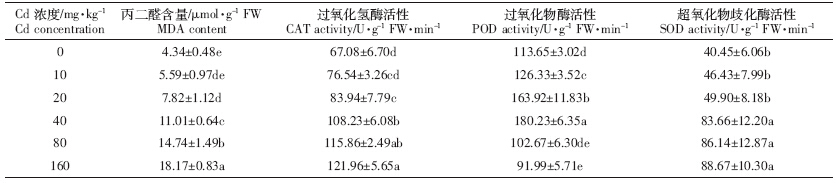
表 4显示,MDA含量随着Cd胁迫浓度增大而增大,160 mg·kg-1处理下达最大,20、40、80、160 mg·kg-1处理下较CK分别提高80.2%、153.7%、239.6%和318.7%,而10 mg·kg-1处理与CK间差异不显着.同时,CAT与SOD随Cd浓度增大而增大,10、20 mg·kg-1与CK处理以及40、80、160 mg·kg-1处理间差异不显着;而POD则随胁迫程度增强先升后降,40 mg·kg-1处理下达最大,较CK提高58.6%,160 mg·kg-1处理下最低,且低于CK.
 |
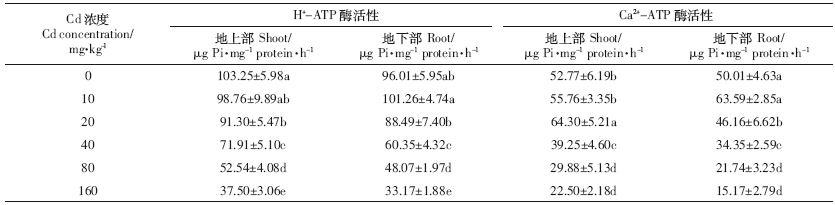
随着 Cd 浓度的增加,地上(下)部质膜 H+-ATP酶和地下部 Ca2+-ATP酶活性逐渐降低,160 mg·kg-1处理下最低,分别较CK降低63.7%、65.5%和73.9%;而地上部 Ca2+-ATP酶活性则先升后降,20 mg·kg-1处理下达最大(较CK升高21.9%).10 mg·kg-1处理下,地上(下)部质膜H+-ATP和Ca2+-ATP酶活性与CK处理间均无显着差异(表 5).
 |
随Cd浓度增大,根、茎、叶和果实中N、P、K积累量(除茎P外)均先升后降(表 6).茎N和P积累量以及根、叶、果实中N和K积累量均在20 mg·kg-1处理达到最大;而根、叶和果实中P积累量在40 mg·kg-1处理达最高,较CK分别提高24.5%、37.1%和 63.5%.茎K积累量随Cd浓度增大而降低,160 mg·kg-1处理达最小,较CK降低40.2%.同时随Cd浓度增大,幼苗器官Cd积累逐渐增大,至160 mg·kg-1处理达最大,较CK升高34.4%~127.1%.相同Cd浓度下,叶Cd积累量达最高(166.33~291.41 mg·kg-1),茎次之(92.90~198.29 mg·kg-1),果实中最低(42.82~97.22 mg·kg-1),其大小顺序为:叶>茎>根>果实.
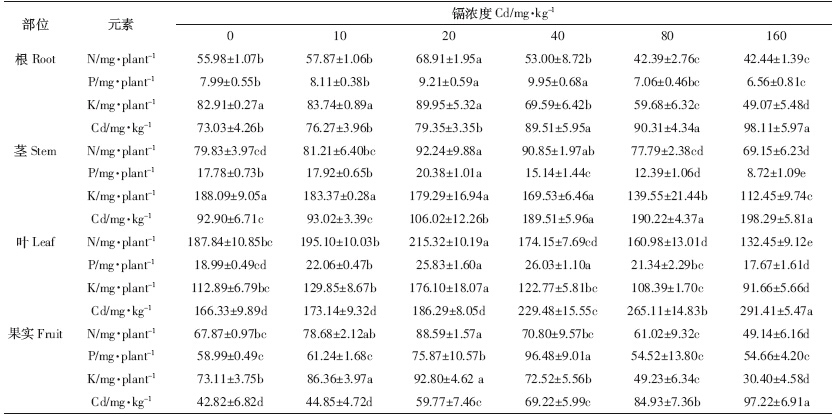 |
根系作为接触土壤Cd的直接器官,对吸收的Cd2+具有截留作用[19],能够通过根细胞中的谷胱甘肽(GSH)或含硫化合物作用生成的螯合物降低Cd对根的毒害.本研究中龙葵主根长的变化就佐证了该观点,表明一定浓度Cd刺激根细胞壁,增强交换位点蛋白活性,对Cd2+交换排斥从而促进其发育[20].研究表明,根、茎、叶及果实中Cd积累量随Cd浓度的增大而增大,高于超积累植物滇苦菜(Picris divaricate)[21],但低于洋甘菊(Matricaria chamomilla)[8].究其原因,可能是由于不同植物对Cd的耐受属性存在差异及Cd处理浓度不同.同时,生物量能够反映植物对重金属的耐性情况[22].研究中龙葵根、茎、叶、果实及植株鲜(干)重均随Cd浓度增大呈“低促高抑”.Gonzaga等[23]指出,植物在逆境条件下,常常会改变其生物量的分配与利用方式,将有限的资源分配到不同的结构和功能器官上以更好适应恶劣环境.将重金属向地上部转移,使根部重金属含量下降是许多超积累植物抗重金属胁迫的重要原因之一.另一方面,株高和基径粗作为植物生长的重要指标.龙葵幼苗表现出与皇竹草(Pennisetum hydridum)[24]和石竹(Dianthus chinensis)[25]相似的“低促高抑”,是由于较低浓度Cd2+能加快细胞分裂,而高Cd浓度则阻碍细胞分裂[10].
叶绿素含量高低常作为植物进行光合作用的评判标准.Cd能直接干扰叶绿素生物合成,从而降低其光合速率[26].研究表明,10 mg·kg-1 Cd处理下,叶片Chla、Chlb和Chl含量较CK显着提高,而后随胁迫浓度增大出现不同程度降低,160 mg·kg-1处理下最低.高Cd胁迫导致植物Chl含量的降低可能是因为Cd与叶绿体中多种酶的巯基(-SH)结合导致叶绿体的结构和功能受到破坏,致使叶绿素分解[27].邵国胜等[28]发现,较高浓度Cd 显着降低分蘖期的水稻叶片色素含量,且Chlb降低程度大于Chla.Pankovic等[29]认为,一定浓度Cd能抑制向日葵(Portulaca grandiflora)叶片中Rubisco活性,降低叶绿素含量从而降低植物光合能力. 3.2 Cd胁迫对龙葵抗氧化系统的影响
MDA含量常被作为植物细胞ROS累积水平和受损程度的判断指标,研究中MDA含量积累量随Cd浓度增大而增大.Cd是质膜过氧化的重要诱变剂,高Cd诱导会产生较多MDA,加剧植物细胞自由基量态,促进Cd2+与细胞内的含 N、S 基团或蛋白质亲和形成二硫键(-S-S-)[30],导致膜离子通道结构破坏.刘俊祥等[20]对超积累植物P. divaricate的研究得到了相似结论.SOD 作为细胞内清除ROS的首要防线酶,能将 O2-·歧化为H2O2,通过催化Fenton反应而消除产生的更多 ·OH.通常情况下,SOD在Cd胁迫下表现为随胁迫增加而增加,或先升后降.POD和CAT可催化H2O2形成 H2O,从而有效阻止O2-·和 H2O2积累.本研究中,CAT与SOD活性随Cd浓度增大而增大,而POD活性随Cd浓度增大则先增后降(表 4).SOD活性增强,是由于SOD核编码酶(Cu/Zn-SOD、Fe-SOD 和 Mn-SOD)存在于介质中,当其受到 ROS 刺激时,会通过 -NH2末端定位顺序运至细胞并产生作用[19].另一方面,CAT活性逐渐增强可能由于CAT2 基因表达产物对H2O2特异性清除.Kovácik等[8]对洋甘菊研究结果就证实了该观点.Cd浓度≤40 mg·kg-1时,POD活性先升后降,与CAT和SOD对H2O2催化作用起共同主导作用;而Cd浓度>40 mg·kg-1时,POD活性由于Cd毒害而失去其主导作用.这些结果表明,抗氧化酶活性变化可能是超积累植物的重金属解毒机制之一. 3.3 Cd胁迫对龙葵吸收N、P和K的影响
重金属胁迫易导致植物营养元素不足或失调,扰乱正常的生理代谢乃至植物生长[7].Cd在叶片内积累过多,易与叶绿体蛋白质上的巯基(-SH-)键结合,或取代Ca、Mg、Zn和Fe等元素,破坏叶绿体结构,干扰植物对营养元素吸收和转移,从而降低叶绿素的生物合成能力[9].研究中根、茎、叶和果实中全N、P、K积累量均随Cd浓度增大而先升后降(除茎P外),表明一定浓度Cd胁迫能降低C和N代谢相关酶活性[31],限制对N吸收和利用.K 积累量在Cd 胁迫下发生显着改变,Cd 干扰对K+吸收可能是因为存在某种交互作用[5, 7].另一方面,细胞质膜H+-ATP酶活性变化与植物抗性紧密相关,Ca2+-ATP酶能通过主动运输对胞内Ca2+ 平衡微调[3].研究发现,地上部H+-ATP酶活性随Cd浓度增加而降低(表 6),Cd胁迫增强细胞呼吸强度,抵御Cd2+毒害,将 H+泵出胞外.地下部H+-ATP酶在Cd 浓度≤10 mg·kg-1时略有上升,表明根尖组织需要较高的质子电化学势梯度维持离子平衡,保证细胞对Cd胁迫的渗透调节; Cd 浓度≥20 mg·kg-1时则显着下降,可能与胞内Ca调素(CaM)有关[32].Cd 胁迫造成胞内 Ca2+水平上升,导致CaM下降而使质膜Ca2+-ATP酶活性下降,高水平Ca2+无法有效泵出细胞,于是通过信号传导降低质膜H+-ATPase mRNA转录水平,导致活性下降[4].Cd浓度≥20 mg·kg-1 时,地上部ATP酶(H+-ATPase和Ca2+-ATPase)活性高于地下部,表明高浓度Cd胁迫破坏质膜,损伤了根主动吸收,影响根系活力[2]. 4 结论
(1)土壤培养下,龙葵幼苗能够超积累Cd,其器官组织累积量顺序由高到低依次为:叶>茎>根>果实.
(2)从幼苗叶性状、株高、主根长及叶绿素含量等生长指标来看,高浓度Cd(>40 mg·kg-1)抑制龙葵幼苗生长.
(3)当Cd浓度≤40 mg·kg-1时,幼苗的过氧化程度(MDA和H2O2)较轻,细胞质膜H+-ATP酶和Ca2+-ATP酶活性未受严重影响,促进器官对N、P和K的吸收; 而当Cd浓度>40 mg·kg-1时,则限制幼苗对N、P、K吸收,其对氧化胁迫的响应方式不同.
| [1] | Kudo H, Kudo H, Ambo H, et al. Cadmium sorption to plasma membrane isolated from barley roots is impeded by copper association onto membranes[J]. Plant Science, 2011, 180(2):300-305. |
| [2] | Janicka-Russak M, Kaba?a K, Burzyński M. Different effect of cadmium and copper on H+-ATPase activity in plasma membrane vesicles from Cucumis sativus roots[J]. J Exp Bot, 2012, 63(11):4133-4142. |
| [3] | 刘柿良, 潘远智, 马明东, 等. 外源 NO 对镉胁迫下长春花质膜过氧化、ATPase及矿质营养吸收的影响[J]. 植物营养与肥料学报, 2014, 20(2):445-458. LIU Shi-liang, PAN Yuan-zhi, MA Ming-dong, et al. Effects of exogenous NO on mineral nutrition absorption, lipid peroxidation and ATPase of plasma membrane in Catharanthus roseus tissues under cadmium stress[J]. J Plant Nutri Fert, 2014, 20(2):445-458. |
| [4] | Burzyński M, Kolano E. In vivo and in vitro effects of copper and cadmium on the plasma membrane H+-ATPase from cucumber(Cucumis sativus L.) and maize(Zea mays L.) roots[J]. Acta Physiol Plant, 2003, 25(1):39-45. |
| [5] | Xu L, Dong Y, Kong J, et al. Effects of root and foliar applications of exogenous NO on alleviating cadmium toxicity in lettuce seedlings[J]. Plant Growth Regul, 2014, 72(1):39-50. |
| [6] | 刘柿良, 杨容孑, 潘远智, 等. 镉胁迫对长春花质膜过氧化、ATP酶及5'-核苷酸酶活性的影响[J]. 农业环境科学学报, 2013, 32(5):916-914. LIU Shi-liang, YANG Rong-jie, PAN Yuan-zhi, et al. Effects of cadmium on lipid peroxidation, ATPase and 5'-AMPase activity of cytomembrane in Catharanthus roseus tissues[J]. J Agro-Environ Sci, 2013, 32(5):916-914. |
| [7] | Wu F Z, Yang W Q, Zhang J, et al. Cadmium accumulation and growth responses of a poplar(Populus deltoids×Populus nigra) in cadmium contaminated purple soil and alluvial soil[J]. J Haza Mater, 2010, 177(1):268-273. |
| [8] | Ková?ik J, Babula P, Klejdus B, et al. Unexpected behavior of some nitric oxide modulators under cadmium excess in plant tissue[J]. PLoS ONE, 2014, 9:e91685. DOI:10. 1371/journal. pone. 0091685. |
| [9] | Xu J, Wang W, Yin H, et al. Exogenous nitric oxide improves antioxidative capacity and reduces auxin degradation in roots of Medicago truncatula seedlings under cadmium stress[J]. Plant and Soil, 2010, 326(1):321-330. |
| [10] | Liu J G, Liang J S, Li K Q, et al. Correlation between cadmium and mineral nutrients in absorption and accumulation in various genotypes of rice under cadmium stress[J]. Chemosphere, 2003, 52(9):1467-1473. |
| [11] | Wei S H, Zhou Q X, Wang X, et al. A newly discovered Cd-hyperaccumulator Solanum nigrum L[J]. Chin Sci Bull, 2004, 49(24):2568-2573. |
| [12] | Wang L, Zhou Q X, Ding L L, et al. Effect of cadmium toxicity on nitrogen metabolism in leaves of Solanum nigrum L. as a newly found cadmium hyperaccumulator[J]. J Haza Mater, 2008, 154(1-3):818-825. |
| [13] | Sun R L, Zhou Q X, Jin C X. Cadmium accumulation in relation to organic acids in leaves of Solanum nigrum L. as a newly found cadmium hyperaccumulator[J]. Plant and Soil, 2006, 285(1):125-134. |
| [14] | 李合生, 孙 群, 赵世杰. 植物生理生化试验原理和技术[M]. 北京:高等教育出版社, 2000. LI He-sheng, SUN Qun, ZHAO Shi-jie. Theory and technique of plant physiological and biochemical experiments[M]. Beijing:Higher Education Press, 2000. |
| [15] | Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves[J]. Plant Physiology, 1992, 98(4):1222-1227. |
| [16] | Patterson B D, MacRae E A, Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium(Ⅳ)[J]. Analytical Biochemistry, 1984, 139(2):487-492. |
| [17] | Wang Y, Sze H. Similarities and differences between the tonoplast-type and the mitochondrial H+-ATPase of oat roots[J]. J Biol Chem, 1985, 260(19):10434-10443. |
| [18] | 缪 颖, 曹家树, 将有条, 等. 大白菜干烧心病发生过程中Ca2+-ATPase 活性的变化[J]. 园艺学报, 1998, 25(1):51-55. MIAO Ying, CAO Jia-shu, JIANG You-tiao, et al. Changes of Ca2+-ATPase activity in inner leaves during the development of tipburn in Chinese cabbage[J]. Acta Horticulturae Sinica, 1998, 25(1):51-55. |
| [19] | Benavides M, Gallego S, Tomaro M. Cadmium toxicity in plants[J]. Braz J Plant Physiol, 2005, 17(1):21-34. |
| [20] | 刘俊祥, 孙振元, 勾 萍, 等. 镉胁迫下多年生黑麦草的光合生理响应[J]. 草业学报, 2012, 21(3):191-197. LIU Jun-xiang, SUN Zhen-yuan, GOU Ping, et al. Response of photosynthetic physiology of perennial ryegrass(Lolium perenne) to Cd2+ stress[J]. Acta Prataculture Sinica, 2012, 21(3):191-197. |
| [21] | 汤叶涛, 关丽捷, 仇荣亮, 等. 镉对超富集植物滇苦菜抗氧化系统的影响[J]. 生态学报, 2010, 30(2):324-332. TANG Ye-tao, GUAN Li-jie, QIU Rong-liang, et al. Antioxidative defense to cadmium in hyperaccumulator Picris divaricata V.[J]. Acta Ecologica Sinica, 2010, 30(2):324-332. |
| [22] | Liu S L, Yang R J, Ma M D, et al. Effects of exogenous NO on the growth, mineral nutrient content, antioxidant system, and ATPase activities of Trifolium repens L. plants under cadmium stress[J]. Acta Physiologiae Plantarum, 2015, 37(1):1721-1723. |
| [23] | Gonzaga M I S, Santos J A G, Ma L Q. Phytoextraction by arsenic hyperaccumulator Pteris vittata L. from six arsenic-contaminated soils:Repeated harvests and arsenic redistribution[J]. Environ Pollut, 2008, 154(8):212-218. |
| [24] | 易自成, 贺俊波, 程 华, 等. 镉对皇竹草构件生长及生理特性的影响[J]. 农业环境科学学报, 2014, 33(2):276-282. YI Zi-cheng, HE Jun-bo, CHENG Hua, et al. Effects of Cd polluted soil on the modular growth and physiological characteristics of Pennisetum hydridum[J]. J Agro-Environ Sci, 2014, 33(2):276-282. |
| [25] | 丁继军, 潘远智, 刘柿良, 等. 外源AsA对土壤重金属镉胁迫下石竹(Dianthus chinensis)幼苗生长的影响[J]. 农业环境科学学报, 2013, 32(8):1520-1528. DING Ji-jun, PAN Yuan-zhi, LIU Shi-liang, et al. Effects of exogenous AsA on the growth of Dianthus chinensis seedlings under soil Cd stress[J]. J Agro-Environ Sci, 2013, 32(8):1520-1528. |
| [26] | Zhang X, Gao B, Xia H. Effect of cadmium on growth, photosynthesis, mineral nutrition and metal accumulation of bana grass and vetiver grass[J]. Ecotox Environ Safety, 2014, 106(5):102-108. |
| [27] | Sakuraba Y, Rahman M L, Cho S H, et al. The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions[J]. Plant J, 2013, 74(1):122-133. |
| [28] | 邵国胜, 谢志奎, 张国平. 杂草稻和栽培稻氮代谢对镉胁迫反应的差异[J]. 中国水稻科学, 2006, 20(2):189-193. SHAO Guo-sheng, XIE Zhi-kui, ZHANG Guo-ping. Different responses to cadmium stress in nitrogen metabolism between weedy rice and cultivated rice(Oryza sativa)[J]. Chin J Rice Sci, 2006, 20(2):189-193. |
| [29] | Pankovic D, Plesnicar M, Arsenijevic M I, et al. Effects of nitrogen nutrition on photosynthesis in Cd-treated sunflower plants[J]. Ann Bot, 2000, 86(4):841-847. |
| [30] | Mishra S, Srivastava S, Tripathi R D, et al. Phytochelatin synthesis and response of antioxidants during cadmium stress in Bacopa monnieri L.[J]. Plant Physiol Biochem, 2006, 44(2):25-37. |
| [31] | Broadley M R, Escobar-Gutiérrez A J, Burns A. What are the effects of nitrogen deficiency on growth components of lettuce?[J]. New Phytol, 2000, 147(3):519-526. |
| [32] | Kabała K, Janicka-Russak M, Burzyński M, et al. Comparison of heavy metal effect on the proton pumps of plasma membrane and tonoplast in cucumber root cells[J]. J Plant Physiol, 2008, 165(2):278-288. |
 2015, Vol. 34
2015, Vol. 34