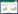文章信息
- 凌德,李婷,张世熔,李云,贾永霞,徐小逊
- LING De, LI Ting, ZHANG Shi-rong, LI Yun, JIA Yong-xia, XU Xiao-xun
- 外源土霉素和磺胺二甲嘧啶对土壤活性有机碳含量的影响
- Effects of Exogenetic Oxytetracycline and Sulfamethazine on Soil Labile Organic Carbon Contents
- 农业环境科学学报, 2015, 34(2): 297-302
- Journal of Agro-Environment Science, 2015, 34(2): 297-302
- http://dx.doi.org/10.11654/jaes.2015.02.013
-
文章历史
- 收稿日期:2014-09-03
随着养殖业集约化和规模化的快速发展,每年有数万吨的抗生素被用于预防和治疗动物疾病[1].然而,动物机体对抗生素吸收率较低,摄入抗生素的40%~90%以原药或者代谢物的形式通过排泄物排出体外[2],未经处理的排泄物作为有机肥被大量施入农田,为作物生长提供养分,最终导致抗生素进入土壤并积累[3].土霉素(OTC)和磺胺二甲嘧啶(SMZ)在兽用抗生素中是使用最广泛、用量最大的抗生素之一,目前土壤中OTC和SMZ最大残留量分别已达2.6 mg·kg-1和0.2 mg·kg-1[4, 5],残留抗生素会对植物、微生物等代谢活动产生胁迫,而逆境下有机体的代谢活动受到抑制将对土壤内循环产生未知的影响[6, 7, 8].
活性有机碳参与植物和微生物代谢,是土壤中具有较高活性的能量来源,同时在土壤物质能量循环方面起重要作用[9].易氧化碳(ROC)、微生物量碳(MBC)、水溶性有机碳(WSOC)和溶解性有机碳(DOC)是土壤活性有机碳的重要表征指标,能直观反映土壤环境变化[10].目前通过活性有机碳的变化反映重金属、多环芳烃等污染物的影响已有诸多报道[11, 12],但是抗生素污染条件下对活性有机碳的影响却鲜为人知.因此,本研究拟通过盆栽试验探讨不同浓度和种类的抗生素胁迫对土壤活性有机碳含量的影响,反映抗生素污染下土壤养分转化及质量变化情况,并为抗生素污染评估及治理技术研发提供基础数据. 1 材料与方法 1.1 供试材料
供试土壤:土样采自成都市四川农业大学农学试验基地稻田0~20 cm的耕层土壤.土壤样品自然风干除去植物残体及碎石后磨碎,过2 mm筛后混匀备用.土壤类型为潮土,质地为壤质粘土,土壤基本理化性质:pH6.3、总有机碳 20.11 g·kg-1、全氮 1.09 g·kg-1、碱解氮 68.1 mg·kg-1、速效磷16.2 mg·kg-1、速效钾 156.2 mg·kg-1.
供试辣椒:品种为羊角椒,种子购自四川省农业科学院.
供试药物:土霉素(Oxytetracycline,OTC,水中溶解度0.2 g·L-1,CAS no. 2058-46-0)和磺胺二甲嘧啶(Sulfamethazine,SMZ,水中溶解度1.5 g·L-1,CAS no. 57-68-1)购自上海顺达制药有限公司,纯度>98%.试验分析所用其他药品均为分析纯,购自成都万科化学试剂公司. 1.2 试验设计
试验共设置8个OTC浓度处理,分别为 0(CK)、1、5、10、50、100、150、 200 mg·kg-1,6个SMZ浓度处理,分别为 0(CK)、1、5、10、50、100 mg·kg-1.每个处理重复3次,并且试验处理随机排布.
称取5 kg风干过筛后的土壤和处理所需用量的抗生素(固体粉末),将其充分搅拌混匀后装入塑料盆(直径30 cm,高25 cm).土壤含水量保持75%田间持水量水平并持续7 d(根据盆中土壤、水分和抗生素总质量的变化定时定量补充水量).每处理选取3株长势相当的辣椒幼苗(株高10~11 cm,叶片数量6~7)移栽入盆中,幼苗存活后定苗1株,所有处理容器均移入聚乙烯薄膜包裹的网室以避免雨水过量淋入.辣椒生长期土壤保持水量充足,每天少量多次供水.试验期间,所有农艺管理措施都按常规盆栽试验进行. 1.3 样品采集及分析
培养期共103 d,辣椒收获后每处理随机采集辣椒主根周围5 cm土壤并混匀制成一个土样,其中一份鲜样在-4 ℃下保存,另一份风干备用,用于测定土壤总有机碳(TOC)、MBC、ROC、WSOC和DOC含量.
TOC测定采用高温外热K2Cr2O7氧化-容量法[13]; MBC测定采用氯仿熏蒸-0.5 mol ·L-1 K2SO4提取法[14];ROC测定采用KMnO4氧化-比色法[15];DOC和WSOC提取及测定分别参照Jones 等[16]及郝瑞军等[17]方法:DOC采用5 mmol·L-1 CaCl2溶液并振荡30 min(水土比5∶1),WSOC采用蒸馏水并振荡30 min(水土比2∶1),振荡后其提取液均在4000 r·min-1转速下离心20 min,取上清液过0.45 μm滤膜,所获滤液均采用岛津TOC 5000分析仪测定. 1.4 土壤微生物熵值计算方法
土壤微生物熵能够最大程度降低不同处理土壤有机质含量造成的差异响应,也是衡量土壤污染状况的重要指标[18].其计算公式为:

数值采用平均值±标准差表示,所有数据采用Microsoft Excel 2007和SPSS 19.0进行统计分析,采用LSD法检验处理间是否存在显着差异(P<0.05). 2 结果与分析 2.1 OTC和SMZ对土壤总有机碳的影响
外源OTC和SMZ污染将导致土壤中TOC含量升高(表 1),而在1~5 mg·kg-1 OTC和5 mg·kg-1 SMZ处理下,TOC含量与对照相比无显着变化(P>0.05).当OTC和SMZ处理浓度分别达到10~150 mg·kg-1和10~100 mg·kg-1 时,TOC含量显着增加(P<0.05),但OTC和SMZ处理浓度分别高于50 mg·kg-1和10 mg·kg-1时,TOC含量在处理间并无显着差异.
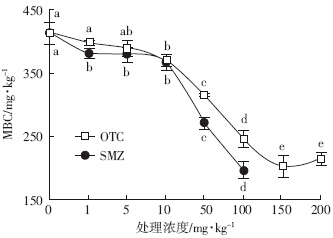
外源OTC对土壤MBC含量有明显的抑制作用(图 1).OTC处理浓度低于5 mg·kg-1时,MBC含量与对照相比并无显着变化(P>0.05);当OTC处理浓度为10~150 mg·kg-1时,MBC含量降低10.6%~50.9%(P<0.05).SMZ在1~10 mg·kg-1时能明显抑制MBC含量(P<0.05),但是处理间并无显着差异;当SMZ 处理达100 mg·kg-1时,MBC含量降低52.4%.
|
| 图 1 OTC和SMZ对土壤微生物量碳的影响 Figure 1 Effect of OTC and SMZ on microbial biomass carbon |
抗生素胁迫下土壤WSOC含量呈上升趋势(图 2),但在1~5 mg·kg-1 OTC处理下,WSOC含量并无显着变化;当处理浓度增至10~150 mg·kg-1时,WSOC含量显着增加,且增幅高达43.8%~137.1%(P<0.05).外源SMZ添加后,WSOC含量变化敏感,1 mg·kg-1 SMZ处理下,WSOC含量增至58.8 mg·kg-1,增幅为149.5%(P<0.05);随着SMZ处理浓度增加,WSOC含量增幅明显增大,当SMZ处理达100 mg·kg-1时,WSOC含量增幅高达251.8%(P<0.05).
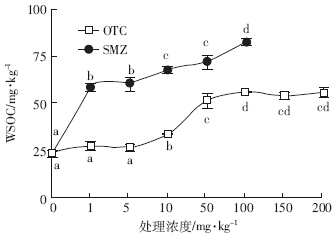
|
| 图 2 OTC和SMZ对土壤水溶性有机碳的影响 Figure 2 Effect of OTC and SMZ on water-soluble organic carbon |
外源OTC添加会导致土壤ROC含量降低(表 2),但在低浓度(1~5 mg· kg-1)时,ROC含量无显着变化,当OTC浓度≥10 mg·kg-1时,各处理ROC含量显着降低(P<0.05).OTC处理中ROC最大降幅为0.06 mg·kg-1,为对照处理的4.88%.低浓度(1~10 mg·kg-1)SMZ处理对土壤ROC含量无显着影响(P>0.05),当SMZ≥50 mg·kg-1 时,ROC含量表现出显着降低(P<0.05),但其最大降幅仅为对照处理的5.38%.以上结果表明,OTC和SMZ处理浓度分别达到10 mg·kg-1和50 mg·kg-1后将导致土壤ROC含量下降.
土壤DOC含量在OTC和SMZ胁迫下呈增加趋势(图 3).低浓度OTC(≤5 mg·kg-1)处理下,DOC含量无显着变化,当OTC处理浓度达10 mg·kg-1时,DOC含量增加31.4%(P<0.05);但是10~200 mg·kg-1 OTC处理下,DOC增幅仅保持在29.0%~32.0%,且处理间并无显着差异(P>0.05).各SMZ处理DOC含量均无显着差异(P>0.05),但在SMZ处理浓度达50 mg kg-1时,DOC增幅达到10.7%,说明高浓度SMZ处理下土壤DOC含量具有增加趋势.
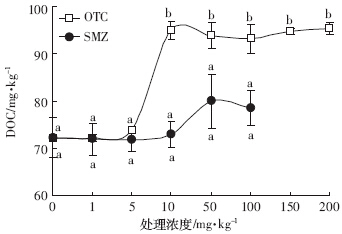
|
| 图 3 OTC和SMZ对土壤溶解性有机碳的影响 Figure 3 Effect of OTC and SMZ on dissolved organic carbon |
土壤中残留的抗生素会对非靶标动植物有机体产生毒害,进而可能影响到土壤内环境的稳定.活性有机碳是对外界变化敏感的一部分有机碳,同时也是植物和微生物代谢活动中的能量来源,其组分含量的改变能够表征土壤环境的短期变动情况.
土壤MBC是土壤中细菌、真菌、微动物体内所含有的有机碳,能灵敏地反应土壤质量和健康状况的变化,是土壤污染预警的重要指标.本研究发现,OTC和SMZ处理下MBC含量均显着降低,与姚建华等[19]和刘爱菊等[20]研究OTC和SMZ对土壤MBC影响的结果一致.这可能是土壤微生物组成及数量发生剧变所致,因为磺胺类和四环素类抗生素对土壤细菌和放线菌具有强烈的毒性[21],抗生素进入土壤后,细菌等被大量杀死导致土壤细菌/真菌之比下降,微生物活性被抑制使其仅能维持正常代谢,微生物种群结构及多样性遭到破坏造成MBC含量大幅降低[22, 23].
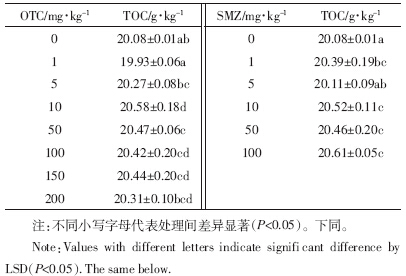
非污染、轻度污染和重度污染情况下,农业土壤微生物熵值分别为2%~3%,0.94%~1.46%和≤0.6%[18, 24].OTC和SMZ处理浓度分别为100~200 mg·kg-1和50~100 mg·kg-1时,微生物熵值处于0.94%~1.46%(表 3),说明培养期结束后土壤仍处于轻度污染;而当OTC和SMZ处理浓度分别低于50 mg·kg-1和10 mg·kg-1时,土壤污染程度较低,能够进行自我修复.
土壤WSOC是微生物的底物,并且在提供土壤养分方面具有关键作用.本研究结果表明WSOC含量在OTC和SMZ残留的土壤中有显着增加,其原因可能是土壤微生物产生剧变.抗生素的加入对土壤微生物产生胁迫作用,造成微生物数量剧减及结构缺失[23],微生物死亡、分解后会产生大量小分子糖、氨基酸等而增加土壤有机物质的含量,能够一定程度增加WSOC含量[17].另一方面,细菌产生的多聚物和真菌菌丝作为有机胶结物质在保持土壤团聚体稳定方面起到重要作用,土壤细菌的大量死亡和抗生素胁迫下微生物种群数量长期保持较低水平,将会降低土壤团聚体的稳定性[25].土壤团聚体受到破坏后,其包裹的小分子物质发生解聚,也进一步造成WSOC积累[26].此外,前人研究表明土壤微生物群落组成及数量产生剧变后可导致WSOC含量增加,也与本试验研究结果一致[17].
土壤ROC是对于微生物而言可利用性较高的有机碳,对土壤碳及质量的变化具有极高的灵敏性[27].本研究结果表明外源抗生素添加导致土壤ROC含量降低,可能是辣椒根系分泌物减少所致.根系分泌物经微生物作用后的产物是ROC的重要来源,而根系生长状况和根活力决定根系分泌物数量及质量[28, 29].通过观察法发现,在OTC和SMZ胁迫下辣椒根长及数量与对照组相比均有明显减少,并且在OTC 200 mg·kg-1和SMZ 100 mg·kg-1处理下,辣椒根系死亡,根系发育受到抑制,最终造成ROC来源减少.此外,前人研究[19, 23]表明OTC和SMZ添加后对土壤微生物种群数量和活性均有显着抑制作用,可能减弱微生物分解转化根系分泌物的能力,进一步导致ROC积累受阻.
土壤DOC是土壤微生物代谢过程中重要的能量与物质源,而且其对污染物的化学活性与生物活性具有明显的影响.本研究发现OTC和SMZ两种抗生素添加下土壤DOC含量具有积累趋势,原因可能是污染物抑制微生物数量和活性,导致其对土壤活性有机碳库的矿化保持在较低水平[12, 18],造成DOC含量增加.另一方面,DOC可充当污染物移动和扩散的载体,同时其在土壤胶体表面的强竞争性吸附[30],可能导致例如抗生素类疏水性有机污染物在土壤中的溶解性增加,从而增强污染物生物有效性[31].污染物毒性提高可能进一步抑制微生物对DOC的消耗,导致DOC含量产生积累.
SMZ添加后对土壤活性有机碳各组分含量的影响效果整体上强于同一浓度的OTC处理,可能是土壤对OTC和SMZ的吸附量不同所致.OTC和SMZ在粘土中的吸附系数分别为290~1030 L·kg-1 和0.6~3.1 L·kg-1,OTC被强烈吸附在土壤表面后导致其大量活性位点被覆盖,进而造成药物失活[32, 33].SMZ在土壤中大部分以游离态存在并且具有较强的移动性[34],因而表现出较强的毒性.然而本研究发现,培养末期OTC处理对DOC含量的影响强于SMZ处理,其原因可能是OTC发生滞后解吸.OTC添加后微生物受到胁迫,造成DOC含量上升,可能引起DOC在土壤胶体表面产生强竞争吸附,使OTC产生解吸作用并且药物活性增强,导致微生物活性及其对DOC消耗进一步降低,最终造成DOC在土壤中大量积累[30, 31].此外,SMZ影响低于OTC也可能是自身较高降解率所致.前人研究[35, 36] 结果表明,SMZ在自然土壤中半衰期为102 d,而OTC代谢产物非常稳定,其半衰期高达270 d,同时调查发现并证实土壤OTC最大残留量为2.6 mg·kg-1,远高于SMZ残留量0.2 mg·kg-1 [4, 5].培养后期,由于SMZ半衰期较小,导致处理的真实含量远低于初始设计含量,因此微生物受到的胁迫作用减弱,其种群数量及活性会有一定程度恢复,在此期间DOC作为微生物代谢的重要能量来源被大量消耗[35],造成SMZ处理在培养后期对DOC含量无显着影响.
本研究结果是通过模拟土壤环境的盆栽试验获得,与自然条件下田间实际情况可能具有一定差异,由于相关研究报告较少,还需在田间条件下进一步验证.此外,抗生素对活性有机碳影响的机理还需进一步研究. 4 结论
外源OTC和SMZ胁迫对土壤活性碳含量产生明显影响,其中土壤MBC和ROC含量呈现降低趋势,而WSCO和DOC含量产生积累效应.各指标绝对含量变化显示,ROC含量变化幅度最小,WSCO含量变化幅度最大.4种活性有机碳组分对抗生素敏感性大小顺序为:WSCO>MBC>DOC>ROC.SMZ添加后对土壤活性有机碳的影响大于OTC.当OTC和 SMZ处理浓度分别达100~200 mg·kg-1和50~100 mg·kg-1时,直至培养末期土壤仍处于轻度污染,而当OTC和SMZ处理浓度分别低于50 mg·kg-1和10 mg·kg-1时,土壤污染程度较低,能够进行自我修复.
| [1] | 国 彬, 姚丽贤, 刘忠珍, 等. 广州市兽用抗生素的环境残留研究[J]. 农业环境科学学报, 2011, 30(5):938-945. GUO Bin, YAO Li-xian, LIU Zhong-zhen, et al. Environmental residues of veterinary antibiotics in Guangzhou City, China[J]. Journal of Agro-Environment Science, 2011, 30(5):938-945. |
| [2] | Sarmah A K, Meyer M T, Boxall A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics(VAs) in the environment[J]. Chemosphere, 2006, 65(5):725-759. |
| [3] | Karc? A, Balc?o?lu I A. Investigation of the tetracycline, sulfonamide, and fluoroquinolone antimicrobial compounds in animal manure and agricultural soils in Turkey[J]. Science of the Total Environment, 2009, 407(16):4652-4664. |
| [4] | 尹春艳, 骆永明, 滕 应, 等. 典型设施菜地土壤抗生素污染特征与积累规律研究[J]. 环境科学, 2012, 33(8):2810-2816. YIN Chun-yan, LUO Yong-ming, TENG Ying, et al. Pollution characteristics and accumulation of antibiotics in typical protected vegetable soils[J]. Environmental Sciences, 2012, 33(8):2810-2816. |
| [5] | Kim K R, Owens G, Kwon S I, et al. Occurrence and environmental fate of veterinary antibiotics in the terrestrial environment[J]. Water, Air, and Soil Pollution, 2011, 214(1-4):163-174. |
| [6] | Liu F, Tao R, Ying J F, et al. Effects of six selected antibiotics on plant growth and soil microbial and enzymatic activities[J]. Environmental Pollution, 2009, 157(5):1636-1642. |
| [7] | Gao Y H, Sun X S, Sun Z J, et al. Toxic effects of enrofloxacin on growth rate and catalase activity in Eisenia fetida[J]. Environmental Toxicology and Pharmacology, 2008, 26(2):177-180. |
| [8] | Aldén L, B??th E, Greve G, et al. Effects of sulfamethoxazole on soil microbial communities after adding substrate[J]. Soil Biology and Biochemistry, 2009, 41(4):840-848. |
| [9] | Qualls R G, Haines B L. Geochemistry of dissolved organic nutrients in water percolating through a forest ecosystem[J]. Soil Science Society of America Journal, 1991, 55(4):1112-1123. |
| [10] | Liang B C, MacKenzie A F, Schnitzer M, et al. Management-induced change in labile soil organic matter under continuous corn in eastern Canadian soils[J]. Biology and Fertility of Soils, 1997, 26(2):88-94. |
| [11] | 张涪平, 曹凑贵, 李 苹, 等. 藏中矿区重金属污染对土壤微生物学特性的影响[J]. 农业环境科学学报, 2010, 29(4):698-704. ZHANG Fu-ping, CAO Cou-gui, LI Ping, et al. Effects of heavy metal pollution on microbial characteristics mine soils in central Tibet[J]. Journal of Agro-Environment Science, 2010, 29(4):698-704. |
| [12] | 谯兴国, 李法云, 张 营, 等. 冻融作用对石油污染土壤酶活性和水溶性碳的影响[J]. 农业环境科学学报, 2008, 27(3):914-919. QIAO Xing-guo, LI Fa-yun, ZHANG Ying, et al. The Effect of freezing and thawing on enzyme activity and dissolved organic carbon in petroleum contaminated soil[J]. Journal of Agro-Environment Science, 2008, 27(3):914-919. |
| [13] | 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社, 2000:30-34, 42-49, 71-83, 373-375. BAO Shi-dan. Methods for soil agro-chemical analysis[M]. Beijing:Chinese Agriculture Press, 2000:30-34, 42-49, 71-83, 373-375. |
| [14] | Vance E D, Brookes P C, Jenklmon D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6):703-707. |
| [15] | Blair G J, Lefroy R D B, Lisle L. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems[J]. Crop and Pasture Science, 1995, 46(7):1459-1466. |
| [16] | Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen(DON) and dissolved organic carbon(DOC)in soil[J]. Soil Biology and Biochemistry, 2006, 38(5):991-999. |
| [17] | 郝瑞军, 李忠佩, 车玉萍. 冻融交替对水稻土水溶性有机碳含量及有机碳矿化的影响[J]. 土壤通报, 2007, 38(6):1052-1057. HAO Rui-jun, LI Zhong-pei, CHE Yu-ping. Effects of freezing and thawing cycles on the contents of WSOC and the organic carbon mineralization in paddy soil[J]. Chinese Journal of Soil Science, 2008, 38(6):1052-1057. |
| [18] | 李永涛, 戴 军, Thierry Becquer, 等. 不同形态有机碳的有效性在两种重金属污染水平下水稻土壤中的差异[J]. 生态学报, 2006, 26(1):138-145. LI Yong-tao, DAI Jun, Thierry Becquer, et al. Availability of different organic carbon fractions of paddy soils under two heavy metal contamination levels[J]. Acta Ecologica Sinica, 2006, 26(1):138-145. |
| [19] | 姚建华, 牛德奎, 李兆君, 等. 抗生素土霉素对小麦根际土壤酶活性和微生物生物量的影响[J]. 中国农业科学, 2010, 43(4):721-728. YAO Jian-hua, NIU De-kui, LI Zhao-jun, et al. Effects of antibiotics oxytetracycline on soil enzyme activities and microbial biomass in wheat rhizosphere[J]. Scientia Agricultura Sinica, 2010, 43(4):721-728. |
| [20] | 刘爱菊, 刘 敏, 李梦红, 等. Cu、抗生素协同污染对土壤微生物活性的影响[J]. 生态环境学报, 2013, 22(11):1825-1829. LIU Ai-ju, LIU Min, LI Meng-hong, et al. Collaborative effects of Cu and antibiotic on soil microbial activities[J]. Ecology and Environmental Sciences, 2013, 22(11):1825-1829. |
| [21] | Yang Q X, Zhang J, Zhu K F, et al. Influence of oxytetracycline on the structure and activity of microbial community in wheat rhizosphere soil[J]. Journal of Environmental Sciences, 2009, 21(7):954-959. |
| [22] | Haller M Y, Müller S R, McArdell C S, et al. Quantification of veterinary antibiotics(sulfonamides and trimethoprim) in animal manure by liquid chromatography-mass spectrometry[J]. Journal of Chromatography A, 2002, 952(1):111-120. |
| [23] | Hammesfahr U, Heuer H, Manzke B, et al. Impact of the antibiotic sulfadiazine and pig manure on the microbial community structure in agricultural soils[J]. Soil Biology and Biochemistry, 2008, 40(7):1583-1591. |
| [24] | Anderson T H, Domsch K H. Ratios of microbial biomass carbon to total organic carbon in arable soils[J]. Soil Biology and Biochemistry, 1989, 21(4):471-479. |
| [25] | Guggenberger G, Elliott E T, Frey S D, et al. Microbial contributions to the aggregation of a cultivated grassland soil amended with starch[J]. Soil Biology and Biochemistry, 1999, 31(3):407-419. |
| [26] | 李忠佩, 张桃林, 陈碧云. 可溶性有机碳的含量动态及其与土壤有机碳矿化的关系[J]. 土壤学报, 2004, 41(4):544-552. LI Zhong-pei, ZHANG Tao-lin, CHEN Bi-yun. Dynamics of soluble organic carbon and its relation to mineralization of soil organic carbon[J]. Acta Pedologica Sinica, 2004, 41(4):544-552. |
| [27] | Blair G J, Lefroy R D B, Lisle L. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems[J]. Crop and Pasture Science, 1995, 46(7):1459-1466. |
| [28] | 尹燕东, 裘立群, 魏 珉, 等. 温室CO2施肥对黄瓜幼苗根系生长及分泌物和伤流液组成的影响[J]. 生态学报, 2010, 30(7):1860-1867. YIN Yan-dong, QIU Li-qun, WEI Min, et al. Effects of CO2 enrichment in green house on root growth as well as root exudates and bleaching sap of cucumber seedlings[J]. Acta Ecologica Sinica, 2010, 30(7):1860-1867. |
| [29] | Thorburn P J, Meier E A, Collins K, et al. Changes in soil carbon sequestration, fractionation and soil fertility in response to sugarcane residue retention are site-specific[J]. Soil and Tillage Research, 2012, 120:99-111. |
| [30] | Antoniadis V, Alloway B J. The role of dissolved organic carbon in the mobility of Cd, Ni and Zn in sewage sludge-amended soils[J]. Environmental Pollution, 2002, 117(3):515-521. |
| [31] | Marschner B, Kalbitz K. Controls of bioavailability and biodegradability of dissolved organic matter in soils[J]. Geoderma, 2003, 113(3):211-235. |
| [32] | Tolls J. Sorption of veterinary pharmaceuticals in soils: A review[J]. Environmental Science and Technology, 2001, 35(17):3397-3406. |
| [33] | Thiele S. Adsorption of the antibiotic pharmaceutical compound sulfapyridine by a long-term differently fertilized loess Chernozem[J]. Journal of Plant Nutrition and Soil Science, 2000, 163(6):589-594. |
| [34] | Avisar D, Primor O, Gozlan I, et al. Sorption of sulfonamides and tetracyclines to montmorillonite clay[J]. Water, Air, & Soil Pollution, 2010, 209(1-4):439-450. |
| [35] | 王 冉, 刘铁铮, 耿志明, 等. 兽药磺胺二甲嘧啶在土壤中的生态行为[J]. 土壤学报, 2007, 44(2):307-311. WANG Ran, LIU Tie-zheng, GENG Zhi-ming, et al. Ecotoxicology and ecological behavior of sulfamethazine in soil[J]. Acta Pedologic Sinica, 2007, 44(2):307-311. |
| [36] | Halling-S?rensen B, Sengel?v G, Ingerslev F, et al. Reduced antimicrobial potencies of oxyteracycline, tylosin, sulfadiazine, streptomycin, ciprofloxacin, and olaquindox due to environmental processes[J]. Archives of Environmental Contamination and Toxicology, 2003, 44:7-16. |
 2015, Vol. 34
2015, Vol. 34