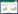文章信息
- 曹勋,韩睿明,章婷曦,王国祥,魏宏农,马月,冀峰,马杰
- CAO Xun, HAN Rui-ming, ZHANG Ting-xi,WANG Guo-xiang, WEI Hong-nong, MA Yue, JI Feng, MA Jie
- 冬季水生植物分解过程及其对水质的影响研究
- Decomposition of Aquatic Plants During Winter and Its Influence on Water Quality
- 农业环境科学学报, 2015, 34(2): 361-369
- Journal of Agro-Environment Science, 2015, 34(2): 361-369
- http://dx.doi.org/10.11654/jaes.2015.02.021
-
文章历史
- 收稿日期:2014-08-14
2. 江苏省环境监测中心, 南京 210036
2. Jiangsu Environmental Monitoring Center, Nanjing 210036, China
水生植物作为水生生态系统的初级生产者,决定了整个生态系统的结构、功能及稳定性[1].水生植物对氮和磷的输移、转化、同化和吸收等过程起着重要作用[2, 3],但是进入冬季以后,大量水生植物衰亡分解,使植物体内的营养物质重新释放到水体中,可能造成水生生态系统二次污染[4, 5, 6].自20世纪50年代后,太湖水质的恶化导致了大量水生植物的消失,由于芦苇、马来眼子菜和荇菜对水质适应能力较强,有逐年扩张的趋势,现已经成为西太湖的优势种,年平均生物量分别达到约900、1350、1500 g·m-2,这3种优势种分解释放的营养盐不可小视[7].目前对植物分解的研究多集中在单一物种或同一生活型的植物[6, 8, 9, 10],对太湖优势种分解的对比研究少见报道.
太湖水生植物大多是在秋冬季节衰亡,大量植物残体随即进入水体进行分解,而目前对水生植物的分解研究多数集中在春、夏季高水温条件下或者是在恒温条件下进行的[11, 12, 13, 14, 10],并不能反映其秋冬衰亡的自然规律.研究冬季低水温条件下水生植物的分解规律,一方面有助于了解植物冬季分解对水质影响的真实情况;另一方面,冬季未分解完的植物残体会沉降到湖底,加快湖泊沼泽化[15],研究冬季不同水生植物的分解率,可以为水生植物收割提供理论依据,减缓湖泊沼泽化压力.
本研究选用太湖优势种芦苇、马来眼子菜和荇菜为材料,在秋、冬季持续下降的水温条件(从18.38 ℃降到1.02 ℃)对比研究冬季植物衰亡分解过程及其引起的水质变化,旨在为湖泊治理和水生植被调控提供理论依据. 1 材料与方法 1.1 实验材料
实验材料芦苇采自太湖梅梁湾,马来眼子菜、荇菜均采自太湖东西山之间水域.于105 ℃杀青15 min,60 ℃烘干至恒重,密封保存备用.
底泥采自南京师范大学校内水塘月亮湾,底泥过100目筛,去除底泥内植物残体和大的杂质,并充分混合均匀.处理后的底泥避光保存备用.
实验水体为自来水,曝晒3 d后使用,初始水质见表 1.
根据太湖贡湖湾马来眼子菜分布密集区的生物量6.52 kg·m-2,以及其干湿比0.15,平均水深2 m,得出干物质投加量为0.50 g·L-1.将烘干的植物剪成1 cm左右,准确称取2.50 g,装入尼龙网袋.网袋规格为:网眼孔径0.149 mm,长×宽10 cm×10 cm.
取5 L底泥至高密度聚乙稀桶(顶直径×底直径×高=55 cm× 45 cm ×75 cm),加入自来水至100 L.稳定3 d后向桶内加入20袋植物样品,有1组容器内不放植物作为对照,共4个处理(对照组CK、芦苇组P. australis、马来眼子菜组P. malaianus、荇菜组L. nymphoides),每处理设3个平行.以2013年11月13日作为实验的第0 d,于第2、4、8、16、24、32、48 d分别测定水温、pH、DO等环境因子,并采取水样,测定其NO3--N、NH4+-N、NO2--N、TN、TP等指标,用蒸馏水补充水量蒸发流失.于第4、8、16、24、32、48 d采取植物样(每次取一袋,取样时尽量避免水体较大搅动),用自来水洗净后60 ℃烘干至恒重计算生物量,并测定残体中C、N、P含量.现场指标的测定和采样工作在当天上午9:00-10:00完成.
用YSI 550A便携式溶氧仪测定水体DO、水温;用pH计测定水体pH;用AAC3(德国)流动分析仪测定水体氮素指标(NO3--N、NH4+-N、NO2--N);TN测定采用碱性过硫酸钾消解紫外分光光度法(GB 11894-1989);TP测定采用钼酸铵分光光度法(GB 11893-1989).植物残体全氮是经H2SO4-H2O2消煮后,用AA3连续流动水质分析仪测定[16];全磷是经H2SO4-H2O2消煮后,用钼锑抗比色法测定[17];有机碳是用低温外热重铬酸钾氧化-比色法测定[18]. 1.3 数据处理
使用SPSS 18.0 和Sigmaplot12.0进行数据分析和作图,图中的数据为三次平行取得平均值.使用SNK检验进行差异显着性分析(P<0.05).
分解速率用分解系数k(d-1)表征,分解模型[19]为Wt/W0=e-kt(Wt表示分解t时间后植物干重;W0表示植物初始干重;t表示分解时间). 2 结果与分析 2.1 植物干重及分解速率的变化
水生植物的分解可以分成两个阶段:快速分解期和缓慢分解期[8, 10].快速分解期主要是植物体内易溶有机颗粒和无机盐类的快速淋溶过程,缓慢分解期主要是难溶性物质在微生物以及酶作用下的分解过程[20].本研究3种水生植物的快速分解期为前4 d,芦苇、马来眼子菜和荇菜4 d内干物质分别减少了15.9%、12.9%和38.8%.
在为期48 d的分解过程中,3种水生植物的生物量呈现先快速下降再缓慢下降的趋势(图 1-A).前4 d干重变化较快,第4 d时芦苇、马来眼子菜、荇菜的干物质剩余量分别为(2.10±0.01)、(2.18±0.03)、(1.53±0.04 g,干物质分别减少了15.9%、12.9%和38.8%.第4 d以后至实验结束,植物残体分解缓慢,实验结束时芦苇、马来眼子菜、荇菜的剩余量分别为(1.93±0.01)、(1.42±0.02)、(0.77±0.03)g,为初始生物量的77.1%、56.8%和30.7%.3种水生植物干物质剩余量差异显着(P<0.01).由图 1-B可知,3种水生植物在前4 d分解最快,分解速率分别达到0.05、0.05、0.12 d-1,分解速率k在第4 d后快速下降,第8 d后缓慢下降并趋于稳定.总体来说,浮叶植物荇菜分解最快,沉水植物马来眼子菜次之,挺水植物芦苇最难.
|
| 图 1 干物质剩余量及分解速率随时间的变化 Figure 1 Changes of remained dry matter and decomposition rate over time |
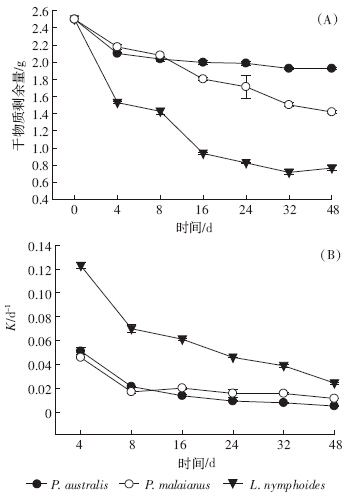
分解过程中,马来眼子菜和荇菜残体全氮呈现波动上升趋势,芦苇则呈现先上升后下降再缓慢上升的趋势(图 2-A).试验结束后,马来眼子菜和荇菜组的全氮分别由初始的30.41、43.40 mg·g-1上升到40.19、47.16 mg·g-1,而芦苇组全氮略有下降,由初始的15.01 mg·g-1下降到 14.26 mg·g-1.整个过程中,全氮始终表现为荇菜>马来眼子菜>芦苇.
|
| 图 2 N、C、P含量随分解时间的变化 Figure 2 Contents of N,C,P during decomposition |
残体中有机碳的含量变化趋势与全氮相反(图 2-B):芦苇组有机碳呈现上升趋势,实验结束时,由初始的398.28 mg·g-1上升到445.19 mg·g-1;马来眼子菜组和荇菜组的C含量呈现先下降后上升再下降的趋势,分别由初始的344.72、361.28 mg·g-1上升到383.84、383.70 mg·g-1.整个过程中,马来眼子菜的有机碳最低,芦苇最高.
实验的前4 d,各实验组的全磷有一个快速的下降过程(图 2-C),芦苇、马来眼子菜、荇菜组分别较初始值下降了59.6%、52.8%和30.9%,之后芦苇组和荇菜组全磷呈现上升、下降再缓慢上升的趋势,马来眼子菜组呈现先缓慢上升再下降的趋势.分解过程中,残体中的全磷含量升高可能是微生物对磷进行固定来满足自身生长需求引起的[21].残体中C/P达到临界值后保持稳定,而不同的植物C/P临界值有所差异,可能是这3种植物全磷变化趋势不同的主要原因[22].实验结束时芦苇、马来眼子菜和荇菜组的全磷分别由初始的2.70、5.73、5.18 mg·g-1下降到0.85、2.55、3.57 mg·g-1.整体上,全磷含量荇菜组>马来眼子菜组>芦苇组.
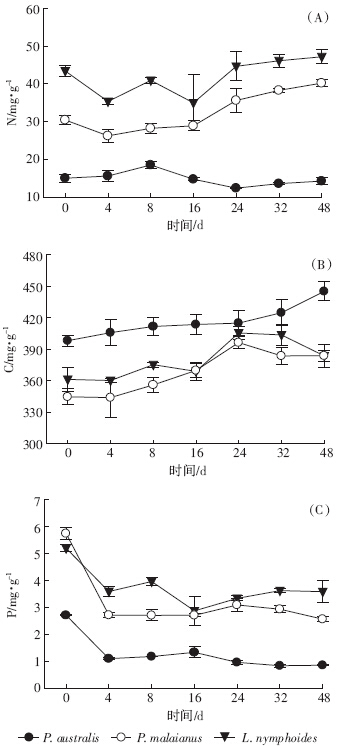
芦苇和荇菜的C/N变化趋势相似(图 3-A),先下降后上升再下降,第8 d时分别下降了16.5%、10.7%,第16 d达到最大值,较最大值增长了20.1%、12.9%.马来眼子菜的C/N在第4 d稍许上升,然后缓慢下降,第48 d时,较初始值下降了15.9%.芦苇、马来眼子菜和荇菜的C/P在实验初期都呈现上升趋势(图 3-B),第4 d分别增长了152.6%、111.4%和45.9%.第4~48 d,各组变化趋势不同,芦苇组先下降后上升,马来眼子菜组继续缓慢上升,而荇菜组呈现下降上升再下降的趋势.实验结束时各组的C/P为初始值的356.4%、249.9%和158.7%.
|
| 图 3 C/N、C/P随分解时间的变化 Figure 3 Changes of C/N and C/P during decomposition |
实验过程中,水温变化较大,总体呈下降趋势(表 2).第0~4 d,水温快速下降,从开始的18.38 ℃下降到9.01 ℃.第4~24 d,水温在7.15~13.28 ℃之间波动,第24 d以后至实验结束水温降到较低水平,第48 d时平均水温只有1.02 ℃.各处理组之间水温差异不显着.
各植物处理组分解过程中pH的变化趋势相似(图 4-A),实验初期pH值迅速下降,第4 d达到最低:芦苇组、马来眼子菜组、荇菜组pH分别降低了7.6%、4.9%和8.5%;然后缓慢上升,实验结束时,pH略低于初始值.对照组pH变化不明显,在8.39~9.13之间波动.芦苇和马来眼子菜处理组pH在第8 d逐渐上升至对照组水平后,一直和对照组保持相似的变化趋势,荇菜处理组在第4 d后一直呈缓慢上升的趋势,到实验结束时,接近对照组水平.各处理组之间pH值差异不显着(P>0.05),荇菜组的pH值低于其他处理组,且差异显着(P<0.05).
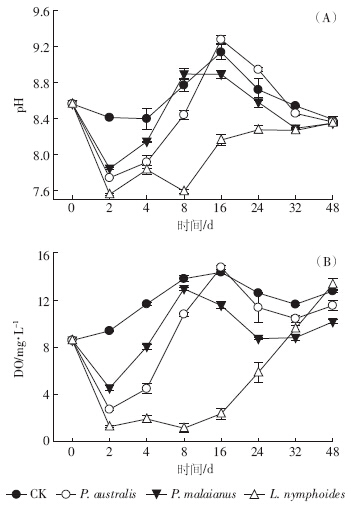
|
| 图 4 pH、溶解氧(DO)随分解时间的变化 Figure 4 Changes of pH and dissolved oxygen(DO) during decomposition |
实验期间,各组水体DO值变化趋势与pH值相似,呈现先快速下降再缓慢上升然后平缓下降的趋势(图 4-B).实验第2 d,除了对照组,各组DO迅速下降,芦苇组、马来眼子菜组与荇菜组的DO分别下降到(2.75±0.41)、(4.55±0.21)、(1.29±0.29)mg·L-1.第8~16 d,芦苇和马来眼子菜组的DO值升至与对照接近的水平,而荇菜组仍明显低于对照,直至第32 d,荇菜组的DO值才明显回升.各处理组之间差异显着,总体表现为对照组>芦苇组>马来眼子菜组>荇菜组. 2.4 水体营养盐的变化
除对照组之外,各处理组TN浓度在实验初期迅速上升至一个较高的水平.芦苇、马来眼子菜和荇菜组的TN在第2 d达到最大值,分别为(3.02±0.11)、(3.80±0.11)、(2.94±0.32)mg·L-1,较初始值分别提高了216.0%、270.8%和210.3%.第2 d至实验结束,有水生植物的处理组TN值总体上呈现先下降再稍许上升的趋势,但是大部分时间高于对照组(图 5-A).在实验的前16 d TN变化较为明显,16~48 d变化幅度较小,可能是温度的持续降低抑制了微生物的活性.不同植物处理组之间差异不显着(P>0.05).
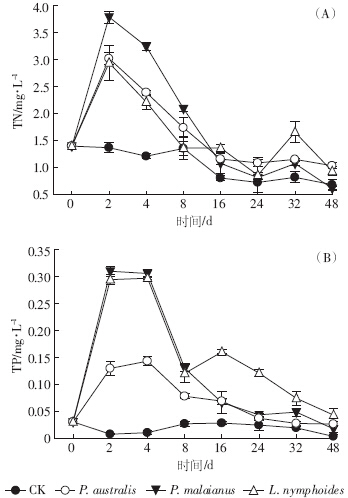
|
| 图 5 总氮(TN)、总磷(TP)含量随分解时间的变化 Figure 5 Changes of total nitrogen(TN) and total phosphorous(TP) during decomposition |
不同植物处理组TP值呈现先快速上升再缓慢下降的趋势(图 5-B).各处理组TP在第2 d达到最大值,并维持到第4 d,第4 d时芦苇、马来眼子菜和荇菜组TP分别为(0.14±0.01)、(0.31±0.01)、(0.30±0.00)mg·L-1.第4~8 d各处理组TP呈下降趋势.芦苇和马来眼子菜处理组在第24 d下降至对照组水平,荇菜处理组在第8~16 d有一个小幅上升过程,之后缓慢下降,到第48 d下降至对照组水平.实验期间,各组TP值大于对照组,且差异显着(P<0.01),总体呈现对照组>芦苇组>马来眼子菜组>荇菜组的趋势.第48 d时,各组TP值接近对照组.
3种水生植物分解过程中,水体NH4+-N浓度都呈现先快速上升,然后快速下降再缓慢上升然后缓慢下降的变化趋势(图 6-A).各处理组的NH4+-N浓度在实验第4 d达到最大值.实验的前16 d NH4+-N浓度变化幅度较大,实验后期各组变化较小,且不同处理组之间的差异不明显.实验结束时,各植物组NH4+-N浓度都低于对照.

|
| 图 6 NH4+-N、NO2--N、NO3--N 含量随分解时间的变化 Figure 6 Changes of NH4+-N、NO2--N、and NO3--N during decomposition |
3种水生植物分解过程中,水体NO2--N浓度呈现先上升再下降的变化趋势(图 6-B).实验第4 d除对照组,各组NO2--N值达到最大值,芦苇组、马来眼子菜组和荇菜组NO2--N值较初始值分别提高了185.5%、151.2%和165.9%.第16 d以后各处理组NO2--N浓度相近,变化较小,略低于初始值,各处理组之间差异较小.不同植物处理组在其实验初始阶段,水体NO3--N浓度快速下降,并于第16 d后趋于稳定(图 6-C).实验结束时各处理组NO3--N浓度均低于对照组. 3 讨论 3.1 水生植物分解的影响因素
影响水生植物分解速度的因素有很多,比如温度、植物自身理化性质、周围营养条件等[23, 14].植物自身的理化性质对分解速率有很大的影响,植物残体的N、C/N、C/P、木质素等都是分解速率的影响因素.本研究3种植物的分解速率k与残体全氮显着正相关(P<0.05,n=54);与全磷极显着正相关(P<0.01,n=54).Taylor等[24]认为植物体C/N能够很好地预测植物的分解速度,C/N值越高分解越慢,反之亦然[25].本研究所选材料芦苇、马来眼子菜和荇菜的初始C/N分别为(26.77±1.65)、(11.37±0.45)、(10.29±2.75),分解速率表现为芦苇组<马来眼子菜组<荇菜组.由图 7-A可知分解速率k与植物残体内的C/N显着负相关(P<0.01,n=54).由图 7-B可知3种实验材料的分解速率与C/P呈显着负相关(P<0.01,n=54).另外,木质素的含量会制约植物后期的分解[26],木质素自身结构非常稳定很难分解[27],而且木质素会和纤维素、半纤维素等碳水化合物以共价键结合,很大程度上制约了碳水化合物的分解.笔者所选的3种水生植物的分解速率差异明显(P<0.01),木质素含量最高的芦苇分解最慢,氮含量较高且木质素含量较低的荇菜分解最快,马来眼子菜的分解速率介于两者之间.这与李文朝等[15]的研究结果一致.
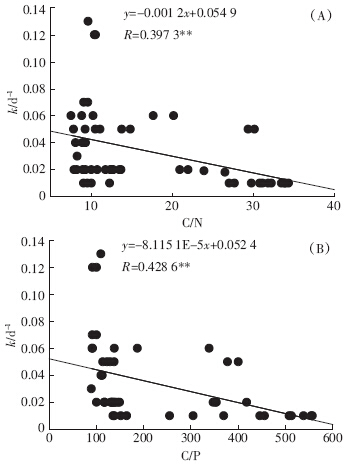
|
| 图 7 NH4+-N、NO2--N、NO3--N 含量随分解时间的变化 Figure 7 Changes of NH4+-N、NO2--N、and NO3--N during decomposition |
微生物分解是植物分解的重要环节,微生物的作用是将植物体内的有机物进行无机化,而温度决定了微生物的活性,其对水生植物的分解影响很大.柳新伟[28]研究了温度对芦苇不同部位分解的影响,发现温度可以明显促进植物干物质的分解.冬季低温一定程度上抑制了植物残体的分解,实验的第16~48 d,平均水温降到8 ℃以下(第24 d有所回升除外),在此期间,芦苇、马来眼子菜和荇菜的干物质质量减少缓慢,分别减少了2.8%,15.3%和6.8%.当实验结束时,各组分解速率仅为0.005、0.012、0.025 d-1. 3.2 植物分解对水质的影响
3种植物分解初期,由于植物体中的有机质厌氧分解会产生有机酸,导致上覆水中pH值迅速降低[29],第2 d时达到最低值,分别为7.74±0.01、7.84±0.02和7.55±0.01.整个分解过程中,有植物的处理组pH均值低于对照组,可能是植物残体在微生物的作用下发生反应,生成CO2[30],从而使水体pH值有所下降.实验组DO在实验前2 d快速下降,芦苇、马来眼子菜和荇菜组相比于初始值分别下降了68.0%,47.1%和85.0%.这是因为实验初期,植物释放了大量的DOC,刺激了微生物的繁殖与生长,从而消耗了水体中溶解氧[31].反应后期,实验组pH值和DO接近对照组,是因为水体温度的下降抑制了微生物的活性,使植物分解减缓.
水生植物死亡后,残体分解会向水体中释放大量的营养物质[32, 33],谢理等[31]研究发现,芦苇和茭草在死亡后120 h内可迅速释放大量营养盐.实验组的TN、TP在分解的前4 d明显升高,主要是残体内可溶性有机颗粒和无机盐的快速淋溶引起的.由图 5可知,第16 d以后,实验组的TN、TP浓度缓慢下降,接近对照组.一方面,较低的水温减缓了植物的分解,营养盐的释放速度变小;另一方面,水体中的氮在微生物作用下,进行硝化和反硝化,生成气体溢出,使TN浓度下降[34, 35].而TP浓度降低是因为植物释放的磷逐渐向底泥中迁移,当上覆水的pH值接近中性时,水体中正磷酸盐的主要存在形态是HPO42-和H2PO4-,很容易和沉积物中的金属元素结合[36].本实验中性偏弱碱的水体条件有利于底质对水体磷的吸附,这是实验进行16 d后总磷持续走低的一个重要原因.王博等[11]研究得出,苦草在70 d分解过程中,体内的磷有55.5%进入水体,但是最终大部分都迁移到底泥中.因此,冬季低温条件下,植物分解释放的营养盐有限,对水质的影响具有一定的时效性[37, 9].由于不同植物的分解速率不同,各处理组TN、TP浓度有一定差异,整体上,芦苇组浓度最低,马来眼子菜组次之,荇菜组浓度最高,与唐金艳等[13]的研究结果一致.
水体中的无机氮分为NO3--N、NH4+-N、NO2--N,其中NO2--N是硝化和反硝化的中间产物,不稳定[38].这3种无机氮在实验的前8 d变化较大,NH4+-N、NO2--N浓度快速上升,NO3--N含量下降,主要是因为微生物消耗了水中大量的DO,发生反硝化作用[39].实验后期其变化缓慢,不同植物组之间差异较小.值得一提的是,实验后期植物组水体3种无机氮的浓度均低于对照组(P<0.05),可见适当的植物残体介入可在一定程度上缓解水体的无机氮负荷.可能是植物残体分解向水体中释放了有机质,而增加有机质含量可以增强反硝化作用[40],具体反应机制有待进一步研究. 4 结论
(1)3种水生植物分解速率差异显着(P<0.01),荇菜分解最快,马来眼子菜次之,挺水植物芦苇最难分解;芦苇、马来眼子菜和荇菜快速分解期为前4 d,第4~48 d为缓慢分解期,第4 d分解速率分别达到0.05、0.05、0.12 d-1,实验结束时各组分解速率仅为0.005、0.012、0.025 d-1.植物最终残留量分别为初始生物量的77.1%、56.8%和30.7%,故及时收割、打捞植物残体,可缓解湖泊沼泽化压力.
(2)由植物残体的N、P、C/N、C/P可在一定程度上预知植物的分解速率:分解速率k与植物残体内的C/N显着负相关(P<0.01,n=54);与C/P呈显着负相关(P<0.05,n=54);与N显着正相关(P<0.05,n=54);与P显着正相关(P<0.01,n=54).
(3)冬季水生植物分解对水质的影响主要表现在分解初期,实验第2 d各水质指标变化明显,各处理组pH和DO在第2 d迅速下降,芦苇、马来眼子菜和荇菜组的TN较初始值分别提高了216.0%、270.8%和210.3%.TP在第2 d达到最大值,并维持到第4 d,第4 d时芦苇、马来眼子菜和荇菜组TP分别为(0.14±0.009)、(0.31±0.008)、(0.30±0.003)mg·L-1.
| [1] | van Donk E, van de Bund W J. Impact of submerged macrophytes including charophytes on phyto-and zooplankton communities:Allelopathy versus other mechanisms[J]. Aquatic botany, 2002, 72(3):261-274. |
| [2] | Gersberg R, Elkins B, Goldman C. Nitrogen removal in artificial wetlands[J]. Water Research, 1983, 17(9):1009-1014. |
| [3] | 付春平, 唐运平, 张志扬, 等. 沉水植物对景观河道水体氮磷去除的研究[J]. 农业环境科学学报, 2005, 24(增刊1):114-117. FU Chun-ping, TANG Yun-ping, ZHANG Zhi-yang, et al. Nitrogen and phosphorus removal capacity of submerged plant, Ruppiamaritime and Potamogeton pectinatus in TEDA Landscape River[J]. Journal of Agro-Environment Science, 2005, 24(Suppl1):114-117. |
| [4] | Hinman M L, Klaine S. Uptake and translocation of selected organic pesticides by the rooted aquatic plant Hydrilla verticillata Royle[J]. Environmental Science & Technology, 1992, 26(3):609-613. |
| [5] | 王丽敏, 尚士友, 吴利斌, 等. 草型湖泊(乌梁素海)氮循环转化规律的研究[J]. 环境科学动态, 2004(1):16-18. WANG Li-min, SHANG Shi-you, WU Li-bin, et al. Study on nitrogen cycling and transformation rules of Wuliangsuhai Lake[J]. Environmental Science Trends, 2004(1):16-18. |
| [6] | 卢少勇, 张彭义, 余刚, 等. 茭草、芦苇与水葫芦的污染物释放规律[J]. 中国环境科学, 2005, 25(5):554-557. LU Shao-yong, ZHANG Peng-yi, YU Gang, et al. The contaminants release rule of Zizania caduciflora, Phragmites austrails and Eichhornia crassipes[J]. China Environmental Science, 2005, 25(5):554-557. |
| [7] | 刘伟龙, 胡维平, 陈永根, 等. 西太湖水生植物时空变化[J]. 生态学报, 2007, 27(1):159-170. LIU Wei-long, HU Wei-ping, CHEN Yong-gen, et al. Temporal and spatial variation of aquaticmacrophytes in West Taihu Lake[J]. Acta Ecologica Sinica, 2007, 27(1):159-170. |
| [8] | 叶 春, 王 博. 沉水植物黑藻早期分解过程及影响因素研究[J]. 中国农学通报, 2009, 25(17):260-264. YE Chun, WANG Bo. The early decomposition process of the submerged macrophyte Hydrilla Verticillata and the actors that have a strong impact on it[J]. Chinese Agricultural Science Bulletin, 2009, 25(17):260-264. |
| [9] | 韩红娟, 翟水晶, 胡维平. 马来眼子菜腐烂分解氮磷转化模型研究[J]. 环境科学, 2010, 31(6):1483-1488. HAN Hong-juan, ZHAI Shui-jing, HU Wei-ping. Modelling nitrogen and phosphorus transfer in Potamogeton malaianus Miq. decompostion[J]. Environmental Science, 2010, 31(6):1483-1488. |
| [10] | 顾久君, 金朝晖, 刘振英. 乌梁素海沉水植物腐烂分解试验研究[J]. 干旱区资源与环境, 2008, 22(4):181-184. GU Jiu-jun, JIN Chao-hui, LIU Zhen-ying. Experimental studies on decomposition process of submerged macrophytes from Wuliangsuhai Lake[J]. Journal of Arid Land Resources and Environment, 2008, 22(4):181-184. |
| [11] | 王 博, 叶 春, 李春华, 等. 初春苦草腐解过程中营养盐释放过程及规律[J]. 生态与农村环境学报, 2012, 28(2):171-175. WANG Bo, YE Chun, LI Chun-hua, et al. Process and law of nutrient release during decomposition of submerged macrophytes(Vallisneria natans) in early spring[J]. Journal of Ecology and Rural Environment, 2012, 28(2):171-175. |
| [12] | 柳新伟, 刘 君. 温度对藨草(Scirpus triqueter)分解的影响[J]. 湿地科学, 2013, 11(3):334-338. LIU Xin-wei, LIU Jun. The effect of temperature on decomposition of Scirpus triqueter[J]. Wetland Science, 2013, 11(3):334-338. |
| [13] | 唐金艳, 曹培培, 徐 驰, 等. 水生植物腐烂分解对水质的影响[J]. 应用生态学报, 2013, 24(1):83-89. TANG Jin-yan, CAO Pei-pei, XU Chi, et al. The effect of submerged macrophytes decomposition on water quality[J]. Research of Environmental Sciences, 2013, 24(1):83-89. |
| [14] | 叶碧碧, 曹德菊, 储昭升, 等. 洱海湖滨带挺水植物残体腐解特征及其环境效应初探[J]. 环境科学研究, 2011, 24(12):1364-1369. YE Bi-bi, CAO De-ju, CU Zhao-sheng, et al. Decomposition characteristics of emergent aquatic plant residues from the Lakeshore of Erhai Lake and their environmental effects[J]. Research of Environmental Sciences, 2011, 24(12):1364-1369. |
| [15] | 李文朝, 陈开宁, 吴庆龙, 等. 东太湖水生植物生物质腐烂分解实验[J]. 湖泊科学, 2001, 13(4):331-336. LI Wen-chao, CHEN Kai-ning, WU Qing-long, et al. Experimental studies on decomposition process of aquatic plant material from East Taihu Lake[J]. Journal of Lake Sciences, 2001, 13(4):331-336. |
| [16] | 张英利, 许安民, 尚浩博, 等. AA3型连续流动分析仪测定土壤和植物全氮的方法研究[J]. 西北农林科技大学学报(自然科学版), 2006, 34(10):128-132. ZHANG Ying-li, XU An-min, SHANG Hao-bo, et al. Determination study of total nitrogen in soil and plant by continuous flow analytical system[J]. Jour of Northwest Sci-Tech Univ of Agri and For(Nat Sci Ed), 2006, 34(10):128-132. |
| [17] | 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 1999:166-168. LU Ru-kun. The analysis method of soil agricultural chemistry[M]. Beijing:China agricultural science and technology press, 1999:166-168. |
| [18] | 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 1999:106-108. LU Ru-kun. The analysis method of soil agricultural chemistry. Beijing:China agricultural science and technology press, 1999:106-108. |
| [19] | Olson J S. Energy storage and the balance of producers and decomposers in ecological systems[J]. Ecology, 1963, 44(2):322-331. |
| [20] | 武海涛, 吕宪国, 杨 青, 等. 三江平原典型湿地枯落物早期分解过程及影响因素[J]. 生态学报, 2007, 27(10):4027-4035. WU Hai-tao, Lü Xian-guo, YANG Qing, et al. The early-stage litter decomposition and its influencing factors in the wetland of the Sanjiang Plain, China[J]. Acta Ecologica Sinica, 2007, 27(10):4027-4035. |
| [21] | Ozalp M, Conner W H, Lockaby B G. Above-ground productivity and litter decomposition in a tidal freshwater forested wetland on Bull Island, SC, USA[J]. Forest Ecology and Management, 2007, 245(1-3):31-43. |
| [22] | 武海涛, 吕宪国, 杨 青. 湿地草本植物枯落物分解的影响因素[J]. 生态学杂志, 2006, 25(11):1405-1411. WU Hai-tao, Lü Xian-guo, YANG Qing. Factors affecting litter decomposition of wetland herbaceous macrophytes[J]. Chinese Journal of Ecology, 2006, 25(11):1405-1411. |
| [23] | Aerts R. Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems:A triangular relationship[J]. Oikos, 1997, 79(3):439-449. |
| [24] | Taylor B R, Parkinson D, Parsons W F. Nitrogen and lignin content as predictors of litter decay rates:A microcosm test[J]. Ecology, 1989, 70(1):97-104. |
| [25] | Moretto A, Distel R. Decomposition of and nutrient dynamics in leaf litter and roots of Poa ligularis and Stipa gyneriodes[J]. Journal of Arid Environments, 2003, 55(3):503-514. |
| [26] | Melillo J M, Aber J D, Muratore J F. Nitrogen and lignin control of hardwood leaf litter decomposition dynamics[J]. Ecology, 1982, 63(3):621-626. |
| [27] | 张 伟, 冯 俊, 杨 超, 等. 白腐真菌的广谱生物降解性研究进展[J]. 环境污染与防治, 2012, 34(1):64-71. ZHANG Wei, FENG Jun, YANG Chao, et al. Broad-spectrum degradation capability of the white rot fungus[J]. Environmental Pullution & Control, 2012, 34(01):64-71. |
| [28] | 柳新伟. 温度对芦苇不同部位分解动态的影响[J]. 生态环境学报, 2009, 18(3):1042-1044. LIU Xin-wei. Effect of temperatures on leaf, sheath and stem decomposition dynamic of Phragmites australis[J]. Ecology and Environmental Sciences, 2009, 18(3):1042-1044. |
| [29] | 尚丽霞, 柯 凡, 李文朝, 等. 高密度蓝藻厌氧分解过程与污染物释放实验研究[J]. 湖泊科学, 2013, 25(1):47-54. SHANG Li-xia, KE Fan, LI Wen-chao, et al. Laboratory research on the contaminants release during the anaerobic decomposition of high-density Cyanobacteria[J]. Journal of Lake Sciences, 2013, 25(1):47-54. |
| [30] | 张来甲, 叶 春, 李春华, 等. 沉水植物腐解对水体水质的影响[J]. 环境科学研究, 2013, 26(2):145-151. ZHANG Lai-jia, YE Chun, LI Chun-hua, et al. The effect of submerged macrophytes decomposition on water quality[J]. Research of Environmental Sciences, 2013, 26(2):145-151. |
| [31] | 谢 理, 杨 浩, 渠晓霞, 等. 滇池优势挺水植物茭草和芦苇降解过程中DOM释放特征研究[J]. 环境科学, 2013, 34(9):3458-3466. XIE Li, YANG Hao, QU Xiao-xia, et al. Dissolved organic matter release of Zizania caduciflora and Phragmites australis from Lake Dianchi[J]. Environmental Science, 2013, 34(9):3458-3466. |
| [32] | Li W, Yang Q. Wetland utilization in Lake Taihu for fish farming and improvement of lake water quality[J]. Ecological Engineering, 1995, 5(1):107-121. |
| [33] | 潘慧云, 徐小花, 高士祥. 沉水植物衰亡过程中营养盐的释放过程及规律[J]. 环境科学研究, 2008, 21(1):64-68. PAN Hui-yun, XU Xiao-hua, GAO Shi-xiang. Study on process of nutrition release during the decay of submerged macrophytes[J]. Research of Environmental Sciences, 2008, 21(1):64-68. |
| [34] | 王 博, 叶 春, 杨 劭, 等. 腐解黑藻生物量对高硝态氮水体氮素的影响[J]. 环境科学研究, 2009, 22(10):1198-1203. WANG Bo, YE Chun, YANG Shao, et al. Effect of Hydrilla verticillata decomposition biomass on nitrogen content in water containing high concentration of nitrate[J]. Research of Environmental Sciences, 2009, 22(10):1198-1203. |
| [35] | 马 培, 李新艳, 王华新, 等. 河流反硝化过程及其在河流氮循环与氮去除中的作用[J]. 农业环境科学学报, 2014, 33(4):623-633. MA Pei, LI Xin-yan, WANG Hua-xin, et al. Denitrification and its role in cycling and removal of nitrogen in river[J]. Journal of Agro-Environment Science, 2014, 33(4):623-633. |
| [36] | 俞振飞. 沉水植物衰亡对上覆水和沉积物之间磷含量再分配的影响[D]. 南京:南京师范大学, 2012:19-20. YU Zhen-fei. The effect of submerged macrophyte on phosphorus reallocation between water and sediment in the decomposition period[D]. Nanjing:Nanjing Normal University, 2012:19-20. |
| [37] | 杨文斌, 王国祥, 王 刚. 菹草衰亡腐烂对水质持续性影响试验研究[J]. 安全与环境学报, 2010, 10(2):90-92. YANG Wen-bin, WANG Guo-xiang, WANG Gang. Experimental study over the continuous effects of decaying Potamogeton crispus on water quality[J]. Journal of Safety and Environment, 2010, 10(2):90-92. |
| [38] | 刘 波, 王国祥, 王风贺, 等. 不同曝气方式对城市重污染河道水体氮素迁移与转化的影响[J]. 环境科学, 2011, 32(10):2971-2978. LIU Bo, WANG Guo-xiang, WANG Feng-he, et al. Effect of different aeration ways on migration and transformation of nitrogen in heavilypolluted urban river[J]. Environmental Science, 2011, 32(10):2971-2978. |
| [39] | 王锦旗, 郑有飞, 王国祥. 菹草种群对湖泊水质空间分布的影响[J]. 环境科学, 2011, 32(2):416-422. WANG Jin-qi, ZHEN You-fei, WANG Guo-xiang. Influences of Potamogeton crispus population on the lake water quality distribution[J]. Environmental Science, 2011, 32(2):416-422. |
| [40] | 曾 巾, 杨柳燕, 肖 琳, 等. 湖泊氮素生物地球化学循环及微生物的作用[J]. 湖泊科学, 2007, 19(4):382-389. ZENG Jin, YANG Liu-yan, XIAO Lin et al. Biogeochemical cycling of nitrogen in lakes and the role of microorganisms in conversion of nitrogen compounds[J]. Journal of Lake Sciences, 2007, 19(4):382-389. |
 2015, Vol. 34
2015, Vol. 34