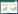文章信息
- 万亚男, 张燕, 余垚, 陈京生, 袁思莉, 李花粉
- WAN Ya-nan, ZHANG Yan, YU Yao, CHEN Jing-sheng, YUAN Si-li, LI Hua-fen
- 铁营养状况对黄瓜幼苗吸收转运镉和锌的影响
- Effects of Iron Supply on Cadmium and Zinc Uptake and Translocation by Cucumber Seedlings
- 农业环境科学学报, 2015, 34(3): 409-414
- Journal of Agro-Environment Science, 2015, 34(3): 409-414
- http://dx.doi.org/10.11654/jaes.2015.03.001
-
文章历史
- 收稿日期:2014-11-17
随着采矿、冶金等工业的发展以及污水灌溉,镉污染问题日益突出。我国受镉污染土壤面积超过13 330 hm2,个别地区镉污染严重[1],首次全国土壤污染状况调查显示土壤镉点位超标率达7.0%[2]。镉不仅易被植物吸收对植物产生毒害,还能在植物体内残留进而通过食物链危害人体健康[3]。
植物对土壤中镉等重金属的吸收和累积受多种因素的影响,主要包括土壤pH、Eh、有机质、土壤质地、镉的形态、陪伴阴离子以及营养元素的缺乏或胁迫等[4,5,6]。铁营养影响植物对重金属的吸收和运输,充足的铁素营养使植物体中其他重金属如锰、铜、锌、镉含量下降,而在铁缺乏状况下,植物体有较高的锰、铜、锌、镉浓度[7]。已有的研究结果表明,禾本科单子叶植物在缺铁环境下会分泌植物铁载体,通过配合作用促进植物对镉的吸收[8,9,10,11];施加铁营养则可以减少根系镉的溶解性和生物有效性[12],并且促进根表面形成更多的铁胶膜来隔离镉,从而减少植株对镉的吸收[13]。铁营养状况对双子叶植物和非禾本科单子叶植物吸收镉也有影响,佘玮等[14]发现铁供应水平增加能显著降低镉在苎麻中的积累,Muneer等[15,16] 对绿豆和印度芥菜的研究也发现这一规律。而锌与镉是同一主族元素,存在相似的化学性质,是土壤中镉吸附位点的主要竞争者[17]。且有研究证明,铁与锌也存在竞争作用[18]。本文选取双子叶植物中对铁相对比较敏感的黄瓜作为供试材料,研究不同铁营养状况对黄瓜吸收、迁移以及累积镉和锌的影响,并初步探讨影响吸收、迁移和累积的机制。 1 材料与方法 1.1 植物培养
试验植物:黄瓜(Cucumis sativus L.),品种为中农8号,由中国农业科学院蔬菜花卉研究所提供,属丰产多抗的一代杂种。
种子发芽前用自来水浮选去掉瘪粒,10% H2O2消毒30 min,洗净后在饱和CaSO4 中浸泡4 h,待种子吸涨后,置于用饱和CaSO4浸润过的石英砂中,用不透光黑塑料袋盖好,在20~24 ℃下放置5 d,当子叶开始展开时,挑选大小一致的幼苗冲洗干净,移栽至pH 6.0的1/2营养液中培养,3 d后移入全营养液中。植物生长在25 ℃/14 h光照和20 ℃/10 h黑暗、相对湿度为60%~70%、光照强度为240 μmol·m-2·s-1 的人工生长室中,24h连续通气。试验采用容积为1.5 L的聚乙烯塑料盆,每盆移入4株黄瓜幼苗。
全营养液配方如下(mmol·L-1):K2SO4 0.75、Ca(NO3)2 2、MgSO4 0.65、KH2PO4 0.25、KCl 0.1、H3BO3 1×10-2、MnSO4 1×10-3、CuSO4 1×10-4、ZnSO4 1×10-3、(NH4)5Mo7O24 5×10-6、Fe-EDTA 1×10-1。每3 d换一次营养液。 1.2 试验处理
黄瓜在完全营养液中培养8 d后,进行铁处理:营养液中Fe-ETDA的添加浓度分别为0、50、100、200 μmol·L-1,分别用Fe0、Fe50、Fe100、Fe200表示。不同铁浓度处理11 d后,停止供铁,在营养液中添加5 μmol·L-1的CdSO4,营养液中锌含量为1 μmol·L-1。每个处理设5次重复,培养3 d后收获。黄瓜幼苗生长期间,在14 h光照的时间段内选取7个时间点对营养液的pH值变化进行随机测定(表 1)。
 |
黄瓜幼苗收获时将植株地上部(茎、叶)和根系分开,先用自来水,然后用去离子水清洗,并记录植株鲜重。将样品在105℃杀青0.5 h,然后在70 ℃经48h烘干,称量干重,磨碎,备用。定量称取待测样品,用HNO3-HClO4消煮,定容,过滤后用原子吸收分光光度计(日立Z-8000)测定地上部和根中镉、锌和铁含量。 1.4 数据的处理
试验数据取5次重复的平均值和标准差,采用SAS软件进行分析。单因素方差分析,采用LSD法进行显著性检验(显著性水平设为0.05)。 数据处理中计算公式:
分配系数DR(Distribution ratio)=根(茎、叶)中吸收镉、锌的量/总吸收量
初级迁移系数PTI(Primary transport index)=茎中含镉、锌量/根中含镉、锌量
次级迁移系数STI(Secondary transport index)=叶中含镉、锌量/茎中含镉、锌量 2 结果与分析 2.1 不同铁营养状况对黄瓜生物量的影响
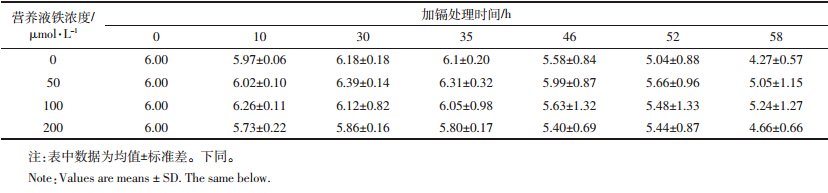
黄瓜干重的分析表明,不同铁营养状况对黄瓜各部位的生物量没有产生显著影响(表 2)。不供铁与供铁的植株生长无明显差异,试验过程中黄瓜缺铁现象不明显,未表现出失绿症状。由于处理时间较短,黄瓜也未出现镉胁迫症状。
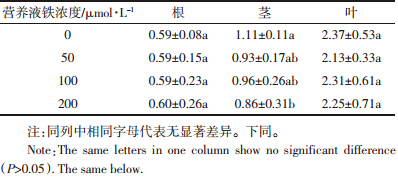 |
黄瓜幼苗中铁的分析结果表明,随着营养液中铁供应水平的提高,植株地上部和根中铁含量均随之升高(表 3)。黄瓜各部分铁含量顺序为根?垌叶>茎,根中铁含量是茎中的79~109倍,叶中铁含量是茎中的1.96~2.62倍。黄瓜茎、叶铁含量在不供铁和供铁50 μmol·L-1的处理之间差异不显著,而不供铁与供铁100、200 μmol·L-1处理之间差异显著。
 |
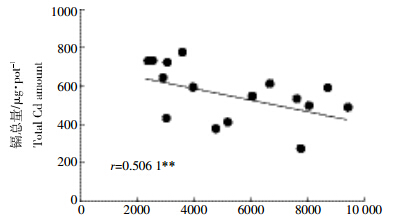
黄瓜不同部位镉含量的分析结果表明,黄瓜各部位镉含量的顺序为根≥垌茎>叶,不供铁培养的黄瓜根、茎、叶中镉含量高于加铁处理,茎、叶中不供铁与供铁处理之间差异显著,而供铁的三个处理之间无显著差异(图 1)。不供铁培养的茎中镉含量分别是供铁50、100、200 μmol·L-1处理的2.9、2.8、2.4倍。不供铁培养的黄瓜根中镉含量高于加铁处理,不供铁与供铁50 μmol·L-1处理之间差异最显著,前者是后者的1.74倍。在供铁的三个处理间,随着营养液中铁浓度的升高,根中镉含量呈现递增趋势,但差异并不显著。黄瓜吸收的镉总量与铁总量存在负相关的关系(r=0.506 1),随着根系吸收铁量的增加,黄瓜幼苗吸收镉的量下降(图 2)。
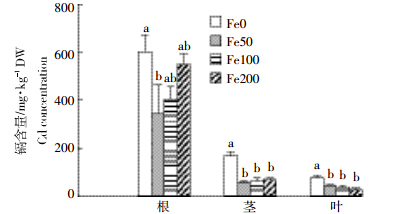
|
|
同一部位相同字母代表不同铁处理
差异不显著(P>0.05)。下同 The same letters within the same part indicate no significant difference between Fe treatments(P>0.05). The same below 图 1 不同铁营养状况对黄瓜镉含量的影响 Figure 1 Effects of iron supply on cadmium concentrations in cucumber seedlings |
|
| 镉总量/μg·pot-1 Total Cd amount 图 2 黄瓜体内铁吸收总量与镉吸收总量相关性 Figure 2 Correlation between total amount of Fe and Cd uptakes by cucumber seedlings |
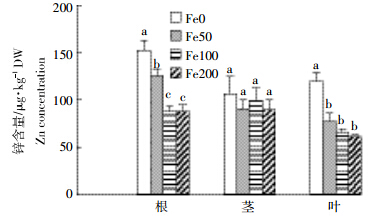
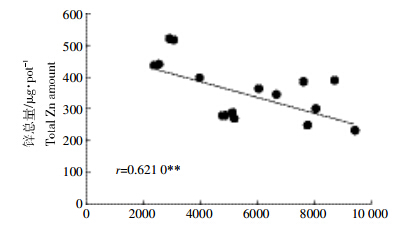
黄瓜不同部位锌含量的分析结果表明,锌含量顺序为根>茎>叶,但是差异并不显著,尤其是茎和叶锌的含量差异不大(图 3)。不供铁培养的黄瓜根和叶中锌含量高于供铁处理,不供铁与供铁处理之间差异显著,供铁的三个处理之间无明显差异,而不同处理的黄瓜茎中锌含量没有显著差异。由图 4可知,黄瓜根系吸收的锌总量与铁总量也具有负相关性(P=0.621 0)。
|
| 图 3 不同铁营养状况对黄瓜锌含量的影响 Figure 3 Effects of iron supply on Zn concentrations in cucumber seedlings |
|
| 锌总量/μg·pot-1 Total Zn amount 图 4 黄瓜体内铁吸收总量与锌吸收总量相关性 Figure 4 EffectsCorrelation between total Fe and Zn uptakes by cucumber seedlings |
不同铁营养状况下黄瓜各部位镉的分配、迁移系数如表 4所示。随着铁供应浓度的升高,镉在根中的分配系数增加了43%,在茎、叶的分配系数分别下降了59%和44%。即不供铁处理降低了镉在根中的分配,增加了镉在茎、叶中的分配。缺铁促进了镉向地上部的运输,尤其是由根部向茎中的转移。在供铁的三个处理之间,镉在茎、叶中的分配系数均随着铁浓度的升高而降低,表明铁浓度的升高抑制了镉向地上部的运输;而对锌的分配却无显著影响(表 5),不供铁和供铁条件下,根、茎、叶的分配系数无显著差异。
 |
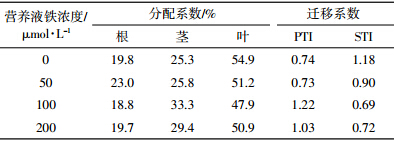 |
不供铁处理镉的PTI值大于供铁处理,促进了黄瓜将根系吸收的镉转运到茎中的能力(表 4),并且随着铁浓度的升高,供铁的三个处理的PTI值均随之降低,铁浓度的升高抑制了镉由根向茎中的转运。通过对不同铁处理下镉的STI值的分析表明,供铁50、100 μmol·L-1处理促进了镉由茎向叶的转运,而供铁200 μmol·L-1处理却稍微抑制了其转运。对锌的PTI值和STI值的影响刚好与镉相反,即供铁促进了锌从根系向茎的转运,却抑制了其由茎向叶的转运(表 5)。 3 讨论
在营养液培养条件下,与供铁相比,缺铁明显促进黄瓜根、茎、叶对镉和锌的吸收。镉通过共质体途径进入根系,然后经木质部向地上部运输[19],与铁的吸收转运存在竞争关系[20],不供铁时竞争作用减弱,镉的吸收增多,而供铁加强了这一竞争,使镉的吸收减少。缺铁条件下黄瓜锌含量的升高可能也是这一作用的结果。
双子叶植物在缺铁诱导下常会出现:(1)根尖膨大、增粗,产生大量根毛;(2)根的外表皮细胞和根毛中有大量转移细胞的形成;(3)根系向外分泌H+ 能力显著增强;(4)有机酸分泌量也增加。这种适应性机制称为机理Ⅰ[21]。本试验中,不供铁处理没有减少黄瓜幼苗根系的生物量,可能是由于在缺铁诱导下,根尖膨大增粗。易翠林等[22] 用电镜将缺铁条件下生长的黄瓜根毛部分放大1600倍后发现其细胞壁内生,质膜出现褶皱、内陷;Su等[23] 对花生的研究结果也表明,缺铁可以促进其根系的生长。因此,根尖的膨大增粗导致根吸收面积的增加可能是促进黄瓜根部对镉吸收的因素。加镉处理后通过对pH值跟踪测定发现,不供铁处理的营养液中pH值下降最快,这与机理Ⅰ中缺铁导致植物根系向外分泌H+能力增强的机制是一致的。Liu等[12] 也发现水稻在营养液pH =5.5(最适生长pH)条件下其根系分泌的氧最多,对镉的吸收最少,随着pH降低,对镉的吸收也增加。根际pH较低时,可以增加镉的活度,促进植物对可溶性镉的吸收[4],但此结论适用于土壤条件下。本试验中(水培)镉以离子形式存在,活度较高,因此pH可能不是主要影响因素。不供铁时根际pH下降较快还可能与缺铁下双子叶植物根系分泌的植物性酸类如苯甲酸、柠檬酸、苹果酸等有关[24]。此外,有研究发现,有机酸可以减少细胞壁上金属离子的吸附位点,从而降低细胞壁对重金属的屏障作用[25,26],因此也可能增加黄瓜对镉的吸收。
镉在不同铁营养状况下的吸收差异还与IRT1转运子基因的表达有关。IRT1 是从拟南芥中克隆的铁转运子基因,铁缺乏能够诱导其表达[27],促进二价铁离子的吸收转运,同时也有利于二价重金属阳离子如镉、锌的吸收转运[28]。在铁充足供应条件下,铁转运子基因关闭,铁吸收增加,镉的主动吸收量下降,随铁含量的增加,叶片镉积累量显著降低[20]。许多研究表明,Nramp族成员(如Nramp1、3、4、5)在植物中负责锰、锌、铜、铁、镉等二价金属离子的运输[29,30]。并且Nramp1在铁充足时基本不表达,缺铁时大量表达,从而使植物中镉和锌含量升高[31]。
与供铁相比,缺铁明显提高镉在黄瓜地上部的分配及由根向茎中转运镉的能力。与不供铁相比,供铁200 μmol·L-1下茎、叶的分配系数分别下降59%和44%。这可能也是供铁200 μmol·L-1下根系镉含量比供铁50、100 μmol·L-1下高的原因,与Muneer等[16]对印度芥菜的研究结果相一致。除上述根系环境变化及IRT1转运子基因等的影响外,蒸腾作用对无机离子的吸收也起着不可忽视的作用。大量研究表明,蒸腾作用影响植物对镉的吸收转运[23,32,33],而这种影响受环境pH的左右。在高pH(7.0)时,蒸腾对吸收几乎不产生影响,而在低pH(3.5)时,高蒸腾导致的镉吸收量是低蒸腾的4倍之多[34]。本试验中,缺铁处理的pH最低,甚至降到3.7,可能由于蒸腾速率较高,溶液中的自由镉离子随着水分的蒸腾而被植物吸收和运输,使得镉在木质部的运输能力提高,且蒸腾越强,向茎中的运输也就越快越多。这在一定程度上解释了缺铁促进黄瓜吸收镉以及提升镉由根向茎中转运能力的现象。此外,由于不供铁时,根系对镉的吸收增多,当根系吸附位点达到饱和时,根系细胞的细胞壁屏障作用随之减弱,镉离子进入细胞后向地上部运输[19]。这可能也是缺铁时镉在地上部分配系数增加的原因。不供铁时,锌由根向茎的转运系数降低,可能是由于同一族元素的锌与镉以相同的方式被植物吸收转运,易竞争植物体内相同的运输通道[14],缺铁促进镉运输的同时,抑制了锌的运输。 4 结论
试验结果表明,在水培条件下:(1)不供铁培养可以促进黄瓜根系对镉的吸收及向茎、叶的转运,提高镉在地上部的分配;(2)不供铁可以提高黄瓜根和叶中锌含量,而对锌的分配影响不大。
| [1] | Wu F B, Zhang G P, Dominy P, et al. Differences in yield components and kernel Cd accumulation in response to Cd toxicity in four barely genotype[J]. Chemosphere, 2007, 70:83-92. |
| [2] | 环境保护部. 环境保护部和国土资源部发布全国土壤污染状况调查公报[R/OL]. 2014-04-17. http://www. zhb. gov. cn/gkml/hbb/qt/201404/t20140417_270670. htm |
| [3] | Nakadaira H, Nishi S. Effects of low-dose cadmium exposure on biological examinations[J]. Science of the Total Environment, 2003, 308:49-62. |
| [4] | Murray B, Mcbride M B. Cadmium uptake by crops estimated from soil total Cd and pH[J]. Soil Science, 2002, 167(1):62-67. |
| [5] | 崔玉静, 赵中秋, 刘文菊, 等. 镉在土壤-植物-人体系统中迁移积累及其影响因子[J]. 生态学报, 2003, 23(10):2133-2144. CUI Yu-jing, ZHAO Zhong-qiu, LIU Wen-ju, et al. Transfer of cadmium through soil-plant-human continuum and its affecting factors[J]. Acta Ecologica Sinica, 2003, 23(10):2133-2144. |
| [6] | Kostova D, Detcheva A, Boteva H, et al. Influence of fertilizing on Fe, Zn, Cu, Pb and Cd content in tomato fruits[J]. Comptes Rendus de l'Académie Bulgare des Sciences, 2013, 66(11):1529-1534. |
| [7] | 安志装, 王校常, 施卫明, 等. 重金属与营养元素交互作用的植物生理效应[J]. 土壤与环境, 2002, 11(4):392-396. AN Zhi-zhuang, WANG Xiao-chang, SHI Wei-ming, et al. Plant physiological responses to the interactions between heavy metal and nutrients[J]. Soil and Environmental Sciences, 2002, 11(4):392-396. |
| [8] | 李花粉, 张福锁, 毛达如. 小麦根表铁氧化物及植物铁载体对植物吸收镉的影响[J]. 中国环境科学, 1997, 17(5):433-436. LI Hua-fen, ZHANG Fu-suo, MAO Da-ru. Effect of ferric hydroxide on root surface and phytosiderophore on cadmium uptake by wheat plants[J]. China Environmental Science, 1997, 17(5):433-436. |
| [9] | 李花粉, 张福锁, 李春俭, 等. Fe对不同品种水稻吸收Cd的影响[J]. 应用生态学报, 1998, 9(1):110-112. LI Hua-fen, ZHANG Fu-suo, LI Chun-jian, et al. Effect of Fe nutrition status on Cd uptake by different rice varieties[J]. Chinese Journal of Applied Ecology, 1998, 9(1):110-112. |
| [10] | 李花粉, 郑志宇, 张福锁, 等. 铁对小麦吸收不同形态镉的影响[J]. 生态学报, 1999, 19(2):170-173. LI Hua-fen, ZHENG Zhi-yu, ZHANG Fu-suo, et al. Effect of iron nutritional status on the uptake of Cd from different compound by wheat plants[J]. Acta Ecologica Sinica, 1999, 19(2):170-173. |
| [11] | 李花粉. 根际重金属污染[J]. 中国农业科技导报, 2000, 2(4):54-59. LI Hua-fen. Heavy metals pollution in rhizosphere[J]. Journal of Agricultural Science and Technology, 2000, 2(4):54-59. |
| [12] | Liu D Q, Zhang C H, Chen X, et al. Effects of pH, Fe, and Cd on the uptake of Fe2+ and Cd2+ by rice[J]. Environmental Science and Pollution Research, 2013, 20:8947-8954. |
| [13] | Liu H J, Zhang J L, Christie P, et al. Influence of iron plaque on uptake and accumulation of Cd by rice(Oryza sativa L.) seedlings grown in soil[J]. Science of the Total Environment, 2008, 394:361-368. |
| [14] | 佘 玮, 崔国贤, 赵丹博, 等. 锌、铁缺失对苎麻吸收及转运重金属镉的影响[J]. 农业环境科学学报, 2014, 33(2):283-287. SHE Wei, CUI Guo-xian, ZHAO Dan-bo, et al. Cadmium uptake and transportation in two ramie cultivars under zinc and iron deficiency[J]. Journal of Agro-Environment Science, 2014, 33(2):283-287. |
| [15] | Muneer S, Kim T H, Qureshi M I. Fe modulates Cd-induced oxidative stress and the expression of stress responsive proteins in the nodules of Vigna radiata[J]. Plant Growth Regulation, 2012, 68:421-433. |
| [16] | Muneer S, Ahmad J, Bashir H, et al. Studies to reveal importance of Fe for Cd tolerance in Brassica juncea[J]. International Applied Biochemistry and Biotechnology, 2011, 1(3):321-338. |
| [17] | Christensen T H. Cadmium soil sorption at low concentrations: Ⅵ. A model for zinc competition[J]. Water, Air, and Soil Pollution, 1987, 34:305-310. |
| [18] | 王衍安, 董佃朋, 李 坤, 等. 铁、锌互作对苹果锌、铁吸收分配的影响[J]. 中国农业科学, 2007, 40(7):1469-1478. WANG Yan-an, DONG Dian-peng, LI Kun, et al. Effects of regulation of zinc and iron uptake and distribution in apple trees under zinc and iron interaction[J]. Scientia Agricultura Sinica, 2007, 40(7):1469-1478. |
| [19] | Lux A, Martinka M, Vaculík M, et al. Root responses to cadmium in the rhizosphere:A review[J]. Journal of Experimental Botany, 2011, 62(1):21-37. |
| [20] | Lombi E, Tearall K L, Howarth J R, et al. Influence of iron status on cadmium and zinc uptake by different ecotypes of the hyperaccumulator Thlaspi caerulescens[J]. Plant Physiology, 2002, 128(4):1359-1367. |
| [21] | Marschner H, Romheld V, Kissel M. Different strategies in higher plants in mobilization and uptake of iron[J]. Journal of Plant Nutrition, 1986, 9(3-7):695-713. |
| [22] | 易翠林, 王 贺, 张福锁, 等. 黄瓜、番茄和大豆对缺铁胁迫适应性反应的差异[J]. 植物生态学报, 1998, 22(6):559-565. YI Cui-lin, WANG He, ZHANG Fu-suo, et al. The Difference of iron deficiency induced adaptable reaction among cucumber, tomato and soybean[J]. Acta Phytoecologica Sinica, 1998, 22(6):559-565. |
| [23] | Su Y, Wang X M, Liu C F, et al. Variation in cadmium accumulation and translocation among peanut cultivars as affected by iron deficiency[J]. Plant Soil, 2013, 363:201-213. |
| [24] | Qin F, Shan X, Wei B. Effects of low-molecular-weight organic acids and residence time on desorption of Cu, Cd, and Pb from soils[J]. Chemosphere, 2004, 57:253-263. |
| [25] | 郑绍建. 细胞壁在植物抗营养逆境中的作用及其分子生理机制[J]. 中国科学, 2014, 44(4):334-341. ZHENG Shao-jian. The Role of cell wall in plant resistance to nutritional stresses and the underlying physiological and molecular mechanisms[J]. Scientia Sinica Vitae, 2014, 44(4):334-341. |
| [26] | 徐 劼, 保积庆. 芹菜根细胞壁对镉的吸附固定机制及其FTIR表征研究[J]. 环境科学学报, 2014, 0922 http://www. cnki. net/kcms/doi/10. 13671/j. hjkxxb. 2014. 0922. html. XU Jie, BAO Ji-qing. Adsorption and fixation mechanism of cadmium on celery(Apium graveolens L.) root cell wall and the analysis of FTIR Spectra[J]. Acta Scientiae Circumstantiae, 2014, 0922 http://www. cnki. net/kcms/doi/10. 13671/j. hjkxxb. 2014. 0922. html. |
| [27] | Yoshihara T, Hodoshima H, Miyano Y, et al. Cadmium inducible Fe deficiency responses observed from macro and molecular views in tobacco plants[J]. Plant Cell Reports, 2006, 25:365-373. |
| [28] | Vert G, Grotz N, Dedaldechamp F, et al. IRT1, an arabidopsis transporter essential for iron uptake from the soil and for plant growth[J]. Plant Cell, 2002, 14(6):1223-1233. |
| [29] | Nevo Y, Nelson N. The NRAMP family of metal-ion transporters[J]. Biochimica et Biophysica Acta, 2006, 1763:609-620. |
| [30] | Akimasa S, Naoki Y, Kengo Y, et al. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]. Plant Cell, 2012, 24:2155-2167. |
| [31] | Takahashi R, Ishimaru Y, Senoura T, et al. The OsNRAMP1 iron transporter is involved in Cd accumulation in rice[J]. Journal of Experimental Botany, 2011, 62:4843-4850. |
| [32] | Van der Vliet L, Peterson C, Hale B. Cd accumulation in roots and shoots of durum wheat:The roles of transpiration rate and apoplastic bypass[J]. Journal of Experimental Botany, 2007, 58:2939-2947. |
| [33] | Liu X, Peng K, Wang A, et al. Cadmium accumulation and distribution in populations of Phytolacca americana L. and the role of transpiration[J]. Chemosphere, 2010, 78:1136-1141. |
| [34] | 夏汉平. 土壤-植物系统中的镉研究进展[J]. 应用与环境生物学报, 1997, 3(3):289-298. XIA Han-ping. Studies on cadmium in soil-plant system[J]. Chinese Journal of Applied & Environmental Biology, 1997, 3(3):289-298. |
 2015, Vol. 34
2015, Vol. 34