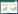文章信息
- 贺瑶, 周惜时, 夏妍, 郭攀, 王桂萍, 沈振国, 陈亚华
- HE Yao, ZHOU Xi-shi, XIA Yan, GUO Pan, WANG Gui-ping, SHEN Zhen-guo, CHEN Ya-hua
- 铜排斥型植物黄花月见草(Oenothera glazioviana)对铜胁迫的响应以及在铜污染土壤上的合理利用
- Physiological Responses of Oenothera glazioviana to Copper Stress and Its Rational Utilization in Copper Contaminated Soil
- 农业环境科学学报, 2015, 34(3): 449-460
- Journal of Agro-Environment Science, 2015, 34(3): 449-460
- http://dx.doi.org/10.11654/jaes.2015.03.006
-
文章历史
- 收稿日期:2014-10-28
2. 南京农业大学农村土地资源利用与整治国家地方联合工程研究中心, 南京 210095;
3. 江苏省有机固体废弃物资源化协同创新中心, 南京 210095
2. National Joint Local Engineering Research Center for Rural Land Resources Use and Consolidation, Nanjing Agricultural University, Nanjing 210095, China;
3. Jiangsu Collaborative Innovation Center for Solid Organic Waste Resource Utilization Nanjing 210095, China
Cu是植物生长的必需微量元素,适量Cu对维持植物正常生理代谢及产量的提高、品质的改善都有重要意义。目前由于污水灌溉、污泥、畜禽粪便和农药的施用、矿藏的开采和冶炼等增加了土壤中的Cu含量[1]。过量的Cu不仅会给植物的生长带来毒害,而且还可通过在植物根、茎、叶及果实中的过量积累进入食物链,进而危及人类健康[2]。
Cu对植物最直观的影响表现于植物长势减缓,根系生长受抑、生物量下降等[3]。Wei等[4]研究发现,当Cu浓度≥10 μmol·L-1时,苏丹草根系呈褐色,生物量与对照相比显著下降。刘登义等[5]的研究表明,小麦在Cu毒害下,除叶片细小、普遍失绿外,还形成特征性的狮尾根,当土壤总铜含量达2000 mg·kg-1时,植株萎蔫,几乎停止生长。过量Cu使玉米根细胞的核仁解体、核仁区缩小,染色质浓缩、核DNA合成受抑制,从而细胞不能顺利地从G0期向S期转变[6]。Cu对叶绿素含量和光合作用有不同程度的影响,Cu与叶绿体蛋白质上的-SH结合或取代其中的Fe2+、Zn2+、Mg2+,致使叶绿体蛋白中心粒子组成发生变化而失活。Lou等[3]研究发现Cu浓度高于50 μmol·L-1时海州香薷叶片叶绿素含量下降,光合效率降低。Cu同样会导致必需营养元素的吸收、运输和积累的失调,这在许多受Cu毒害的植物中均有发现。30 μmol·L-1 Cu2+会导致油菜根系和叶片中K、P、S含量显著下降,同时根系中Ca含量显著上升[7]。植物吸收过量Cu会对细胞膜及多种细胞器的膜系统产生伤害,离子泄漏和水分代谢失调是Cu胁迫破坏质膜的结果,巯基化合物含量下降、膜脂过氧化是质膜透性增加的直接原因[8, 9]。另外,Cu可以通过抑制植物叶片亚硝酸还原酶等氮素代谢相关酶的活性减少氮的吸收及转运,N总量及叶片和根部NO3-和游离氨基酸含量均下降,硝酸还原酶活性几乎被完全抑制,但游离氨和谷氨酰胺含量上升,说明经由较为活跃的谷氨酸脱氢酶的N代谢途径引起N代谢的变化[10, 11]。
黄花月见草(Oenothera glazioviana),柳叶菜科,月见草属,一、二年生或多年生草本植物,又名野芝麻、山芝麻,原产北美洲[12]。近年来,月见草作为油料作物开始人工栽培,因为其种子油中富含7%~10%的γ-亚麻酸(GLA)[13, 14]。GLA是组成人体一系列前列腺素的必需前体物质,是组成人体各组织生物膜的结构材料,具有调节免疫系统、抗癌、抗炎症的作用[15]。由于GLA广泛的生理活性和明显的药理作用,被认为是“21世纪功能性食品主角”[16],自然界中以月见草油中的含量最多[17]。20世纪80年代以来,英、美、德及中国等30多个国家极其重视月见草油的应用研究和开发。
本研究采用溶液培养方法以铜积累型耐性植物海州香薷(Elsholtzia haichowensis)[3]和传统的油料作物芝麻(Sesamum indicum)[18]作为对照植物,研究铜胁迫下黄花月见草幼苗生长、渗透调节的变化、根尖质膜完整性、植物体内有机酸的变化等,探讨黄花月见草对铜胁迫的生理响应及耐铜机理。同时通过盆栽试验,研究不同浓度Cu污染土壤对黄花月见草生长、种子中铜含量、种子油含量以及γ-亚麻酸含量的影响,分析了黄花月见草在合理利用Cu污染废弃地中的应用价值,为选育重金属低积累、对环境适应能力强的经济植物提供依据。 1 材料与方法 1.1 植物材料和实验设计
供试植物为黄花月见草(Oenothera glazioviana)、海州香薷(Elsholtzia haichowensis)和芝麻(Sesamum indicum),采用水培和土培相结合的试验方法。
水培选取三种植物饱满的种子,播种在珍珠岩和蛭石基质上发芽,待幼苗两片子叶全部打开后,选取长势和大小一致的幼苗,用海绵将其固定在有孔的泡沫板上,然后放置在盛有2.5 L营养液周转箱中培养。将幼苗移栽到营养液中,开始培养时使用1/8 Hoagland营养液,然后逐步换为1/4、1/2以至完全Hoagland营养液,用HCl或KOH溶液将营养液pH调至5.45,植物生长在可控的温室中。待幼苗生长至4叶1心期(不包括子叶)开始如下处理:对照和50 μmol·L-1 CuSO4两个处理,3 d后,测定植物根系生长、根尖质膜完整性、叶片叶绿素含量、膜透性、渗透调节物质含量、植物体内有机酸含量、必需营养元素的吸收。
土培的供试土壤采自南京市汤山街道农田土,土壤类型为黄棕壤。土壤取样深度为耕层0~20 cm。供试土壤基础养分含量见表 1。试验设6 个处理,每个处理重复4 次,各处理添加的Cu浓度分别为0、50、100、300、600、1000 mg·kg-1。投加的Cu以CuSO4∶CuCO3=1∶1的形式固态加入到土壤中并充分混匀,平衡14 d后每个花盆装入(2.5±0.05)kg土壤,并在装盆之前取样测定各土样总Cu和提取态Cu含量(表 6)。种子经0.5% NaClO消毒20 min之后播种于经消毒的穴盘,20 d之后约3月下旬选择健壮、生长一致的黄花月见草幼苗移栽到各处理花盆中,培养期间温度为28 ℃/20 ℃,土壤湿度保持在60%田间持水量,自然光照。待种子完全成熟后约10月上旬收获,自然晾干,测定种子千粒重、油含量及γ-亚麻酸含量。
根长、根尖数量、根系表面积、根系直径、根系总投影、根系体积采用WRHIZO全自动根系分析系统测定。 1.2.2 根尖质膜完整性测定
通过不透膜的分子荧光探针碘化丙啶(PI)来分析。PI能够与核苷酸相结合,通过用来标记失去膜完整性的细胞[19],活细胞不被标记。将处理好的植物根尖样品放进5 μg·mL-1的PI溶液中,20 min后取出冲净,立即置于荧光显微镜下,在546 nm波长激发紫外光下观察、拍照。 1.2.3 叶片膜透性测定
用DDS-11A型电导率仪测定相对电导率[20]。 1.2.4 叶片叶绿素含量测定
用SPAD-502叶绿素仪测定叶片叶绿素含量。 1.2.5 叶片脯氨酸的测定
采用酸性茚三酮法[20]测定叶片脯氨酸含量。 1.2.6 植物体内有机酸分析
采用高效液相色谱技术,HITACH UV Detector L-2400,HITACH Pump L-2130。准确称取0.50 g新鲜植物样品,加入5 mL 0.5 mol·L-1 HCl充分研磨,75 ℃水浴30 min,室温放置过夜,20 000×g离心20 min,上清过阳离子树脂(Amberli te IR-120)去除金属离子,用0.22 μmol·L-1水相滤膜过滤后备测。标准品苹果酸、柠檬酸、草酸、酒石酸、琥珀酸(购自Sigma公司),甲醇为色谱纯,水为超纯水,其他试剂为分析纯。色谱柱为C18柱(ZORBAX SB-Aq 4.6×250 mm 5-Micron),柱温25 ℃,流动相为0.05 mol·L-1磷酸二氢钾,含1%甲醇,进样量20 μL,检测波长为214 nm,流速为0.6 mL·min-1。 1.2.7 元素含量测定
Cu处理3 d后,部分样品取样将植物根浸入25 mmol·L-1 EDTA-Na 溶液中交换15 min,以解吸根系表面吸附的金属离子,再用去离子水将植物洗净吸干,将植株分成地上部、根系两部分,120 ℃于烘箱中30 min杀青,之后80 ℃烘干至恒重并称重测定生物量。
植物地上部和根系样品烘干后粉碎,准确称取(0.200 0±0.001 0)g植物样,加入HNO3∶HClO4=87∶13(V/V)的混酸,在电热消解仪上消煮。用电感耦合等离子体发射光谱仪(ICP-OES,Perkin Elmer Optima 2100DV)测定大量元素K、Ca、P、Mg及微量元素Cu、Zn、Fe、B、Mn含量。 1.3 土培试验 1.3.1 土壤总铜和有效铜的测定
采集的土样避光阴干,再经30 ℃烘干至恒重后,玛瑙研钵充分研磨,过2 mm筛,准确称取(0.250 0±0.001 0)g土样倒入洁净干燥的消煮管中,加入6~8 mL HNO3∶HClO4=4∶1(V/V)的混酸,在电热消解仪上消煮完全。消煮后的管子内加入20 mL 2.5%的稀硝酸,涡旋,70 ℃下水浴30 min,取上清作为待测液。用电感耦合等离子体发射光谱仪(ICP-OES,Perkin Elmer Optima 2100 DV)测定土壤总铜含量。样品消煮过程中以消煮的混合酸为空白,同时消煮,以消除消煮和分析过程中污染带来的误差。
另准确称取(5.000 0±0.001 0)g土壤样品(孔径小于2 mm),置于50 mL离心管中,加25 mL 0.01 mol·L-1 CaCl2溶液后室温下水平振荡2 h,离心,取上清液,加入6~8 mL HNO3∶HClO4=4∶1(V/V)的混酸,在电热消解仪上消煮完全。用电感耦合等离子体发射光谱仪(ICP-OES,Perkin Elmer Optima 2100DV)测定CaCl2提取态Cu含量。 1.3.2 黄花月见草种子千粒重测定
千粒重的测定参照Balasubramanian等[21]的方法,取100 g黄花月见草种子,将种子随机分成10等份,然后随机从各份中取种子,数够1000粒,置于40 ℃烘箱中干燥。然后电子天平(精确到小数点后四位)称重,每次称重重复5 次取平均值。 1.3.3 黄花月见草种子油含量测定
称取备用试样5 g,准确至0.000 1 g,置于(105±2)℃烘箱中,干燥1 h后取出,放入干燥器内冷却至室温,同时测定样品的水分含量。籽粒油含量的测定参照Zaidul等[22]的方法,将样品放入研钵内研细,必要时可加适量石英砂助研,将研细的样品过18~35目(1~0.5 mm)筛子后移入干燥的滤纸筒内,取少量脱脂棉蘸乙醚抹净研钵、研棒和药匙上的试样和油迹,一并投入滤纸筒内,在试样面层塞以脱脂棉,然后将滤纸筒放入索氏提取器的抽提管内。抽提剂采用无水乙醚,抽提8 h后,转移到旋转蒸发器蒸至恒重。
采样气相色谱法,色谱柱:SupelcoTM弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);检测器:FID;载气:N2;灵敏度:20;衰减:-5;分流比:30∶1;进样量:1 μL;柱温:170 ℃;进样口温度:180 ℃;检测器温度:200 ℃。对照品溶液:γ-亚麻酸甲酯对照品购自中国药品生物制品检定所,批号:110898~200503。准确称取γ-亚麻酸甲酯对照品11.62 mg,置于10 mL容量瓶中,准确加入正己烷溶解并制成每1 mL含1.162 mg的γ-亚麻酸甲酯对照品溶液。供试品溶液:黄花月见草种子油100 g经皂化反应后得总脂肪酸,准确称取总脂肪酸约8 mg,置于10 mL具塞试管中,加入甲醇2 mL,三氟化硼乙醚液1 mL,振摇,于60 ℃水浴5 min,冷却至室温,准确加入正己烷2 mL,饱和氯化钠溶液2 mL,旋涡振摇,放置片刻,加入无水硫酸钠2 g,上层液即为甲酯化供试品溶液。 1.4 数据处理
方差分析使用SPSS 14.0(SPSS Inc.,Chicage,U.S.A)数据处理软件,采用Duncan多重范围检验方法。采用SigmaPlot 12.5进行数据分析与作图。 2 结果与分析 2.1 铜对三种植物根系生长的影响
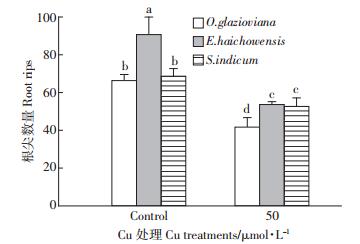
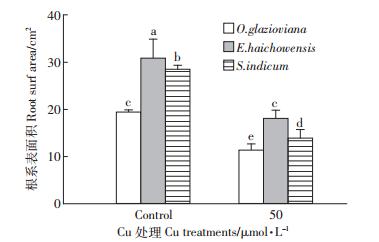
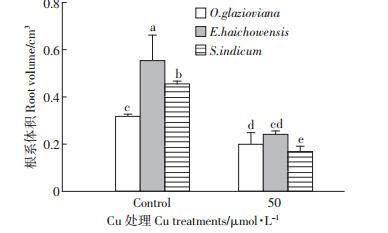
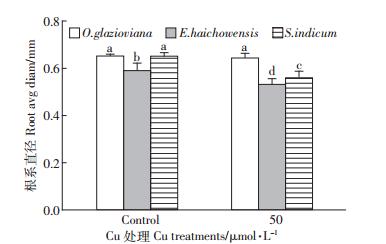
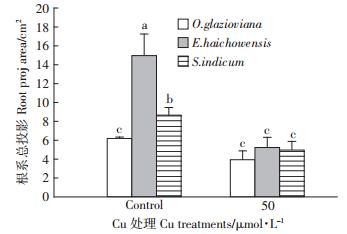
如图 1所示,50 μmol·L-1 Cu处理3 d时,黄花月见草、海州香薷和芝麻的根伸长量均受到显著抑制,与对照比较分别下降了31%、30%和46%。作为根系中生命活动最旺盛的区域也是根实现吸收功能的主要部位,黄花月见草、海州香薷和芝麻的根尖数量在铜的胁迫下分别比对照下降了37%、41%和23%(图 2),下降的程度均达到显著水平。从图 3可以看出,黄花月见草、海州香薷和芝麻的根系表面积在铜的胁迫下分别比对照下降了42%、41%和51%,降低的程度同样也均达到显著水平。就根系体积而言(图 4),黄花月见草、海州香薷和芝麻的根系体积在铜的胁迫下分别比对照下降了37%、56%和63%,降低的程度同样也均达到显著水平。黄花月见草、海州香薷和芝麻的根系直径在铜的胁迫下分别比对照下降了1%、10%和14%,如图 5所示,黄花月见草根系直径几乎没有变化,而海州香薷和芝麻的根系直径均受到了显著抑制。黄花月见草、海州香薷和芝麻的根系总投影在铜的胁迫下分别比对照下降了36%、65%和43%,其中黄花月见草根系总投影下降得不明显,而海州香薷和芝麻根系总投影下降的程度达到显著水平(图 6)。
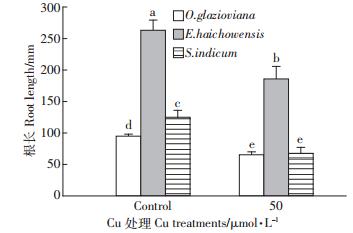
|
| 图中不同小写字母表示各处理间差异显著 (P<0.05 )。下同 Different letters indicate significant differences between different treatments (P<0.05 ) . The same below图 1 50 μmol · L-1 Cu 处理 3d 对三种植物根系伸长生长的影响 Figure 1 Effect of 50 μmol · L-1 Cu treatment for 3 days on root elongation of three plant species |
|
| 图 2 50 μmol · L-1 Cu 处理 3d 对三种植物根系根尖数量的影响 Figure 2 Effect of 50 μmol · L-1 Cu treatment for 3 days on root tips of three plant species |
|
| 图 3 50 μmol · L-1 Cu 处理 3d 对三种植物根系表面积的影响 Figure 3 Effect of 50 μmol · L-1 Cu treatment for 3 days on root surface area of three plant species |
|
| 图 4 50 μmol · L-1 Cu 处理 3d 对三种植物根系体积的影响 Figure 4 Effect of 50 μmol · L-1 Cu treatment for 3 days on root volume of three plant species |
|
| 图 5 50 μmol · L-1 Cu 处理 3d 对三种植物根系直径的影响 Figure 5 Effect of 50 μmol · L-1 Cu treatment for 3 days on average root diameters of three plant species |
|
| 图 6 50 μmol · L-1 Cu 处理 3d 对三种植物根系 总投影面积的影响 Figure 6 Effect 50 μmol · L-1 Cu treatment for 3 days on root projection area of three plant species |
图 7为三种植物在50 μmol·L-1 Cu处理3 d时根尖细胞质膜完整性的荧光检测结果,可以看出黄花月见草和海州香薷受铜胁迫后与对照相比,红色轻微的加深,而芝麻根尖在铜处理后红色非常深,说明芝麻失去膜完整性的细胞最多,Cu处理使其膜完整性破坏严重。
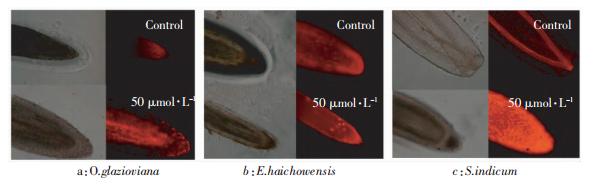
|
| 图 7 50 μmol · L-1 Cu 处理 3d 三种植物根系根尖质膜完整性的荧光染色图 Figure 7 Fluorescence images of cell plasma membrane integrity in root tips of three plant species with 50 μmol · L-1 Cu treatment for 3 days |
如图 8所示,铜对黄花月见草、海州香薷叶片的膜透性无显著影响,却显著增大了芝麻叶片细胞膜的透性,可能由于大量铜进入植物体造成膜蛋白的磷脂结构改变,膜系统遭受破坏,透性增大,使细胞内一些可溶性物质外渗,从而导致相对电导率增大。
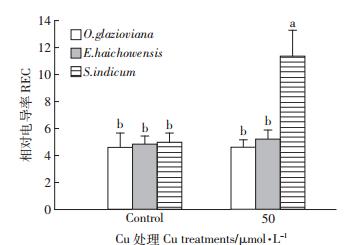
|
| 图 8 50 μmol · L-1 Cu 处理 3d 对三种植物叶片膜透性的影响 Figure 8 Effect of 50 μmol · L-1 Cu treatment for 3 days on membrane permeability in leaves of three plant species |
由表 2可以看出,50 μmol·L-1 Cu处理对黄花月见草和海州香薷叶片的叶绿素含量的影响不明显,而芝麻叶绿素含量在铜胁迫下下降了6.9%,差异显著。
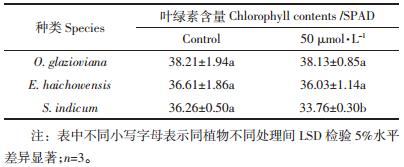 |
脯氨酸是植物重要的渗透调节物质。本实验中,Cu胁迫对黄花月见草叶片的脯氨酸含量影响不显著,而显著影响了海州香薷和芝麻叶片脯氨酸含量。相对于只添加营养液的对照而言,Cu处理3 d后,海州香薷和芝麻叶片脯氨酸含量分别上升了37%和73%(图 9)。
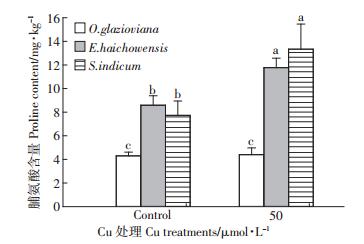
|
| 图 9 50 μmol · L-1 Cu 处理 3d 对三种植物叶片脯氨酸 含量的影响 Figure 9 Effects of 50 μmol · L-1 Cu treatment for 3 days on proline contents in leaves of three plant species |
图 10所示为有机酸标准样品的离子色谱图谱,分析了草酸、酒石酸、苹果酸、柠檬酸、琥珀酸5种有机酸。由图 11可见,三种植物体内的有机酸主要以草酸、柠檬酸、苹果酸为主,其他有机酸均未检出,其中Cu胁迫对三种植物体内的柠檬酸含量均没有显著的影响。就黄花月见草而言,其地上部草酸含量受Cu的影响不显著,但苹果酸升高了3.2 倍,而根系草酸和苹果酸含量在50 μmol·L-1 Cu处理3 d时分别上升了69%和5.5 倍。Cu胁迫导致了海州香薷地上部草酸含量降低了63%,苹果酸含量却上升了7.9倍,其根系中草酸含量受Cu影响上升19%,苹果酸含量剧增90%。芝麻在50 μmol·L-1 Cu处理3 d时生命体征受损严重,地上部和根系的草酸含量分别下降了26%和52%,然而其地上部和根系的苹果酸含量分别上升了81%和1.8 倍。
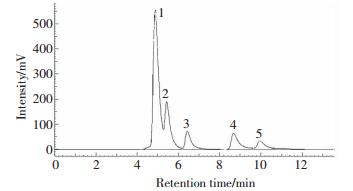
|
| 1.草酸 Oxalic acid; 2.酒石酸 Tartaric acid; 3.苹果酸 Malic acid; 4.柠檬酸 Citric acid; 5.琥珀酸 Succinic acid图 10 有机酸标准样品的离子色谱图 Figure 10 IC chromatogram of standard organic acids |

|
| 图 11 50 μmol · L-1 Cu 处理 3 天对三种植物地上部和根系有机酸含量的影响 Figure 11 Effects of 50 μmol · L-1 Cu treatment for 3 days on organic acid contents in shoots and roots of three plant species |
就大量元素而言(表 3),Cu胁迫对三种植物地上部和根系的P、Ca含量影响不显著,而黄花月见草和芝麻根系中的Mg含量相比对照分别减少了28%和41%,海州香薷根系中的Mg却比对照增加了34%。三种植物对K的吸收也有较大差异,其中黄花月见草和芝麻根系中的K相比对照减少了16%和79%,而海州香薷根系中的K含量却比对照提高了2.3 倍。
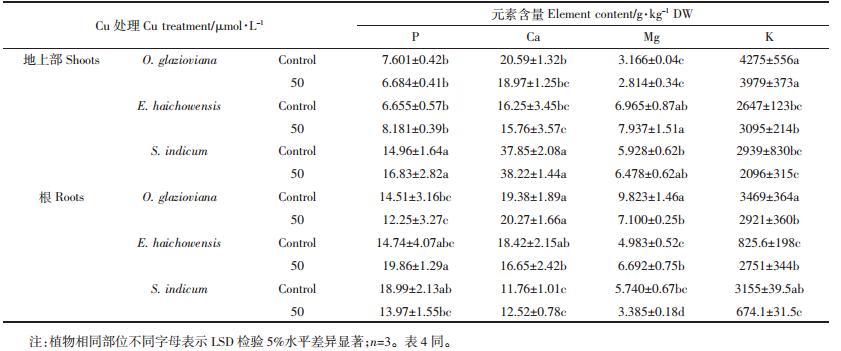 |
至于微量元素(表 4),Cu处理并没有导致黄花月见草地上部Cu含量产生变化,而海州香薷和芝麻地上部的Cu含量分别增加了0.7倍和1.4 倍,同时黄花月见草根系中Cu含量升高了19 倍,远低于海州香薷和芝麻升高的52 倍和94 倍。Cu处理使得黄花月见草和芝麻根系对Zn吸收分别下降了25%和48%,相反,海州香薷根系中Zn含量却升高了1.05 倍。三种植物在Cu胁迫下对Fe的吸收也存在较大差异,黄花月见草地上部和根系中的Fe含量分别比对照减少了31%和32%,然而芝麻地上部和根系中的Fe含量却分别增加了29%和22%,Cu处理并没有影响海州香薷对Fe的吸收和积累。Cu处理导致三种植物地上部B含量均呈增加趋势,但影响不显著,芝麻根系中B含量减少了24%。海州香薷体内Mn含量不受Cu胁迫的影响,然而黄花月见草和芝麻根系中Mn含量分别减少了58%和54%。
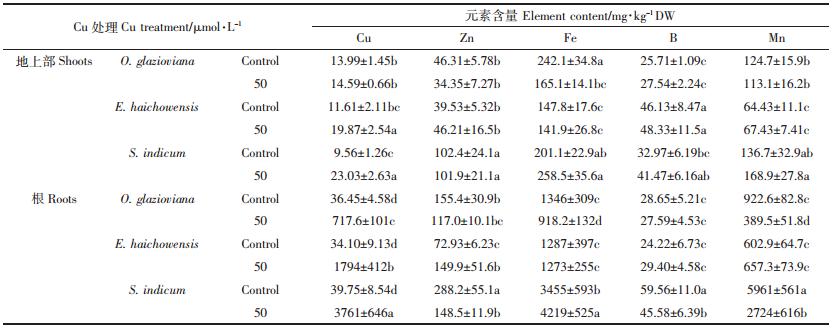 |
黄花月见草是铜排斥型的耐性植物,海州香薷是铜积累型耐性植物,芝麻属于对铜比较敏感的非耐性植物,三种植物用于研究对Cu胁迫的响应比较有代表性,对三种植物体内Cu的积累与其他必需营养元素积累的相关性分析数据如表 5所示,植物体内Cu的积累与Zn、Fe、Mn的积累呈显著正相关,与Ca、K的积累呈负相关。
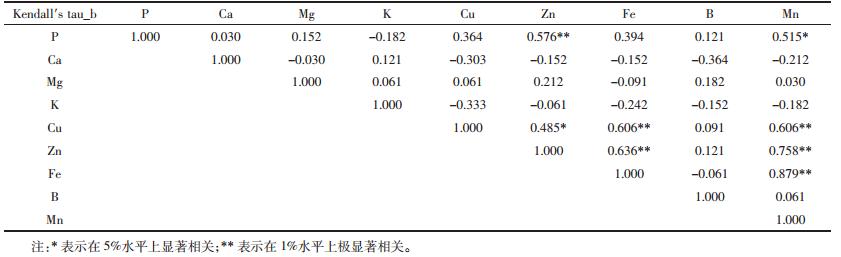 |
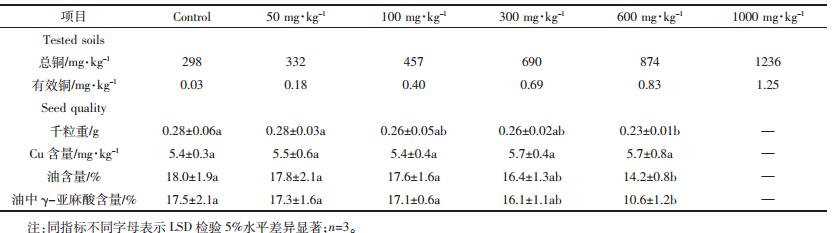
如表 6所示,土壤中有效态铜含量随着添加的总铜含量的升高而升高,有效态铜大约是土壤总铜量的0.1%。土壤中总铜含量为1236 mg·kg-1时严重抑制了黄花月见草的生长,该处理浓度下,植株生长缓慢未收获种子。当土壤总铜含量低于700 mg·kg-1时,对黄花月见草种子的千粒重、种子铜含量、种子油含量、种子油中γ-亚麻酸含量均没有显著影响,当土壤中总铜含量为874 mg·kg-1时,种子的千粒重、种子油含量、种子油中γ-亚麻酸含量分别降低了18%、13%和34%,然而黄花月见草种子中的铜含量始终保持在5 mg·kg-1左右。
 |
Patterson和Olson[23]认为生物量是探讨植物重金属耐性最直接的参数,海州香薷是目前发现耐铜性最高的积累性植物之一[24],虽然经济作物黄花月见草铜耐性不及海州香薷,但是远高于芝麻。水培实验发现黄花月见草在<25 μmol·L-1 Cu处理下生物量并未下降,其半抑制浓度在50~100 μmol·L-1之间。10 μmol·L-1 Cu处理导致苏丹草生物量显著下降[4],3.6 μmol·L-1 Cu显著抑制了小麦的根长,阻碍了其生长。由此可见,黄花月见草具有一定铜耐受性。
细胞膜作为植物调节和控制细胞内外物质运输和交换的重要结构,其完整性是评价植物对污染物反应的常用指标之一[25]。本实验利用荧光检测的方法发现黄花月见草和海州香薷的根系质膜完整性在50 μmol·L-1 Cu处理下相对较完整,而芝麻受损严重,这与三者耐受实验的结果相一致。
细胞膜结构是植物遭受Cu毒害的首要部位,Cu可以与细胞膜蛋白的巯基或磷脂分子层的磷脂类物质结合或者反应,从而使电导率增大[26, 27]。Strange等[28]认为过量的Cu可以使细胞膜的强度下降,Cu渗入细胞内部,同时造成胞内物质外渗而亏缺[29]。对三种植物叶片的相对电导率的测定结果显示,芝麻地上部细胞膜受损同样非常严重,可能与其地上部被动积累大量的铜有关。
储玲等[30]研究发现,三叶草在经10 mg·L-1 Cu处理后,叶绿素含量微增,之后随处理浓度的升高而递减。可能是因为少量Cu弥补了植物体内质体蓝素所需[31],而质体蓝素又是光合作用电子传递系统的一部分,因此,适宜浓度的Cu可使叶绿素含量增加。我们采用50 μmol·L-1 Cu处理时,发现黄花月见草和海州香薷叶片叶绿素受铜胁迫没有显著变化,而芝麻叶片黄化严重,叶绿素含量显著下降。叶绿素含量的减少,可能是由于Cu进入植物体内使叶绿体酶活性比例失调,致使叶绿素分解加快[32]。同时,由于Cu局部积累过多,与叶绿体中蛋白质-SH结合或取代其中的Fe2+、Zn2+、Mg2+,致使叶绿素蛋白中心离子组成发生变化而失活[33]。
为了适应逆境,植物通常会在短时间内,通过迅速大量地合成和积累如脯氨酸、甜菜碱等一些渗透调节物质,来增强其对渗透胁迫的抵抗能力[34]。脯氨酸优先储存在液泡中,是所有氨基酸中水溶性最强的一种氨基酸[35, 36]。本研究发现,海州香薷和芝麻叶片因Cu胁迫导致脯氨酸含量显著升高,而黄花月见草叶片中脯氨酸没有显著变化,可能与黄花月见草地上部铜积累量并没有因Cu处理而明显增加、叶片受逆境伤害较小有关。
有机酸在植物重金属解毒过程中起重要作用[37],植物根系吸收重金属后,重金属向地上部分的转移以及在贮存位点内的解毒通过在细胞亚细胞水平与有机配体的螯合、转运、交换和隔离等作用实现[38]。目前关于Cu有机酸配位螯合物的报道非常少,苹果酸、柠檬酸是目前发现最多的在耐性植物体内螯合Cd、Ni、Zn等重金属的有机酸[39, 40, 41, 42, 43],它们与重金属结合后贮存在液泡内[44]。在比较三种植物铜胁迫下体内有机酸种类和含量变化时,三种植物地上部苹果酸含量增加。
植物必需营养元素的吸收、运输和积累的失调在许多受Cu毒害的植物中均有发现,重金属可通过干扰植物矿质营养元素的代谢活动而使植物中毒[45]。Vardaka等[46]发现小麦根中的Fe含量会随Cu浓度的增加而降低,Ca浓度改变被视为植物对Cu毒害的普遍反应[47]。在铜处理下凤丹根部及茎部P的含量呈下降趋势,但叶片中P的含量稳定[48],铜胁迫导致垂柳叶片中Zn含量的显著降低[49]。外源50 μmol·L-1 Cu胁迫3 d并没有引起黄花月见草地上部Cu含量的变化,而海州香薷和芝麻地上部Cu含量有一定增加,说明黄花月见草对Cu具有较强的排斥机制。在Cu胁迫下,黄花月见草根系中的Mg、K、Mn、Zn和Fe含量相比对照显著降低,地上部K和Mn含量也有同样的下降趋势,另外海州香薷根系中的Zn含量因Cu胁迫增加1.05倍,芝麻体内几种元素含量大多呈显著减少趋势,而地上部和根系中的Fe含量却呈现增加趋势。Cu对不同植物几种矿质元素积累的差异性,可能是由于不同植物对不同矿质元素吸收特性和体内需求的不同决定的。Cu可能会使植物根部受到损害或者引起酶的变化,都是Cu胁迫影响其他矿质元素在体内分布的原因,但具体的原因还需进一步研究。
对Cu污染土壤中黄花月见草种子品质的研究发现,当土壤中总Cu浓度为690 mg·kg-1时,土壤有效态Cu(CaCl2提取)含量为0.69 mg·kg-1,该浓度的Cu污染土壤对黄花月见草种子的千粒重、油含量、油中γ-亚麻酸含量均没有显著影响;当土壤中总Cu浓度为874 mg·kg-1时,黄花月见草种子品质明显下降,而种子的Cu含量在5 mg·kg-1左右,符合食品中的限定标准(GBT 5009.13—2003,Cu:20 mg·kg-1)。根据本研究结果说明,总Cu含量低于700 mg·kg-1的土壤符合黄花月见草生长的环境要求,利用黄花月见草不仅能够充分利用荒置的Cu污染农田,扩大植被覆盖率,减少土壤中的重金属向周边土地及地下水的迁移,而且能够获得安全的月见草种子以及种子油,可以获取更高的经济效益。 4 结论
(1)50 μmol·L-1 Cu 处理下,与Cu敏感型植物芝麻相比,黄花月见草和海州香薷均具有较高的耐Cu性,表现在根系质膜完整性较好、叶片细胞膜透性和叶绿素含量维持相对稳定。
(2)Cu胁迫下,三种植物体内苹果酸含量均显著增加;海州香薷和芝麻叶片中脯氨酸含量上升,而黄花月见草叶片脯氨酸含量变化不大;三种植物体内Cu积累与Zn、Fe、Mn的积累呈显著正相关,与Ca、K积累呈负相关。
(3)土壤总Cu含量不高于700 mg·kg-1时,对黄花月见草的种子的千粒重、种子Cu含量、种子油含量、种子油中γ-亚麻酸含量均没有显著影响,且种子Cu含量符合国家食品卫生标准。低生产成本和较高的经济效益使得黄花月见草在Cu污染土壤中具有推广价值。
| [1] | 张国军, 邱栋梁, 刘星辉. Cu对植物毒害研究进展[J]. 福建农林大学学报, 2004, 33(3):289-294. ZHANG Guo-jun, QIU Dong-liang, LIU Xing-hui. Advances in copper toxicity to plants[J]. Journal of Fujian Agricultural and Forestry University, 2004, 33(3):289-294. |
| [2] | Chen B C, Ho P C, Juang K W. Alleviation effects of magnesium on copper toxicity and accumulation in grapevine roots evaluated with biotic ligand models[J]. Ecotoxicology, 2013, 22(1):174-183. |
| [3] | Lou L Q, Shen Z G, Li X D. The copper tolerance mechanisms of Elsholtzia haichowensis. a plant from copper-enriched soils[J]. Environmental and Experimental Botany, 2004, 51(2):111-120. |
| [4] | Wei L, Luo C L, Li X D, et al. Copper accumulation and tolerance in Chrysanthemum coronarium L. and Sorghum sudanense L.[J]. Archives of Environmental Contamination and Toxicology, 2008, 55(2):238-246. |
| [5] | 刘登义, 谢建春, 杨世勇, 等. 铜尾矿对小麦生长发育和生理功能的影响[J]. 应用生态学报, 2001, 12(1):126-145. LIU Deng-yi, XIE Jian-chun, YANG Shi-yong, et al. Effects of copper mine tailings on growth and development and physiological function of wheat[J]. Chinese Journal of Applied Ecology, 2001, 12(1):126-145. |
| [6] | Doncheva S. Ultrastructural localization of Ag-NOR proteins in root meristem cells after copper treatment[J]. Journal of Plant Physiology, 1997, 151(2):242-245. |
| [7] | Cestone B, Cuypers A, Vangronsveld J, et al. The influence of EDDS on the metabolic and transcriptional responses induced by copper in hydroponically grown Brassica carinata seedlings[J]. Plant Physiology and Biochemistry, 2012, 55:43-51. |
| [8] | De Vos C H R, Schat H, Vooijs R. Copper-induced damage to the permeability barrier in roots of Silene cucubalus[J]. Journal of Plant Physiology, 1989, 135(2):165-169. |
| [9] | De Vos C H R, Vonk M J, Vooijs R, et al. Glutathione depletion due to copper-induced phytochelatin synthesis causes oxidative stress in Silene cucubalus[J]. Plant Physiology, 1992, 98(3):853-858. |
| [10] | Marchand L, Mench M, Marchand C, et al. Phytotoxicity testing of lysimeter leachates from aided phytostabilized Cu-contaminated soils using duckweed(Lemna minor L.)[J]. Science of the Total Environment, 2011, 410(411):146-153. |
| [11] | Al-HakiMi A B M, Hamad A A M. Ascorbic acid, thiamine or salicylic acid induced changes in some physiological parameters in wheat grown under copper stress[J]. Plant Protection Science, 2011, 47(3):90-108. |
| [12] | Singh S, Kaur R, Sharma S K. An updated review on the Oenothera genus[J]. Chinese Journal of Integrative Medicine, 2012, 10(7):717-725. |
| [13] | Ghoreishi S M, Bataghva E. Supercritical extraction of evening primrose oil:Experimental optimization via response surface methodology[J]. Aiche Journal, 2011, 57(12):3378-3384. |
| [14] | Christie W W. The analysis of evening primrose oil[J]. Industrial Crops and Products, 1999, 10(2):73-83. |
| [15] | Fan Y Y, Chapkin R S. Importance of dietary gamma-linolenic acid in human health and nutrition[J]. Journal of Nutrition, 1998, 130(Suppl1):1411-1414. |
| [16] | 田歆珍, 王贤磊, 孙桂琳, 等. γ-亚麻酸的研究进展[J]. 生物技术, 2008, 18(1):89-92. TIAN Xin-zhen, WANG Xian-lei, SUN Gui-lin, et al. Research advance of γ-linoleneic acid[J]. Biotechnology, 2008, 18(1):89-92. |
| [17] | 万红贵, 张 建, 袁建锋, 等. 生物制备γ-亚麻酸研究进展[J]. 中国酿造, 2012, 31(2):12-16. WAN Hong-gui, ZHANG Jian, YUAN Jian-feng, et al. Research progress of biological preparation of gamma linoleic acids[J]. China Brewing, 2012, 31(2):12-16. |
| [18] | 杨 湄, 黄凤洪. 中国芝麻产业现状与存在问题、发展趋势与对策建议[J]. 中国油脂, 2009, 34(1):7-12. YANG Mei, HUANG Feng-hong. Situation, problem, development trend and suggestion of sesame industry in China[J]. China Oils and Fats, 2009, 34(1):7-12. |
| [19] | De Cnodder T, Vissenberg K, Van Der Straeten D, et al. Regulation of cell length in the Arabidopsis thaliana root by the ethylene precursor 1-aminocyclopropane-1-carboxylic acid:A matter of apoplastic reactions[J]. New Phytologist, 2005, 168(3):541-550. |
| [20] | 王学奎. 植物生理生化实验原理和技术[M]. 2版. 北京:高等教育出版社, 2006. WANG Xue-kui. Principles and techniques of plant physiological biochemical experiment[M]. 2nd Edition. Beijing:Higher Education Press, 2006. |
| [21] | Balasubramanian S, Viswanathan R. Influence of moisture content on physical properties of minor millets[J]. Journal of Food Science and Technology-Mysore, 2010, 47(3):279-284. |
| [22] | Zaidul I S M, Norulaini N N A, Omar A K M, et al. Supercritical carbon dioxide(SC-CO2) extraction and fractionation of palm kernel oil from palm kernel as cocoa butter replacers blend[J]. Journal of Food Engineering, 2006, 73(3):210-216. |
| [23] | Patterson W A, OLson J J. Effects of heavy metals on radical growth of selected woody species germinated on filter paper, mineral and organic soil substrates[J]. Canadian Journal of Forest Research, 1983, 13(2):233-238. |
| [24] | Xia Y, Qi Y, Yuan Y X, et al. Overexpression of Elsholtzia haichowensis metallothionein1(EhMT1) in tobacco plants enhances copper tolerance and accumulation in root cytoplasm and decreases hydrogen peroxide production[J]. Journal of Hazardous Materials, 2012, 233-234:65-71. |
| [25] | Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance[J]. Journal of Experimental Botany, 2002, 53(366):1-11. |
| [26] | Jouili H, Feriani E. Changes in antioxidant and lignifying enzyme activities in sunflower roots(Helianthus annuus L.) stressed with copper excess[J]. Comptes Rendus Biologies, 2003, 326(7):639-644. |
| [27] | Teisseire H, Guy V. Copper-induced changes in antioxidant enzymes activities in fronds of duckweed(Lemna minor)[J]. Plant Science, 2000, 153(1):65-72. |
| [28] | Strange J, Macnair M R. Evidence for a role for the cell-membrane in copper tolerance of Mimulus-guttatu Fischer ex DC[J]. New Phytologist, 1991, 119(3):383-388. |
| [29] | Clijsters H, Van Assche F. Inhibition of photosynthesis by heavy metals[J]. Photosynthesis Research, 1985, 7(1):31-40. |
| [30] | 储 玲, 刘登义, 王友保, 等. 铜污染对三叶草幼苗生长及活性氧代谢影响的研究[J]. 应用生态学报, 2004, 15(1):119-122. CHU Ling, LIU Deng-yi, WANG You-bao, et al. Effect of copper pollution on seedling growth and activate oxygen metabolism of Trifolium pretense[J]. Chinese Journal of Applied Ecology, 2004, 15(1):119-122. |
| [31] | Tapken W, Rave K, Pilon M. Plastocyanin controls the stabilization of the thylakoid Cu-transporting P-type ATPase PAA2/HMA8 in response to low copper in Arabidopsis[J]. The Journal of Biological Chemistry, 2012, 287(22):18544-18550. |
| [32] | Barón M, Arellano J B, Gorgé J L. Copper and photosystem Ⅱ:A controversial relationship[J]. Physiologia Plantarum, 1995, 94(1):174-180. |
| [33] | Hsu B D, Lee J Y. Toxic effects of copper on photosystem of spinach chloroplasts[J]. Plant Physiology, 1988, 87(1):116-119. |
| [34] | 焦 蓉, 刘好宝, 刘贯山, 等. 论脯氨酸累积与植物抗渗透胁迫[J]. 中国农学通报, 2011, 27(7):216-221. JIAO Rong, LIU Hao-bao, LIU Guan-shan, et al. Discussion of accumulation of proline and its relationship with osmotic stress tolerance of plants[J]. Chinese Agricultural Science Bulletin, 2011, 27(7):216-221. |
| [35] | Szabados L, Savouré A. Proline:A multifunctional amino acid[J]. Trends in Plant Science, 2010, 15(2):89-97. |
| [36] | Choudhary N L, Sairam R K, Tyagi A. Expression of Δ1-pyrroline-5-carboxylate synthetase gene during drought in rice(Oryza sativa L.)[J]. Indian Journal of Biochemistry & Biophysics, 2005, 42(6):366-370. |
| [37] | Pittman J K. Managing the manganese:molecular mechanisms of manganese transport and homeostasis[J]. New Phytologist, 2005, 167(3):733-742. |
| [38] | Clemens S. Molecular mechanisms of plant metal tolerance and homeostasis[J]. Planta, 2001, 212(4):475-486. |
| [39] | Bhatia N P, Walsh K B, Baker A J M. Detection and quantification of ligands involved in nickel detoxification in a herbaceous Ni hyperaccumulator Stackhousia tryonii Bailey[J]. Journal of Experimental Botany, 2005, 56(415):1343-1349. |
| [40] | Maketon W, Ogden K L. Synergistic effects of citric acid and polyeth-yleneimine to remove copper from aqueous solutions[J]. Chemosphere, 2009, 75(2):206-211. |
| [41] | Küpper H, Mijovilovich A, Meyer-Klaueke Wa, et al. Tissue and age-dependent differences in the complexation of cadmium and zinc in the cadmium/zinc hyperaccumulator Thlaspi caerulescens(Ganges ecotype) revealed by X-ray absorption spectroscopy[J]. Plant Physiology, 2004, 134(2):748-757. |
| [42] | Ma J F, Ueno D, Zhao F J, et al. Subcellular localization of Cd and Zn in the leaves of a Cd-hyperaccumulating ecotype of Thlaspi caerules-cens[J]. Planta, 2005, 220(5):731-736. |
| [43] | Salt D E, Prince R C, Baker A J M, et al. Raskin I and Pickering IJ. Zinc ligands in the metal hyperaccumulator Thlaspi caerulescens as determined using X-ray absorption spectroscopy[J]. Environmental Science & Technology, 1999b, 33(5):713-717. |
| [44] | Memon A R, Aktoprakligil D, Özdemir A, et al. Heavy metal accumulation and detoxification mechanisms in plants[J]. Turkey Journal of Botany, 2001, 25:111-121. |
| [45] | Monni S, Salemaa M, White C, et al. Copper resistance of Calluna vulgaris originating from the pollution gradient of a Cu-Nismelter, in southwest Finland[J]. Environment Pollution, 2000, 109(2):211-219. |
| [46] | Vardaka E, Cook C M, Lanaras T. Inter elemental relationship in the soil and plant tissue and photosynthesis of field cultivated wheat growing in naturally enriched copper soils[J]. Journal of Plant Nutrition, 1997, 20(4-5):441-453. |
| [47] | Nieminen T, Helmisaari H S. Nutrient retranslocation in the foliage of Pinus sylvestris L. growing along a heavy metal pollution gradient[J]. Tree Physiology, 1996, 16(10):825-831. |
| [48] | 周 燕, 张桂花, 徐迎春, 等. 铜对凤丹生长、生理及体内矿质元素吸收分配的影响[J]. 生态学杂志, 2011, 30(3):415-423. ZHOU Yan, ZHANG Gui-hua, XU Ying-chun, et al. Effects of Cu on Paeonia ostii growth, physiology, and element absorption and allocation[J]. Chinese Journal of Ecology, 2011, 30(3):415-423. |
| [49] | 陈彩虹, 刘治昆, 陈光才, 等. Cu胁迫对苏柳172和垂柳吸收矿质元素的影响[J]. 中南林业科技大学学报, 2011, 31(6):28-32. CHEN Cai-hong, LIU Zhi-kun, CHEN Guang-cai, et al. Effects of copper stress on uptake of mineral elements by Salix jiangsuensis CL J-172 and Salix babylonica Linn[J]. Journal of Central South University of Forestry & Technology, 2011, 31(6):28-32. |
 2015, Vol. 34
2015, Vol. 34