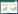文章信息
- 赵凌宇, 王延华, 杨浩, 王红, 徐美娜, 王丹
- ZHAO Ling-yu, WANG Yan-hua, YANG Hao, WANG Hong, XU Mei-na, WANG Dan
- 木屑和稻秆基生物质炭对汞的吸附特性比较
- Adsorption of Hg(Ⅱ) by Biochars Produced from Sawdust and Rice Straw
- 农业环境科学学报, 2015, 34(3): 556-562
- Journal of Agro-Environment Science, 2015, 34(3): 556-562
- http://dx.doi.org/10.11654/jaes.2015.03.019
-
文章历史
- 收稿日期:2014-10-30
2. 江苏省地理信息资源开发与利用协同创新中心, 南京 210023
2. Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China
汞是一种毒性很强的重金属,摄入量超过10 μg·L-1就会对生物体产生危害,环境中的汞主要来源于燃煤、混汞炼金、塑料及电子工业和氯碱工业[1],全球每年向环境中排放的汞量达4.4~7.5万t[2]。为了降低含汞废水毒性并符合安全排放标准,需要在其排放到环境中之前去除废水中的重金属。去除废水中汞的常见方法有沉淀、电解、离子交换、吸附、溶剂萃取和反渗透等方法[3,4,5],然而当溶液中汞浓度较低时这些方法存在去除率低,且费用昂贵等缺点,迫切需要发展废水中汞去除的新处理技术。
生物质炭是生物质在厌氧或者绝氧的条件下热解产生的含碳丰富的固体物质,制备生物质炭的原料主要是农业、林业及动物废弃物[6]。生物质炭来源广泛,制备简单,能够实现废弃物的循环利用,同时作为一种生物燃料,很容易对吸附重金属后的生物质炭进行后续处置。已有研究表明,生物质炭对重金属和有机污染物表现出了良好的吸附性能,例如鸡粪生物质炭对Cd的最大吸附量达到54.3 mg·g-1[7],稻秆秸秆炭对Pb和Cd的最大吸附量分别为126.58、60.61 mg·g-1[8]。由于生物质炭吸附汞的相关研究还不全面,对生物质炭吸附汞的吸附特性及吸附机理也有待进一步完善。目前各种生物材料对汞的去除已有一定研究,如Das等[9]研究表明花斑曲霉吸附汞的主要机制是官能团之间的络合;Killc等[10]发现活化的污泥生物质吸附汞的过程中释放了大量的碱性金属离子(Ca2+、Na+和K+),说明吸附过程中涉及离子交换机制。木屑和稻秆是林业、农业废弃物,焚烧秸秆既浪费资源又污染环境,本研究将其热解制备的生物质炭作为生物吸附剂去除模拟废水中的Hg(Ⅱ),以期为工业废水中汞的去除以及汞污染土壤修复提供数据支持和试验方法参考。 1 材料和方法 1.1 生物质炭的制备
生物质炭的制备:以木屑、稻秆为原材料制备生物质炭(分别记为MX、DG)。将原材料烘干、粉碎、过20目筛,于60 ℃下烘干24 h,之后取适量的生物质粉末于100 mL的陶瓷坩埚中,轻轻压实后盖上盖子,将坩埚放入马弗炉(SG-XL1200,上海)中,600 ℃裂解4 h。冷却至室温后取出,磨细过60目筛备用。 1.2 生物质炭理化性质的测定
(1)pH值:将0.5 g生物质炭样品置于50 mL的离心管中,加入12.5 mL的去离子水,混匀,在25 ℃下振荡24 h,用pH计(SevenCompact S220K,瑞士)测定浑浊液pH值,每个样品平行测定2次。
(2)酸性官能团:采用Boehm滴定法[11]测定,称取1 g生物质炭于40 mL水中,用1∶1(体积比)HCl调节pH值至5,放置7 d,烘干待测。准确称取3份0.1 g此生物质炭于50 mL离心管中,分别加入10 mL 浓度为0.05 mol·L-1的NaHCO3、Na2CO3、NaOH溶液。在25 ℃下振荡24 h,过0.45 μm滤膜得5 mL滤液,加入10 mL浓度为0.05 mol·L-1的HCl预酸化,用0.05 mol·L-1 NaOH滴定,滴定终点pH为7,并计算生物质炭酸性官能团的量。
(3)扫描电镜(SEM-EDS):取10 mg生物质炭样品黏于样品台上,在扫描电镜(JSM-5610LV,日本)上观察形貌特征和X光微区分析。
(4)红外光谱(FTIR):将0.01 g生物质炭与KBr混合,压片制样,用傅立叶变换红外光谱联用仪(NEXUS670,美国)测定吸附Hg(Ⅱ)前后生物质炭的红外光谱,扫描波数范围为20~4500 cm-1,分辨率0.09 cm-1,波数精度0.01 cm-1。
(5)Hg(Ⅱ)浓度:用2.5%NaBH4和0.8%NaOH作为还原剂,冷原子吸收光谱仪(PerkinElmer AA800,美国)测定。 1.3 Hg(Ⅱ)的吸附试验
为研究pH值对生物质炭吸附Hg(Ⅱ)的影响,用HNO3和NaOH将初始溶液pH值分别调至2~8,在Hg(Ⅱ)的浓度为15 mg·L-1,生物质炭的投加量为4 g·L-1,温度为25 ℃的条件下,振荡24 h。为研究生物质炭的投加量对吸附的影响,在最佳pH值,Hg(Ⅱ)的浓度为15 mg·L-1,温度为25 ℃的条件下,分别加入0.2~12 g·L-1的生物质炭,振荡吸附24 h;之后,3000 r·min-1离心10 min,过0.45 μm滤膜得吸附平衡液。测定平衡液中的Hg(Ⅱ)浓度,以此来确定吸附最佳pH值以及生物质炭投加量。
等温吸附试验:称取0.06 g生物质炭于50 mL塑料离心管中,加入20 mL不同浓度的Hg(Ⅱ)标液,用HNO3和NaOH调至pH值为5,在25 ℃下振荡4 h。吸附之后,3000 r·min-1离心10 min,过0.45 μm滤膜得吸附平衡液,测定其中的Hg(Ⅱ)浓度。
动力学吸附试验:取0.06 g生物质炭于50 mL塑料离心管中,加入20 mL Hg(Ⅱ)标液(15 mg·L-1),用HNO3和NaOH将悬液调至pH值为5,在25 ℃下振荡,于反应进行10、20、30、40、50、60、90、120、180、240、480、960、2440 min时分别取样,3000 r·min-1离心10 min,过0.45 μm滤膜得吸附平衡液,测定平衡液中Hg(Ⅱ)浓度。 2 结果与讨论 2.1 pH值对生物质炭吸附Hg(Ⅱ)的影响
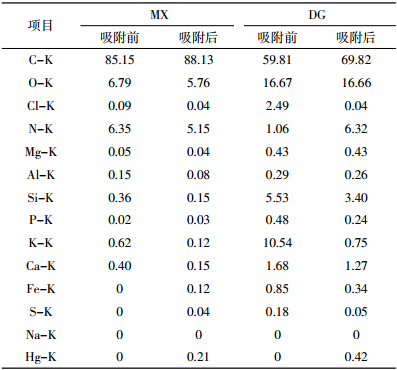
pH值是影响重金属吸附过程的重要因素,溶液初始pH值会影响金属离子的形态和吸附剂表面官能团的电离状态[12]。pH值变化对两种生物质炭吸附Hg(Ⅱ)的影响如图 1所示,在测定的pH值范围内,汞的去除率随着pH值的增大而增大,在pH值为5时达到最大值,随后去除率呈下降的趋势,因此本研究吸附试验均在pH值为5的条件下进行。
在较低的pH条件下,溶液中大量的质子使吸附剂表面活性位点质子化,对Hg(Ⅱ)产生静电排斥而导致去除率较低。随着pH值增加,活性位点的去质子化导致吸附剂表面的负电荷密度增加,可以结合更多的正电荷,H+的竞争能力减弱[12]。不同于其他金属(如Cd和Pb)以自由离子的形态存在于溶液中,汞以中性盐的形态存在,主要为HgCl2、HgClOH、Hg(OH)2,因此吸附剂表面正电荷的减少是吸附能力增加的主要原因[13]。当pH<4.5时,汞溶液中主要是可溶性HgCl2;随着pH值增加,水解作用使得HgClOH和Hg(OH)2增加,由于HgClOH比HgCl2更容易被吸附[14],使吸附量随pH值的增加而变大;而当pH>7时,溶液中以Hg(OH)2为主,OH-会占据吸附剂的吸附位点[15],减少Hg(Ⅱ)的吸附。
另外,吸附剂表面的主要官能团的离子化状态也与汞的去除有关。从图 1中我们可以发现,当pH较高时,生物质炭对汞的去除率也较强。这可能与羧基的去质子化有关,使得汞化合物更容易被去除,已有研究证实吸附剂表面的羧化物会和中性汞化合物相互作用[16]。
|
| 图 1 pH值对生物质炭吸附Hg(Ⅱ)的影响 Figure 1 Effect of solution pH on sorption of Hg(Ⅱ) by two biochars |
值得注意的是,稻秆生物质炭在强酸条件下仍对Hg(Ⅱ)有较强的去除率,可能与稻秆生物质炭的可氧化官能团使金属还原有关[15]。这对应用于酸性废水如矿山废水中汞的去除具有重要的意义。 2.2 生物质炭投加量对吸附的影响
Hg(Ⅱ)的去除率随着生物质炭投加量的增加而加强(图 2)。木屑和稻秆两种生物质炭在投加量为0.2~1 g·L-1时,汞的去除率呈线性增加,分别为63.13%~89.81%和51.87%~89.20%。其原因可能是当投加量较低时,生物质炭表面少量的吸附位点与金属离子结合呈现饱和,溶液中剩余的金属离子较多[17]。随着生物质炭质量浓度的增加,吸附表面积增加,提供了更多的吸附位点,使Hg(Ⅱ)更容易渗透入吸附位点。当木屑和稻秆生物质炭的投加量为3 g·L-1时,汞去除率达到97%以上,基本达到吸附饱和[19]。

|
| 图 2 生物质炭投加量对吸附的影响 Figure 2 Effects of biochar rates on Hg(Ⅱ) adsorption |
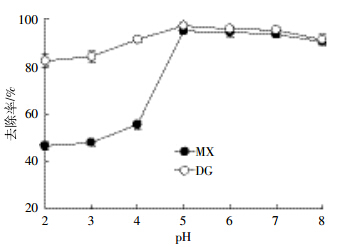
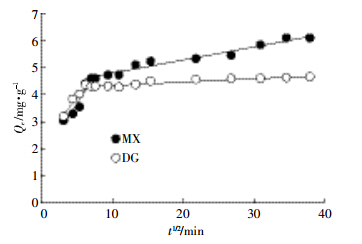
由生物质炭对Hg(Ⅱ)吸附动力学曲线可知(图 3),吸附过程可以分为快速吸附和慢速吸附两个阶段,木屑和稻秆生物质炭对Hg(Ⅱ)的吸附速率在反应开始40 min内增幅比较大,之后趋于平缓,分别在反应进行12 h和4 h后吸附量达到最大并趋于平衡。初始阶段,由于生物质炭表面吸附位点较多,Hg(Ⅱ)能与其吸附位点快速结合,且吸附主要发生在外表面上,故吸附量迅速增大[19];随着吸附的进行,Hg(Ⅱ)逐渐进入生物质炭孔隙中,Hg(Ⅱ)在孔隙中的传质速度相对较慢,同时由于固液相对Hg(Ⅱ)的排斥,Hg(Ⅱ)将会很难与剩余的吸附位点结合,因此吸附速率增加缓慢,逐渐达到吸附平衡。两种生物质炭对Hg(Ⅱ)吸附的快慢及达到平衡时间有较大差异,可能与不同原料的生物质炭具有不一样的微孔结构和表面性质有关。木屑生物质炭对溶液中Hg(Ⅱ)的吸附是较慢的动力学过程,可能是因为Hg(Ⅱ)扩散至木屑基质较慢[20]。
|
| 图 3 吸附时间对生物质炭吸附Hg(Ⅱ)的影响 Figure 3 Effect of contact time on adsorption of Hg(Ⅱ) by biochars |
吸附等温线对于描述吸附质和吸附剂之间的相互作用至关重要,用来反映吸附剂对吸附质亲和力强弱。本研究采用Langmuir和Freundlich等温吸附模型分析生物质炭对Hg(Ⅱ)的吸附过程,其表达式分别为公式(1)和公式(2)。
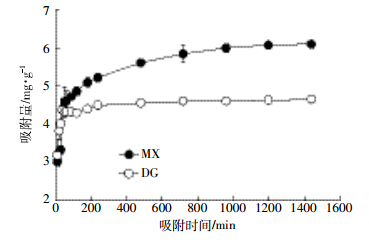
式中:Qe为平衡吸附量,mg·g-1;Ce为平衡液中重金属的浓度,mg·L-1;KL为吸附常数;Qm是单分子层的饱和吸附容量,mg·g-1;Kf为Freundlich吸附容量的参数;n是关于吸附强度的经验参数,其值由材料的异质性改变。两种生物质炭对Hg(Ⅱ)的等温吸附线如图 4,从等温线的形状上看,MX和DG生物质炭的等温线符合BDDT分类中的Ⅰ型等温线,因此选择常用的Langmuir和Freundlich方程进行拟合。两种方程拟合的参数和相关系数见表 1。Langmuir方程能很好地描述两种生物质炭对Hg(Ⅱ)溶液的吸附行为,说明这两种生物质炭对Hg(Ⅱ)的吸附过程以单层吸附为主,以吸附剂表面的官能团为吸附位点[12];Langmuir方程拟合结果表明,MX的最大吸附量为60.2 mg·g-1,高于稻秆生物质炭的吸附量。通过Boehm滴定法得出MX、DG生物质炭总酸性基团量分别为1.25、0.64 mmol·g-1,较高的酸性官能团总量可能是导致MX最大吸附量较强的原因之一,同时还可能与生物质炭的去质子化状态有关[21]。Freundlich方程拟合的相关性系数分别为0.924和0.926,同种吸附剂的拟合结果均低于Langmuir方程。
|
| 图 4 生物质炭对Hg(Ⅱ)的等温吸附线 Figure 4 Isotherms of Hg(Ⅱ) adsorption by biochars |
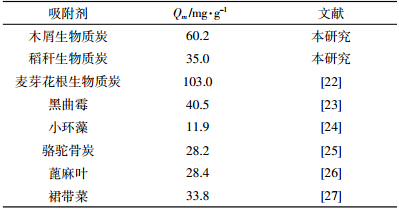
表 2将本研究所选的生物质炭吸附Hg(Ⅱ)的能力与其他生物吸附剂进行比较,发现生物质炭对Hg(Ⅱ)的最大吸附量高于大多数的生物材料,因而将生物质炭应用于废水中Hg(Ⅱ)的去除具有非常重要的意义。
 |
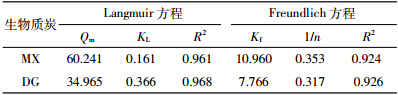
吸附过程的动力学研究主要用来描述吸附剂吸附溶质的速率快慢,通过动力学模型对数据进行拟合,从而探讨两种生物质炭对Hg(Ⅱ)的吸附机制[28]。应用准一级、假二阶动力学方程模拟吸附动力学过程,方程线性形式如下:
式中:Qe为平衡吸附量,mg·g-1;Qt是t时刻的吸附量,mg·g-1;k1为一阶吸附动力学平衡常数,min-1;k2为一级吸附动力学平衡常数,g·mg-1·min-1。由表 3可知,试验得出的吸附量与准一级动力学方程拟合曲线计算得到的吸附量相差较大,且相关性不好,因此不能用准一级方程来描述两种生物质炭对Hg(Ⅱ)的吸附。这可能和准一级模型的局限性有关,通常只适合用来描述吸附初始阶段的动力学,而不能准确地描述吸附的全过程[29]。由假二阶动力学方程拟合结果(表 3)可知,理论吸附值和计算得到的吸附值非常接近,且两种生物质炭的相关性系数(R2)均接近1,因此本实验采用的两种生物质炭对Hg(Ⅱ)的吸附均符合假二阶动力学方程。这说明化学吸附是整个吸附过程中的一个重要限速步骤[30]。
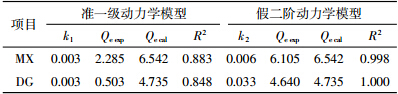
Hg(Ⅱ)从液相主体移至生物质炭颗粒表面的过程可分为3个阶段:Hg(Ⅱ)经液膜扩散至生物质炭表面;Hg(Ⅱ)由表面向生物质炭内部扩散;Hg(Ⅱ)在生物质炭活性位点发生化学反应。一般来说,第三阶段吸附速度很快,吸附质会迅速在活性位点上达到吸附平衡,因此扩散速率快慢取决于膜扩散和颗粒内扩散。为确定生物质炭吸附Hg(Ⅱ)过程中吸附速率的限速步骤,本文采用Weber-Morris颗粒内扩散方程来分析两种生物质炭吸附Hg(Ⅱ)的动力学过程,公式如下:
式中:Qt是t时刻的吸附量,mg·g-1;t为反应时间,min;Kw为内扩散速率常数,mg·g-1·min-0.5;截距I反映边界层效应,mg·g-1。MX和DG两种生物质炭吸附Hg(Ⅱ)的Weber-Morris曲线如图 5,拟合得出的方程参数见表 4。Weber-Morris曲线分为两个线性阶段,两种生物质炭对应的拟合线均未通过原点,说明粒子内扩散不是唯一的限速步骤,膜扩散在整个吸附过程中起着重要的作用。MX和DG两种生物质炭吸附Hg(Ⅱ)过程中第二阶段的吸附速率常数远低于第一阶段,这就可以解释初始阶段吸附速率较快。同时发现Weber-Morris方程对DG生物质炭吸附Hg(Ⅱ)拟合线性方程的截距I均高于MX生物质炭,边界层厚度大,说明膜扩散对DG生物质炭吸附Hg(Ⅱ)的吸附速率的影响更大。
|
| 图 5 颗粒内扩散方程拟合曲线 Figure 5 Plots of intra-particle diffusion equation for Hg(Ⅱ)adsorption by biochars |
两种生物质炭的表面形态如图 6,MX和DG两种生物质炭表面形态有很大差别,DG是长度超过50 μm的多层结构物,孔隙较少,而MX具有丰富的孔隙结构,这可能是木屑生物质炭对Hg(Ⅱ)的最大吸附量高于稻秆生物质炭的主要原因之一。生物质炭表面结构的特征可能是导致它们比表面积及吸附特性差异的主要原因。

|
| 图 6 生物质炭的表面形态 Figure 6 Scanning electron micrograph of biochars |
EDS分析表明(表 5),吸附之后所有生物质炭的能谱上均出现了汞峰,从而证实生物质炭已有效吸附了一定量的汞。从谱图中还可以发现吸附之后生物质炭上K+、Ca2+、Mg2+的含量均减少,说明吸附过程中吸附剂释放出大量的碱性金属离子。该现象与Mehmet等[31]研究结果一致,说明吸附过程中离子交换机制导致了吸附剂的碱性金属离子进入到溶液中。
生物质炭吸附溶液中Hg(Ⅱ)还可能涉及的吸附机制:一是还原作用,Shilpi等[32]研究表明木质纤维素材料对Hg(Ⅱ)的吸附过程中Hg(Ⅱ)被还原为Hg(0),木质纤维素材料包含了大量酚官能团,有较强的还原金属的能力;二是络合作用,生物质炭含有芳香基、羟基和一些含氧官能团,吸附过程中生物质炭的羟基和羧基与重金属离子发生了反应,羧基和羟基官能团去质子化导致生物质炭表面净负电荷,可以吸引更多的金属离子到吸附剂表面[33]。下面的反应式[32]可以用来解释生物质炭表面官能团吸附Hg(Ⅱ):
2(-COOH)+ Hg2+ →(-COO)2-Hg + 2H+
2(-OH)+ Hg2+ →(-O)2-Hg + 2H+ 3 结论
(1)木屑和稻秆生物质炭吸附Hg(Ⅱ)的最佳条件为:汞溶液初始浓度为15 mg·L-1,pH值均为5,投加量均为3 g·L-1,木屑和稻秆炭对Hg(Ⅱ)的去除率达到95%以上;木屑和稻秆炭吸附Hg(Ⅱ)分别在反应进行的12 h和4 h达到平衡,木屑对溶液中Hg(Ⅱ)的吸附相对较慢。
(2)Langmuir等温线方程很好地描述了木屑和稻秆生物质炭吸附Hg(Ⅱ)的过程,木屑炭吸附Hg(Ⅱ)的能力强于稻秆炭。两种生物质炭对Hg(Ⅱ)的吸附动力学过程符合准二级动力学模型,两种生物质炭的吸附过程受内扩散和膜扩散共同控制。
(3)SEM-EDS分析结果表明,吸附之后所有生物质炭的能谱上均出现了汞峰,K+、Ca2+、Mg2+的含量却相应减少,说明存在离子交换作用。同时生物质炭对Hg(Ⅱ)的吸附机制可能涉及还原作用和生物质炭羟基和羧基与汞的络合作用,对此还有待进一步验证。
| [1] | 孙阳昭, 陈 扬, 蓝 虹, 等. 中国汞污染的来源、成因及控制技术路径分析[J]. 环境化学, 2013(6):937-942. SUN Yang-zhao, CHEN Yang, LAN Hong, et al. Study on pollution sources, cause of mercury pollution and its control technical roadmap in China[J]. Environmental Chemistry, 2013, (6):937-942. |
| [2] | 张荣斌. 工业废水中汞的处理技术[J]. 山东化工, 2007(6):17-22. ZHANG Rong-bin. The Technology in treatment of mercury-containing industrial sewage[J]. Shandong Chemical Industry, 2007(6):17-22. |
| [3] | 魏扬城, 周志红, 何志强, 等. 反渗透水处理设备在污水处理中的应用[J]. 中国卫生工程学, 2005, 4(4):246-248. WEI Yang-cheng, ZHOU Zhi-hong, HE Zhi-qiang, et al. Application of reverse osmosis water treatment equipments on sewage disposal[J]. Chinese Journal of Public Health Engineering, 2005, 4(4):246-248. |
| [4] | Melamed R, Da Luz A B. Efficiency of industrial minerals on the removal of mercury species from liquid effluents[J]. Science of the Total Environment, 2006, 368(1):403-406. |
| [5] | Zhang F S, Nriagu J O, Itoh H. Mercury removal from water using activated carbons derived from organic sewage sludge[J]. Water Research, 2005, 39(2-3):389-395. |
| [6] | 袁金华, 徐仁扣. 生物质炭的性质及其对土壤环境功能影响的研究进展[J]. 生态环境学报, 2011, 20(4):779-785. YUAN Jin-hua, XU Ren-kou. Progress of the research on the properties of biochars and their influence on soil environmental functions[J]. Ecology and Environment, 2011, 20(4):779-785. |
| [7] | 徐义亮. 生物炭的制备热动力学特性及其对镉的吸附性能和机理[D]. 杭州:浙江大学, 2013:45-50. XU Yi-liang. Thermodynamic properties of biochar preparation and sorption characteristics and mechanisms of cadmium onto biochars[D]. Hangzhou:Zhejiang University, 2013:45-50. |
| [8] | 戴 静, 刘阳生. 四种原料热解产生的生物炭对Pb2+和Cd2+的吸附特性研究[J]. 北京大学学报(自然科学版), 2013, 49(6):1075-1082. DAI Jing, LIU Yang-sheng. Adsorption of Pb2+ and Cd2+ onto biochars derived from pyrolysis of four kinds of biomasses[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2013, 49(6):1075-1082. |
| [9] | Das S K, Das A R, Guha A K. A study on the adsorption mechanism of mercury on Aspergillus versicolor biomass[J]. Environmental Science & Technology, 2007, 41(24):8281-8287. |
| [10] | Kilic M, Keskin M E, Mazlum S, et al. Hg(Ⅱ) and Pb(Ⅱ) adsorption on activated sludge biomass:Effective biosorption mechanism[J]. International Journal of Mineral Processing, 2008, 87(1-2):1-8. |
| [11] | 毛 磊, 童仕唐, 王 宇. 对用于活性炭表面含氧官能团分析的Boehm滴定法的几点讨论[J]. 炭素技术, 2011, 30(2):17-19. MAO Lei, TONG Shi-tang, WANG Yu. Discussion on the Boehm titration method used in analysis of surface oxygen functional groups on activated carbon[J]. Carbon Techniques, 2011, 30(2):17-19. |
| [12] | Sari A, Tuzen M. Removal of mercury(Ⅱ) from aqueous solution using moss(Drepanocladus revolvens) biomass:Equilibrium, thermodynamic and kinetic studies[J]. Journal of Hazardous Materials, 2009, 171(1-3):500-507. |
| [13] | Anagnostopoulos V A, Manariotis I D, Karapanagioti H K, et al. Removal of mercury from aqueous solutions by malt spent rootlets[J]. Chemical Engineering Journal, 2012, 213:135-141. |
| [14] | Knocke W R, Hemphill L H. Mercury(Ⅱ) sorption by waste rubber[J]. Water Research, 1981, 15(2):275-282. |
| [15] | Carro L, Anagnostopoulos V, Lodeiro P, et al. A dynamic proof of mercury elimination from solution through a combined sorption -reduction process[J]. Bioresource Technology, 2010, 101(23):8969-8974. |
| [16] | Herrero R, Lodeiro P, Rey-Castro C, et al. Removal of inorganic mercury from aqueous solutions by biomass of the marine macroalga Cystoseira baccata[J]. Water Research, 2005, 39(14):3199-3210. |
| [17] | Shao W J, Chen L H, Lu L L, et al. Removal of lead(Ⅱ) from aqueous solution by a new biosorption material by immobilizing Cyanex272 in cornstalks[J]. Desalination, 2011, 265(1-3):177-183. |
| [18] | Karthikeyan S, Balasubramanian R, Yer C. Evaluation of the marine algae Ulva fasciata and Sargassum sp. for the biosorption of Cu(Ⅱ) from aqueous solutions[J]. Bioresource Technology, 2007, 98(2):452-455. |
| [19] | Aslam M, Rais S, Alam M, et al. Adsorption of Hg(Ⅱ) from aqueous solution using Adulsa(Justicia adhatoda) leaves powder:Kinetic and equilibrium studies[J]. Journal of Chemistry, 2013(174807). |
| [20] | Kargi F, Cikla S. Zinc(Ⅱ) ion recovery by biosorption onto powdered waste sludge(PWS):Effects of operating conditions[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(10):1661-1668. |
| [21] | Carro L, Herrero R, Barriada J L, et al. Mercury removal:A physicochemical study of metal interaction with natural materials[J]. Journal of Chemical Technology and Biotechnology, 2009, 84(11):1688-1696. |
| [22] | Boutsika L G, Karapanagioti H K, Manariotis I D. Aqueous mercury sorption by biochar from malt spent rootlets[J]. Water, Air & Soil Pollution, 2014, 225(11): 1805. |
| [23] | Khambhaty Y, Mody K, Basha S, et al. Hg(Ⅱ) removal from aqueous solution by dead fungal biomass of marine Aspergillus niger:Kinetic studies[J]. Separation Science and Technology, 2008, 43(5):1221-1238. |
| [24] | Schmitt D, Muller A, Csogor Z, et al. The adsorption kinetics of metal ions onto different microalgae and siliceous earth[J]. Water Research, 2001, 35(3):779-785. |
| [25] | Hassan S, Awwad N S, Aboterika A. Removal of mercury(Ⅱ) from wastewater using camel bone charcoal[J]. Journal of Hazardous Materials, 2008, 154(1-3):992-997. |
| [26] | Al Rmalli S W, Dahmani A A, Abuein M M, et al. Biosorption of mercury from aqueous solutions by powdered leaves of castor tree(Ricinus communis L.)[J]. Journal of Hazardous Materials, 2008, 152(3):955-959. |
| [27] | Plaza J, Viera M, Donati E, et al. Biosorption of mercury by Macrocystis pyrifera and Undaria pinnatifida:Influence of zinc, cadmium and nickel[J]. Journal of Environmental Sciences-China, 2011, 23(11):1778-1786. |
| [28] | 李坤权, 郑正, 蒋剑春, 等. 铅在棉秆基活性炭上的吸附动力学与热力学[J]. 环境科学, 2010, 31(5):1402-1408. LI Kun-quan, ZHENG Zheng, JIANG Jian-chun, et al. Adsorption kinetic and thermodynamic studies of lead onto activated carbons from cotton stalk[J]. Chinese Journal of Environmental Science, 2010, 31(5):1402-1408. |
| [29] | 丁世敏, 封享华, 汪玉庭, 等. 交联壳聚糖多孔微球对染料的吸附平衡及吸附动力学分析[J]. 分析科学学报, 2005, 51(2):127-130. DING Shi-min, FENG Xiang-hua, WANG Yu-ting, et al. Equilibrium and Kinetic analysis of adsorption for dyestuff by cross-linked chitosan porous microbeads[J]. Journal of Analytical Science, 2005, 51(2):127-130. |
| [30] | Ozacar M, Sengili A. Adsorption of reactive dyes on calcined alunite from aqueous solutions[J]. Journal of Hazardous Materials, 2003, 98(1-3):211-224. |
| [31] | Kilic M, Keskin M E, Mazlum S, et al. Hg(Ⅱ) and Pb(Ⅱ) adsorption on activated sludge biomass:Effective biosorption mechanism[J]. International Journal of Mineral Processing, 2008, 87(1-2):1-8. |
| [32] | Kushwaha S, Sreedhar B, Sudhakar P P. Adsorption of Hg2+ onto Borassus flabellifer:A redox mechanism[J]. Chemical Engineering Journal, 2012, 193-194:328-338. |
| [33] | Das S K, Das A R, Guha A K. A Study on the adsorption mechanism of mercury on Aspergillus versicolor biomass[J]. Environmental Science & Technology, 2007, 41(24):8281-8287. |
 2015, Vol. 34
2015, Vol. 34