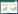文章信息
- 李志波, 宋超, 张聪, 范立民, 陈家长
- LI Zhi-bo, SONG Chao, ZHANG Cong, FAN Li-min, CHEN Jia-zhang
- 养殖池塘底泥中重金属镉对孔雀石绿代谢的影响
- Effect of Cadmium on Degradation of Malachite Green in Sediment from an Aquaculture Pond
- 农业环境科学学报, 2015, 34(3): 563-569
- Journal of Agro-Environment Science, 2015, 34(3): 563-569
- http://dx.doi.org/10.11654/jaes.2015.03.020
-
文章历史
- 收稿日期:2014-10-04
2. 中国水产科学研究院淡水渔业研究中心 中国水产科学研究院内陆渔业生态环境和资源重点开放实验室, 江苏 无锡 214081
2. Key Laboratory of Ecological Environment and Resources of Inland Fisheries Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
目前,国内外严重的环境污染态势不仅表现在污染物的种类及含量的多量化上,还表现在污染载体受多重物质复合污染的复杂化上。工农业污染物的排放和转移很大程度上是以水为载体的,而在水体环境中,难降解的污染物会向固相化转移,水体沉积物则成了这类物质的主要归趋。重金属和难分解的有机物是目前各类环境的主要污染物来源之一,而这两类物质的化学形态都比较稳定,它们易于共同沉降和吸附于底泥而形成复合污染[1,2]。据报道,美国近40%的污染为重金属与有机物复合型污染[3],我国的这类复合污染状况也十分突出。在重金属和有机物的这类复合污染中,多数重金属的半衰期长,在很长时间内都难以消失,而许多重金属具有一定的生物毒性以及金属离子化学特性,会通过化学络合作用以及改变微生物属性等的方式对有机物的降解产生抑制或促进的影响,这就使得复合型污染比非复合污染的环境行为更为复杂化[4]。
孔雀石绿(MG)在工业上广泛用作化工染料,也曾是一类杀菌作用效果很好的渔用药物。但MG及其代谢产物无色孔雀石绿(LMG)在生物体中具有高毒、高残留和“三致”(致畸、致癌、致突变)的危害[6]。MG对环境的污染主要来自于工业残留排放。另外,在池塘养殖中由于MG的抗菌效果好、价格便宜且在水霉病防治方面尚无很好的替代品,同时对MG又缺乏有效的监督管理,目前仍有不少单位和养殖户在违规使用,使其成为池塘等小水体MG污染的另一重要来源。目前,国内外有关水体、土壤等环境及生物载体中MG的研究主要集中在MG的毒性机理、检测手段及降解方法上,有关MG在水体及底泥中的具体降解过程及降解过程与环境因子的关系方面的报道则很少见。研究环境中MG在各类环境条件下的降解机制、MG在与重金属等复合污染后的降解效果,对解决环境中长期存在的MG残留及突发的孔雀石绿污染问题很有帮助。
工业化的快速发展引起了不同程度镉污染的普遍存在。在汞、镉、铅、铬、砷等生物毒性显著元素的重金属污染物中,镉以移动性大、毒性高、污染面积最大被称为“ 五毒之首”而成为最受关注的元素。在水体中,悬浮物和沉积物对镉有很好的吸附能力,使得悬浮物和沉积物中镉的含量可以达到水体总镉量的90%以上[5]。底泥载体对MG吸附性强,而MG、LMG在底泥环境中的降解比在水体中更慢[7],因此在水体沉积物中重金属Cd和MG形成的复合污染会在一定程度上发生。本实验采集水产养殖池塘底泥作为环境载体,对其进行重金属Cd和MG的复合污染,测定和分析底泥培养过程中MG及LMG的含量变化,以期为了解和把握池塘等水体底泥中重金属对孔雀石绿降解过程产生的影响和作用机制提供资料。 1 材料和方法 1.1 实验材料
隐色孔雀石绿标准品(Dr. Ehrenstorfer,纯度 98.5%),孔雀石绿标准品(Dr. Ehrenstorfer,纯度 95.0%),乙腈、二氯甲烷(CNW,HPLC级),乙酸铵(CNW,纯度98.0%),氯化镉(上海金山亭新化工试剂厂,分析纯)。无机盐培养基(配方见表 1)[8]。
MG、LMG以Agilent 1100 series高效液相色谱仪(美国安捷伦公司)检测;Cd以WFX-210原子吸收分光光度计(北京北分瑞利公司)检测。 底泥样品于2014年5月20日采自中国水产科学研究院淡水渔业研究中心南泉养殖基地罗非鱼亲本繁育池塘(表层0~10 cm,无菌袋装好,-20 ℃ 冷冻保存)。采样池塘的主要水质指标值及底泥理化指标百分含量分别见表 2、表 3。
氯化镉溶液(a):0.203 2 g CdCl2(=0.1 g Cd)溶于水,定容至100 mL;孔雀石绿溶液(b):0.046 8 g溶于乙腈,定容至100 mL。氯化镉溶液(a1):10 mL a液以水稀释10倍;孔雀石绿溶液(b1):10 mL b液以乙腈稀释10倍。 1.2.2 加样
灭菌干净的三角瓶27个,分为9组,每组3个平行。分别加入40 g沉积物+40 mL无机盐培养基。第1组设为对照组,第2至第9组分别加入0.25 mg·kg-1 MG(0.427 35 mL b1液)、2.5 mg·kg-1 MG(0.427 35 mL b液)、0.5 mg·kg-1 Cd(0.4 mL a1液)、5 mg·kg-1 Cd(0.4 mLa液)、0.25 mg·kg-1 MG+0.5 mg·kg-1 Cd、0.25 mg·kg-1 MG+5 mg·kg-1 Cd、2.5 mg·kg-1 MG+0.5 mg·kg-1 Cd、2.5 mg·kg-1 MG+5 mg·kg-1 Cd。 1.2.3 培养及取样
三角瓶用铝箔纸盖好,放入恒温振荡培养箱中于30 ℃、120 r·min-1黑暗条件下培养。培养过程中定期加水以补充蒸发的水分量(加水量=前次采样后瓶及瓶内物总质量-当次采样前瓶及瓶内物总质量)。分别于第1、7、17、35 d采样0.5、3.2 g左右泥样分置10、50 mL离心管中,-65 ℃ 下保存。 1.3 样品前处理方法
MG、LMG测定样品前处理方法(参照孙言春等[9]的底泥样品前处理方法):向取好底泥样的50 mL离心管中,加入乙腈10 mL,先后旋涡1 min,超声提取20 min,静置10 min。再加入6.67 mL二氯甲烷,旋涡2 min,于5000 r·min-1离心3 min后,把上层液体全部取出置于旋转蒸发瓶(可直接倒入)。再向离心管中加入3 mL乙腈和2 mL二氯甲烷,旋涡2 min后5000 r·min-1离心3 min,上层液体合并入蒸发瓶。45 ℃下旋转蒸干,向蒸发瓶中加入1 mL流动相(乙腈∶乙酸铵溶液=8∶2),并旋涡振荡1 min,充分与瓶壁接触以便较完全溶解提取物,所得液体以0.22 μm有机相注射器滤头过滤至样瓶中,待上机检测。
重金属测定样品前处理方法(参照马奇英课题组EPA法测定土壤中重金属):把10 mL离心管里的底泥样全部加入消煮管,加入硝酸(1∶1)10 mL,于105 ℃下消煮约5 h至硝酸剩1~2 mL,冷却;加入0.5 mL双氧水,105 ℃加热15 min,冷却后再次加入0.5 mL双氧水,重复上述操作。定容至25 mL,过滤,待上机检测。 1.4 样品检测方法
参照叶四化研究的高效液相色谱双波长法同时测定水产品中孔雀石绿和隐性孔雀石绿的方法[10]。紫外检测器下MG、LMG的最大吸收波长分别为620、260 nm。本实验采用的高效液相色谱机器紫外吸收波长范围为200~600 nm,因此选择260 nm紫外吸收波长检测LMG,选择吸收值较大的600 nm紫外波长检测MG。高效液相色谱检测条件:色谱柱CNW Athena C18-wp,5 μm,4.6 mm×250 mm;流动相为乙腈∶0.125 mol·L-1乙酸铵=80∶20(9.64 g乙酸铵溶解于水,定容至1000 mL,冰乙酸调pH=4.5);流速1 mL·min-1;柱温35 ℃。
原子吸收分光光度计下,对照组及0.5 mg·kg-1 Cd实验组采用石墨炉法,5.0 mg·kg-1实验组采用火焰法测定Cd含量。 1.5 数据处理方法
实验数据表示为平均值±标准差。利用Excel进行数据输入及方程拟合。利用GraphPad Prism 5作图。 2 结果及分析 2.1 孔雀石绿和隐性孔雀石绿标样检测结果
MG、LMG高效液相色谱检测结果见图 1(以1 mg·kg-1为例)。MG及LMG标样的测定结果见表 4。MG、LMG工作曲线的相关系数分别为0.999 2、0.999 9,表明线性关系良好。0.2、2.0 mg·kg-1 MG底泥加标的回收率平均值分别达到77.3%、83.8%,LMG的回收率平均值分别为84.9%、 81.9%,同时各回收率的标准偏差都较小(<8.0%),表明该方法对底泥中MG、LMG的检测具有较高的准确性。
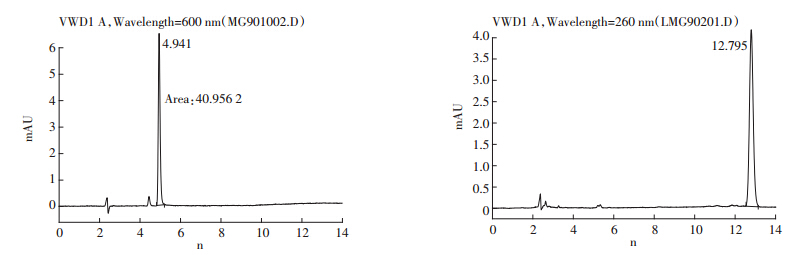
|
| 图 1 1 mg·kg-1 MG、1 mg·kg-1 LMG高效液相色谱检测结果 Figure 1 HPLC results of 1 mg·kg-1 MG and 1 mg·kg-1 LMG |
实验中对各取样时间点各组的重金属Cd含量进行了测定,结果如图 2。
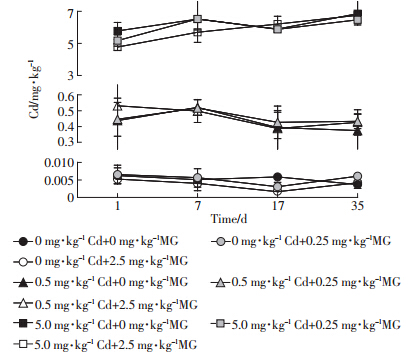
|
| 图 2 实验过程中Cd含量 Figure 2 Dynamics of cadmium contents during experiment |
各实验组在整个实验过程中Cd含量大体维持不变,在后续对MG及LMG含量变化过程的分析中,可视为各实验组对应Cd含量在整个实验过程中保持不变。经检测,本实验所用底泥材料中重金属Cd的基底含量约为0.006 mg·kg-1(对照组含量),低于我国土壤Cd背景值(我国41个土类Cd含量范围为0.017~0.332 mg·kg-1[11]),其原因在于池塘上层底泥为新形成的土类层面,尚未经历一定程度的地质循环和物质积累。 2.3 MG的降解过程
不同镉含量下高、低MG浓度组在各检测时间点的含量及变化趋势绘制如图 3和图 4。
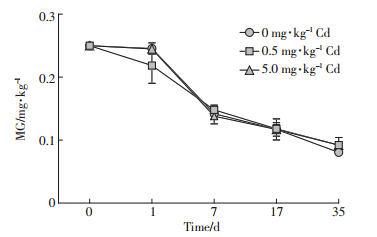
|
| 图 3 底泥低浓度(0.25 mg·kg-1)MG在不同镉含量下的变化趋势 Figure 3 Changes of low MG(0.25 mg·kg-1) in sediment at different cadmium concentrations |
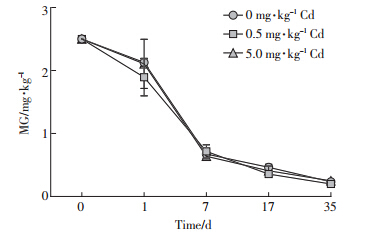
|
| 图 4 底泥高浓度(2.5 mg·kg-1)MG在不同镉含量下的变化趋势 Figure 4 Changes of high MG(2.5 mg·kg-1) in sediment at different cadmium concentrations |
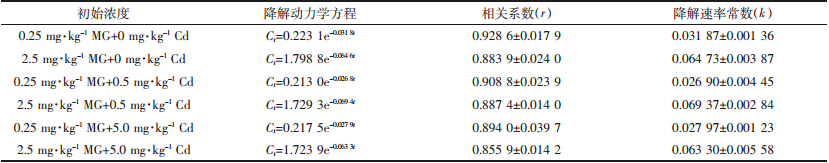
所有实验组中MG的变化趋势大体相似,都随时间逐渐降解,在实验开始时段即前7 d有很大的降解速率,在第7 d至实验结束降解斜率渐趋平缓。至第35 d,高、低浓度组中MG的含量分别约为0.227 7、0.088 2 mg·kg-1,降解率分别约为90.1%、64.7%。前者与余培建研究的光照、常温下沉积物中0.4 mg·kg-1 MG在30 d时降解率(对照组)为89.1%相近[7];较蒋丽娟实验中沉积物2.491 mg·kg-1 MG于30 ℃下静置避光培养条件下28 d时72.5%的降解率高[12]。各MG浓度组中,含0 mg·kg-1 Cd和5.0 mg·kg-1 Cd实验组MG的变化幅度更为接近,而含0.5 mg·kg-1 Cd实验组在第0~7 d MG的降解速率相对较为平稳(此时两图中该浓度曲线明显位于下方)。利用Excel对降解曲线进行对数拟合,得出本实验条件下MG的降解动力学方程(表 5)。各方程相关系数r较高(>85%),经显著性检验,前5个方程在0.05水平上显著,最后一个方程在0.1水平上显著,MG的降解规律符合一级降解动力学方程。
表 5中,方程相关系数(r)、降解速率常数(k)以每实验组Mean±SD表示;t为MG降解时间,d;Ct表示t时间点底泥中MG的残留量,mg·kg-1。降解动力学方程以每实验组3个平行的平均值计算。
MG的半衰期可由T1/2=ln2/k计算,则各实验组的半衰期分别为(4.140±0.042)、(3.432±0.059)、(4.318±0.167)、(3.362±0.041)、(4.271±0.045)、(3.456±0.088)d。绘制柱形图如图 5,可看出同Cd含量下高MG浓度组MG的半衰期比低浓度组的短约1 d,分别在3.4、4.2 d左右。不同Cd含量下高、低MG浓度组的半衰期大小相差不大。

|
| 图 5 各实验组半衰期柱形图 Figure 5 Half-life of MG at different cadmium concentrations |
不同镉含量下,高、低MG浓度组在降解过程中LMG的存在量(相同Cd浓度下,实验组LMG减去对照组LMG)随时间的变化如图 6。MG低浓度下LMG的存在量随镉浓度变化未表现出明显的规律性。其中未含Cd组其LMG的存在量随时间呈一个先升后降的趋势,含Cd组(0.5、5.0 mg·kg-1)从第1 d开始LMG的存在量就随时间呈逐渐降低,尤其是高含量Cd组其LMG存在量的降低趋势更为迅速,至第7 d时LMG的存在量几乎为0。

|
| 图 6 底泥中0.25 mg·kg-1 MG降解过程中存在的LMG Figure 6 Dynamics of LMG during MG degradation at low concentration(0.25 mg·kg-1) |
图 7显示2.5 mg·kg-1 MG实验组LMG的存在量随时间呈现相同的变化趋势,都是一个先升后降的过程,第1~7 d为上升过程,第7~35 d为降低过程,且降低斜率逐渐加大。整个实验过程中LMG的存在量在不同含Cd组间的大小都为C0.5 mg·kg-1 Cd>C5.0 mg·kg-1 Cd>C0mg·kg-1 Cd,至第35 d,LMG的存在量由大至小分别为0.037 80、0.026 63、0.017 15 mg·kg-1。
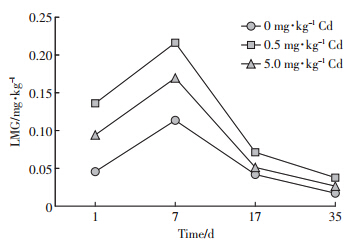
|
| 图 7 底泥中2.5 mg·kg-1 MG降解过程中存在的LMG Figure 7 Dynmics of LMG during MG degradation at high concentration(2.5 mg·kg-1) |
一定条件下重金属的介入能对环境载体中存在的难降解有机物的降解和转化产生影响,其作用原理和方式主要包括重金属与目标有机物及其降解中间产物发生配合的化学作用,重金属因其生物毒性对载体中微生物活性和微生物群落结构属性产生改变的生物作用等[13]。重金属对目标有机物的影响性质和影响程度因重金属种类及浓度的不同而存在很大差别。Hong 等的研究发现,浓度为1 mg·kg-1和10 mg·kg-1的 Hg2+、Cu2+及Cd2+对降解二噁英的一种菌株都具有抑制作用,且其作用大小为 Hg2+>Cu2+>Cd2+,但Pb和As对此几乎没有影响[14];刘慧等的研究显示,Zn2+对酵母菌降解苯酚有促进作用[15];Chen等的研究表明,一定量的TiO2可作催化剂,加速孔雀石绿的光降解[16]。
本实验向底泥中加入不同浓度的离子态重金属Cd及MG进行两者的复合污染实验。结果显示在同MG浓度下,与对照组相比,MG的降解趋势及降解幅度都未出现明显的变化。这说明重金属Cd对MG的降解过程产生的影响很小,在复合污染日趋严重的池塘等环境中,Cd2+未造成MG降解的复杂化。作为一级反应,高MG浓度组的反应速率常数却明显高于低MG浓度组的,其原因可能在于高MG浓度组对微生物群落产生了较强的选择作用,使得MG分解微生物成为群落优势种或优势性更为明显,并最终导致高低MG浓度组降解反应出现差异。但Cd2+对MG的代谢产物LMG的存在量却产生了影响,尤其在高浓度MG组,Cd2+对LMG存在量的影响十分显著。数据表明,加5.0 mg·kg-1 Cd组LMG的存在量都大于对照组,但Cd浓度与LMG存在量之间不呈线性关系,0.5 mg·kg-1 的加Cd组对LMG存在量的正向效果大于5.0 mg·kg-1 Cd组。由于Cd2+对LMG的上行来源即MG降解为LMG的影响很小,则造成这种结果的原因应归于以下两方面:其一,Cd2+的存在效应与LMG的下行去向存在很大相关性,即一定含量的Cd2+能够抑制LMG的降解,其机理可能在于Cd2+能够对LMG的降解微生物产生毒害作用;其二,高浓度的Cd2+对LMG的非生物降解作用具有促进作用,其能够与LMG的降解产物进行配位络合,进而促进LMG的降解,抵消甚至超过Cd2+对生物降解的抑制作用。
环境载体中MG等各类污染物的降解都是在多种环境因子的综合作用下进行的。水体沉积物中MG的降解主要有微生物降解和非生物降解,其中MG的非生物降解主要包括光降解和水解[17],生物降解则来自于各类微生物及藻类的物质代谢作用。而不同的环境载体、同环境载体的不同生物化学条件都会引起MG的降解出现差异。
蒋丽娟对不同孔雀石绿含量沉积物的降解研究显示,沉积物中2.491 mg·kg-1 MG初始浓度组的半衰期为13.09 d,且高浓度组的半衰期比低浓度组的长[12],与本实验结果存在较大差异。造成2.5 mg·kg-1 MG浓度组半衰期出现相差约10 d的原因可能由于两者培养条件方面的差异所致,其中本实验120 r·min-1的振荡培养相对前者的静置培养是造成结果差异的主要因素,因为振荡培养能够为MG的物理降解提供很好的动力学条件。许多有关环境中MG的降解规律研究都显示,随着MG浓度的降低,其降解速度会减缓[1,18,19],低MG浓度组可视为高MG浓度组降解过程的后阶段,这样低MG浓度组的半衰期应当会更长,与本研究的结果相符。出现两实验高、低MG浓度组半衰期长短相反的结果很大程度上可能是因为生物降解过程存在不同所致。微生物在底泥中含量十分丰富,其生物分解作用是沉积物中许多物质进入物质循环的主要动力。底泥中加入MG可能会对微生物活性及微生物类群产生影响,而不同来源的实验底泥中原始微生物群落结构存在一定差异,则加入MG后,MG对微生物的选择能够表现出很大的差异性,进而造成微生物对MG的降解出现加强或减弱的作用效果。另外,两实验中低MG浓度组的设置存在较大差异(1.35、0.25 mg·kg-1),也可能是因为较高浓度的MG才会对微生物的种类产生较强的选择作用所致。为对此予以验证,需对底泥中MG降解过程中微生物群落的变化进行研究。 4 结论
(1)孔雀石绿的降解过程在实验组和对照组之间未出现明显变化,养殖池塘等水体底泥中重金属Cd对孔雀石绿降解产生的影响很小,不会因Cd的复合污染而使MG的降解复杂化。
(2)重金属Cd对孔雀石绿的降解产物隐性孔雀石绿的产生量有一定影响,且在高MG浓度组表现明显,其中含0.5 mg·kg-1 Cd的实验组LMG产生量最大。
| [1] | 张彤晴, 周 刚, 林 海, 等. 孔雀石绿溶液水体自然降解初步研究[J]. 江苏农业科学, 2007(1):211-214. ZHANG Tong-qing, ZHOU Gang, LIN Hai, et al. Preliminary study on natural degradation of malachite green solution in water[J]. Jiangsu Agricultural Science, 2007(1):211-214. |
| [2] | 楠定其其格, 何 江, 吕昌伟, 等. 岱海沉积物中AVS-SEM分布特征及重金属生物有效性研究[J]. 农业环境科学学报, 2014, 33(1):155-161. Nandingqiqige, HE Jiang, LV Chang-wei, et al. Distribution of acid volatile sulfide and sim-ultaneously extracted metals and bioavailability of heavy metals in sediments from Lake Daihai[J]. Journal of Agro-Environment Science, 2014, 33(1):155-161. |
| [3] | Sandrin T R, Maier R M. Impact of metals on the biodegradation of organic pollutants[J]. Environ Health Perspect, 2003, 111(8):1093-1101. |
| [4] | Yoo J Y, Cho J Y, Lee T Y, et al. Organobentonite for sorption and degradation of phenol in the presence of heavy metals[J]. Water Air Soil Poll, 2004, 154(1-4):225-237. |
| [5] | 戴世明, 吕锡武. 镉污染的水处理技术研究进展[J]. 安全与环境工程, 2006, 13(3):63-71. DAI Shi-ming, LV Xi-wu. Advances on cadmium pollution water treatment technology[J]. Safety and Environmental Engineering, 2006, 13(3):63-71. |
| [6] | 何丽华, 沈国顺, 邹 伟, 等. 孔雀石绿及其危害[J]. 吉林畜牧兽医, 2006, 27(5):45-46. HE Li-hua, SHEN Guo-shun, ZOU Wei, et al. Malachite green and its harm[J]. Jilin Animal Science and Veterinary Medicine, 2006, 27(5):45-46. |
| [7] | 余培建. 降解水体中孔雀石绿的药物的初步研究[J]. 水生态学杂志, 2009, 30(1):21-24. YU Pei-jian. Degradation of malachite green in the fishery water by medicine[J]. Journal of Hydroecology, 2009, 30(1):21-24. |
| [8] | Wu P, Wang Y S, Sun C C, et al. Microbial community shift with decabromodip-henyl ether(BDE 209) in sediments of the Pearl River estuary, China[J]. Biologia, 2013, 68(5):788-796. |
| [9] | 孙言春, 李池陶, 杜宁宁, 等. 超高效液相色谱串联质谱法测定水体与底泥中孔雀石绿及隐性孔雀石绿残留[J]. 分析测试学报, 2013, 32(2):205-210. SUN Yan-chun, LI Chi-tao, DU Ning-ning, et al. Determination of malachite green and leucomalachite green residues in water and sediment by Ultra-performance liquid chromato-graphy tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2013, 32(2):205-210. |
| [10] | 叶四化, 陆超华, 谢海平, 等. 高效液相色谱双波长法同时测定水产品中孔雀石绿和隐性孔雀石绿[J]. 分析科学学报, 2007, 23(1):69-72. YE Si-hua, LU Chao-hua, XIE Hai-ping, et al. Determination of malachite green and leucomalachite green in fishery products by HPLC with dual wavelength detector[J]. Journal of Analytical Science, 2007, 23(1):69-72. |
| [11] | 高利娟, 李吉进, 孙钦平, 等. 土壤重金属Cd毒害的评价方法[J]. 现代农业科技, 2011(22):287-288. GAO Li-juan, LI Ji-jin, SUN Qin-ping, et al. The poisoning evaluation method of soil heavy metal Cd[J]. Modern Agricultural Science and Technology, 2011(22):287-288. |
| [12] | 蒋丽娟. 两种渔药在沉积物中的微生物降解研究[D]. 南京:南京大学, 2011:43-48. JIANG Li-juan. Microbiodegradation of two aquacultural drugs in the sediment[D]. Nanjing:Nanjing University, 2011:43-48. |
| [13] | 吴耀国, 刘保超, 徐友宁, 等. 重金属对难降解有机物生物降解的影响及机制[J]. 现代化工, 2009, 29(5):87-90. WU Yao-guo, LIU Bao-chao, XU You-ning, et al. Characteristics of effects of heavy metals on biodegradation of recalcitrant pollutants and its mechanism[J]. Modern Chemical Industry, 2009, 29(5):87-90. |
| [14] | Hong H B, Nam I H, Kim Y M, et al. Effect of heavy metals on the biodegradation of diben-zofuran in liquid medium[J]. J Hazard Mater, 2007, 140(1-2):145-148. |
| [15] | 刘 慧, 杨柳燕, 肖 琳. 重金属离子对酵母降解苯酚的影响[J]. 环境化学, 2004, 23(5):495-500. LIU Hui, YANG Liu-yan, XIAO Lin. Toxic effect of heavy metal ions on yeast growth and phenol degradation[J]. Environmental Chemistry, 2004, 23(5):495-500. |
| [16] | Chen C C, Lu C S, Chung Y C, et al. UV light induced photodegradation of Malachite green on TiO2 nanoparticles[J]. Journal of Hazardous Materials, 2007, 141(3):520-528. |
| [17] | Perez-Estrada L A, Aguera A, Hernando M D, et al. Photodegradation of malachite green under natural sunlight irradiation:Kinetic and toxicity of the transformation products[J]. Chinoshpere, 2008, 70(11):2068-2075. |
| [18] | 李红霞, 那广水, 贺 伟, 等. 孔雀石绿及其代谢物研究概况[J]. 水产科学, 2008, 27(8):430-432. LI Hong-xia, NA Guang-shui, HE Wei, et al. Advances in studies on malachite green and leucomalachite green[J]. Fisheries Science, 2008, 27(8):430-432. |
| [19] | 陈永平, 张素青, 李青春, 等. 不同水产品中有色和无色孔雀石绿的降解动力学研究[J]. 食品安全质量检测学报, 2013, 4(1):183-188. CHEN Yong-ping, ZHANG Su-qing, LI Qing-chun, et al. Studies on degradation kinetics of malachite green and leucomalachite green in different aquatic products[J]. Journal of Food Safety and Quality, 2013, 4(1):183-188. |
 2015, Vol. 34
2015, Vol. 34