文章信息
- 曹霞, 郭朝晖, 肖细元, 刘亚男, 曾鹏
- CAO Xia, GUO Zhao-hui, XIAO Xi-yuan, LIU Ya-nan, ZENG Peng
- 海桐(Pittosporum tobira)对污染土壤中镉的耐受和吸收特征
- Cadmium Tolerance and Uptake Characteristics in Pittosporum tobira in Contaminated Soil
- 农业环境科学学报, 2015, 34(4): 627-632
- Journal of Agro-Environment Science, 2015, 34(4): 627-632
- http://dx.doi.org/10.11654/jaes.2015.04.003
-
文章历史
- 收稿日期:2014-11-11
土壤中镉(Cd)主要来自于金属矿资源的采选冶炼活动,污水灌溉,过度使用杀虫剂、农药、化肥等[1]。我国土壤中Cd等重金属污染突出,因而寻求一种环境友好且高效的调控土壤Cd污染的方法具有非常重要的意义。目前,重金属污染土壤的修复方法主要有化学修复、物理修复和生物修复等。对于小范围的Cd污染土壤可通过化学或物理方法修复,但一般修复成本比较高,且易破坏土壤结构。相比化学和物理修复,生物修复尤其是植物修复是一种绿色、环境友好的修复方法[2],具有修复成本低、简便易行、安全可靠等优点。近年来,植物修复研究主要集中在超富集植物的筛选上,目前已发现近400种超富集植物[3],截止2010年,国内外发现的Cd超富集植物超过20种,包括印度芥菜(Brassica juncea)、天蓝遏兰菜(Thlaspi caerulescens)、东南景天(Sedum alfredii)[4]、忍冬(Lonicera japonica)[5]和滇苦菜(Picris divaricata)[6]等。但这些Cd超富集植物生物量较小,生长周期较长,限制了其修复效率[7]。一些速生、生物量大、观赏性耐性植物开始进入修复植物范畴。如向日葵(Helianthus annuus)能够在添加KCl的Cd、Pb污染土壤中正常生长[8];万寿菊(Tagetes patula)可用于修复苯并(а)芘和Cd复合污染土壤[9];含羞草(Mimosa pudica)、白雪姬(Tradescantia sillamontana)和树马齿苋(Portulaca afra)对Cd均具有较强累积能力,在Cd污染土壤治理中有一定的应用价值[10]。选用合适的观赏性园林景观植物进行重金属污染土壤修复,不仅能达到修复目的,还可以美化环境。
海桐(Pittosporum tobira)为海桐花科海桐花属植物,常绿灌木或小乔木,主要分布于福建、广东、广西、贵州等地。海桐多为园林、行道栽培植物,有研究表明,交通环境下海桐对Ag、Cd、Rb和Sc等有较强的累积特性[11],其叶片中Cd和Pb的沉积量随交通密度降低而显著降低[12]。海桐对污泥堆肥土中Cd、Pb的富集能力很弱[13],而对城市环境中Cd或Pb的吸收累积能力较强[14]。海桐对Cd的耐受与累积程度如何,是否适用于修复Cd污染土壤,目前还没有系统的研究报道。本文通过室内培养试验,研究海桐对污染土壤中Cd的耐受与吸收特征,探讨其在Cd污染土壤中的应用潜力,以期为选用海桐等景观植物修复重金属污染土壤提供科学依据,同时获得较好的生态和景观效应。 1 材料与方法 1.1 供试土壤和植物
供试土壤取自湖南衡阳某典型矿冶区周边表层土壤(0~20 cm),将收集的土壤经自然风干后过5 mm筛,从中取小部分土壤过0.85 mm和0.15 mm筛,分析土壤基本理化性质和土壤中Cd含量。供试土壤pH值为7.76,土壤有机质含量为5.05 g·kg-1,速效氮、速效磷和速效钾含量分别为5.60、9.80和15.20 mg·kg-1,Cd含量为3.60 mg·kg-1。供试植物海桐幼苗采自湖南省长沙市一苗木基地,为两年生种苗,株高10 cm左右,海桐幼苗中Cd含量为1.03 mg·kg-1。 1.2 试验设计
将供试土壤样品充分混合后装入下口直径为13 cm、上口直径为18 cm、高为17 cm的塑料盆中,每盆装土3.5 kg。参照我国《土壤环境质量标准》(GB 15618—1995)和《展览会用地土壤环境质量评价标准(暂行)》(HJ 350—2007),以Cd(NO3)2·4H2O作为外源Cd,向供试土壤中分别添加0(对照,CK)、6 mg·kg-1(T1)和21 mg·kg-1(T2)的Cd,形成Cd污染土壤系列,每个处理重复4次。保持土壤湿度为田间持水量的70%,平衡15 d后移栽海桐幼苗,每盆移栽大小基本一致的幼苗4株,于2013年7月至2014年2月在温室内进行培养。试验期间,每天光照周期10 h,温室内昼夜温度30 ℃/20 ℃。分别在培养56、105、154 d和203 d后进行第1、2、3和4次取样。将每次收获的海桐植株按根、茎、叶分开,依次用自来水和蒸馏水清洗干净后,105 ℃杀青30 min后在60 ℃下烘干至恒重。植物样品称重,粉碎备用。 1.3 测试与分析
从每次收集的海桐样品中取少量新鲜叶片测定其光合色素和丙二醛(MDA)含量。叶片中光合色素含量的测定[15]:取0.2 g海桐叶片,用不锈钢剪刀剪碎后放入研钵中,加2~3 mL质量分数为95%的乙醇,以SiO2和CaCO3为助磨剂研磨,研成匀浆后,再加10 mL 95%的乙醇,继续研磨至组织变白。静置3~5 min,过滤定容至25 mL棕色容量瓶,于665 nm、649 nm和470 nm处测定其吸光度,分别计算叶绿素a、叶绿素b和类胡萝卜素含量。MDA含量的测定[16]:取0.5 g海桐叶片,用不锈钢剪刀剪碎后放入研钵中,加入5 mL质量分数为5%的三氯乙酸进行研磨,研磨后所得匀浆液在3000 r·min-1下离心10 min。取2 mL上清液与2 mL质量分数为0.67%的硫代巴比妥酸,在100 ℃水浴上煮沸30 min,冷却再离心一次。取上清液于450、532 nm和600 nm处测定吸光度,计算MDA含量。
土壤基本理化性质的测定参照鲁如坤[17]的方法:土壤pH值按水土比2.5∶1,Mettler Toledo 420 pH计测定;有机质含量采用外加热-K2Cr2O7容量法;土壤中速效氮含量采用碱解扩散-H2SO4中和滴定法测定;速效磷含量采用0.5 mol·L-1 NaHCO3浸提-矾钼黄比色法测定;速效钾含量采用1.0 mol·L-1 NH4OAc浸提-火焰光度法测定。供试土壤样品采用HNO3-HCl-H2O2(MDS-8G型多通量密闭微波消解仪)消解;海桐根、茎、叶样品采用HNO3-HClO4法消解(体积比为3∶1)[18],消解液中Cd含量采用原子吸收分光光度法(AA-6800,岛津公司)测定。所用试剂均为分析纯或优级纯。分析过程中加入土壤标准物质(GBW08303)和植物标准物质(GBW07603)进行质量控制。海桐植株中Cd的富集系数[19]和转运系数[20]按照如下公式计算:

数据分析采用Excel 2007软件。显著性检验分析采用SPSS 13.0统计软件,利用单因素方差分析(One-way ANOVA)不同处理之间的差异,P<0.05为显著性水平。 2 结果与讨论 2.1 不同Cd浓度处理下海桐生物量
土壤Cd含量对海桐生长影响明显。从图 1可看出,海桐对土壤Cd污染有一个适应过程。培养56 d和105 d后,T1和T2处理下海桐生物量均低于对照处理;随培养时间增加,154 d后海桐的生长发生明显变化,T1处理下海桐生物量略高于对照处理,显著高于T2处理,表明土壤中较低含量Cd(9.6 mg·kg-1)对海桐的生长具有一定的促进作用。203 d后,土壤T2处理下海桐生物量有所减少,表明土壤中较高含量Cd(24.6 mg·kg-1)对海桐产生了一定的毒害和生长抑制效应。
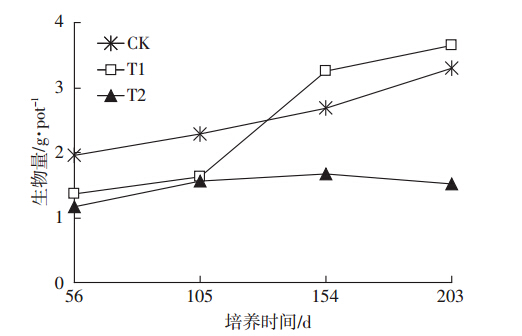 |
| 图 1 不同Cd处理对海桐整株生物量的影响 Figure 1 Effect of soil Cd on total dry biomass of Pittosporum tobira |
对培养154 d收集的海桐样品根、茎、叶含量进行统计分析,从图 2可看出,T1处理下海桐根、茎、叶干重与对照相比分别增加55%、18%和16%,T2处理下根、茎、叶干重较对照处理分别降低38.7%、5.2%和52.5%。T1处理下海桐根、茎、叶干重与CK相比无显著性差异(P>0.05)。T2处理下海桐叶片干重与CK处理有显著差异(P<0.05)。上述结果表明,土壤中较低Cd含量能促进海桐植株生长,而较高Cd含量却有明显的抑制作用,这与Yu等[21]的研究结果相一致。但从海桐的生长特征来看,海桐在较高Cd含量处理下仍能保持正常生长,说明其对土壤中Cd具有较强耐受能力。
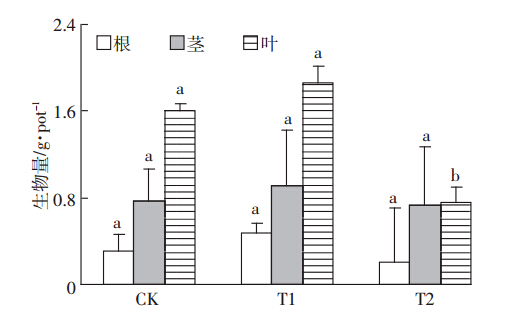 |
| 不同小写字母代表不同处理组差异性显著(P<0.05) Different lowercase letters mean significant difference between treatments at 0.05 level 图 2 培养154 d后不同Cd处理对海桐根、茎、叶生物量的影响 Figure 2 Effects of soil Cd on root,stem and leaf dry biomass of Pittosporum tobira after 154-day of Cd treatments |
植物叶片中光合色素在光能的吸收、传递和转换中起着重要作用,而植物光合作用对重金属胁迫非常敏感[22]。从图 3可看出,在56 d时,海桐处于生长适应期,其叶片中的叶绿素a、叶绿素b、类胡萝卜素含量高低顺序为T2>CK>T1,随着培养时间的增加,CK和T1处理下海桐叶片叶绿素a和叶绿素b含量呈增加趋势,而类胡萝卜素含量没有明显变化。说明Cd对海桐的毒害是一个长期累积的过程,较短时间的Cd胁迫不足以影响叶片中叶绿素生物合成的相关酶活性。培养154 d后,T1处理下海桐叶片中叶绿素a、叶绿素b、类胡萝卜素含量与CK处理相近,表明T1处理下Cd含量在海桐的耐受阈值范围内,海桐可通过调节自身的生理代谢来缓解Cd毒害。T2处理下海桐的叶绿素a、叶绿素b和类胡萝卜素含量随着培养时间的增加呈明显降低趋势,培养154 d后T2处理下海桐叶片中叶绿素a、叶绿素b、类胡萝卜素含量分别是CK处理下的71.3%、68.2%、75%,与培养56 d后取样相比,T2处理下叶片的叶绿素(叶绿素a+叶绿素b)含量降低了54.78%,说明较高Cd处理条件下长时间的胁迫对海桐光合作用产生了一定的抑制作用,这与其生物量减少的结果相一致。有研究表明,Cd可与叶绿体中蛋白质上的-SH等结合或取代其中的Fe2+、Zn2+、Mg2+等元素,破坏叶绿素体结构和功能活性[23]。但总的来看,海桐在较高含量Cd胁迫下也能保持正常的生理活动,对污染土壤中Cd仍具有较强的忍耐能力。
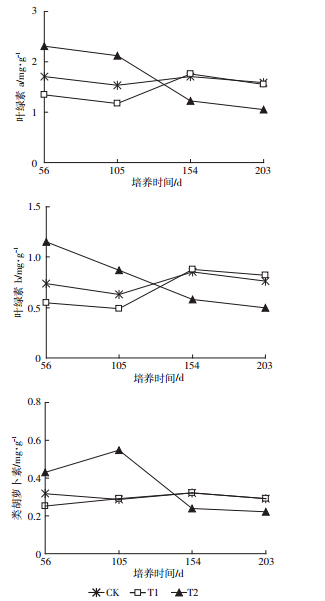 |
| 图 3 不同Cd处理对海桐叶片中光合色素含量的影响 Figure 3 Effect of soil Cd on photosynthetic pigment content in Pittosporum tobira leaves |
一般来说,植物细胞膜被认为是受重金属伤害的基本位点,MDA是膜质过氧化的产物,其含量可反应膜质过氧化、植物衰老或遭受逆境伤害程度[24]。从图 4可看出,培养56 d和105 d后,CK处理下海桐叶片中MDA含量高于T1和T2处理;但随着培养时间增加,154 d后,T1和T2处理下海桐叶片中MDA含量与CK处理相当,随着培养时间的进一步延长,203 d后T2处理下海桐叶片中MDA含量已经明显高于CK和T1处理,T2处理下海桐叶片中MDA含量较对照处理增加了52%。从MDA含量变化过程也可以看出,Cd对海桐的毒害是一个长期作用的结果,土壤中Cd含量达到24.6 mg·kg-1时,Cd对海桐产生了一定的毒害作用。有研究表明,Cd胁迫可诱导植物产生大量的ROS(O2-,OH-和H2O2),导致膜质过氧化,从而使膜系统结构功能遭受破坏,减少细胞膜的选择透过性[25]。其原因可能是在Cd长时间胁迫下,植物能通过提高细胞抗氧化防御系统忍受由少量Cd诱导产生的活性氧自由基的伤害,而较高含量Cd长时间作用则会破坏植物抗氧化防御系统,迅速降低植物体内相关抗氧化酶活性,进而导致细胞死亡[26]。本研究结果表明,T2处理下较高Cd含量诱导海桐叶片产生较高含量MDA,对海桐的生理产生了一定的毒害作用。
 |
| 图 4 不同Cd处理对海桐叶片中丙二醛含量的影响 Figure 4 Effect of soil Cd on malondialdehyde content in Pittosporum tobira leaves |
海桐对污染土壤中Cd具有一定的吸收和累积能力。海桐根、茎、叶中Cd吸收和累积量随培养时间和污染土壤Cd含量增加而逐渐增加(图 5)。培养56 d后,不同Cd处理下海桐根、茎、叶中Cd含量没有明显区别;培养105 d后,其根部Cd含量明显大于茎、叶中Cd含量,T2处理下的结果尤为明显,这说明海桐对Cd胁迫有一个适应期。有研究表明,植物积累Cd2+的机理主要通过与细胞壁结合、与有机化合物形成金属螯合物及区室化分布等途径进行解毒[27]。随着培养时间进一步增加,154 d后,海桐对土壤Cd的吸收和累积发生了明显变化,T2处理下海桐根、茎、叶中Cd含量分别为21.2、26.1、26.0 mg·kg-1,其茎、叶中Cd含量高于根部Cd含量;204 d后,Cd含量在海桐根、茎、叶中的分布特征与培养154 d时相一致。研究表明,植物根部吸收的Cd可通过木质部维管束逐渐向地上部转移,之后主要沉积于液泡中[28];但也有研究表明,到达地上部分的Cd与细胞壁中纤维素和木质素结合,从而大部分沉积于细胞壁中[29]。但海桐对Cd的吸收和累积机制尚未清楚,有待进一步研究。
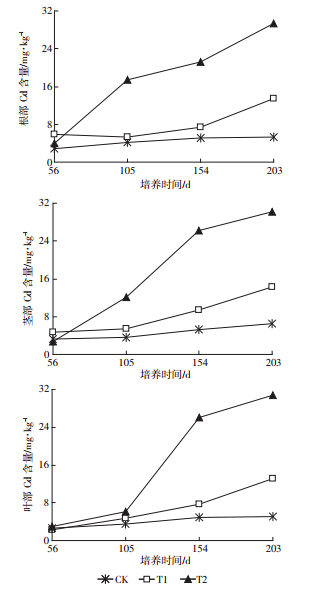 |
| 图 5 不同Cd处理下海桐根、茎、叶中Cd含量 Figure 5 Contents of Cd in roots,stems and leaves of Pittosporum tobira grown in Cd contaminated soil |
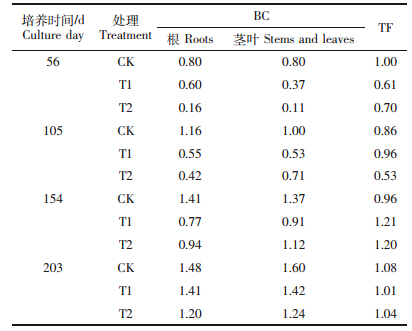
重金属在植物体内的吸收分布特征是选择耐性物种的重要指标。从表 1可发现,不同Cd处理下海桐植株对Cd的富集系数随着培养时间的增加而增加,且T1和T2处理下的富集系数较CK小。在整个培养期间,海桐体内的转运系数都能保持在一个较高水平,尤其在培养后期(154 d后)转运系数都在1.0左右,这表明海桐能有效地将吸收的Cd运输到地上部,海桐体内可能存在较好的运输和解毒机制以应对重金属Cd的胁迫。
 |
(1)污染土壤中Cd对海桐生长影响明显。土壤中Cd含量为9.6 mg·kg-1时,与对照处理(土壤中 Cd含量为3.6 mg·kg-1)相比,海桐生物量、叶片中叶绿素a、叶绿素b、类胡萝卜素含量和丙二醛含量没有发生明显变化。当土壤中Cd含量为24.6 mg·kg-1时,海桐的生物量、叶绿素a、叶绿素b、类胡萝卜素含量均明显下降,丙二醛含量明显增加。但海桐在较高含量Cd处理下都能正常生长,说明海桐对污染土壤中Cd有一定的耐受能力。
(2)海桐对土壤中Cd有一定的累积和转运能力。海桐植株中Cd含量随土壤Cd含量的增加而增加。在培养前期,海桐吸收的Cd主要累积在根部,随着培养时间的延长,海桐体内Cd逐渐向地上部转移,154 d时,Cd在海桐体内的分布特征为茎≈叶>根。
| [1] | Ha H, Olson J R, Bian L, et al. Analysis of heavy metal sources in soil using kriging interpolation on principal components[J]. Environmental Science & Technology, 2014, 48(9):4999-5007. |
| [2] | Chen Y, Shen Z, Li X. The use of vetiver grass(Vetiveria zizanioides) in the phytoremediation of soils contaminated with heavy metals[J]. Applied Geochemistry, 2004, 19(10):1553-1565. |
| [3] | Sun Y, Zhou Q, Wang L, et al. Cadmium tolerance and accumulation characteristics of Bidens pilosa L. as a potential Cd-hyperaccumulator[J]. Journal of Hazardous Materials, 2009, 161(2-3):808-814. |
| [4] | Padmavathiamma P K, Li L Y. Phytoremediation technology:hyper-accumulation metals in plants[J]. Water, Air, and Soil Pollution, 2007, 184(1-4):105-126. |
| [5] | Liu Z, He X, Chen W, et al. Accumulation and tolerance characteristics of cadmium in a potential hyperaccumulator: Lonicera japonica Thunb[J]. Journal of Hazardous Materials, 2009, 169(1-3):170-175. |
| [6] | Tang Y. Zn and Cd hyperaccumulating characteristics of Picris divaricata Vant.[J]. International Journal of Environment and Pollution, 2009, 31(1-2):26-38. |
| [7] | Smits E, Freeman J. Environmental cleanup using plants:biotechnological advances and ecological considerations[J]. Frontiers in Ecology and the Environment, 2006, 4(4):203-210. |
| [8] | Hao X, Zhou D, Li D, et al. Growth, cadmium and zinc accumulation of ornamental sunflower(Helianthus annuus L.) in contaminated soil with different amendments[J]. Pedosphere, 2012, 22(5):631-639. |
| [9] | Sun Y, Zhou Q, Xu Y, et al. Phytoremediation for co-contaminated soils of benzo[a]pyrene(B[a]P) and heavy metals using ornamental plant Tagetes patula[J]. Journal of Hazardous Materials, 2011, 186(2-3):2075-2082. |
| [10] | 燕傲蕾, 吴亭亭, 王友保, 等. 三种观赏植物对重金属镉的耐性与积累特性[J]. 生态学报, 2010(9):2491-2498.YAN Ao-lei, WU Ting-ting, WANG You-bao, et al. The characteristics of cadmium to tolerance and accumulation in three kinds of ornamental plants[J]. Acta Ecologica Sinica, 2010(9):2491-2498. |
| [11] | Rucandio M I, Petit-Domínguez M D, Fidalgo-Hijano C, et al. Biomonitoring of chemical elements in an urban environment using arboreal and bush plant species[J]. Environmental Science and Pollution Research, 2011, 18(1):51-63. |
| [12] | Palmieri R M, La Pera L, Di Bella G. Simultaneous determination of Cd(Ⅱ), Cu(Ⅱ), Pb(Ⅱ) and Zn(Ⅱ) by derivative stripping chronopotentiometry in Pittosporum tobira leaves:A measurement of localatmospheric pollution in Messina(Sicily, Italy)[J]. Chemosphere, 2005, 59(8):1161-1168. |
| [13] | 刘忠良, 田晓军, 龚 萍, 等. 污泥堆肥农用中重金属在海桐中的积累效应[J]. 广东微量元素科学, 2009, 16(9):34-38.LIU Zhong-liang, TIAN Xiao-jun, Gong Ping et al. Adsorption of heavy metals by Pittosporum tobira from mixed soils containing composted sewage sludge[J]. Guangdong Trace Elements Science, 2009, 16(9):34-38. |
| [14] | 汪有良. 园林灌木对城市环境中镉和铅吸收积累作用研究[J]. 北方园艺, 2010(10):103-106.WANG You-liang. Study on the absorption and accumulation of garden shrubs to cadmium and lead in urban environment[J]. Northern Horticulture, 2010(10):103-106. |
| [15] | Mobin M, Khan N A. Photosynthetic activity, pigment composition and antioxidative response of two mustard(Brassica juncea) cultivars differing in photosynthetic capacity subjected to cadmium stress[J]. Journal of Plant Physiology, 2007, 164(5):601-610. |
| [16] | 张志良, 胡伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社, 2004:274-277.ZHANG Zhi-liang, HU Wei-jing. Laboratory guide of plant physiology[M]. Beijing:Higher Education Press, 2004:274-277. |
| [17] | 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 1999:150-194.LU Ru-kun. Soil and agricultural chemistry analysis[M]. Beijing:China Agriculture Press, 1999:150-194. |
| [18] | Sun Y, Zhou Q, Diao C. Effects of cadmium and arsenic on growth and metal accumulation of Cd-hyperaccumulator Solanum nigrum L.[J]. Bioresource Technology, 2008, 99(5):1103-1110. |
| [19] | Tanhan P, Kruatrachue M, Pokethitiyook P, et al. Uptake and accumulation of cadmium, lead and zinc by Siam weed[Chromolaena odorata(L.) King & Robinson][J]. Chemosphere, 2007, 68(2):323-329. |
| [20] | Baker A J M, Reeves R D, Hajar A S M. Heavy metal accumulation and tolerance in British populations of the metallophyte Thlaspi caerulescens J. & C. Presl(Brassicacaeae)[J]. New Phytologist, 1994, 127(1):61-68. |
| [21] | Yu Z, Zhou Q. Growth responses and cadmium accumulation of Mirabilis jalapa L. under interaction between cadmium and phosphorus[J]. Journal of Hazardous Materials, 2009, 167(1-3):38-43. |
| [22] | Ekmek?i Y, Tanyola? D, Ayhan B. Effects of cadmium on antioxidant enzyme and photosynthetic activities in leaves of two maize cultivars[J]. Journal of Plant Physiology, 2008, 165(6):600-611. |
| [23] | Sun S C, Wang H X, Li Q R. Preliminary studies on physiological changes and injury mechanism in aquatic vascular plants treated with cadmium[J]. Acta Phytophysiologica Sinica, 1985, 11(2):113-121. |
| [24] | ?elekli A, Kap? M, Bozkurt H. Effect of cadmium on biomass, pigmentation, malondialdehyde, and proline of scenedesmus quadricauda var. logician[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 91(5):571-576. |
| [25] | Yan C G, Hong Y T, Fu S Z. Effect of Cd, Pb stress on scarenging system of activated oxygen in leaves of tobacco[J]. Acta Ecologica Sinica, 1997, 17(5):488-492. |
| [26] | Soudek P, Petrová ?, Vaňková R, et al. Accumulation of heavy metals using Sorghum sp.[J]. Chemosphere, 2014, 104(2):15-24. |
| [27] | 仇 硕, 张 敏, 孙延东, 等. 植物重金属镉(Cd2+)吸收、运输、积累及耐性机理研究进展[J]. 西北植物学报, 2006(12):2615-2622.QIU Shuo, ZHANG Min, SUN Yan-dong, et al. Research advances in the mechanisms of Cd2+ uptake, transport, accumulation and tolerance in plants[J]. Acta Botanica Boreali-Occidentalia Sinica, 2006(12):2615-2622. |
| [28] | Jabeen R, Ahmad A, Iqbal M. Phytoremediation of heavy metals:Physiological and molecular mechanisms[J]. The Botanical Review, 2009, 75(4):339-364. |
| [29] | Nishizono H, Ichikawa H, Suziki S, et al. The role of the root cell wall in the heavy metal tolerance of Athyrium yokoscense[J]. Plant and Soil, 1987, 101(1):15-20. |
 2015, Vol. 34
2015, Vol. 34




