文章信息
- 王荣, 刘艳丽, 张民, 高翔, 李成亮
- WANG Rong, LIU Yan-li, ZHANG Min, GAO Xiang, LI Cheng-liang
- 纳米银对黑麦草生长特性的影响
- Effects of Nano-silver on Growth Characteristics of Perennial Ryegrass
- 农业环境科学学报, 2015, 34(4): 639-645
- Journal of Agro-Environment Science, 2015, 34(4): 639-645
- http://dx.doi.org/10.11654/jaes.2015.04.005
-
文章历史
- 收稿日期:2014-11-02
纳米材料是三维结构中至少有一维在1~100 nm范围内的材料,其粒径处于原子簇和宏观物体交接区域[1]。与普通大颗粒材料相比,由于纳米材料呈现出许多传统材料所不具备的物理、化学性质,近年来已成为物理、化学、材料学等学科研究的前沿[2]。纳米银目前已广泛应用于医疗产品、纺织品、个人护理产品、洗衣添加剂、家电、油漆甚至食物等领域[3],因此使得纳米银通过不同方式最终进入土壤而对人类以及土壤生态系统造成危害[4]。纳米材料的粒径微小,具有较高的比表面积和较强的比表面活性[5],进入生态系统后将干扰某些反应过程[6, 7],如纳米银颗粒表面生成超氧自由基等对细胞产生氧化作用[8, 9],或纳米银颗粒表面不断释放出的银离子进入活体细胞后与酶蛋白质巯基(-SH)迅速结合,将使一些以此为必要基团的酶失去活力[10],或破坏DNA结构而使DNA丧失复制能力[11]。但纳米银对植物的毒害究竟是由纳米银材料本身还是由纳米银释放的银离子造成的尚不明确。目前已有大量报道指出,纳米银进入土壤后会通过食物链危害人体健康,一些纳米材料对生态环境和人体健康均会带来一定的负面影响[12]。
植物是陆地生态系统的重要组成部分,与纳米材料在土壤中的迁移和转化息息相关[13],研究植物对纳米材料的响应可更易于了解纳米材料在进入自然生态系统后产生的影响[14, 15]。Barrena等[16]研究发现,100 mg·L-1 纳米银(粒径29 nm)处理可抑制黄瓜和生菜的种子萌发;10 mg·L-1 纳米银(粒径2~20 nm)处理黑麦草种子后,种子萌发率下降20%[17]。Stampoulis等[18]研究发现,纳米银浓度为100、500 mg·L-1时导致西葫芦生物量和蒸腾作用较空白处理分别下降41%和57%。Dimkpa等[14]研究发现,纳米银(粒径10 nm)显著降低小麦芽和根的长度,且降低程度与加入纳米银的浓度有关。纳米银对植物生理性状以及细胞结构也会产生影响,如:低浓度(1 mg·L-1)纳米银(粒径6~8 nm)使紫背浮萍的可溶性糖增加,但高浓度纳米银(5 mg·L-1)使紫背浮萍组织中硝态氮、可溶性糖、叶绿素a(Chla)、叶绿素a 和叶绿素b 比率(Chla/Chlb)及光催化效率(Fv/Fm)显著降低,并使脯氨酸含量增加[19];黑麦草种子暴露于40 mg·L-1浓度的纳米银(粒径6 nm和25 nm)溶液中,其根系很难生长根毛,根尖细胞高度液泡化,且观察到表皮有破碎的细胞[20];Mazumdar等[21]研究发现,纳米银(粒径25 nm)导致水稻根细胞的细胞壁断裂、液泡受损。
目前纳米材料植物毒性研究大多局限于水培试验或短期(15~30 d)培养实验[18, 20, 22, 23],但是溶液介质与实际土壤环境相距甚远,并且植物对纳米材料毒性的响应需经过时间来验证,或许取决于时间的长短。因此,本研究利用盆栽试验,探讨不同浓度纳米银处理后黑麦草生物量、植株体内银残留量以及植物根系生长特性的影响,同时设置同等浓度的硝酸银为对照,研究纳米单质银与离子银的植物毒性差异。本试验的结果将为理解纳米银的植物毒害提供支撑和依据。 1 材料与方法 1.1 试验材料
试验地点为山东省泰安市山东农业大学土肥资源高效利用国家工程实验室和国家缓控释肥工程技术研究中心中试基地,位于北纬35°09′,东经117°08′,属温带半湿润季风性气候区,年均气温为12.9 ℃,极端最高气温40 ℃,极端低温-27.5 ℃。年降水量600~800 mm,干燥度1.1~1.5,冬季气候温和、较湿润,夏季炎热多雨,降雨多集中在7—8月。本研究中盆栽试验所用土壤样品采自该试验基地,土壤砂粒含量为53.2%、粉粒含量为32%、粘粒含量为14.8%,为砂壤质棕壤(据美国土壤系统分类方法)。供试土壤基本理化性质见表 1。
纳米银(上海沪正纳米科技有限公司)含银量≥20%,平均粒径15 nm。黑麦草(Lolium perenne L.),禾本科(Poaceae)黑麦草属(Lolium)植物。试验所选品种为“绅士”,一年生,须根发达,多分蘖,种子千粒重2 g左右,是土壤重金属污染试验的指示植物[24, 25]。 1.2 试验方法
盆栽设置6个不同浓度的纳米银处理,分别为0、10、20、60、120、200 mg·kg-1同时设置同浓度硝酸银作对照,每个处理4次重复。
试验于2014年4月8日开始。取过筛土15 kg,按照不同处理纳米银的用量准确称量,将所用纳米银粉末均匀混合于盆栽土壤中,同时按照尿素0.25 g·kg-1、过磷酸钙0.576 g·kg-1、氯化钾0.192 g·kg-1的剂量将三种肥料也均匀混于土壤中,然后装入直径为20 cm、高18 cm的塑料花盆中,每盆装土1.5 kg。选取黑麦草饱满籽粒,每盆播种量为2 g,覆土0.5 cm,播种后每盆浇水500 mL。黑麦草将要出苗时搭遮阳棚,防止灼伤幼苗,一周后撤去遮阳棚。每天浇水,每次每盆浇水量保持一致,浇入的水不能从盆底托盘流出,及时清除盆内杂草。5月27日进行盆栽采样。
植株采集处理与测定方法:将盆内黑麦草及土壤倾倒出分离,取出植株洗净根系,留取三株直接用于根系形态参数测定;其余部分105 ℃杀青30 min ,75 ℃烘干至恒重后称其干重,并粉碎备用。利用根系分析软件(WinRHIZO Pro. 2005b,加拿大)分析根长、根平均直径、根尖数等根系形态参数[26]。根系活力采用氯化三苯基四氮唑(TTC)法测定[27]。
植物体内银残留量测定:称取0.5 g 样品于消解管中,加入7 mL硝酸,浸泡2 h后,加盖密封;将消解管对称放入微波消解仪(Anton-Paar Maltiwave Pro. 48,奥地利)中(15 min 升温至180 ℃,保持 20 min后系统自动降温);待消解结束后,取出消解管冷却,赶酸后转移并定容至50 mL[28],采用AAS(日本岛津AA7000)测定溶液中银浓度。 1.3 数据与处理
试验数据利用Excel 2007处理,ANOVA方差分析及Duncan差异显著性检验,分析不同处理间的显著性(P<0.05)水平,相关数据的统计分析利用SAS 8.5统计分析软件完成。 2 结果与分析 2.1 不同处理下黑麦草生物量
黑麦草地上部和地下部生物量对土壤中纳米银浓度响应不同,抑制作用呈现在较高浓度范围内(图 1)。当纳米银添加剂量大于10 mg·kg-1时,各处理黑麦草地上部生物量均显著低于空白处理,但各处理间差异不显著。对于黑麦草根系生物量而言,添加剂量大于20 mg·kg-1时也发现了类似的趋势。同等浓度作用下,纳米银与硝酸银对黑麦草生物量的抑制作用差异不显著。
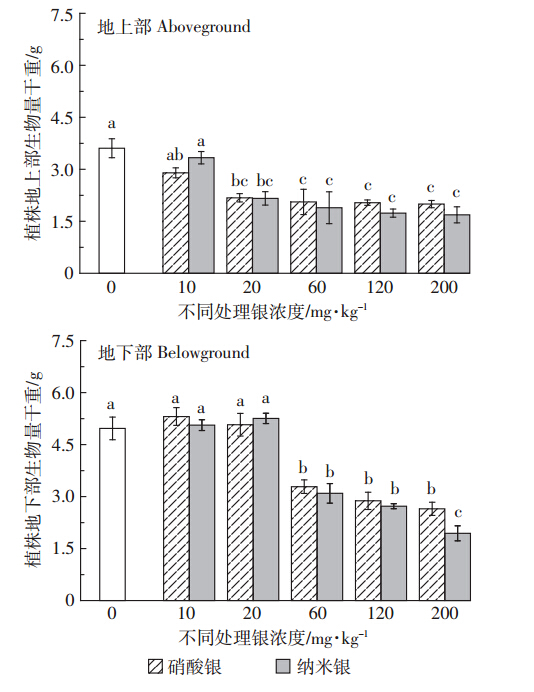 |
| 图 1 不同处理对植株地上部和地下部生物量的影响 Figure 1 Effects of different silver concentrations on aboveground and belowground biomass of ryegrass |
在供试浓度范围内,黑麦草根冠比为先增大后减小。添加剂量为20 mg·kg-1时纳米银与硝酸银处理的根冠比最大,分别为2.43、2.33;银浓度大于20 mg·kg-1时对根系的抑制作用要大于对地上部的抑制作用。 2.2 不同处理下黑麦草体内银残余量
植株体内银的残留量随添加量的增加而增加(图 2)。同等浓度处理下,硝酸银处理的黑麦草地上部银残留量显著高于纳米银处理(除添加浓度10、200 mg·kg-1外)。然而仅在120、200 mg·kg-1浓度作用下,硝酸银处理的黑麦草地下部银残留量显著低于纳米银处理,其他浓度范围内二者差异未达显著水平。上述结果表明,硝酸银较纳米银在植株体内的移动性高,纳米银易贮存于根系中。
 |
| 图 2 不同处理对植株地上部和地下部银残留量的影响 Figure 2 Effects of different silver concentrations on residual Ag concentrations in aboveground and belowground parts of ryegrass |
纳米银处理中,各浓度的根系总长度都显著小于空白处理,并呈现先增后减的趋势,浓度为60 mg·kg-1时根系总长度最大(图 3)。但对于硝酸银处理,浓度为20 mg·kg-1时黑麦草根系总长度最大(为438 cm);当浓度高于20 mg·kg-1后,其根系总长度则先减后增(图 3)。
 |
| 图 3 不同处理对黑麦草根系总长度的影响 Figure 3 Effects of different silver concentrations on total root length of ryegrass |
在土壤非生物逆境胁迫条件下,植物最先感受逆境胁迫的器官是根系,植物通过改变根系形态以适应环境胁迫[30]。无论纳米银或硝酸银处理下,黑麦草根系直径均随处理浓度的增加而加粗(图 4)。在浓度20 mg·kg-1和200 mg·kg-1时,纳米银处理的黑麦草根系直径显著高于硝酸银处理;在其他供试浓度范围内,二者差异不显著。
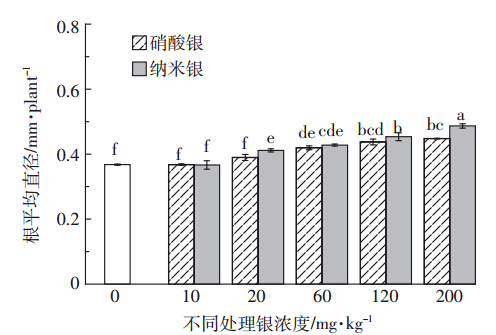 |
| 图 4 不同处理对黑麦草根系平均直径的影响 Figure 4 Effects of different silver concentrations on average diameters of ryegrass roots |
除20 mg·kg-1硝酸银处理外,纳米银和硝酸银处理较空白处理均显著地抑制黑麦草根尖数量(图 5)。在供试浓度范围内,纳米银和硝酸银处理的黑麦草根尖数呈先增后减的趋势,但是纳米银处理的黑麦草根尖数最大值出现在60 mg·kg-1浓度下,而纳米银处理的黑麦草根尖数最大值出现在20 mg·kg-1浓度下。
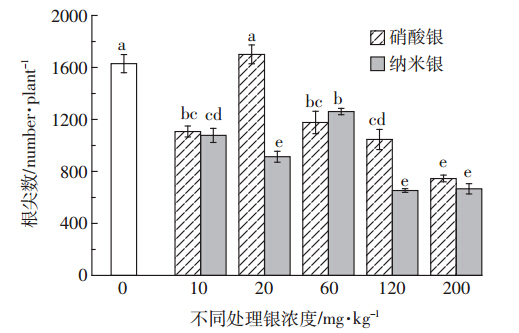 |
| 图 5 不同处理对黑麦草根尖数的影响 Figure 5 Effects of different silver concentrations on number of ryegrass root tips |
植物受外界胁迫而产生的氧自由基除部分被生物体歧化酶等解毒外,多余的自由基对根系代谢中的琥珀酸脱氢酶等造成伤害,从而使根系活力下降[31]。在60 mg·kg-1浓度下纳米银处理的黑麦草根系活力显著高于空白处理,而在纳米银浓度为10 mg·kg-1下,根系活力显著低于空白处理,其他浓度下二者差异不显著(图 6)。在10~60 mg·kg-1浓度内硝酸银处理的黑麦草根系活力显著高于空白处理;硝酸银处理仅在10、20 mg·kg-1浓度时黑麦草根系活力显著高于纳米银处理。
 |
| 图 6 不同处理对黑麦草根系活力的影响 Figure 6 Effects of different silver concentrations on activity of ryegrass roots |
纳米银的尺寸效应和氧化态银离子对植物产生一定的胁迫或抑制作用,且取决于纳米银的污染浓度。另外,进入土壤的纳米银与土壤中的矿物组分、土壤有机质和溶液中离子产生物理化学反应,改变了纳米银的形态,最终减弱纳米银对植物的影响。在本研究中,处理浓度为10 mg·kg-1时纳米银对黑麦草的生物量较空白处理无明显抑制作用,与Stampoulis等[18]研究结果一致;但随着银浓度增加,地上生物量下降,根系生物量先增高后降低(图 1),且显著影响黑麦草生物量的纳米银浓度阈值不同。浓度大于10 mg·kg-1 后其地上部的生物量显著下降,地下部则在浓度大于20 mg·kg-1后显著下降。这种现象类似于重金属污染的“毒物兴奋效应”,即由生物体对胁迫响应的“过渡补偿”引起的[32]。本研究表明,纳米银浓度较低(10、20 mg·kg-1)时,急性毒性不明显,甚至可以促进植物生长。氧化胁迫是纳米材料生物毒性在文献中普遍被认可的机制,而对于氧化胁迫,植物体会产生响应机制——氧化应激。林仁漳等[33]研究发现低浓度的土壤外源重金属能够通过抗氧化系统诱导SOD等酶的产生,促进植物体内活性氧的清除,从而促进植物生长。陆长梅等[34]研究发现某些纳米材料可促进大豆的萌发生长,防止种子发霉,提高根系活力、叶片硝酸还原酶活性以及抗氧化酶系活性,增强植物吸收水、肥与利用氮肥的能力。
银浓度20 mg·kg-1时黑麦草根冠比达最大,纳米银与硝酸银处理下黑麦草根冠比分别为2.43、2.33。银浓度大于20 mg·kg-1时,随浓度升高根冠比逐渐减小,高浓度时纳米银处理黑麦草生物量显著小于同浓度硝酸银处理。Jiang等[19]研究发现纳米银(粒径6~8 nm)不但影响紫背浮萍干重和鲜重,而且导致叶片萎黄及根细胞瓦解,最终导致浮萍新鲜叶脱落及根脱落;Yin等[20]也发现经纳米银处理后的黑麦草根、茎长及其生物量与纳米银浓度及粒径相关;Shah等[35]发现金属纳米材料能使莴苣根冠比减小。这说明纳米银对根系的抑制作用大于对地上部的抑制作用,同等剂量时纳米银对植物的毒害高于同浓度硝酸银。纳米银对植物毒害的机理是:纳米银的尺寸效应,其粒径尺寸越小对植物抑制作用和毒性越大[20];纳米银的表面被缓慢氧化释放出银离子并被植物受体所吸收,从而产生毒害[20, 36]。此外,纳米材料还引起氧化胁迫和脂质过氧化,导致DNA损伤,细胞结构被破坏以及细胞死亡[37, 38, 39, 40, 41],而表皮细胞的死亡脱落导致未成熟细胞的死亡,降低了根对水分、养分的吸收[42],最终降低生物量。此外,有报道表明,2.5 mg·kg-1的纳米银(10 nm)虽然能增加小麦的侧根数量,但明显抑制了根的伸长,造成生物量下降[14],可能因为纳米银对植物的毒害作用,与植物种类或供试土壤有关。也有研究表明,纳米银可以抑制植物根际微生物的生长导致侧根增多,使得地下部分生物量减少[6]。 3.2 不同处理对植物体内银残留量的影响
无论纳米银还是硝酸银,黑麦草体内银的残留量随其添加量的增加而增加(图 2),与Jiang等[19]对纳米银材料抑制紫背浮萍生长的研究结果类似。同等浓度处理下,硝酸银处理的黑麦草地上部银残留量显著高于纳米银处理(除浓度10、200 mg·kg-1外)。然而仅在120、200 mg·kg-1浓度作用下,硝酸银处理的黑麦草地下部银残留量显著低于纳米银处理,其他浓度范围内二者差异未达显著水平。上述结果表明,硝酸银较纳米银在植株体内的移动性高,纳米银易贮存于根系中,对根系的毒性更大一些。纳米银可通过根的吸收运输至茎部。纳米粒子进入植物体后主要通过共质体途径和质外体途径进行运输,但具体是哪种途径取决于纳米银粒径及化学态转化等因素[43]。纳米银处理后,其植物体内可能存在两种形式吸收和运输,即纳米银粒子和银离子形式[14],但具体的吸收和运输方式还有待研究。Yin等[20]的黑麦草苗期水培试验结果表明,无论地上部还是地下部,植物体内银的残留量随培养液中银浓度的增加而增高。在土壤体系与纯溶液培养体系中研究结果存在显著的不同:首先是介质不同,介质中氧化剂(氧气等)存在差异,导致纳米银被氧化成银离子的速率不同;其次,硝酸银和被转化为银离子的植物有效性存在差异,对于硝酸银,由于硝酸根离子的存在,在银离子被黑麦草吸收时可形成协同作用,促进银离子在植物体内转移。但由纳米银转化成的银离子在被吸收过程中,因缺乏相应的阴离子而受到抑制作用。此外,土壤体系更为复杂,土壤中的氧化剂含量、黏土颗粒、有机质和土壤溶液中电解质均通过吸附、包被等物理化学过程影响纳米银和银离子的植物有效性,最终导致二者对植物的毒害存在差异。 3.3 不同处理对黑麦草根系性状的影响
黑麦草暴露于高浓度纳米银处理中,使植株根系的根长和平均直径增加,根尖数降低,从而导致根的比表面积、根体积降低,抑制了整个根系的横向发育,且随浓度增加抑制作用逐渐增大。纳米银处理中银浓度大于20 mg·kg-1时根系直径显著增加,而硝酸银处理中银浓度大于60 mg·kg-1时根系直径显著增加。这与已报道的在浮萍[44]、西葫芦[45]、黑麦草[20]、洋葱[46]、水稻[21]等作物生长过程中纳米银的研究结果一致,其原因可能是纳米银诱导根的损伤使根逆重力方向弯曲,失去向地性,影响生长素在植物体内的运输,或是氧化胁迫使得根细胞瓦解,导致根系脱落[19]。
本研究还发现添加银浓度较低(10、20 mg·kg-1)时,植物根系生物量较空白处理有一定的增加。这可能是由于纳米银或银离子能够抑制乙烯的生成,进而降低其与吲哚乙酸的拮抗作用[14];或可能是类似于重金属污染的“毒物兴奋效应”,即由生物体对胁迫响应的“过渡补偿”引起的[32]。在纳米银浓度较低(10、20 mg·kg-1)时,根系总长度、根尖数、根系活力较空白处理有一定下降,但是根系的生物量却有不同程度的增加。造成上述矛盾的原因可能是低浓度的纳米银能够杀灭土壤中的有害微生物,在一定程度上降低了黑麦草为抵御有害微生物所需产生的活力强度,从而可在一定程度上增加黑麦草的产量。另外,Feng等[6]研究也证实,低剂量的纳米银或硝酸银促进黑麦草菌根的生长,并抑制有害微生物的生长,最终促进了根系的生物量的增加。当土壤中纳米银浓度为60 mg·kg-1时,黑麦草的根系活力较空白处理升高,但生物量的趋势是相反的。 4 结论
低浓度(<20 mg·kg-1)的纳米银对黑麦草生长有促进作用,而高浓度(>20 mg·kg-1)纳米银的抑制作用强于同浓度普通银离子;黑麦草体内的银含量随添加剂量的增加而增加。与硝酸银处理相比,纳米银处理中黑麦草根系中银含量更高。纳米银处理显著地降低了黑麦草根系总长度、活力和根尖数,但增加了根系平均直径。纳米银对植物毒害作用的机理不仅是因为纳米银能转化为离子态银,还与其粒径微小、比表面活性高等特有性质有关。
| [1] | 曲 晨, 刘 伟, 荣海钦, 等.纳米银的生物学特性及其潜在毒性的研究进展[J]. 环境与健康杂志, 2010, 27(9):842-845.QU Chen, LIU Wei, RONG Hai-qin, et al. Research advance on biological features and toxicities of silver nanoparticles[J]. Environment and Health, 2010, 27(9):842-845. |
| [2] | 高雯雯, 兰新哲, 宋永辉, 等.化学法制备形态可控纳米银的研究进展的研究[J]. 贵金属, 2009, 30(2):64-65.GAO Wen-wen, LAN Xin-zhe, SONG Yong-hui, et al. Research and development in preparation of shape-controlled silver nanoparticles by chemical methods[J]. Precious Metals, 2009, 30(2):64-65. |
| [3] | Maynard A D, Aitken R J, Butz T, et al. Safe handling of nanotechnology[J]. Nature, 2006, 444(7117):267-269. |
| [4] | Gottschalk F, Sonderer T, Scholz R W, et al. Modeled environmental concentrations of engineered nanomaterials(TiO2, ZnO, Ag, CNT, fullerenes) for different regions[J]. Environmental Science and Technology, 2009, 43(24):9216-9222. |
| [5] | Auffan M, Rose J, Wiesner M R, et al. Chemical stability of metallic nanoparticles:A parameter controlling their potential cellular toxicity in vitro[J]. Environmental Pollution, 2009, 157(4):1127-1133. |
| [6] | Feng Y Z, Cui X C, He S Y, et al. The role of metal nanoparticles in influencing arbuscular mycorrhizal fungi effects on plant growth[J]. Environmental Science and Technology, 2013, 47(16):9496-9504. |
| [7] | Mathias H, Christoph E. Effects of silver nanoparticles on the microbiota and enzyme activity in soil[J]. Plant Nutrition and Soil Science, 2010, 173(4):554-558. |
| [8] | Choi O, Hu Z. Size dependent and reactive oxygen species related nanosilver toxicity to nitrifying bacteria[J]. Environmental Science and Technology, 2008, 42(12):4583-4588. |
| [9] | Hwang E T, Lee J H, Chae Y J, et al. Analysis of the toxic mode of action of silver nanoparticles using stress-specific bioluminescent bacteria[J]. Small, 2008, 4(6):746-750. |
| [10] | Liau S Y, Read D C, Pugh W J, et al. Interaction of silver nitrate with readily identifiable groups relationship to the antibacterial action of silver ions[J]. Letters in Applied Microbiology, 1997, 25(4):279-283. |
| [11] | Feng Q L, Wu J, Chen C Q, et al. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. Journal of Biomedical Materials Research, 2000, 52(4):662-668. |
| [12] | 林道辉, 冀 静, 田小利, 等.纳米材料的环境行为与生物毒性[J].科学通报, 2009, 54(23):3590-3604.LIN Dao-hui, JI Jing, TIAN Xiao-li, et al. Environmental behavior and toxicity of engineered nanomaterials[J]. Chinese Science Bulletin, 2009, 54(23):3590-3604. |
| [13] | Ruffini C M, Cremonini R. Nanoparticles and higher plants[J]. Caryologia, 2009, 62(2):161-165. |
| [14] | Dimkpa C O, McLean J E, Martineau N, et al. Silver nanoparticles disrupt wheat(Triticum aestivum L.) growth in a sand matrix[J]. Environmental Science and Technology, 2013, 47(2):1082-1090. |
| [15] | Hernandez-Viezcas J A, Castillo-Michel H, Andrews J C, et al. In situ synchrotron X-ray fluorescence mapping and speciation of CeO2 and ZnO nanoparticles in soil cultivated soybean(glycine max)[J]. ACS Nano, 2013, 7(2):1415-1423. |
| [16] | Barrena R, Casals E, Colón J, et al. Evaluation of the ecotoxicity of model nanoparticles[J]. Chemosphere, 2009, 75(7):850-857. |
| [17] | El-Temsah Y S, Joner E J. Impact of Fe and Ag nanoparticles on seed germination and differences in bioavailability during exposure in aqueous suspension and soil[J]. Environmental Toxicology, 2012, 27(1):42-49. |
| [18] | Stampoulis D, Sinha S K, White J C. Assay-dependent phytotoxicity of nanoparticles to plants[J]. Environmental Science and Technology, 2009, 43(24):9473-9479. |
| [19] | Jiang H S, Li M, Chang F Y, et al. Physiological analysis of silver nanoparticles and AgNO3 toxicity to Spirodela polyrhiza[J]. Environmental Toxicology and Chemistry, 2012, 31(8):1880-1886. |
| [20] | Yin L Y, Cheng Y W, Espinasse B, et al. More than the ions:The effects of silver nanoparticles on Lolium multiflorum[J]. Environmental Science and Technology, 2011, 45(6):2360-2367. |
| [21] | Mazumdar H, Ahmed G. Phytotoxicity effect of silver nanoparticles on Oryza sativa[J]. International Journal of ChemTech Research, 2011, 3(3):1494-1500 |
| [22] | Zhu H, Han J, Xiao J Q, et al. Uptake, translocation, and accumulation of manufactured iron oxide nanoparticles by pumpkin plants[J]. Environmental Monitoring, 2008, 10(6):713-717. |
| [23] | Krishnaraj C, Jagan E G, Ramachandran R, et al. Effect of biologically synthesized silver nanoparticles on Bacopa monnieri(Linn.) Wettst. plant growth metabolism[J]. Process Biochemistry, 2012, 47(4):651-658. |
| [24] | 唐海明, 汤文光, 肖小平, 等. 冬种黑麦草对6种水稻土重金属含量及晚稻不同器官重金属累积与分配的影响[J]. 作物学报, 2012, 38(6):1121-1126.TANG Hai-ming, TANG Wen-guang, XIAO Xiao-ping, et al. Effects of winter ryegrass planting on soil heavy metal content and accumulation and distribution in different organs of late rice in six paddy soils[J]. Acta Agronomica Sinca, 2012, 38(6):1121-1126. |
| [25] | 王 晨, 王海燕, 赵 琨, 等. 硅对镉、锌、铅复合污染土壤中黑麦草生理生化性质的影响[J]. 生态环境, 2008, 17(6):2240-2245.WANG Chen, WANG Hai-yan, ZHAO Kun, et al. Effects of silicon on physiological and biochemical properties of ryegrass under the compound pollution of Cd, Zn and Pb[J]. Ecology and Environment, 2008, 17(6):2240-2245. |
| [26] | 王震宇, 于晓莉, 高冬梅, 等.人工合成纳米TiO2 和MWCNTs对玉米生长及其抗氧化系统的影响[J]. 环境科学, 2010, 31(2):480-487.WANG Zhen-yu, YU Xiao-li, GAO Dong-mei, et al. Effect of nano-rutile TiO2 and multiwalled carbon nanotubes on the growth of maize(Zea mays L.) seedlings and the relevant antioxidant response[J]. Environment Science, 2010, 31(2):480-487 |
| [27] | 赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京:中国农业科学技术出版社, 2002:47-48.ZHAO Shi-jie, SHI Guo-an, DONG Xin-chun. Techniques of plant physiological experiment[M]. Beijing:China Agriculture Scientech Press, 2002:47-48. |
| [28] | 叶 润, 刘芳竹, 刘 剑, 等.微波消解-电感耦合等离子体发射光谱法测定大米中铜、锰、铁、锌、钙、镁、钾、钠8 种元素[J].食品科学, 2014, 35(6):117-120.YE Run, LIU Fang-zhu, LIU Jian, et al. Determination of contents of Cu, Mn, Fe, Zn, Ca, Mg, K and Na in rice using microwave digestion and inductively coupled plasma-optical emission spectrometry[J]. Food Science, 2014, 35(6):117-120. |
| [29] | 高向阳, 王银娟, 卢 彬. 微波消解-连续光源原子吸收法快速顺序测定枸杞果中的6 种金属元素[J]. 食品科学 2011, 32(16):229-232.GAO Xiang-yang, WANG Yin-juan, LU Bin. Microwave digestion and continuum source atomic absorption spectrometric determination of six metal elements in medlar(Mespilus germanica L.) Fruit[J]. Food Science, 2011, 32(16):229-232. |
| [30] | 方金梅, 应朝阳, 黄毅斌, 等. 铝胁迫对决明属水土保持牧草幼苗根系的影响[J]. 中国水土保持, 2003(7):30-32.FANG Jin-mei, YING Chao-yang, HUANG Yi-bin, et al. Effects of aluminum force to the root system of herbage seedlings of Chamaecrista spp. for soil and water conservation[J]. Soil and Water Conservation in China, 2003(7):30-32. |
| [31] | 何翠萍, 王慧忠. 重金属镉、铅对草坪植物根系代谢和叶绿素水平的影响[J]. 湖北农业科学, 2003(5):60-63.HE Cui-ping, WANG Hui-zhong. Effect of cadmium and lead on the roots metabolizm and chlorophyll of lawn plant[J]. Hubei Agricultural Sciences, 2003(5):60-63. |
| [32] | Aina R, Labra M, Fumagalli P, et a1. Thiol-peptide level and proteomic changes in response to cadmium toxicity in Oryza sativa L. roots[J]. Environmental and Experimental Botany, 2007, 59(3):381-392. |
| [33] | 林仁漳, 杜文超, 王晓蓉, 等.土壤外源Cd胁迫对小麦幼苗生长自由基代谢及抗氧化酶活性的影响[J]. 农业环境科学学报, 2008, 27(1):23-29.LIN Ren-zhang, DU Wen-chao, WANG Xiao-rong, et al. Free radical metabolism and response of antioxidant enzymes in wheat seedlings(Triticum aestivum L.) exposed to soil cadmium[J]. Agro-Environment Science, 2008, 27(1):23-29. |
| [34] | 陆长梅, 张超英, 温俊强, 等.纳米材料促进大豆萌芽、生长的影响及其机理研究[J].大豆科学, 2002, 21(3):168-172.LU Chang-mei, ZHANG Chao-ying, WEN Jun-qiang, et al. Research of the effect of nanometer materials on germination and growth enhancement of glycine max and its mechanism[J]. Soybean Science, 2002, 21(3):168-172. |
| [35] | Shah V, Belozerova I. Influence of metal nanoparticles on the soil microbial community and germination of lettuce seeds[J]. Water, Air, and Soil Pollution, 2009, 197(1-4):143-148. |
| [36] | Liu J Y, Robert H. Ion release kinetics and particle persistence in aqueous nano-silver colloids[J]. Environmental Science and Technology, 2010, 44(6):2169-2175. |
| [37] | Oberd?rster E. Manufactured nanomaterials(Fullerenes, C60) induce oxidative stress in the brain of juvenile largemouth bass[J]. Environmental Health Perspect, 2004, 112(10):1058-1062. |
| [38] | Hsin Y, Chen C, Huang S, et al. The apoptotic effect of nanosilver is mediated by a ROS-and JNK-dependent mechanism involving the mitochondrial pathway in NIH3T3 cells[J]. Toxicology Letters, 2008, 179(3):130-139. |
| [39] | Li N, Xia T, Nel A E. The role of oxidative stress in ambient particulate matter-induced lung diseases and its implications in the toxicity of engineered nanoparticles[J]. Free Radical Biology and Medicine, 2008, 44(9):1689-1699. |
| [40] | Reeves J F, Davies S J, Dodd N J F, et al. Hydroxyl radicals(·OH) are associated with titanium dioxide(TiO2) nanoparticle induced cytotoxicity and oxidative DNA damage in fish cells[J]. Mutation Research, 2008, 640(1-2):113-122. |
| [41] | Sayes C M, Gobin A M, Ausman K D, et al. Nano-C60 cytotoxicity is due to lipid peroxidation[J]. Biomaterials, 2005, 26(36):7587-7595. |
| [42] | Vitoria A P, Rodriguez A P M, Cunha M, et al. Structural changes in radish seedlings exposed to cadmium[J]. Biologia Plantarum, 2003, 47(4):561-568. |
| [43] | Geisler-Lee J, Wang Q, Yao Y, et al. Phytotoxicity, accumulation and transport of silver nanoparticles by Arabidopsis thaliana[J]. Nanotoxicology, 2013, 7(3):323-337 |
| [44] | Gubbins E J, Batty L C, Lead J R. Phytotoxicity of silver nanoparticles to Lemna minor L.[J]. Environmental Pollution, 2011, 159(6):1551-1559. |
| [45] | Musante C, White J C. Toxicity of silver and copper to Cucurbita pepo:Differential effects of nano and bulk-size particles[J]. Environmental Toxicology, 2012, 27(9):510-517. |
| [46] | Kumari M, Mukherjee A, Chandrasekaran N. Genotoxicity of silver nanoparticles in Allium cepa[J]. The Science of the Total Environment, 2009, 407(19):5243-5246. |
 2015, Vol. 34
2015, Vol. 34





