文章信息
- 徐红霞, 李宵慧, 孙媛媛, 施小清, 吴吉春
- XU Hong-xia, LI Xiao-hui, SUN Yuan-yuan, SHI Xiao-qing, WU Ji-chun
- 一株荧蒽降解菌Herbaspirillum chlorophenolicum strain FA1的固定化及其优化
- Immobilization of Fluoranthene-Degrading Herbaspirillum chlorophenolicum strain FA1 and Its Optimization
- 农业环境科学学报, 2015, 34(4): 672-678
- Journal of Agro-Environment Science, 2015, 34(4): 672-678
- http://dx.doi.org/10.11654/jaes.2015.04.010
-
文章历史
- 收稿日期:2014-11-23
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类颇具代表性的疏水性有机物,在土壤和水体环境中分布广泛,由于明确或潜在的致癌、致畸、致突变作用[1, 2],PAHs的环境归趋已在全球范围内受到越来越多的关注。被美国环保局列为优先污染物的荧蒽[3](Fluoranthene),是由四个苯环组成的杂环芳烃,其分子中的五元环结构与二噁英和二苯呋喃相似,常被用作高分子PAHs生物降解研究的典型化合物[4, 5]。
与传统的物理或化学处理方法相比,利用微生物修复环境中的PAHs受到越来越多的重视,然而由于污染物的毒害作用以及环境中其他微生物、土著菌群的竞争和捕食作用,实验室筛选出的降解菌在实际修复中的应用仍面临挑战[6]。近来,微生物的固定化技术发展迅速,降解菌经固定后,具有保持微生物活性、降解效率高、稳定性好以及可重复利用等特点[7, 8, 9, 10],有效提高了微生物修复技术的实用性。在各类被用于固定化的载体中,聚乙烯醇(Polyvinyl alcohol,PVA)和海藻酸钠被广泛应用于降解微生物的固定,但不同研究采用的固定化方法不尽一致[8, 9, 10]。
目前已有较多关于PAHs生物降解的研究,具有降解荧蒽能力的细菌包括Sphingomonas paucimobilis[11],Pseudomonas[12]、Bacillus cereus[13]等,但对草螺菌属(Herbaspirillum)细菌降解PAHs的研究尚少有报道。课题组从活性污泥中筛选出一株能够降解多环芳烃荧蒽的草螺菌属细菌Herbaspirillum chlorophenolicum strain FA1[14],为了提高菌株FA1对荧蒽的降解效果,本研究采用不同载体和固定化方法来固定菌株,考察其对土水体系中荧蒽的降解性能,筛选出固定化效果最好的载体,并通过响应曲面法(Response surface methodology,RSM)进一步优化,确定最佳固定化条件并进行验证,以期为采用固定化技术修复PAHs污染环境的应用提供依据。 1 材料与方法 1.1 菌株和培养基
实验用荧蒽降解菌Herbaspirillum chlorophenolicum strain FA1筛选自南京某石化厂的活性污泥[14],其NCBI序列登录号为HM107777。
牛肉膏蛋白胨培养基:牛肉膏5 g·L-1,蛋白胨10 g·L-1,NaCl 5 g·L-1,pH 7.0~7.2。 无机盐培养基(MSM):磷酸盐缓冲液(pH7.0)100 mL·L-1,MgSO4 0.067 5 g·L-1,CaCl2 0.036 4 g·L-1,FeCl3溶液(0.25 g·L-1)1.0 mL·L-1,微量元素溶液[15][Mn2SO4 39.9 mg,ZnSO4·H2O 42.8 mg,(NH4)Mo7O24·4H2O 34.7 mg,水1.0 L]1.0 mL·L-1,pH 7.0。 1.2 供试土壤
采集南京大学校园内的表层土壤(5~20 cm),阴干,去杂后研细,过1 mm筛备用。土壤氮含量0.011%,磷含量0.042%,TOC为0.12%,土壤含水率为2.67%,pH7.7。将一定量的荧蒽甲醇溶液添加入土壤中制备人工污染土样,充分混合均匀后,纱布封口于通风阴暗处,待甲醇挥发完毕后,用铝箔包裹容器,置于黑暗处4 ℃恒温老化4周。 1.3 固定化载体制备
将菌株FA1接入牛肉膏蛋白胨培养基富集培养,将处于对数生长期的菌液以8000 r·min-1冷冻离心10 min,用磷酸盐缓冲液(pH 7.0)洗涤3次并稀释成浓度为7.2×109 CFU·mL-1的菌悬液。 1.3.1 海藻酸钠载体
于90 mL的4%(质量浓度,下同)海藻酸钠溶液中加入1.575 g改性硅藻土[16],接入菌悬液10 mL,充分混匀后滴入4% 的CaCl2溶液中,室温下静置1 h,于4 ℃下交联20 h[7],生理盐水冲洗2次后冷藏备用。小球直径约为4 mm。 1.3.2 硼酸法制备PVA复合载体
PVA-硅藻土载体:将90 mL含有12%PVA和1%海藻酸钠的混合溶液与10 mL菌悬液混合,加入2.5%的改性硅藻土,混匀后室温下静置1 h,滴入5%的硼酸溶液中[9](含2% CaCl2,pH 6.5~7.0),同时以磁力搅拌器搅动,防止粘连,4 ℃下交联20 h。将制得的小球浸泡在10%的硼酸溶液中30 min并保持搅动,然后置于0.5 mol·L-1的Na2SO4溶液中浸泡30 min并保持搅动,最后以无菌去离子水浸泡1 h后,生理盐水冲洗2次,冷藏备用。小球直径约4 mm。
PVA-活性炭载体:以等量活性炭代替硅藻土,同样方法制得PVA-活性炭载体小球。 1.3.3 冷冻-解冻法制备PVA复合载体
PVA-硅藻土载体:将90 mL含有12%PVA和1%海藻酸钠的混合溶液与10 mL菌悬液混合,加入2.5%的改性硅藻土。混匀静置1 h后,将溶液倾注于平板上,形成厚度约为3 mm的薄层。-20 ℃急冻12 h,4 ℃下融冻12 h。重复上述冻融过程2次后制备成边长为3 mm的小立方体颗粒。
PVA-活性炭载体:以等量活性炭代替硅藻土,同样方法制得PVA-活性炭载体颗粒。 1.4 游离和固定化菌株FA1对荧蒽的降解
为了比较不同方法固定的降解菌对荧蒽的降解效果,设置游离菌FA1和固定化菌株FA1对土水体系中荧蒽的降解实验,以游离菌为对照,筛选出降解效果好的载体进一步优化。根据课题组之前对土水反应体系的优化结果安排实验[14],于污染土样中分别加入吐温80、无机盐培养基及N源(NaNO3)、P源(K2HPO4·3H2O),使得反应体系中荧蒽浓度为5 mg·kg-1土壤,氮磷比为5∶1,盐度(氮磷总浓度)为2%,吐温80浓度为100 mg·kg-1土壤,土水比为1∶3,调节体系pH值至8.0。游离菌和固定化菌株降解体系中,菌株FA1的初始浓度均为7.8×107 CFU·g-1土壤。以无菌去离子水代替降解菌设置空白,同时设置3组平行样。样品置于黑暗环境下30 ℃恒温培养,每天摇匀,并通过称重法控制水分。定时取样,测定体系中的荧蒽含量。 1.5 固定化条件的优化 1.5.1 响应曲面法实验设计
根据1.4的结果,选取对荧蒽降解效率最高的PVA-硅藻土载体(硼酸法)进行固定化条件的RSM优化。选取影响降解菌固定化效果的4个主要因子[9, 17]:菌浓度(X1)、PVA浓度(X2)、硅藻土浓度(X3)和载体粒径(X4),采用Box-Behnken设计来安排试验。以4个影响因子为自变量,记为Xi;以对土水系统中荧蒽的降解率为响应值,记为Y。
根据实验设计,对自变量Xi按照式(1)进行编码转换,各影响因子的编码水平和对应实际值见表 1。

采用Design-Expert软件(Version 7.1,Stat-ease Inc.,USA) 进行实验设计与分析。根据Box-Behnken设计的因子水平组合(表 2) 以硼酸法制备PVA-硅藻土载体,按1.4的方法进行土水系统中荧蒽的降解实验,共计29组不同因素水平组合,中心点处安排5次重复,样品培养20 d后,测定荧蒽残留量。
 |
对1.5.1的实验数据进行分析,建立二次多项回归方程来描述自变量和响应值之间的关系(式2)[18],并对回归方程和方程各项系数的统计显著性进行评价。对实验所得数据和模型的预测值进行方差分析(Analysis of variance,ANOVA),观察模型的实际拟合效果。
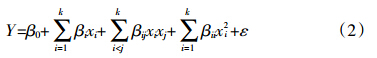
根据RSM的优化结果,以硼酸法制备降解菌FA1的PVA-硅藻土载体,参照1.4的方法设置荧蒽的土水反应体系,向体系接入包埋高温灭活菌体的载体作为空白,反应20 d后取样测定荧蒽的降解率,与模型的预测结果对比。为了考察载体的可重复利用性,按照上述实验设置进行连续多次的荧蒽降解实验,将载体接入降解体系中,反应10 d后取出,测定体系中荧蒽残留量,并将载体重新接入至相同的新鲜降解体系,如此循环进行8次降解实验。 1.6 荧蒽测定
盐酸调节待测样品的pH值至2.0左右,加入二氯甲烷静置2 h后,以150 r·min-1振荡1 h,超声萃取1 h,将混合液以4000 r·min-1离心20 min,重复萃取2次[19]。收集有机相,无水Na2SO4除水后真空旋转蒸发,以甲醇定容至10 mL,过0.22 μm滤膜,HPLC测定。HPLC条件为:HPEclipse XDB-C8柱(5 μm,4.6 mm×150 mm),甲醇∶水=80∶20,流速1.0 mL·min-1,DAD检测器,检测波长235 nm,柱温40 ℃,进样量20 μL。外标法定量。 2 结果与讨论 2.1 菌株FA1固定化载体的筛选
在此前的多环芳烃生物降解研究中,课题组从活性污泥中分离出一株以荧蒽为唯一碳源和能源且生长良好的草螺菌属细菌Herbaspirillum chlorophenolicum strain FA1[14]。为了提高菌株对荧蒽的降解效果和易于生物修复应用,采用不同材料和方法固定化菌株FA1,考察其对土水系统中荧蒽的降解效果,以FA1的游离菌为对照,筛选出固定化效果最好的载体以便进一步优化,结果如图 1所示。
 |
| 图 1 游离和固定化菌株FA1对土水体系中荧蒽的降解 Figure 1 Fluoranthene degradation by free and immobilized cells of strain FA1 in soil-water system |
游离菌FA1对土水系统中荧蒽的25 d降解率为65.94%,与游离菌相比,除了海藻酸钠载体外,其余4种PVA复合载体对荧蒽的25 d降解率均明显增加。其中,硼酸法制备的PVA-硅藻土载体的表现最为优异,在反应的最开始阶段即能够迅速降解荧蒽,反应进行15 d后,对土水系统中荧蒽的降解率超过87%,反应25 d后,对荧蒽的降解率达97.74%,体系中的荧蒽几乎完全被去除。此外,在接种了含灭活降解菌的PVA-硅藻土载体(硼酸法)的对照体系中,荧蒽浓度无显著变化(减少量小于2%),说明反应体系中荧蒽浓度的降低主要是由载体对荧蒽的降解造成的。对降解菌进行固定后,提高了单位体积介质中的微生物密度。荧蒽通过扩散作用从载体外部进入载体内部,形成浓度梯度,使其内部的微环境与游离菌株所处的环境不同,载体内生物细胞受到的污染物毒害压力较小[10],有利于细胞的生理特性以及降解所需生物酶的活性保持,从而有效提高了对荧蒽的降解效率。Li等[8]研究表明,经固定化处理后Zoogloea sp.对土水体系中菲和芘的降解效果有了明显提高,降解率超出游离态Zoogloea sp.的两倍。
在实验的几种载体中,海藻酸钠载体的表现最为脆弱,对荧蒽的降解效果远低于其他载体(图 1)。20 ℃下海藻酸钠载体6 d内的质量变化率较小,随着温度的升高,载体颗粒的稳定性和机械强度随之下降[7]。本实验在30 ℃下进行,降解过程中海藻酸钠载体的溶胀现象明显,部分载体颗粒在反应进行5 d后即膨胀碎裂,其对荧蒽的降解也随之处于停滞状态。这可能是由于载体颗粒的膨胀和碎裂阻碍了氧气的传导,反应体系中溶解氧锐减,妨害了微生物的生长和代谢并使其失去活性所致。
从图 1可以看出,在反应进行25 d内,以硼酸法或冷冻-解冻法制备的PVA-硅藻土载体对荧蒽的降解率始终优于PVA-活性炭载体。与硼酸法不同,使用冷冻-解冻法制备PVA复合载体时,由于方法本身的特点,不易制备球形载体。虽然两种方法制备的PVA复合载体形状不同,但含有不同载体反应体系的降解菌初始浓度是一致的。实验结果表明硼酸法制备的PVA复合载体(PVA-硅藻土和PVA-活性炭载体)对荧蒽的降解率比相应冷冻-解冻法制备的载体高,与Li等[8]的研究结果一致。但是在喹啉的生物降解过程中,与硼酸法制得的PVA载体相比,冷冻-解冻法制备的PVA载体对喹啉的降解速率更高[20]。这些结果说明利用复合载体来固定降解菌时,其对污染物的降解效果不仅受载体成分的影响,还和载体的制备方法密切相关。 2.2 菌株FA1固定化参数的优化
根据2.1的实验结果,对PVA-硅藻土载体(硼酸法)的制备参数采用响应曲面法(RSM)进行优化。RSM法已被成功应用于诸多生物处理工程的条件优化[17, 18],该方法将体系的响应作为一个或多个因素的函数,通过相对较少的组合试验来建立回归方程模型,并对各影响因素的水平及交互作用进行评价,从而快速确定系统的最佳条件。本文以响应值(荧蒽降解率)最大化为条件,采用4因素的Box-Behnken实验设计来考察菌浓度、PVA浓度、硅藻土浓度以及粒径对载体固定化效果的影响,在各因子的编码值范围内(-1~+1)求取其最优解。Box-Behnken设计和相应的实验结果如表 2所示。通过Design Expert软件对实验数据进行二次多项回归拟合,获得荧蒽降解率对四个独立变量的二次多项回归模型为 :

对所得的模型及模型的各项系数进行方差分析(ANOVA),确定其统计显著性(表 3)。由方差分析结果可以看出,模型P<0.000 1,远小于显著水平0.05,说明根据实际降解数据拟合得到的模型是显著的,且R2为0.948,反映出模型的预测值与实验所得荧蒽降解率吻合良好,说明模型的统计具有显著性。通常情况下变异系数CV(Coefficient of variation)值越低,实验的可信度越好。本实验设计的CV值为5.25%,说明所建模型具有良好的可靠性,可以利用该模型进行分析和荧蒽降解预测。对模型中各项变量的显著性检验表明:x1(菌浓度)、x2(PVA 浓度)和x3(硅藻土浓度)对荧蒽降解率的线性效应显著,对响应值(荧蒽降解率)的影响程度依次为PVA浓度>硅藻土浓度>菌浓度;x2、x3和x4(粒径)对响应值的曲面效应显著,并且菌浓度(x1)和硅藻土含量(x3)之间、硅藻土含量(x3)和粒径(x4)之间存在着较强的交互作用。
由响应曲面三维图(图 2),可以直观地看出各因素之间的相互影响和关系,且各因素对响应值的影响并不是简单的线性关系,与表 3中模型的方差分析结果一致。
 |
| 图 2 PVA-硅藻土载体(硼酸法)的影响因子对荧蒽降解率的响应曲面 Figure 2 Response surface plotting effects of immobilization parameters of PVA-diatomite matirx (boric acid method) on fluoranthene degradation |
如图 2(a)所示,在试验水平范围内,要使得荧蒽降解率最大化,硅藻土浓度应控制在4%~6%之间,菌浓度的设置范围则为8%~12%。当硅藻土浓度在5%以下时,PVA-硅藻土载体对土水系统中荧蒽的降解率随着硅藻土含量的增加而增加;而当菌浓度增加时,荧蒽降解率的上升幅度较小。改性硅藻土具有较好的孔状结构[16],在一定范围内增加载体中硅藻土的含量有助于增加载体内部的孔隙和连通性,提高载体的传质效率,进而提高固定化菌株对污染物的降解能力。载体中固定的微生物量过少不利于降解反应的快速进行,但微生物量过多不仅会引起诸如碳源、营养源和氧气上的竞争,还将占据更多的载体孔隙空间,降低载体的传质性能[21]。因为固定化材料和降解微生物的差异,已有报道中微生物的包埋量各不相同[22, 23]。在Lee等[22]利用不同载体固定混合菌株来降解柴油的研究中,混合降解菌的包埋量为109 CFU·g-1。Chorao等[23]利用固定在海藻酸钠载体中的Rhodococcus rhodochrous降解2-氨基苯并噻唑时,采用的微生物包埋量为108 CFU·g-1。
如图 2(b)所示,当粒径一定时,随着PVA浓度的增加,载体对荧蒽的降解率随之先增加后减小;当PVA浓度一定时,随着粒径的增加,载体对荧蒽的降解率表现出相同的变化规律。载体的比表面积随着粒径的减小而增大;与之相反,传质阻力随着载体粒径的增加而增大[17]。据Idris等[9]的报道,PVA浓度为12%的载体在保持酶活性和稳定性方面较之10.5%浓度的PVA载体更具优势,但高浓度PVA所制备载体的内部孔隙相对较小,固定在其中的降解菌细胞容易凝结在一起,妨碍氧气和基质的传输速率,使得生物降解效率下降。从响应曲面图 2(b)可以直接判断出PVA浓度和粒径应该分别设置在10%~12%和3.0~5.0 mm的范围内。类似地,从响应曲面图 2(c)可以看出荧蒽降解率随着硅藻土浓度或粒径的增加呈现出先上升后下降的趋势。为了荧蒽降解率的最大化,硅藻土浓度和粒径的取值范围分别为3%~5%和3.5~4.5 mm。
通过对回归模型(式3)进行求导和解逆矩阵,确定PVA-硅藻土载体(硼酸法)的最佳水平分别为:菌浓度 9.6%、PVA浓度 11.2%、硅藻土浓度 4.5%、粒径4.0 mm,此条件下载体中降解菌FA1的包埋量为6.3×108 CFU·g-1。将该最优水平代入回归模型(式3)求解,得到优化条件下载体对荧蒽降解率的理论预测值为99.98%。 2.3 模型验证及载体可重复使用性
为了检验所建模型预测结果的可靠性,根据优化后的结果制备PVA-硅藻土载体(硼酸法),进行土水体系中荧蒽的降解实验,测得荧蒽的20 d降解率为99.46%,该结果与模型的理论预测值99.98%非常接近,证明了回归模型的有效性和采用响应曲面法优化固定化参数的可行性。
载体的可重复利用性是其可否应用于实际修复的重要依据之一。为了考察对优化后PVA-硅藻土载体的可重复使用性,将载体接入荧蒽的土水反应体系,进行连续多次的荧蒽降解实验,每次降解反应持续10 d。结果表明,在实验设置的8次循环降解过程中,固定在载体内的菌株FA1对荧蒽的10 d降解率并无显著差异。使用80 d以后,载体的形态保持完好,且在反应过程中无明显溶胀和成分析出现象。 3 结论
(1)海藻酸钠载体在30 ℃下稳定性较差,易溶胀碎裂。荧蒽降解菌Herbaspirillum chlorophenolicum strain FA1经PVA复合载体固定后,对荧蒽的降解率明显增加。其中,PVA-硅藻土载体(硼酸法或冷冻-解冻法)对荧蒽的降解率高于PVA-活性炭载体;硼酸法制备的PVA-硅藻土和PVA-活性炭载体对荧蒽的降解效果优于相应冷冻-解冻法制得的载体。
(2)采用响应曲面法对PVA-硅藻土载体(硼酸法)的4个主要参数进行优化,确定其最佳水平分别为:菌浓度 6.3×108 CFU·g-1、PVA浓度 11.2%、硅藻土浓度 4.5%、粒径4.0 mm。在此条件下固定的菌株FA1对荧蒽的20 d降解率达99.46%。
| [1] | Rybicki B A, Nock N L, Savera A T, et al. Polycyclic aromatic hydrocarbon-DNA adduct formation in prostate carcinogenesis[J]. Cancer Letters, 2006, 239(2):157-167. |
| [2] | Brody J G, Moysich K B, Humblet O, et al. Environmental pollutants and breast cancer-epidemiologic studies[J]. Cancer, 2007, 109(12):2667-2711. |
| [3] | 沈德中. 污染环境的生物修复[M]. 北京:化学工业出版社, 2002:51-53.SHEN De-zhong. Bioremediation of contaminated environment[M]. Beijing:Chemical Industry Press, 2002:51-53. |
| [4] | Hickey A M, Gordon L, Dobson A D W, et al. Effect of surfactants on fluoranthene degradation by Pseudomonas alcaligenes PA-10[J]. Applied Microbiology and Biotechnology, 2007, 74(4):851-856. |
| [5] | Lei A P, Hu Z L, Wong Y S, et al. Removal of fluoranthene and pyrene by different microalgal species[J]. Bioresource Technology, 2007, 98(2):273-280. |
| [6] | Naidu R. Recent advances in contaminated site remediation[J]. Water Air Soil Pollution, 2013, 224:1-11. |
| [7] | 翟晓萌, 李道棠. 海藻酸钠固定化包埋微生物处理有机微污染源水[J]. 环境科学, 2000, 21(6):80-84.ZHAI Xiao-meng, LI Dao-tang. Organic micropolluted source water treatment by immobilized cells[J]. Environmental Science, 2000, 21(6):80-84. |
| [8] | Li P, Wang X, Stagnitti F, et al. Degradation of phenanthrene and pyrene in soil slurry reactors with immobilized bacteria Zoogloea sp.[J]. Environmental Engineering Science, 2005, 22(3):390-399. |
| [9] | Idris A, Zain N A M, Suhaimi M S. Immobilization of baker's yeast invertase in PVA-alginate matrix using innovative immobilization technique[J]. Process Biochemistry, 2008, 43(4):331-338. |
| [10] | Partovinia A, Naeimpoor F. Phenanthrene biodegradation by immobilized microbial consortium in polyvinyl alcohol cryogel beads[J]. International Biodeterioration & Biodegradation, 2013, 85:337-344. |
| [11] | Willumsen P A, Arvin E. Kinetics of degradation of surfactant-solubilized fluoranthene by a Sphingomonas paucimobilis[J]. Environmental Science & Technology, 1999, 33(15):2571-2578. |
| [12] | Gordon L, Dobson A D W. Fluoranthene degradation in Pseudomonas alcaligenes PA-10[J]. Biodegradation, 2001, 12(6):393-400. |
| [13] | Fuchedzhieva N, Karakashev D, Angelidaki I. Anaerobic biodegradation of fluoranthene under methanogenic conditions in presence of surface-active compounds[J]. Journal of Hazardous Materials, 2008, 153:123-127. |
| [14] | Xu H X, Wu H Y, Qiu Y P, et al. Degradation of fluoranthene by a newly isolated strain of Herbaspirillum chlorophenolicum from activated sludge[J]. Biodegradation, 2011, 22:335-345. |
| [15] | 雷 萍, 聂麦茜, 温晓玫, 等. 优势黄杆菌对蒽、菲、芘混合物的降解特征研究[J]. 西安交通大学学报, 2004, 38(6):657-660.LEI Ping, NIE Mai-qian, WEN Xiao-mei, et al. Study to degradation characters of preponderant flavobacterials strains in a mixture of anthrance, phenanthrene and pyrene[J]. Journal of Xi'an Jiaotong University, 2004, 38(6):657-660. |
| [16] | 石太宏, 贾世国, 陈 颖, 等. 改性天然矿物吸附废水中重金属离子的研究进展[J]. 水处理技术, 2009, 35(4):18-23.SHI Tai-hong, JIA Shi-guo, CHEN Ying, et al. Removal of heavy metal ions from wastewater by modified natural ores as adsorbents:A review[J]. Technology of Water Treatment, 2009, 35(4):18-23. |
| [17] | Gummadi S N, Ganesh K B, Santhosh D. Enhanced degradation of caffeine by immobilized cells of Pseudomonas sp. in agar-agar matrix using statistical approach[J]. Biochemical Engineering Journal, 2009, 44(2-3):136-141. |
| [18] | Annadurai G, Ling L Y, Lee J F. Statistical optimization of medium components and growth conditions by response surface methodology to enhance phenol degradation by Pseudomonas putida[J]. Journal of Hazardous Materials, 2008, 151(1):171-178. |
| [19] | 平立凤, 李 振, 赵 华, 等. 土壤样品中多环芳烃分析方法研究进展[J]. 土壤通报, 2007, 38(1):179-184.PING Li-feng, LI Zhen, ZHAO Hua, et al. Advance in analytical methods for the determination of polycyclic aromatic hydrocarbons in soil[J]. Chinese Journal of Soil Science, 2007, 38(1):179-184. |
| [20] | Wang J L, Quan X C, Han L P, et al. Microbial degradation of quinoline by immobilized cells of Burkholderia pickettii[J]. Water Research, 2002, 36(9):2288-2296. |
| [21] | 李 婷, 任 源, 韦朝海. 固定化Lysinibacillus cresolivorans的PVA-SA-PHB-AC复合载体制备及间甲酚的降解[J]. 环境科学, 2013, 34(7):2899-2905.LI Ting, REN Yuan, WEI Chao-hai. Preparation of PVA-SA-PHB-AC composite carrier and m-cresol biodegradation by immobilized Lysinibacillus cresolivorans[J]. Environmental Science, 2013, 34(7):2899-2905. |
| [22] | Lee Y C, Shin H J, Ahn Y, et al. Biodegradation of diesel by mixed bacteria immobilized onto a hybrid support of peat moss and additives:A batch experiment[J]. Journal of Hazardous Materials, 2010, 183:940-944. |
| [23] | Chorao C, Charmantray F, Besse-Hoggan P, et al. 2-Aminobenzothiazole degradation by free and Ca-alginate immobilized cells of Rhodococcus rhodochrous[J]. Chemosphere, 2009, 75:121-128. |
 2015, Vol. 34
2015, Vol. 34





