文章信息
- 高敏, 贾瑞志, 仇天雷, 韩梅琳, 宋渊, 王旭明
- GAO Min, JIA Rui-zhi, QIU Tian-lei, HAN Mei-lin, SONG Yuan, WANG Xu-ming
- 集约化养鸡场空气环境中生物气溶胶特点研究
- Characteristics of Bioaerosols in Air Environment of Confined Poultry Feeding Operations
- 农业环境科学学报, 2015, 34(4): 787-794
- Journal of Agro-Environment Science, 2015, 34(4): 787-794
- http://dx.doi.org/10.11654/jaes.2015.04.026
-
文章历史
- 收稿日期:2014-10-13
2. 中国农业大学生物学院, 北京 100193
2. College of Biological Sciences, China Agricultural University, Beijing 100193, China
目前,集约化养殖已经成为家禽养殖的主要方式,但在集约化养殖过程中,动物在小范围内高密度聚集,其散发的化学和生物质对周边空气环境造成严重污染,并可远距离传播,具体包括有机无机尘埃、有害气体和生物气溶胶等[1]。
生物气溶胶是具有生命的气溶胶粒子(包括细菌、真菌、病毒等微生物粒子)和活性粒子(花粉、孢子等)以及由有生命活性的机体所释放到空气中的质粒等[2]。畜禽养殖过程逸散的生物气溶胶中含有致病微生物,可通过空气长距离传播,危害动物[3]和从业人员[4, 5]的健康并污染周围环境[6]。作为空气环境污染的一个重要源头,人们自上世纪70年代开始对畜禽养殖空气环境中的生物气溶胶展开研究[7, 8]。近些年具有防疫和促生长作用的抗生素在畜禽养殖业大量使用[9],导致空气中抗生素耐药菌[10]和耐药基因[4]的出现,使得畜禽养殖空气环境中生物气溶胶的潜在危害性增加。
目前,国内家禽集约化养殖方式主要有笼养和网上养殖两种。北京地区蛋鸡通常采用笼养,而肉鸡采用网上养殖。二者在存栏时间、粪便处理周期、饲料成分以及抗生素使用等方面均存在差异,导致逸散的生物气溶胶可能有所不同。针对以上情况,本研究对肉鸡和蛋鸡养殖过程中逸散生物气溶胶的浓度、粒径分布以及抗生素抗性菌浓度进行了对比分析,以期为不同养殖条件下,禽场空气环境中生物气溶胶的危害评估提供基础数据。 1 材料与方法 1.1 采样地点和时间
采样地点为北京市怀柔区(肉鸡养殖场)和平谷区(蛋鸡养殖场)。采样时间从2013年8月到2014年5月,一共对北京两个区的7家规模化养鸡场进行调查,其中蛋鸡3家(代码A~C),肉鸡4家(D~G)。共采集空气样品15次,蛋鸡8次,肉鸡7次。同时记录养殖密度、鸡龄、鸡舍清洁度、舍内外温度和湿度等信息。本研究将清洁度分为1~5个等级,数值越高表明卫生状况越差。样品采集信息如表 1所示。
 |
生物气溶胶的采集使用FA-I撞击式采样器(辽阳,中国)。该仪器将空气中的带菌粒子按大小分别捕获在各级的培养皿上:StageⅥ(0.65~1.1 μm)、StageⅤ(1.1~2.1 μm)、StageⅣ(2.1~3.3 μm)、StageⅢ(3.3~4.7 μm)、StageⅡ(4.7~7.0 μm )和 StageⅠ(>7.0 μm)。采样高度1.5 m,样品采集时间为2 min,气体流量为28.3 L·min-1,每次采样前用流量计(余姚,中国)对采样泵的流量进行校准。样品采集采用五点法,即鸡舍对角线的交叉点以及每条对角线的两个四分点。每个采样点重复取样3次,鸡舍内浓度为五点的平均值。舍内空气温度和相对湿度的检测采用相同方式,使用温湿度计(WD-35612,OAKTON,德国)检测。 1.2.1 细菌和真菌气溶胶的培养
采用9 cm培养皿,灭菌后在无菌条件下加入20 mL培养基。细菌采用牛肉膏蛋白胨培养基,30 ℃培养箱内培养2 d;真菌采用孟加拉红培养基,25 ℃培养箱内培养3 d。采集样品后进行菌落计数时,采用Positive hole method 方法对菌落数进行相应校正。 1.2.2 总大肠菌群气溶胶的培养
总大肠菌群的采集使用伊红美蓝培养基。经36 ℃培养箱内培养1 d后,挑取以下形态菌落进行乳糖发酵实验:(1)深紫黑色、具有光泽的菌落;(2)紫黑色、不带或略带金属光泽的菌落;(3)淡紫红色、中心较深的菌落。确定大肠菌群数量。具体方法参照国标GB/T 5750.12—2006。 1.2.3 抗生素耐药菌气溶胶培养
抗生素溶液的配制:800 mg·L-1四环素溶液的溶剂为超纯水,采用0. 22 μm 水相滤头(聚醚砜)过滤。4800 mg·L-1红霉素溶液的溶剂为乙醇溶液,采用0.22 μm 有机相滤头(尼龙)过滤。每次使用当日配制。
抗生素抗性培养基:将相应的培养基灭菌后冷却至45~50 ℃,分别加入过膜除菌后的四环素和红霉素母液,摇均匀,使培养基中这两种抗生素的最终浓度分别为8 mg·L-1和48 mg·L-1。 1.3 计算方法 1.3.1 生物气溶胶总浓度
根据采样时间和气体流量,利用公式(1)计算各级生物气溶胶总浓度。

因FA-I撞击式采样器无PM2.5切割器,依据以往报道[11],本文将粒径D50≤2.1 μm(StageⅢ)定义为细颗粒物。细颗粒物中生物气溶胶比例(FBT)计算公式如下:
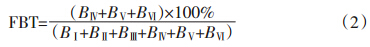
利用SPSS 21.0来计算描述性统计参数,如t-检验、单因素方差分析和Spearman′s 相关性分析。当P<0.05时,表明在95%的置信区间内具有统计学意义上的差异;当P<0.01时,表明在99%的置信区间内具有统计学意义上的显著差异。 2 结果与分析 2.1 禽舍内外空气环境中生物气溶胶浓度和影响因素
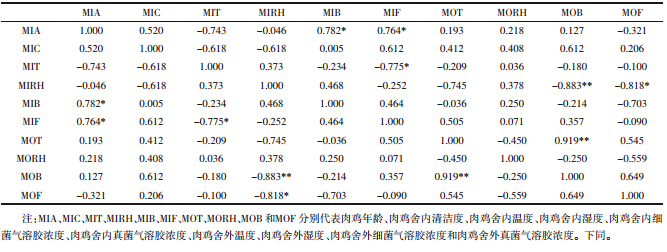
首先,对肉鸡和蛋鸡舍内外空气环境中细菌和真菌气溶胶的浓度进行检测,结果如图 1所示。其中,EI、EO、MI和MO分别代表蛋鸡舍内、蛋鸡舍外、肉鸡舍内和肉鸡舍外。
 |
 |
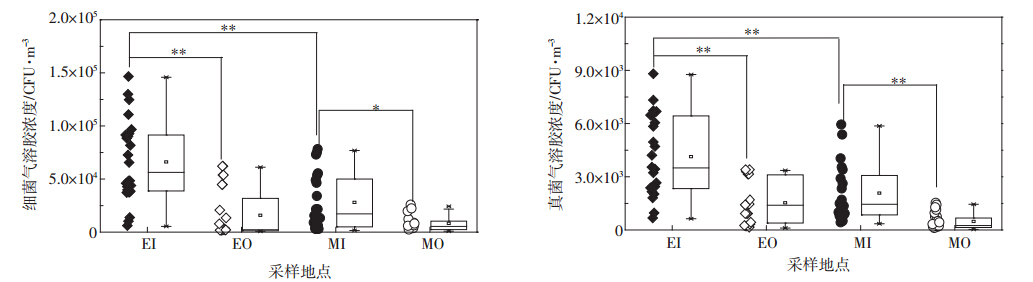 |
| EI、EO、MI和MO分别代表蛋鸡舍内、蛋鸡舍外、肉鸡舍内和肉鸡舍外。**P<0.01,*P<0.05。下同 图 1 肉鸡和蛋鸡舍内外空气中细菌(左图)和真菌(右图)气溶胶浓度 Figure 1 Concentrations of airborne bacteria(left) and fungi(right) in both inside and outside air of layer and broiler houses |
在所调查北京郊区县禽场空气中,蛋鸡舍内细菌气溶胶的平均浓度高于肉鸡舍内(P<0.01),浓度分别为7.48×104 CFU·m-3(EI)和3.72×104 CFU·m-3(MI),舍外的平均浓度分别为3.02×103 CFU·m-3和3.36×103 CFU·m-3,蛋鸡和肉鸡舍内细菌气溶胶浓度均高于舍外(P<0.01)。魏磊等[12] 对潍坊市鸡舍内细菌气溶胶浓度进行检测,其浓度与本研究结果相近,本研究调查的蛋鸡舍内细菌气溶胶浓度略低于莱芜市蛋鸡舍内浓度[13]。值得注意的是,在所调查的15次试验中,有10次禽舍内细菌气溶胶浓度超出我国《畜禽场环境质量标准》的限定值(2.5×104 CFU·m-3)。
整体上,所调查的鸡舍内部真菌气溶胶的浓度低于细菌气溶胶(P<0.01)。与细菌气溶胶浓度的分布规律相似,蛋鸡舍内真菌气溶胶浓度大于肉鸡舍(P<0.01),分别为4.53×103 CFU·m-3(EI)和2.39×103 CFU·m-3(MI)。目前,国内关于禽舍中真菌气溶胶的研究少有报道。国外学者在鸡舍空气中检测出两个致病真菌气溶胶,烟曲霉(Aspergillus fumigatus)和热带念珠菌(Candida tropicalis)[14]。根据本研究结果,禽舍内可培养真菌气溶胶浓度较高,将来还需要对禽舍内致病真菌气溶胶进一步研究。
本文所调查北京两区县内,蛋鸡舍内空气环境中生物气溶胶浓度要高于肉鸡舍,分析原因可能有以下几个方面。首先,消毒方式和周期可能影响舍内生物气溶胶[1]。虽然蛋鸡养殖的消毒周期(7 d左右)小于肉鸡(40 d左右),但蛋鸡的消毒方式是带鸡作业,很难去除彻底,而肉鸡是待鸡出栏后,对空鸡舍进行清理和消毒,确保了空气微生物有效去除。其次,粪便作为舍内生物气溶胶的主要来源,是另一个重要的影响因素[15]。蛋鸡清粪周期要小于肉鸡(1 d),清粪的机械作用加速了粪便中微生物气溶胶化过程,导致蛋鸡舍内空气微生物浓度较高。最后,蛋鸡的养殖密度和规模大于肉鸡(表 1),高密度禽类也可能导致空气环境中微生物浓度较高。为排除采样期间季节因素对浓度的影响,对春季(3—5月)采集的蛋鸡和肉鸡舍内空气微生物浓度进行了对比。结果显示,蛋鸡舍内细菌气溶胶(6.85×104 CFU·m-3)和真菌气溶胶的平均浓度(3.92×103 CFU·m-3)分别高于肉鸡舍内细菌气溶胶(3.72×104 CFU·m-3)和真菌气溶胶的平均浓度(2.39×103 CFU·m-3)。
与土壤、水体和粪便中微生物不同,空气微生物对多种环境因素敏感。本研究分别考察了蛋鸡和肉鸡舍内外环境温度、环境湿度、鸡龄、养殖密度、鸡舍内卫生状况多个因素与生物气溶胶浓度之间的关系,以期找到可能的影响因素。以上各项指标间的Spearman 相关性分析结果分别如表 2、表 3所示,表中:EIA、EIC、EIT、EIRH、EIB、EIF、EOT、EORH、EOB和EOF分别代表蛋鸡年龄、蛋鸡舍内清洁度、蛋鸡舍内温度、蛋鸡舍内湿度、蛋鸡舍内细菌气溶胶浓度、蛋鸡舍内真菌气溶胶浓度、蛋鸡舍外温度、蛋鸡舍外湿度、蛋鸡舍外细菌气溶胶浓度和蛋鸡舍外真菌气溶胶浓度,MIA、MIC、MIT、MIRH、MIB、MIF、MOT、MORH、MOB和MOF分别代表肉鸡年龄、肉鸡舍内清洁度、肉鸡舍内温度、肉鸡舍内湿度、肉鸡舍内细菌气溶胶浓度、肉鸡舍内真菌气溶胶浓度、肉鸡舍外温度、肉鸡舍外湿度、肉鸡舍外细菌气溶胶浓度和肉鸡舍外真菌气溶胶浓度。
由表 2可知,舍内细菌和真菌气溶胶浓度同舍外细菌(P<0.05)和真菌气溶胶浓度正相关,说明蛋鸡舍外生物气溶胶可能是来自于舍内。同时相关性结果显示,舍内生物气溶胶浓度同舍内温度负相关,而以往对城市空气环境的调查结果显示,生物气溶胶浓度同温度成正比[16]。造成该差异的原因可能是鸡舍的通风状态不同。在冬季,鸡舍处于封闭状态,虽然舍内温度较低,生物气溶胶因难以逸散而浓度较高;夏季虽然舍内温度较高,但是鸡舍处于开放通风状态,舍内生物气溶胶逸散至舍外,使得舍内浓度较低。本研究结果显示,舍内外真菌气溶胶的浓度均与湿度成正比,并未发现鸡龄和舍内清洁度同生物气溶胶之间的显著相关性。
根据肉鸡舍内外生物气溶胶浓度影响因素分析可知(表 3),鸡龄与舍内细菌(P<0.05)和真菌(P<0.05)气溶胶浓度均呈显著正相关。说明在肉鸡养殖过程中,舍内细菌和真菌气溶胶的浓度随着鸡龄的增长而增长。与蛋鸡舍内生物气溶胶的规律相似,肉鸡舍内生物气溶胶的浓度与温度呈负相关,该现象可能也与通风状态有关。值得注意的是,所调查肉鸡舍内和舍外生物气溶胶浓度与温度的相关性有所差异,而本阶段研究并没有检测到肉鸡舍内外生物气溶胶浓度之间存在显著相关性,说明肉鸡舍内生物气溶胶可能不是舍外生物气溶胶的主要来源。 2.2 禽舍内外空气环境中生物气溶胶粒径分布 2.2.1 生物气溶胶粒径分布
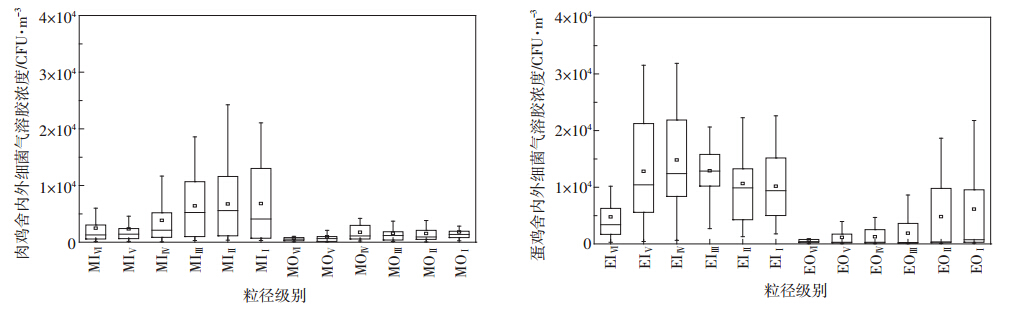
不同粒径的生物气溶胶可沉降在人体呼吸道的不同位置,所引起的危害有所差异,如粒径≥6 μm的粒子通常被截留在鼻腔内,而<2 μm的粒子可进入深层呼吸道或者肺泡[17]。因此,本研究对鸡舍内外空气环境中生物气溶胶粒径分布特点进行分析。蛋鸡和肉鸡舍内外空气中细菌和真菌气溶胶粒径分布结果分别如图 2和图 3所示。
 |
|
EIⅠ~EIⅥ和EOⅠ~EOⅥ分别表示蛋鸡舍内和舍外生物气溶胶在StageⅠ~Ⅵ 粒径范围内的浓度;MIⅠ~MIⅥ和MOⅠ~MOⅥ分别
表示肉鸡舍内和舍外生物气溶胶在StageⅠ~Ⅵ 粒径范围内的浓度。下同 EIⅠ~EIⅥ and EOⅠ~EOⅥ represent concentrations of bioaerosols distributed at StageⅠ~Ⅵ in both inside and outside air of layer house;MIⅠ~MIⅥ and MOⅠ~MOⅥ represent concentrations of bioaerosols distributed at StageⅠ~Ⅵ in both inside and outside air of broiler house,respectively. The same below 图 2 肉鸡和蛋鸡舍内外细菌气溶胶粒径分布特点 Figure 2 Size distribution of airborne bacteria in both inside and outside air of layer and broiler houses |
 |
| 图 3 肉鸡和蛋鸡舍内外真菌气溶胶粒径分布特点 Figure 3 Size distribution of airborne fungi in both inside and outside air of layer and broiler houses |
目前国内对家禽养殖环境中生物气溶胶粒径分布规律的研究较少。本研究对肉鸡和蛋鸡舍内外细菌气溶胶粒径分布特点检测结果显示,肉鸡舍内空气环境中细菌气溶胶有69.72%分布在粒径较大的三个范围:StageⅢ(3.3~4.7 μm)、StageⅡ(4.7~7.0 μm)和StageⅠ(>7.0 μm)。这与以往关于北京城市空气环境中细菌气溶胶粒径分布的研究结果相似[18]。细菌通常负载在气溶胶的表面,其浓度会随着粒径的增大而升高。然而,蛋鸡舍内空气环境中细菌气溶胶分布规律与肉鸡舍内有所不同,最小粒径Stage Ⅵ(0.65~1.1 μm)所占比例仅为7.19%,其余则均匀分布于其他五个粒径范围。由研究可知,不同的养殖方式(蛋鸡,笼养;肉鸡,网上养殖)可能对舍内空气环境中细菌气溶胶的粒径分布产生影响。肉鸡舍内空气中细菌气溶胶主要分布在大粒径范围,而蛋鸡舍除Stage
Ⅳ之外,其他几个级别细菌气溶胶分布比例相似。同时,本研究结果显示蛋鸡舍内外细菌气溶胶粒径分布规律有所差异。 根据图 3可知,肉鸡舍内真菌气溶胶粒径分布呈近似正态分布规律。以往对于北京城市环境中真菌气溶胶粒径分布的研究结果也得出相似结论[19]。蛋鸡和肉鸡舍内空气中真菌气溶胶的粒径分布规律有所差异:肉鸡舍内的真菌气溶胶主要分布在中间三个粒径范围(Stage Ⅱ、Stage Ⅲ和Stage Ⅳ),所占比例为69.76%;蛋鸡舍内的真菌气溶胶在Stage Ⅰ(>7.0 μm)所占比例较高(24.55%)。综合分析粒径分布研究结果发现,蛋鸡和肉鸡舍内细菌和真菌气溶胶粒径分布有所差异,不同的养殖方式可能对禽舍内生物气溶胶的粒径分布产生影响,从而对人体造成的危害有所不同。 2.2.2 细颗粒物表面负载生物气溶胶比例
根据流行病学研究,长期暴露在细颗粒物(动力学粒径<2.5 μm的颗粒)污染的环境中,可导致动物和人的发病率和死亡率升高。鉴于此,本研究对肉鸡和蛋鸡舍内外空气环境中细颗粒物负载生物气溶胶比例进行研究,结果如图 4所示。
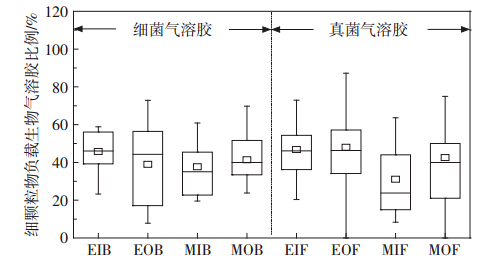 |
| 图 4 蛋鸡和肉鸡舍内外细颗粒物负载细菌和真菌气溶胶比例 Figure 4 Percentages of airborne bacteria and fungi on fine particles in both inside and outside air of layer and broiler houses |
由图 4可知,蛋鸡和肉鸡舍内外空气中细颗粒物负载细菌气溶胶比例的平均值分别为45.78%、38.97%、37.72%和41.37%,且蛋鸡舍内空气中细颗粒物负载细菌气溶胶比例高于肉鸡舍内(P=0.053);同时,对空气中细颗粒物负载真菌气溶胶比例分析结果显示,蛋鸡舍内细颗粒物负载真菌气溶胶比例明显高于肉鸡舍内(P<0.05)。该结果与粒径分布研究结果一致(图 2和图 3)。综合研究结果可知,蛋鸡和肉鸡舍内生物气溶胶粒径分布规律存在差异,该差异导致细颗粒物负载生物气溶胶比例有所不同。 2.3 禽舍内外空气环境中抗生素抗性菌气溶胶研究 2.3.1 抗生素抗性菌气溶胶浓度及比例
对肉鸡和蛋鸡舍内外空气环境中四环素和红霉素抗性菌浓度进行检测,并对其在细菌气溶胶中所占比例进行分析,结果如图 5所示。
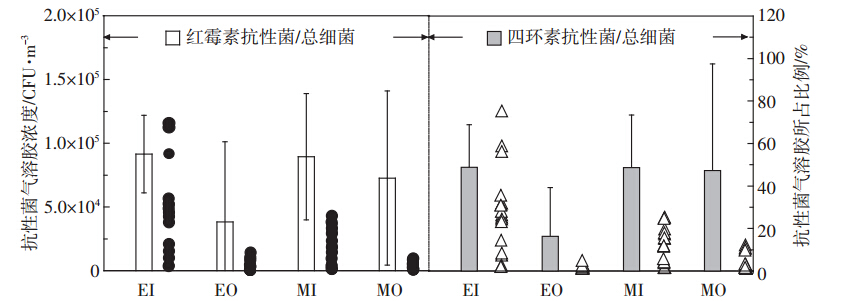 |
| 图 5 鸡舍内外红霉素和四环素抗性菌气溶胶浓度及比例 Figure 5 Concentrations and percentages of tetracycline- and erythromycin-resistant bacteria in both inside and outside air of layer and broiler houses |
在所调查的蛋鸡和肉鸡舍内,空气中抗性菌所占比率较高,约为50%。红霉素抗性菌在蛋鸡和肉鸡舍内细菌气溶胶中所占比例分别为54.87%和53.63%,而在舍外的比例低于舍内,分别为23.01%和43.57%。两种养殖方式下,鸡舍外红霉素抗性菌浓度同样明显低于舍内(P<0.01)。虽然所占比率相近,但蛋鸡舍内空气环境中红霉素抗性菌浓度高于肉鸡舍内(P<0.05),平均浓度分别为5.50×104 CFU·m-3和1.65×104 CFU·m-3。四环素抗性菌在蛋鸡舍内外和肉鸡舍内外生物气溶胶中所占的比例分别为48.80%、16.29%和48.62%、47.31%。与红霉素抗性菌研究结果相似,虽然蛋鸡和肉鸡舍内四环素抗性菌在细菌气溶胶中所占比例相似,但是蛋鸡舍内四环素抗性菌的浓度高于肉鸡舍内,浓度分别为4.28×104 CFU·m-3和1.58×104 CFU·m-3,且舍内浓度均大于舍外(P<0.01)。
综上,所调查的蛋鸡和肉鸡养殖空气环境中两种抗性菌所占比例相似,但蛋鸡舍内抗性菌气溶胶的浓度高于肉鸡舍内,与细菌气溶胶浓度分布规律一致。说明禽舍空气环境中抗性菌浓度可能与细菌气溶胶浓度相关。舍外抗性菌气溶胶浓度和所占比例均低于舍内。抗生素在家禽养殖过程中的使用是导致空气中抗生素抗性菌产生的主要原因。在本研究时间内,肉鸡和蛋鸡养殖场均使用了红霉素类的抗生素。虽然在调查期间没有四环素的使用记录,但是根据以往报道,当抗生素停止使用四周后,仍可在猪舍空气中检测到相应的抗生素耐药菌[20, 21]。 2.3.2 抗性大肠菌群浓度及比例
大肠菌群作为评价水体质量的重要指标之一,目前已被国内外广泛应用。本研究考察了蛋鸡和肉鸡舍内外空气中大肠菌群浓度和比例,及具有四环素和红霉素抗性的大肠菌群浓度和比例。结果分别如图 6和7所示。
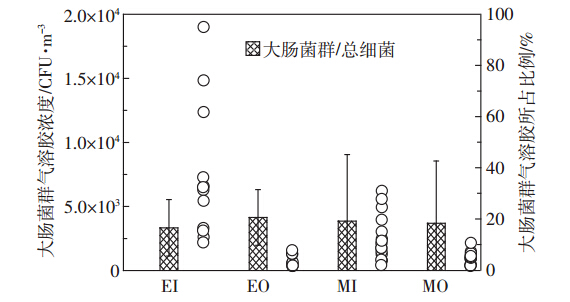 |
| 图 6 鸡舍内外生物气溶胶中大肠菌群浓度及比例 Figure 6 Concentrations and percentages of coliform bacteria in both inside and outside air of layer and broiler houses |
根据图 6可知,蛋鸡舍内外和肉鸡舍内外空气中,大肠菌群在总细菌中所占的平均比例较相近,分别为16.53%、20.57%、19.16%和18.30%,且舍内外所占比率差异不明显。蛋鸡舍内空气中大肠菌群的浓度明显高于肉鸡舍内(P<0.01),平均浓度分别为7.32×103 CFU·m-3和2.06×103 CFU·m-3。但是蛋鸡和肉鸡舍外的浓度均低于舍内(P<0.01)。姚美玲等[13] 在鸡舍内检测到浓度为950~1300 CFU·m-3的大肠杆菌,他们同时发现舍内空气中大肠杆菌具有多重抗生素抗药性。因此,本研究对两种鸡舍内外空气环境中具有抗生素抗性的大肠菌群进行研究,结果如图 7所示。
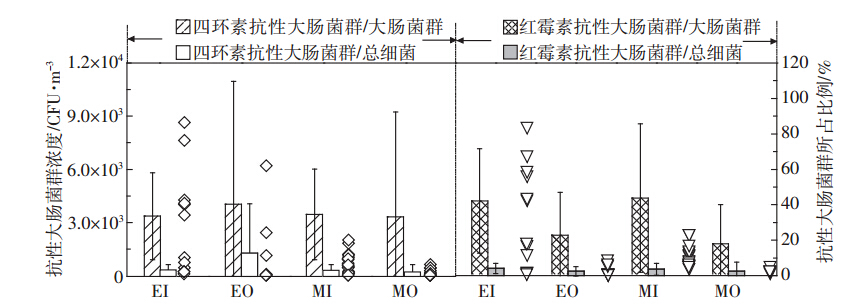 |
| 图 7 鸡舍内外空气环境中四环素和红霉素抗性大肠菌群浓度及比例 Figure 7 Concentrations and percentages of tetracycline- and erythromycin-resistant coliform bacteria in both inside and outside air of layer and broiler houses |
与空气中大肠菌群浓度分布规律相似,蛋鸡舍内四环素抗性大肠菌群浓度高于肉鸡舍内,浓度分别为2.87×103 CFU·m-3和6.3×102 CFU·m-3,且舍外浓度均低于舍内。对具有四环素抗性的大肠菌群在总大肠菌群中所占比例进行检测,结果显示,在各个采样点所占比例较相近,为33.55%~40.30%。虽然蛋鸡舍内红霉素抗性大肠菌群的浓度大于肉鸡舍内(浓度分别为3.31×103 CFU·m-3和7.4×102 CFU·m-3),但具有红霉素抗性的大肠菌群在总大肠菌群中所占比例相近,分别为41.25%和42.88%。舍外具有红霉素抗性大肠菌群的浓度及其在总大肠菌群中所占比例均低于舍内。本研究结果显示,具有红霉素和四环素抗性的大肠菌群在禽舍空气环境的细菌气溶胶中所占比例较小,在2.44%~13.08%之间。
综上,本研究结果有助于评价不同养殖方式下生物气溶胶的危害。然而本研究基于可培养的检测方法,如要全面理解禽场空气环境中生物气溶胶的污染状况,将来还需要利用分子生物学手段对空气中的微生物,特别是致病菌以及抗性基因做系统研究。 3 结论
本研究结果表明,禽舍内细菌和真菌气溶胶的浓度分别为104、103 CFU·m-3。蛋鸡舍内生物气溶胶浓度大于肉鸡,且舍外浓度要低于舍内。蛋鸡和肉鸡舍内空气中具有四环素和红霉素抗性的细菌气溶胶比例、大肠菌群比例、及具有抗性的大肠菌群在总大肠菌群中比例均相似,表明禽舍中四环素和红霉素抗性气溶胶及大肠菌群浓度与细菌气溶胶浓度有关。同时,蛋鸡和肉鸡舍内生物气溶胶粒径分布存在差异,细颗粒物负载细菌和真菌气溶胶比例均高于肉鸡,使得蛋鸡舍内生物气溶胶的潜在危害可能大于肉鸡。
| [1] | Chien Y C, Chen C J, Lin T H, et al. Characteristics of microbial aerosols released from chicken and swine feces[J]. Journal of the Air & Waste Management Association, 2011, 61(8):882-889. |
| [2] | 杜 睿. 大气生物气溶胶的研究进展[J]. 气候与环境研究, 2006, 11(4):546-552.DU Rui. The Progress of atmospheric bioaerosol research[J]. Climatic and Environmental Research, 2006, 11(4):546-552. |
| [3] | Heederik D, Brouwer R, Biersteker K, et al. Relationship of airborne endotoxin and bacteria levels in pig farms with the lung function and respiratory symptoms of farmers[J]. International Archives of Occupational and Environmental Health, 1991, 62(8):595-601. |
| [4] | Létourneau V, Nehmé B, Mériaux A, et al. Human pathogens and tetracycline-resistant bacteria in bioaerosols of swine confinement buildings and in nasal flora of hog producers[J]. International Journal of Hygiene and Environmental Health, 2010, 213(6):444-449. |
| [5] | Just N A, Letourneau V, Kirychuk S P, et al. Potentially pathogenic bacteria and antimicrobial resistance in bioaerosols from cage-housed and floor-housed poultry operations[J]. The Annals of Occupational Hygiene, 2012, 56(4):440-449. |
| [6] | Cox C S, Airborne bacteria and viruses[J]. Science Progress, 1989, 73(292):469-499. |
| [7] | Cormier Y, Tremblay G U Y, Meriaux A, et al. Airborne microbial contents in two types of swine confinement buildings in quebec[J]. American Industrial Hygiene Association Journal, 1990, 51(6):304-309. |
| [8] | Donaldson A I, Gibson C F, Oliver R, et al. Infection of cattle by airborne foot-and-mouth disease virus:Minimal doses with O1 and SAT 2 strains[J]. Research in Veterinary Science, 1987, 43(3):339-346. |
| [9] | Pan X, Qiang Z, Ben W, et al. Residual veterinary antibiotics in swine manure from concentrated animal feeding operations in Shandong Province, China[J]. Chemosphere, 2011, 84(5):695-700. |
| [10] | 柴同杰, 赵云玲, 刘文波, 等. 鸡舍环境耐药细菌气溶胶及其向环境传播的研究[J]. 中国预防兽医学报, 2003, 25(3):209-214.CHAI Tong-jie, ZHAO Yun-ling, LIU Wen-bo, et al. 2003. The resistance against antibiotics of bacteria from a poultry house and their spreading to surroundings of the house[J]. Chinese Journal of Preventive Veterinary Medicine, 25(3):209-214. |
| [11] | Sun Z, Mu Y, Liu Y, et al. A comparison study on airborne particles during haze days and non-haze days in Beijing[J]. Science of the Total Environment, 2013, 456-457:1-8. |
| [12] | 魏 磊, 崔金生. 不同季节鸡舍环境中细菌气溶胶含量的变化分析[J]. 中国家禽, 2012, 34(4):59-60.WEI Lei, CUI Jin-sheng. Concentration variation of airborne bacteria in broiler house during different seasons[J]. China Poultry, 2012, 34(4):59-60. |
| [13] | 姚美玲, 张 彬, 柴同杰. 鸡兔舍耐药大肠杆菌气溶胶向环境扩散的研究[J]. 西北农林科技大学学报:自然科学版, 2007, 35(8):60-64.YAO Mei-ling, ZHANG Bin, CHAI Tong-jie. Antibiotic resistance of airborne escherichia colf from hen house and rabbitry and their spreading to surroundings[J]. Journal of Northwest A&F University(Nat Sci Ed), 2007, 35(8):60-64. |
| [14] | Sowiak M, Brodka K, Kozajda A, et al. Fungal aerosol in the process of poultry breeding: Quantitative and qualitative analysis[J]. Medycyna Pracy, 2012, 63(1):1-10. |
| [15] | Dungan R S. BOARD-INVITED REVIEW:Fate and transport of bioaerosols associated with livestock operations and manures[J]. Journal of Animal Science, 2010, 88(11):3693-3706. |
| [16] | Li M, Qi J, Zhang H, et al. Concentration and size distribution of bioaerosols in an outdoor environment in the Qingdao coastal region[J]. Science of the Total Environment, 2011, 409(19):3812-3819. |
| [17] | St?Rk K D C. The role of infectious aerosols in disease transmission in pigs[J]. The Veterinary Journal, 1999, 158(3):164-181. |
| [18] | Fang Z G, Ouyang Z Y, Zheng H, et al. Concentration and size distribution of culturable airborne microorganisms in outdoor environments in Beijing, China[J]. Aerosol Science and Technology, 2008, 42(5):325-334. |
| [19] | 方治国, 欧阳志云, 胡利锋, 等. 北京市夏季空气真菌生态分布特征[J]. 环境科学学报, 2005, 25(2):160-165.FANG Zhi-guo, OUYANG Zhi-yun, HU Li-feng, et al. Ecological distribution characteristics of airborne fungi in summer, Beijing[J]. Acta Scientiae Circumstantiae, 2005, 25(2):160-165. |
| [20] | Gibbs S G, Green C F, Tarwater P M, et al. Isolation of antibiotic-resistant bacteria from the air plume downwind of a swine confined or concentrated animal feeding operation[J]. Environ Health Perspect, 2006, 114(7):1032-1037. |
| [21] | Manson J M, Smith J M, Cook G M. Persistence of vancomycin-resistant enterococci in New Zealand broilers after discontinuation of avoparcin use[J]. Applied and Environmental Microbiology, 2004, 70(10):5764-5768. |
 2015, Vol. 34
2015, Vol. 34




