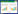文章信息
- 赖长鸿, 刘亚玲, 贺鸿志, 黎华寿, 陈桂葵
- LAI Chang-hong, LIU Ya-ling, HE Hong-zhi, LI Hua-shou, CHEN Gui-kui
- 无机三价砷对生菜的生态毒性及其生物积累
- Eco-toxicity and Accumulation of Inorganic Trivalent Arsenic in Lettuce
- 农业环境科学学报, 2015, 34(5): 831-836
- Journal of Agro-Environment Science, 2015, 34(5): 831-836
- http://dx.doi.org/10.11654/jaes.2015.05.003
-
文章历史
- 收稿日期:2014-12-13
砷(As)是一种类金属元素,通常情况下以极低浓度广泛存在于自然界中,不会对生物造成危害,但目前环境中的砷主要来源于采矿、冶炼、化石燃料、油漆、农药、化肥、饲料添加剂等工农业活动[1, 2, 3]。我国是世界上砷污染最为严重的国家之一,在某些采矿点附近土壤砷含量可高达28 522 mg·kg-1 [4],严重影响了当地农作物的生产。环境中较高浓度的砷会影响种子萌发[5],干扰植物水分代谢[6],破坏植物光合系统[7],影响作物生理过程[8, 9],降低农作物的产量和品质,严重时甚至导致植株死亡[10]。作物中吸收积累的砷可通过食物链进而影响人体各种器官的正常功能,导致神经、免疫、消化和生殖系统紊乱,严重影响人体健康[11, 12, 13, 14]。已有研究发现,砷主要累积在耕作层,易被作物尤其是蔬菜吸收富集,且叶菜类蔬菜中的砷含量一般高于根茎类和瓜果类[15, 16]。
生菜(Lactuca sativa)属菊科莴苣属,一年生或二年生草本作物,由于其生长快、产量高、适应性广、口感好,深受人民喜爱,在全国各地被广泛种植,是一种最普遍的食用叶菜类蔬菜。目前关于砷的毒理学研究主要是以动物为材料的居多,而对植物尤其是蔬菜的毒性效应研究不多,关于砷胁迫下的生菜抗氧化酶体系的研究较少[17],暂未见砷胁迫对生菜叶绿素含量和叶绿素荧光参数的报道。本文主要从生菜的种子萌发、生长、生理以及生菜不同部位砷含量等方面,探讨砷胁迫对生菜的毒性效应以及累积砷的规律,以期为砷污染区的生菜种植业安全生产提供理论依据。 1 材料与方法 1.1 试验材料
供试生菜为意大利全年耐抽苔生菜,种子购自广州市先科联蔬菜技术中心。供试土壤采自华南农业大学农学院生态系农场菜地0~20 cm土层,去杂,自然风干,磨碎后过孔径2 mm筛备用。测得土壤基本理化性质见表 1。
将籽粒饱满的生菜种子用1%的次氯酸钠溶液浸泡20 min消毒,去离子水漂洗干净后,播于已铺有两层湿润滤纸的玻璃培养皿中,将培养皿置于人工气候室内[(25±2)℃,45%±7% RH]进行发芽试验。挑取一致的种子均匀撒播于培养皿中,每皿25粒,加含砷溶液10 mL,砷浓度[以As(Ⅲ)计]分别设为0、0.1、1、5、10、20、50、100、200 mg·L-1,每一浓度3个重复,共27个处理。种子萌发期间所有试验条件保持一致,每天更换一次滤纸和加入10 mL相应浓度的污染物溶液,处理4 d后,统计发芽势,7 d后记录发芽率[18]。 1.2.2 盆栽试验
以塑料圆桶(高×下部直径×上部直径:23 cm×20 cm×31 cm)作为盆栽容器,每盆装入5.00 kg菜地土,将事先预备好的菜地土混匀后装入塑料盆中,准确量取一定量的含砷[以As(Ⅲ)计]母液,定容后加入到土壤中,使土壤中添加的As(Ⅲ)浓度分别为0、5、10、50、100、200 mg·kg-1。加水浸泡土壤,并将土壤充分混匀,平衡10 d左右。选取长势一致的两叶一芯的生菜幼苗移至各盆中,每盆移栽3株幼苗,每个处理3个重复。试验期间保持土壤湿润,50 d后统一收获,测定各项指标。
本文所用含As(Ⅲ)母液是由无机砷As2O3和NaOH匹配反应生成NaAsO2溶于水配制而成。 1.3 分析测定方法
株高和根长用直尺分别测量。生菜样品收获后,将植株地上部和地下部分离,用去离子水洗净后,用滤纸吸干,直接用万分之一天平称量鲜重,然后分别置于烘箱中55 ℃烘至恒重,称量干重。
叶绿素含量采用便携式叶绿素仪直接测定,叶绿素荧光参数使用美国产的OS-30P调制式叶绿素荧光仪直接测定。测定选在种植后第45 d(晴天)上午9:00—10:00温室大棚中,测量时选取生长一致的生菜叶片,用叶片夹夹住生菜叶片20 min,然后测定基础荧光(F0)、最大荧光(Fm)、PSⅡ的潜在活性(Fv/ F0)和PSⅡ的光化学效率(Fv/ Fm)。
取生菜的倒数第二片叶子进行植物抗氧化酶活性等的测定。参照陈建勋等[19]的方法,用氮蓝四唑(NBT)还原法测定超氧化物歧化酶(SOD)活性,于560 nm波长以抑制NBT光化还原50%为1个酶活性单位U,酶活性以U·g-1 FW表示;用过氧化氢法测定过氧化氢酶(CAT)活性,于240 nm波长处以每分钟吸光度减少0.01为1个活力单位U,酶活性以U·min-1·g-1 FW 表示;采用愈创木酚法测定过氧化物酶活性,以470 nm波长每分钟吸光度增加0.01为1个活力单位,酶活性以U·min-1·g-1 FW表示;丙二醛含量(MDA)采用硫代巴比妥酸法测定。
将烘干后的植物样品用微型植物粉碎机粉碎,过75目筛,称取0.3 g(精确至0.001 g)放入消解罐中,加入6 mL浓硝酸以及2 mL 30%的双氧水,浸泡1 h后进行微波消解,用去离子水将消解液定容到25 mL,冷藏待测。
总砷的测定:吸取4 mL消解液,加入1 mL硫脲,混合均匀后用AFS-930型双道原子荧光光度计测定。 1.4 数据处理和统计分析
试验数据用平均数±标准误(Mean±SE)来表示,采用Microsoft Excel和SPSS 13.0进行统计,并用Duncan检验法进行差异显著性分析(P<0.05)。
参考李玲的《植物生理学模块实验指导》[18],采用以下公式计算生菜种子的发芽率和发芽势:
发芽率(%)=(发芽种子数/供试种子数)×100%
发芽势(%)=(4 d内种子的发芽数/供试种子数)×100%
相对生长量(%)=(处理组/对照组)×100% 2 结果与分析 2.1 砷对生菜种子萌发的影响
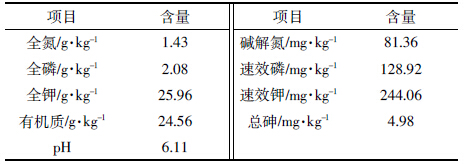
发芽率和发芽势是反映种子萌发的重要参数,不同浓度As(Ⅲ)处理对生菜种子萌发的影响见表 2。当As(Ⅲ)浓度为0.1 mg·L-1时,生菜种子的发芽率与对照组无显著差异,但随As(Ⅲ)浓度的升高,种子发芽率显著下降;当As(Ⅲ)浓度升至50 mg·L-1和100 mg·L-1时,生菜种子的发芽率分别只有对照组的20.00%和4.00%。As(Ⅲ)对生菜种子发芽势的影响呈现出低浓度促进而高浓度抑制的规律,当As(Ⅲ)浓度为0.1 mg·L-1时,生菜种子的发芽势显著高于对照组,是对照组的107.68%;当As(Ⅲ)浓度为1、5 mg·L-1时,发芽势与对照比无显著差异,而当As(Ⅲ)浓度高于10 mg·L-1时,发芽势显著下降。
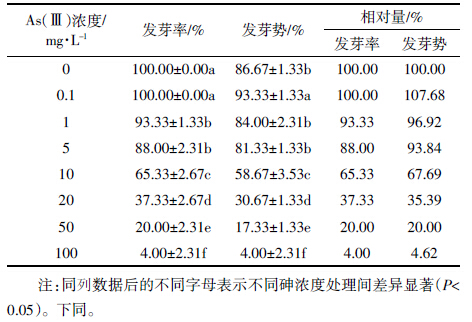
株高、根长和生物量是反映生物生长情况的三个指标。由表 3可见,As(Ⅲ)对生菜株高、根长和生物量的影响均表现出低浓度促进高浓度抑制的效果,且浓度越高抑制作用越明显,当土壤中添加的As(Ⅲ)升至200 mg·kg-1时,生菜的株高和根长分别只有对照组的86.07%和74.48%,生菜地上部和地下部干重则只有对照组的72.39%和72.73%。
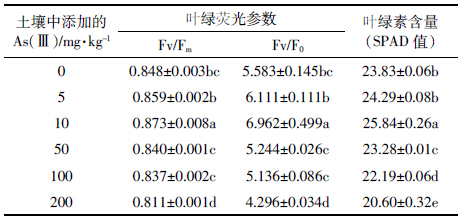
叶绿素含量是反映光合作用能力的重要指标之一,常作为植物抗性指标应用于评价污染物对植物生长的影响。由表 4可见,随着砷浓度的升高,生菜光合特性呈现低促高抑的趋势。当土壤中添加的As(Ⅲ)浓度为10 mg·kg-1时,生菜的叶绿素荧光参数和叶绿素含量显著高于对照组;当土壤中添加的As(Ⅲ)浓度为50、100 mg·kg-1时,生菜叶绿素荧光参数与对照组无显著性差异,但当土壤中添加的As(Ⅲ)浓度为200 mg·kg-1时,则显著低于对照组。总体上,当土壤中添加的As(Ⅲ)浓度高于50 mg·kg-1时,生菜叶绿素含量均显著低于对照组。
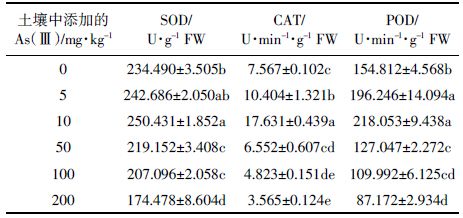
抗氧化保护酶系统是植物体内控制活性氧平衡的重要物质,是反应植物适应逆境的重要指标。由表 5可见,三种抗氧化酶酶活性随土壤中添加的As(Ⅲ)浓度的升高均呈现低浓度促进而高浓度抑制的趋势。当土壤中添加的As(Ⅲ)浓度为5、10 mg·kg-1时,生菜叶片的SOD、CAT和POD 活性均显著高于对照组;当土壤中添加的As(Ⅲ)浓度为50、100、200 mg·kg-1时,生菜的SOD和POD活性显著下降,而CAT也在添加的As(Ⅲ)浓度高于100 mg·kg-1时显著低于对照组。这说明当土壤中添加的As(Ⅲ)浓度高于100 mg·kg-1时,生菜的抗氧化保护酶系统活性降低,可能机体处于受损害状态。
MDA是膜脂过氧化的主要产物,可反映植物体内过氧化作用的强弱。由图 1可见,随As(Ⅲ)浓度的升高,MDA含量呈现先降低后升高的趋势。当土壤中添加的As(Ⅲ)浓度为5、10 mg·kg-1时,生菜体内的MDA含量均显著低于对照组;当土壤中添加的As(Ⅲ)浓度为50、100 mg·kg-1时,MDA含量与对照比差异不显著,而当土壤中添加的As(Ⅲ)浓度为200 mg·kg-1时,MDA显著升高,说明生菜体内已经积累了过量的脂质过氧化产物。
 |
| 图 1 砷对生菜叶片丙二醛含量的影响 Figure 1 Effect of arsenic on MDA contents of lettuce |
由图 2可见,随着As(Ⅲ)浓度的升高,生菜地上部和地下部的砷含量都明显增加,且在同一处理浓度下,生菜地下部的砷含量显著高于其地上部。当土壤中添加的As(Ⅲ)浓度低于50 mg·kg-1时,生菜地上部砷含量与对照组无显著性差异,而当土壤中添加的As(Ⅲ)浓度达到50 mg·kg-1时,生菜地上部砷含量显著高于其对照组以及其他低剂量添加组。
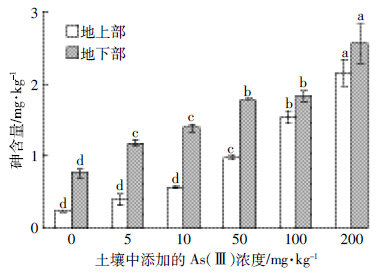 |
| 图 2 土壤中添加砷对生菜各部位砷含量的影响 Figure 2 Concentrations of arsenic in lettuce under different treatments |
试验结果表明,砷胁迫可抑制生菜的种子萌发和植株生长,使抗氧化酶活性下降,生物量下降,与前人[10, 20, 21]对其他植物的研究结果一致;同时,研究还表明,长时间的砷胁迫会降低生菜的叶绿素荧光参数和叶绿素含量,说明高浓度的砷胁迫可破坏生菜的光合系统,影响其正常光合生理过程,也与李仁英等[5]的试验结果一致。目前的研究表明,植物在砷胁迫下会通过各种途径产生大量的活性氧(Reactive oxygen species,ROS),造成活性氧积累而引起严重的危害。薛美昭等[22]的研究证实NaAsO2能诱发蚕豆保卫细胞程序性死亡,该过程是由胁迫引发的ROS升高引起的,ROS可能通过激活质膜Ca2+通道,使胞外Ca2+内流,造成胞内Ca2+浓度升高,进而诱导细胞程序性死亡,当过氧化氢酶与NaAsO2共同作用时,细胞死亡率显著低于砷单独处理组。当植物受到砷胁迫时,其体内的抗氧化防御酶系被激活,抗氧化酶如SOD、CAT、POD等的活性提高,以维持细胞内的氧化还原平衡,同时植物体内解毒系统中的植物络合素、金属硫蛋白和谷胱甘肽硫转移酶以及蛋白和非蛋白巯基等均能与砷结合,发挥解毒作用[9, 23]。但由于植物难以适应较高浓度的砷胁迫,会产生毒性效应,如破坏植物的光合系统,降低植物生物量,甚至导致植物死亡等[7, 8, 9, 10]。因此,氧化胁迫是目前比较公认的砷毒性作用机制,即砷可诱发植物体内ROS的生成,而ROS分子能破坏细胞膜及胞内生物大分子如膜脂、蛋白和核苷酸[24],进而影响细胞和分子的结构与功能,使细胞生理功能紊乱,细胞死亡。本试验也表明当土壤砷浓度较高(高于100 mg·kg-1)时,生菜体内脂质过氧化产物MDA显著升高,生菜的抗氧化保护酶SOD、POD和CAT的活性显著下降,说明高浓度的砷胁迫降低了生菜的活性氧清除能力,导致了生菜的毒性效应。
环境中过量的砷不仅严重影响作物的生长和生理,降低产量和品质,还会直接或通过食物链进入人体,产生生物放大效应,危害人体健康[12, 13, 14]。作物种类不同,吸收富集砷的能力也不同。肖细元等[16]的研究发现,水稻的砷含量显著高于小麦和玉米,不同种类蔬菜砷含量大小依次为叶菜类>根茎类>茄果类>鲜豆类。本试验中的生菜属于叶菜类蔬菜,当土壤砷含量高于14.98 mg·kg-1时,其地上部砷含量超出了我国《食品卫生标准》中所规定的蔬菜可食用部分砷含量最大值0.5 mg·kg-1,存在严重的食品安全风险。有研究认为少施磷肥是减少土壤砷向植物转移的有效措施之一[25]。这主要是因为砷与磷的化学性质类似,在土壤-植物系统中的行为也很相像,磷能够通过离子交换作用置换出土壤中的砷,所以施磷肥可增加土壤砷的生物有效性,进而增加作物吸收砷的风险[25, 26]。同时,正是由于砷与磷的结构类似,砷可通过质膜上的磷转运通道而进入植物细胞内,干扰磷的代谢过程,砷可代替磷与胞内酶和组织蛋白中的巯基发生反应,导致蛋白结构异常、多种酶促反应受阻等[23]。因此,根据砷的这种生物学特性,可以采取适当的农艺措施来降低土壤中砷的生物有效性,减少植物对砷的吸收,降低砷对植物的危害,这对当前耕地日益减少而污染土壤中的砷仍未达到安全标准之前,保证粮食数量和质量安全有非常重要的意义。 4 结论
当As(Ⅲ)浓度高于1 mg·L-1时,可显著抑制生菜种子的萌发,且浓度越高抑制效果越明显;当土壤中添加的As(Ⅲ)浓度高于50 mg·kg-1时,可显著抑制生菜地上部的生长,生菜的株高和生物量明显低于对照。随着土壤中添加的As(Ⅲ)浓度的升高,生菜的光合参数和抗氧化酶活性均表现出“低浓度促进高浓度抑制”的趋势,且浓度越高抑制作用越明显,高浓度的砷可导致丙二醛含量显著升高。随着土壤砷含量的升高,生菜地上部和地下部的砷含量都明显增加,当土壤砷含量高于14.98 mg·kg-1时,生菜可食用部分的砷含量超出了我国《食品卫生标准》中所规定的限值标准,存在明显的食品安全风险。
| [1] | Garelick H, Jones H, Dybowska A, et al. Arsenic pollution sources[J]. Reviews of Environmental Contamination and Toxicology, 2008, 197:17-60. |
| [2] | Tarvainen T, Albanese S, Birke M, et al. Arsenic in agricultural and grazing land soils of Europe[J]. Applied Geochemistry, 2013, 28(1):2-10. |
| [3] | 姚丽贤, 黄连喜, 蒋宗勇, 等. 动物饲料中砷、铜和锌调查及分析[J]. 环境科学, 2013, 34(2):732-739. YAO Li-xian, HUANG Lian-xi, JIANG Zong-yong, et al. Investigation and analysis arsenic, copper and zinc of in animal feed[J]. Environmental Sciences, 2013, 34(2):732-739. |
| [4] | Liao X Y, Chen T B, Lei M, et al. Root distributions and elemental accumulations of Chinese brake(Pteris vittata L.) from As contaminated soils[J]. Plant and Soil, 2004, 261(1-2):109-116. |
| [5] | 李仁英, 沈孝辉, 张耀鸿, 等. 无机砷对不同水稻品种种子萌发和幼苗光合生理的影响[J]. 农业环境科学学报, 2014, 33(6):1067-1074. LI Ren-ying, SHEN Xiao-hui, ZHANG Yao-hong, et al. The effects of inorganic arsenic to seed germination seedling photosynthetic physiological in different rice varieties[J]. Journal of Agro-Environment Science, 2014, 33(6):1067-1074. |
| [6] | Singh N, Ma L Q, Srivastava M, et al. Metabolic adaptations to arsenic-induced oxidative stress in Pteris vittata L. and Pteris ensiformis L.[J]. Plant Science, 2006, 170(2):274-282. |
| [7] | Li W X, Chen T B, Huang Z C, et al. Effect of arsenic on chloroplast ultrastructure and calcium distribution in arsenic hyperaccumulator Pteris vittata L.[J]. Chemosphere, 2006, 62(5):803-809. |
| [8] | Stoeva N, Berova M, Zlatev Z. Effect of arsenic on some physiological parameters in bean plants[J]. Biologia Plantarum, 2005, 49(2):293-296. |
| [9] | Sharma I. Arsenic induced oxidative stress in plants[J]. Biologia, 2012, 67(3):447-453. |
| [10] | Titah H S, Abdullah S R S, Idris M, et al. Arsenic range finding phytotoxicity test against Ludwigia octovalvis as first step in phytoremediation[J]. Research Journal of Environmental Toxicology, 2012, 6(4):151-159. |
| [11] | Han Y H, Moon H J, You B R, et al. Effects of arsenic trioxide on cell death, reactive oxygen species and glutathione levels in different cell types[J]. International Journal of Molecular Medicine, 2010, 25(1):121-128. |
| [12] | Hughes M F, Beck B D, Chen Y, et al. Arsenic exposure and toxicology:A historical perspective[J]. Toxicology Science, 2011, 123(2):305-320. |
| [13] | Kim K W, Bang S, Zhu Y G, et al. Arsenic geochemistry, transport mechanism in the soil-plant system, human and animal health issues[J]. Environment International, 2009, 35(3):453-454. |
| [14] | 韩俊洋, 吴顺华. 地方性砷中毒致肝损伤机制研究进展[J]. 中国公共卫生, 2014, 30(3):374-376. HAN Jun-yang, WU Shun-hua. The review of endemic arsenic poisoning causing liver damage mechanism[J]. China Public Health, 2014, 30(3):374-376. |
| [15] | 宋 波, 伏凤艳, 张学洪, 等. 桂林市菜地土壤和蔬菜砷含量调查与健康风险评估[J]. 环境科学学报, 2014, 34(3):728-735. SONG Bo, FU Feng-yan, ZHANG Xue-hong, et al. A survey of arsenic concentrations in vegetables and soils in Guilin and the health risks assessment[J]. Acta Scientiae Circumstaniae, 2014, 34(3):728-735. |
| [16] | 肖细元, 陈同斌, 廖晓勇, 等. 我国主要蔬菜和粮油作物的砷含量与砷富集能力比较[J]. 环境科学学报, 2009, 29(2):291-296. XIAO Xi-yuan, CHEN Tong-bin, LIAO Xiao-yong, et al. Comparison of concentrations and bioconcerntration factors of arsenic in vegetables grain and oil crops in China[J]. Acta Scientiae Circumstaniae, 2009, 29(2):291-296. |
| [17] | Cusman G S, Oliveira J A, Farnese F S. Mineral nutrition and enzymatic adaptation induced by arsenate and arsenite exposure in lettuce plants[J]. Plant Physiology and Biochemistry, 2013, 10(71):307-314. |
| [18] | 李 玲. 植物生理学模块实验指导[M]. 北京: 科学出版社, 2009:25-27. LI Ling. Plant physiology experiment module guide[M]. Beijing: Science Press, 2009:25-27. |
| [19] | 陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州:华南理工大学出版社, 2006:68-81. CHEN Jian-xun, WANG Xiao-feng. Plant physiology experiment guidance[M]. Guangzhou:South China University of Technology Press, 2006:68-81. |
| [20] | 谢 飞, 王宏镔, 王海娟, 等. 砷胁迫对不同砷富集能力植物叶片抗氧化酶活性的影响[J]. 农业环境科学学报, 2009, 28(7):1379-1385. XIE Fei, WANG Hong-bin, WANG Hai-juan, et al. The effect of antioxidant enzyme activity under the As stress on plant leaves of different arsenic enrichment ability[J]. Journal of Agro-Environment Science, 2009, 28(7):1379-1385. |
| [21] | 胡拥军, 王海娟, 王宏镔, 等. 砷胁迫下不同砷富集能力植物内源生长素与抗氧化酶的关系[J]. 生态学报, 2015, 35(10).DOI: 10.5846/stxb201312022863. HU Yong-jun, WANG Hai-juan, WANG Hong-bin, et al. The relationship between endogenous auxin and antioxidant enzymes in two plants with different arsenic-accumulative ability under arsenic stress[J]. Acta Ecologica Sinica, 2015, 35(10).DOI: 10.5846/stxb201312022863. |
| [22] | 薛美昭, 仪慧兰. 砷诱导蚕豆气孔保卫细胞死亡的毒性效应[J]. 生态学报, 2014, 34(5):1134-1139. XUE Mei-zhao, YI Hui-lan. The effect of stomatal guard cells death for arsenic inducing horsebean toxicity[J]. Acta Ecologica Sinica, 2014, 34(5):1134-1139. |
| [23] | Malik J A, Goel S, Kaur N, et al. Selenium antagonises the toxic effects of arsenic on mungbean(Phaseolus aureus Roxb.) plants by restricting its uptake and enhancing the antioxidative and detoxification mechanisms[J]. Environmental and Experimental Botany, 2012, 77:242-248. |
| [24] | Wu L H, Yi H L, Yi M. Assessment of arsenic toxicity using Allium/Vicia root tip micronucleus assays[J]. Journal of Hazardous Materials, 2010, 176(1-3):952-956. |
| [25] | 杨 玲, 连 娟, 郭再华, 等. 砷胁迫下磷用量对不同磷效率水稻产量、生物量以及P、As含量的影响[J]. 中国农业科学, 2012, 45(8):1627-1635. YANG Ling, LIAN Juan, GUO Zai-hua, et al. The influence of dosage of different phosphorus efficiency to rice production, biomass and the content of P, under asarsenic stress[J]. Scientia Agricultural Sinica, 2012, 45(8):1627-1635. |
| [26] | Cui Y S, Du X, Weng L P, et al. Assessment of in situ immobilization of lead(Pb) and arsenic(As) in contaminated soils with phosphate and iron:Solubility and bioaccessibility[J]. Water Air Soil Pollution, 2010, 213(1-4):95-104. |
 2015, Vol. 34
2015, Vol. 34