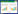文章信息
- 杜金梁, 曹丽萍, 刘英娟, 贾睿, 赵才源, 申玉金, 殷国俊
- DU Jin-liang, CAO Li-ping, LIU Ying-juan, JIA Rui, ZHAO Cai-yuan, SHEN Yu-jin, YIN Guo-jun
- 甘草提取物对2,3,7,8-四氯二苯并-p-二噁英致建鲤精密肝切片组织损伤中生化指标及免疫功能的影响
- Effects of Glycyrrhiza glabra Extract on Biochemical Indices and Immune Function of Jian Carp(Cyprinus carpiovar. Jian) Precision Cut Liver Slices Injured by 2, 3, 7, 8 tetrachlorodibenzo-p-dioxin
- 农业环境科学学报, 2015, 34(5): 837-843
- Journal of Agro-Environment Science, 2015, 34(5): 837-843
- http://dx.doi.org/10.11654/jaes.2015.05.004
-
文章历史
- 收稿日期:2014-12-04
2. 中国水产科学研究院淡水渔业研究中心 农业部鱼类免疫药理学国际联合实验室, 江苏 无锡 214081;
3. 南京农业大学无锡渔业学院, 江苏 无锡 214081
2. International Joint Research Laboratory for Fish Immunopharmacology, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China;
3. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081, China
二噁英主要来源于人类工业生产和生活垃圾的焚烧,不仅给畜牧业和水产养殖业造成了巨大经济损失,同时也给人类的健康构成严重威胁,近年来引起了广泛的重视,是当今科研领域研究热点。2,3,7,8-四氯二苯-p-二噁英(TCDD)是其中毒性最强的一类物质,可以对鱼类产生负效应。目前关于TCDD对鱼类的研究相对较少,主要集中在斑马鱼。鱼类对水体污染较敏感,鱼组织吸收了污染物TCDD后会影响其许多生理和生化作用,宋士波等[1]利用同位素示踪把标记的TCDD溶解于丙酮/植物油中,对鲤鱼进行腹腔注射,发现TCDD分布总量最多的部位是鱼体脂肪、肝脏、消化管、性腺和肌肉。关于受二噁英污染动物的治疗,国内外相关报道较少,目前没有有效的治疗药物,国内学者在研究茶多酚对二噁英所致肝损伤的影响中发现,茶多酚在一定程度上可以缓解TCDD所造成的人胚肝细胞损伤[2]。国外学者报道虾青素对受TCDD诱导大鼠肝组织损伤的影响中发现,虾青素可以抑制TCDD造成的肝损伤,表现出较强的保护作用;谷氨酰胺也可以缓解TCDD造成的大鼠肝损伤[3, 4]。
近年来,中药以其环保低残留等优点,被广泛用于疾病的治疗,甘草提取物(Glycyrrhiza glabra Extract)是从甘草中提取的有效成分,其中包含甘草酸、甘草甜素、甘草类黄酮等。关于其有效成分甘草酸类化合物的研究发现,甘草酸对于治疗乙型肝炎具有很好的效果[5];黄酮类化合物具有抗病毒、抗氧化、保肝等功效[6]。在治疗动物肝损伤方面,Cao等[7] 在甘草提取物对叔丁基氢过氧化物诱导的建鲤原代培养肝细胞损伤的研究中发现,甘草提取物对t-BHP造成的鱼类肝细胞损伤具有一定的保护作用;陈红艳等[8] 通过研究甘草提取物对四氯化碳所造成小鼠急性肝损伤的保护作用发现,甘草提取物可以明显降低四氯化碳造成的肝损伤,且效果显著。甘草提取物是否也可以抑制TCDD造成的鱼类肝组织损伤,目前还不清楚。
本试验以分离培养的建鲤精密肝切片作为实验材料,用TCDD构建鱼类的急性肝损伤,来探究甘草提取物对TCDD所造成的鱼类精密肝切片损伤的影响,旨在为开发抗TCDD损伤的鱼类保肝药物提供理论依据。 1 材料与方法 1.1 试验材料 1.1.1 试验鱼
试验用建鲤取自中国水产科学研究院淡水渔业研究中心渔场,取回后放置于循环水养殖系统中暂养1周。 1.1.2 试剂和仪器
L15培养基、HBSS(Hanks balanced saults)溶液、庆大霉素和两性霉素B(美国SIGMA公司);新生小牛血清(FCS)(浙江天杭生物科技有限公司);细胞培养板(GIBCO公司);2,3,7,8-四氯二苯-p-二噁英(厦门慧嘉生物科技有限公司);丙氨酸转氨酶(GPT)、天冬氨酸转氨酸(GOT)、丙二醛(MDA)和超氧化物歧化酶(SOD)测定试剂盒(南京建成生物工程研究所科技有限公司);肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、免疫球蛋白M(IgM)试剂盒(上海朝瑞生物科技有限公司);MS-222麻醉剂(美国SIGMA公司);723分光光度计(上海欣茂仪器有限公司);酶标仪MK3(美国Thermo公司);KD-400切片机(浙江金华科迪仪器有限公司)。 1.2 方法 1.2.1 建鲤精密肝切片的制备
选取健康无病、体重在1000 g左右建鲤进行试验。采用MS-222麻醉,无菌采取肝脏后放入冷的HBSS培养基中(50 μg·mL-1庆大霉素,2.5 mg·mL-1两性霉素B),修整肝组织块,选取5 mm×5 mm的肝组织块进行切片,厚度为300 μm,选取完整切片置于含新生小牛血清(FCS)5%的L-15培养基的24孔培养板中,每组4孔,每孔6片,于27 ℃、5%体积分数 CO2条件下培养备用。 1.2.2 精密肝切片处理及分组
将培养于24孔板中建鲤精密肝切片组织培养30 min 后,弃掉上清,换用含TCDD和不同浓度甘草提取物的L-15培养基进行培养处理,观察甘草提取物对精密肝切片的保护作用。
Control组:为不用任何药物处理的精密肝切片,用 L-15培养基培养6 h,再换用新鲜的L-15培养基继续培养3 h,然后用24孔板收集上清液和肝切片。 TCDD造模组:精密肝切片用L-15培养基培养6 h,换用含0.3 μg·L-1 TCDD的L-15培养基继续培养3 h,然后用24孔板收集上清液和肝切片。
甘草提取物对照组:精密肝切片用L-15培养基培养6 h,换用含0.8 mg·mL-1甘草提取物的L-15培养基继续培养3 h,然后用24孔板收集上清液和肝切片。
甘草提取物前处理组:精密肝切片用L-15培养基培养3 h,换用含甘草提取物(0.2、0.4、0.8 mg·mL-1)的L-15培养基继续培养3 h,再换用含浓度为0.3 μg·L-1 TCDD的L-15培养基培养3 h,然后用24孔板收集上清液和肝切片。
甘草提取物后处理组:精密肝切片用 L-15培养基培养3 h,换用含0.3 μg·L-1 TCDD的L-15培养基培养3 h,再换用含甘草提取物(0.2、0.4、0.8 mg·mL-1)的L-15培养基继续培养3 h,然后用24孔板收集上清液和肝切片。
甘草提取物前后处理组:精密肝切片用含甘草提取物(0.2、0.4、0.8 mg·mL-1)的L-15培养基培养3 h,换用含浓度为0.3 μg·L-1 TCDD的L-15培养基培养3 h,再换用含甘草提取物(0.2、0.4、0.8 mg·mL-1)的L-15培养基继续培养3 h,然后用24孔板收集上清液和肝切片。 1.2.3 生化指标测定
收集精密肝切片各处理组上清培养液,按照试剂盒说明书操作方法进行SOD、GPT、MDA、GOT的测定。 1.2.4 精密肝切片培养液中TNF-α、IL-1β、IgM 含量的测定
采用双抗体夹心法测定肝切片培养液中TNF-α、IL-1β、IgM水平。用酶标仪在450 nm波长下测定吸光度值(OD值),测定应在加入终止工作液15 min内进行,通过标准曲线计算样品中TNF-α、IL-1β、IgM的浓度。 1.2.5 统计学处理
结果以平均值±标准误表示,所有数据均用SPSS 16.0软件包进行处理。采用One-Way ANOVA检验法进行显著性分析,以P<0.05为差异显著,P<0.01为差异极显著。 2 结果与分析 2.1 甘草提取物对建鲤精密肝切片培养液中GOT、GPT活性的影响
图 1显示精密肝切片经过TCDD处理后,GOT、GPT活性极显著升高(P<0.01),精密肝切片经过甘草提取物作用后,与TCDD组相比,三个处理组中甘草提取物均不同程度降低了GOT、GPT活性(P<0.01或P<0.05)。综合结果后发现,前处理组中甘草提取物降低GOT、GPT活性值效果较好。
 |
| 图 1 甘草提取物对TCDD损伤精密肝切片培养液中GOT(A)、GPT(B)活性的影响 Figure 1 Effects of GGE on activities of GOT(A)and GPT(B)in TCDD-treated PCLS |
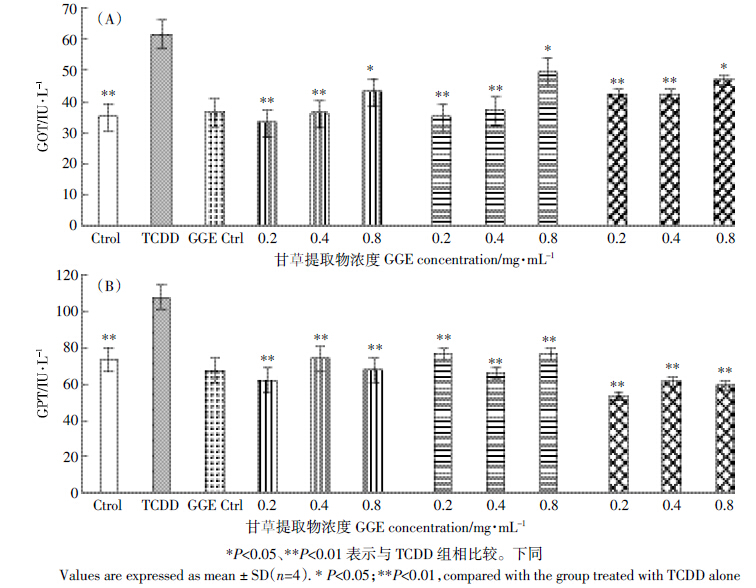
由图 2可以看出,精密肝切片经过TCDD处理后,与Control组相比,肝切片培养液中MDA含量极显著升高、SOD活性值极显著下降(Ps<0.01)。加入不同浓度甘草提取物后发现,3个药物处理组不同程度抑制了受损伤肝切片组织中MDA的分泌,并提高了精密肝切片中SOD活性,其中前处理组对MDA抑制效果较好,后处理组和前后药物处理组效果稍次之。
 |
| 图 2 甘草提取物对TCDD 损伤精密肝切片培养液中MDA 含量(A)、SOD 活性(B)的影响 Figure 2 Effects of GGE on MDA content(A)and SOD activity(B)in TCDD-treated PCLS |
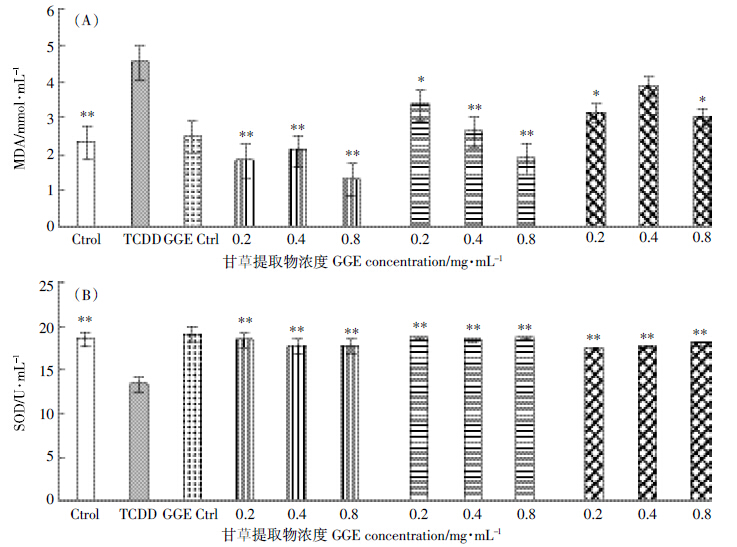
图 3显示精密肝切片组织经TCDD处理后,与Control组相比,TNF-α、IgM含量极显著升高(P<0.01)、IL-1β含量显著升高(P<0.05)。加入不同浓度甘草提取物后发现,3个处理组均可不同程度降低TNF-α、IL-1β、IgM含量,且前处理组抑制效果较好。
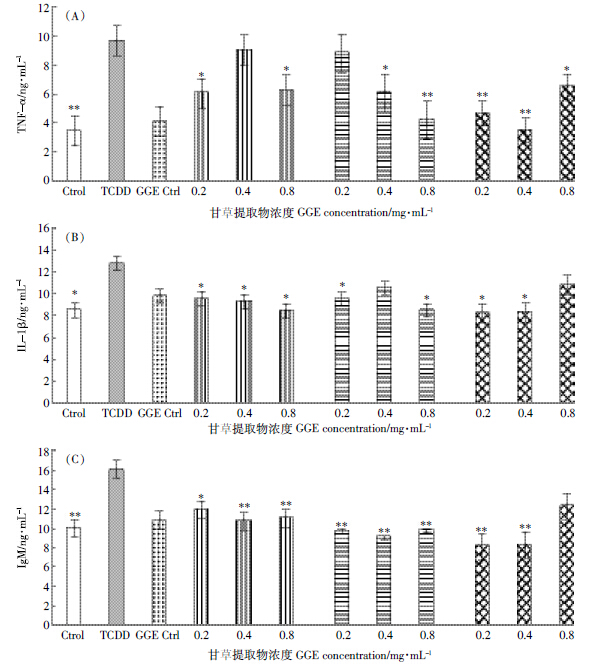 |
| 图 3 甘草提取物对TCDD损伤精密肝切片培养液中TNF-琢(A)、IL-1茁(B)、IgM(C)含量的影响 Figure 3 Effects of GGE on amounts of TNF-琢(A),IL-1茁(B)and IgM(C)in TCDD-treated PCLS |
在过去的几十年间,体外模型实验中原代肝细胞或肝细胞系经常被用于药物的筛选和毒性机制研究[9],但肝细胞也有自身的缺点,如不能够准确反映药物或者毒物对肝组织所造成的影响等。精细肝切片技术是一种新兴的技术手段,它介于器官与细胞水平间的实验手段,无需胶原酶,操作简单,能够保持正常组织结构,更接近在体代谢模式,被国内外广泛用于药理研究中[10, 11]。对水产动物而言,国内外没有应用鱼类肝精密组织切片损伤模型来筛选鱼类保肝药物的报道,也没有应用鱼类肝精密组织切片损伤模型研究中草药保肝机理的报道,从而制约了鱼类保肝药物的研究和开发。将精密肝切片技术应用于新渔药开发方面有很大研究前景,对于研究药物代谢分子机制及临床用药也具有很好的指导意义。
近年来关于TCDD的损伤机制研究主要集中在氧化应激反应,而氧化应激被认为是TCDD发挥毒性作用的重要环节[12]。TCDD对机体产生毒害作用并不是直接与体内蛋白质或核酸结合来实现,而是TCDD与芳香烃受体AHR结合进入细胞核,与转录调控元件的特定受体作用,改变靶基因的mRNA转录,从而改变酶的活性以及蛋白质,产生一系列氧化应激反应。正常生理状态下,机体体内活性氧不断产生,同时动用体内抗氧化酶系统不断清除,来保持体内平衡,当机体代谢平衡失调时,就会造成机体的氧化损伤。
GOT和GPT是两个反映肝组织健康与否的经典指标,被广泛用来评价肝组织损伤程度。许多化学物质造成肝损伤后会表现 GOT和GPT活性的升高,如Jia等[13]研究水飞蓟素对四氯化碳所造成建鲤肝组织损伤的保护作用发现,四氯化碳作用于建鲤肝组织会造成严重损伤,导致GOT和GPT活性极显著升高;禄保平等[14] 用四环素给小鼠灌胃建立肝损伤模型发现,小鼠肝脏中GOT和GPT活性显著升高。在本实验中,精密肝切片组织经过TCDD处理后发现,GOT、GPT活性也极显著升高(P<0.01),说明TCDD对肝切片造成了较严重损伤,经过不同浓度甘草提取物处理后,肝切片组织中GOT、GPT活性升高得到了抑制,且3个处理组均较明显地降低了其活性,减轻了TCDD对肝组织的损伤。
SOD是机体内一种重要的抗氧化酶指标,其活性水平的高低反映了机体内自由基的水平。机体氧自由基产生过多就会造成机体脂质过氧化反应,当肝细胞受到自由基攻击时,机体自身将表现出一种保护机制,就会动用体内抗氧化酶系统,造成SOD活性的降低。MDA是机体受到外界刺激时产生的脂质过氧化产物,通常将SOD活性与MDA含量的变化结合起来反映机体受损伤程度[15, 16, 17, 18]。在本实验中,建鲤肝组织受到TCDD攻击后,SOD活性极显著降低、MDA含量极显著升高,表明建鲤肝组织被TCDD损伤后,体内自由基水平迅速升高,MDA的生成量也不断增加,出于自身保护,SOD作为清除自由基的主要酶,参与肝组织的抗损伤过程,导致其活性的降低。加入甘草提取物后发现,SOD活性极显著升高,MDA含量也不同程度下降,说明甘草提取物对TCDD引起的肝组织损伤起到了一定的保护作用 ,可以协助清除体内自由基。
TNF-α、IL-1β是由肝枯否氏细胞分泌的细胞炎症因子,其主要功能是参与体内免疫防御,使机体产生防护机制,数值升高说明TNF-α、IL-1β参与了机体的病理过程,导致肝组织损害。已经有报道称炎症因子在肝细胞受损伤和自我保护机制中发挥着重要作用[19, 20, 21, 22, 23]。IgM是机体中重要的免疫球蛋白,当机体遭受病原体感染时,体内会产生相应的抗体来抵抗病原体,以保护机体功能的正常运转。当 TCDD诱导急性肝组织损伤时,肝枯否氏细胞释放大量的 TNF-α,导致肝组织产生炎症反应,TNF-α、IL-1β 含量明显升高;同样,为了抵抗TCDD对肝组织的损伤,免疫球蛋白IgM的表达就会启动,造成其含量明显升高,炎症应激和细胞毒作用诱导了肝损伤的进程。本研究显示,在加入甘草提取物后,明显降低了TNF-α、IL-1β、IgM的含量,与TCDD组相比有显著差异(P<0.01或P<0.05),表明甘草提取物能够抑制TNF-α、IL-1β、IgM所介导的肝组织损伤反应,可以有效地保护肝组织。 4 结论
综上所述,前处理组中甘草提取物在抑制TCDD造成机体肝损伤方面较其他两个处理组效果好,能有效降低TCDD对建鲤肝组织造成的损害。本实验为后面有效预防和治疗TCDD造成的鱼类污染提供了理论依据,但其具体防护机制还有待于进一步研究。
| [1] | 宋士波, 惠 阳, 徐旭东, 等. 14C标记1, 2, 7, 8-TCDD在鲤体内分布及代谢的初步研究[J]. 水生生物学报, 2005, 29(4):440-442. SONG Shi-bo, HUI Yang, XU Xu-dong, et al. Preliminary studies on metabolism and distribution of 14C labeled 1, 2, 7, 8-teteachlorodibenzo-p-dioxin in common carp[J]. Acta Hydrobiologica Sinica, 2005, 29(4):439-443. |
| [2] | 刘燕群, 谭佑铭, 沈红兵, 等. 茶多酚对二噁英所致肝损的作用及机理研究[J]. 现代预防医学, 2008, 35(8):1232-1233. LIU Yan-qun, TAN You-ming, SHEN Hong-bing, et al. Effects of tea polyphenols on liver damage caused by TCDD and its possible mechanism[J]. Modern Preventive Medicine, 2008, 35(8):1232-1233. |
| [3] | Turkez H, Geyikoglu F, Yousef M I. Beneficial effect of astaxanthin on 2, 3, 7, 8 tetrachlorodibenzo-p-dioxin-induced liver injury in rats[J]. Toxicology and Industrial Health, 2013, 29(7):591-599. |
| [4] | Turkez H, Geyikoglu F, Yousef M I. Modulatory effect of L-glutamine on 2, 3, 7, 8 tetrachlorodibenzo-p-dioxin-induced liver injury in rats[J]. Toxicology and Industrial Health, 2012, 28(7):663-672. |
| [5] | 张明发, 沈雅琴. 甘草酸防治肝损伤药理作用的研究进展[J]. 抗感染药学, 2010,7(4):232-236. ZHANG Ming-fa, SHEN Ya-qin. Research advances on pharmacological actions of Glycyrrhizic Acid in prevention and treatment of liver injury[J]. Anti-Infection Pharmacy, 2010:7(4 ):232-236. |
| [6] | 张明发, 沈雅琴. 甘草粗提物及其黄酮类成分的抗肿瘤作用[J]. 现代药物与临床, 2010, 25(2):124 -129. ZHANG Ming-fa, SHEN Ya-qin. Anticancer activities of crude extracts of licorice and its flavonoids[J]. Drugs & Clinic, 2010, 25(2):124-129. |
| [7] | CAO Li-Ping, JIA Rui, DU Jin-Liang, et al. Protective effect of Glycyrrhiza glabra Extract against tert-butylhydroperoxide(t-BHP)-induced hepatotoxicity in primary cultured hepatocytes of Jian Carp(Cyprinus carpio var. Jian)[J]. Journal of Agricultural Biotechnology, 2012, 20(10):1192-1200. |
| [8] | 陈红艳, 严 莉, 王建华, 等. 甘草提取物对小鼠四氯化碳急性肝损伤的影响[J]. 中国中医药信息杂志, 2009, 16(7):24-25. CHEN Hong-yan, YAN Li, WANG Jian-hua, et al. Protective effect of extraction of Glycyrrhiza Uralensis Fisch. on CCl4 induced acute hepatic injury in mice[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2009, 16(7):24-25. |
| [9] | Fent K. Fish cell lines as versatile tools in ecotoxicology:Assessment of cytotoxicity, cytochrome P4501A induction potential and estrogenic activity of chemicals and environmental samples, Toxicol[J]. In Vitro, 2001, 15:477-488. |
| [10] | 张 春, 汪 晖, 郭 喻. 阿魏酸钠对乙醇损伤性大鼠肝切片的保护作用及机制[J]. 武汉大学学报(医学版), 2005, 26(4):477-480. ZHANG Chun, WANG Hui, GUO Yu. Protection of sodium ferulate on ethanol-induced hepatotoxicity in precision liver-cut slices of rats and its mechanism[J]. Medical Journal of Wuhan University, 2005, 26(4):477-480. |
| [11] | 李婧婷, 汪 晖, 潘晓靓, 等. 醋氨酚所致精密肝切片损伤模型的建立及CYP2E1的调节作用[J]. 中国临床药理学与治疗学, 2008, 13(1):46-50. LI Jing-ting, WANG Hui, PAN Xiao-liang, et al. Establishment of an acetaminophen-induced hepatotoxicity model of precision-cut liver slices and the regulation of cytochrome P450 2E1[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2008, 13(1):46-50. |
| [12] | 王朝和, 原丽欣, 曹明琳, 等. 2, 3, 7, 8-四氯二苯并二噁英对体内氧化应激反应的研究进展[J]. 中国工业医学杂志, 2003, 16(2):99-111. WANG Chao-he, YUAN Li-xin, CAO Ming-lin, et al. Progress in 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin on oxidative stress in vivo[J]. Chinese Journal of Industrial Medicine, 2003, 16(2):99-111. |
| [13] | Jia R, Cao L P, Du J L, et al. The protective effect of silymarin on the carbon tetrachloride(CCl4)-induced liver injury in common carp(Cyprinus carpio)[J]. In Vitro Cellular & Development Biology Animal, 2013, 49:155-161. |
| [14] | 禄保平, 杨晓娜, 许家艳. 应用四环素灌胃建立小鼠急性肝损伤模型的初步研究[J]. 南京医科大学学报(自然科学版), 2006, 26(8):671-675. LU Bao-ping, YANG Xiao-na, XU Jia-yan. Preliminary study on the establishment of mouse model of acute liver injury by perfusing stomach with tetracycline[J]. Acta Universitatis Medicinalis Nanjing(Natural Science), 2006, 26(8):671-675. |
| [15] | 张迎梅, 王叶菁, 虞闰六, 等. 重金属胁迫对泥鳅肝胰脏ATPase和SOD活性的影响[J]. 甘肃科学学报, 2008, 20(3):55-59. ZHANG Ying-mei, WANG Ye-jing, YU Run-liu, et al. Effects of heavy metals on ATPase and SOD activities of hepatopancreas in Misgurnus anguillicaudatus[J]. Journal of Gansu Sciences, 2008, 20(3):55-59. |
| [16] | 胡义扬, 刘 平, 刘 成, 等. CCl4急性肝损伤肝SOD、MDA的动态变化及扶正化瘀方对其影响[J]. 中西医结合肝病杂志, 1997, 7(2):87-90. HU Yi-yang, LIU Ping, LIU Cheng, et al. Dynamic changes of Superoxide Dismutase(SOD) and Malondialdehyde(DMA) in acute liver injury induced by CCl4-intoxieation and effects of Fu Zheng Hua Yu Decoction(FZHY) on them[J]. Chinese Journal of Integrated Traditional and Western Medicine on Liver Diseases, 1997, 7(2):87-90. |
| [17] | 吴 煜, 许桂林, 楼 敏, 等. 松果菊苷对大鼠急性肝损伤的保护作用[J]. 胃肠病学和肝病学杂志, 2008, 17(5):410-412. WU Yu, XU Gui-lin, LOU Min, et al. The protective effect of echinacoside on acute liver injury in rats[J]. Chinese Journal of Gastroenterology and Hepatology, 2008, 17(5):410-412. |
| [18] | 郑红花, 罗德生, 罗丽芳, 等. 大鼠实验性肝损伤时山梨醇脱氢酶、SOD活性及MDA含量变化[J]. 咸宁医学院学报, 2000, 14(4):232-234. ZHENG Hong-hua, LUO De-sheng, LUO Li-fang, et al. The changes of SDH and SOD activity and MDA level in experimental liver injury in wistar rats[J]. Journal of Xianning Medical College, 2000, 14(4):232-234. |
| [19] | 汤乃军, 刘云儒, 任大林. 2, 3, 7, 8-四氯二苯并二噁英对SD大鼠肝脏SOD、GST、MDA影响的实验研究[J]. 中国工业医学杂志, 2003, 16(6):335-337. TANG Nai-jun, LIU Yun-ru, REN Da-lin. Experimental study on the effects of TCDD on SOD, GST, MDA in livers of SD rats[J]. Chinese Journal of Industrial Medicine, 2003, 16(6):335-337. |
| [20] | Bourdi M, Masubuchi Y, ReiILLY T P, et al. Protection against aceta-minophen-induced liver injury and lethality by interlcukin-10:Role of inducible nitricoxide synthase[J]. Hepatology, 2002, 35:289-298. |
| [21] | Masubuchi Y, Bourdi M, Reilly T P, et al. Role of interlcukin-6 in hepatic heat shock protin expression and protection against acetaminophen induced liver disease[J]. Biochemical Biophysical Research Communications, 2003, 304:207-212. |
| [22] | 江 山, 夏 剑, 赵 剡, 等. 脂氧素 A4通过调节炎症因子保护对乙酰氨基酚所致肝损伤[J]. 临床急诊杂志, 2014, 15(10):611-614. JIANG Shan, XIA Jian, ZHAO Yan, et al. Lipoxin A4 protect paracetamol-induced liver injury through regulating inflammatory factors[J]. Journal of Clinical Emergency, 2014, 15(10):611-614. |
| [23] | 邹登峰, 张可锋, 谢爱泽. 金花茶多糖抗小鼠免疫性肝损伤作用的研究[J]. 华西药学杂志, 2014, 29(5):525 -527. ZOU Deng-feng, ZHANG Ke-feng, XIE Ai-ze. Protective effect of Camellia nitidissima polysaccharides on immunological liver injury in the mice induced by BCG combined LPS[J]. West China Journal of Pharmaceutical Sciences, 2014, 29(5):525 -527. |
 2015, Vol. 34
2015, Vol. 34