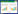文章信息
- 田向荣, 吴昊, 李菁, 李朝阳
- TIAN Xiang-rong, WU Hao, LI Jing, LI Zhao-yang
- Cd、Pb复合胁迫下湿地匍灯藓(Plagiomnium acutum)重金属累积效应及抗氧化系统响应
- Heavy Metal Accumulation and Antioxidative System Responses of Plagiomnium acutum Under Combined Cadmium and Lead Stresses
- 农业环境科学学报, 2015, 34(5): 844-851
- Journal of Agro-Environment Science, 2015, 34(5): 844-851
- http://dx.doi.org/10.11654/jaes.2015.05.005
-
文章历史
- 收稿日期:2014-11-11
2. 植物资源保护与利用湖南省高校重点实验室, 湖南 吉首 416000
2. Key Laboratory of Plant Resources Conservation and Utilization(Jishou University), College of Hunan Province, Jishou 416000, China
苔藓植物与重金属的相互关系已有大量的报道,单一重金属的胁迫研究汇集了大量数据,但有关Cd、Pb复合胁迫的研究并不多见。仅有魏海英等[8, 9] 对Pb、Cd单一和复合胁迫对弯叶灰藓以及大羽藓某些生理特性的影响进行了初步探讨,其结果表明,Pb、Cd复合胁迫对两种藓的生理影响均大于各自的单一胁迫。
湿地匍灯藓(Plagiomnium acutum)是比较常见的一种藓类,生物量较大,多以营养繁殖为主,稀少见有性繁殖,因此是研究逆境胁迫的良好材料[10]。前期研究表明,湿地匍灯藓对Pb、Cd都具有较强的吸收能力,在单一Pb、Cd胁迫下,该藓对两种重金属的响应表现出重金属种类差异特征,Cd 胁迫下主要是超氧化物歧化酶(SOD)和过氧化物酶(POD)起作用,Pb胁迫下仅有SOD发挥了清除活性氧的作用,暗示两种重金属的作用机制存在差异[11, 12]。进一步运用叶绿素荧光动力学技术研究两种重金属胁迫下其叶绿素荧光变化的结果表明,Pb、Cd均使该藓的光合系统PSII活性中心受损,不同的是Pb为直接损伤,而Cd为间接损伤,当环境重金属处于较高浓度时,Pb、Cd对叶绿素荧光的影响表现为相互拮抗效应[13]。
本研究继续以湿地匍灯藓为材料,探讨Cd、Pb 复合胁迫下湿地匍灯藓对两种重金属的累积效应与抗氧化系统对复合胁迫的响应特征,试图找到藓类植物对Pb、Cd胁迫的生理生态响应机制。 1 材料与方法 1.1 材料
湿地匍灯藓采集地点、采集方法及预培养同参考文献[11],材料用蒸馏水培养 2 d,待其基本恢复正常生长状况时挑选长势一致,长度为 3~5 cm的枝条,进行重金属胁迫处理。 1.2 实验设计
本实验共设置10 个处理组,Cd 浓度设定为 0、2、5、50 mg·L-1,以CdCl2·2.5H2O 形式添加,Pb 浓度设定为 0、20、50、100 mg·L-1,以Pb(NO3)2形式添加。10 个复合处理组(Cd+Pb)分别为(0+0)、(2+20)、(2+50)、(2+100)、(5+20)、(5+50)、(5+100)、(50+20)、(50+50)、(50+100)mg·L-1,每个处理设 3个重复,详见表 1。
具体实验过程为:分别按上述浓度用去离子水配成处理液,每份样品称取2.0 g 鲜重材料,放入150 mL各浓度重金属处理液中,对照组用去离子水培养,将培养瓶放于微电脑培养箱中(SPX225012G型,上海博迅)培养,温度保持在(25±1)℃,光暗比为16∶8,光照强度为1600 lx。每 2 d换一次处理液,培养 15 d 后取样测定各指标。 1.3 重金属含量和抗氧化酶活性测定
植株Cd、Pb含量采用ICP-OES法测定,具体做法为:准确称取0.2 g 烘干样品,剪碎后加入浓硝酸 8 mL用微波消解系统(CEM,Mars 240/50)进行消解,然后用去离子水定容到 25 mL。过滤后滤液进行重金属含量测定[11],丙二醛(MDA)含量采用硫代巴比妥法测定[11],脯氨酸含量采用酸性茚三酮显色法测定[11];以NBT光化还原法测定SOD酶活性,分别以愈创木酚和H2O2为底物的紫外可见光光度法测定过氧化物酶(POD)和过氧化氢酶(CAT)的活性[11]。 2 结果与分析 2.1 Cd、Pb 复合胁迫下湿地匍灯藓对两种重金属的吸收与累积效应
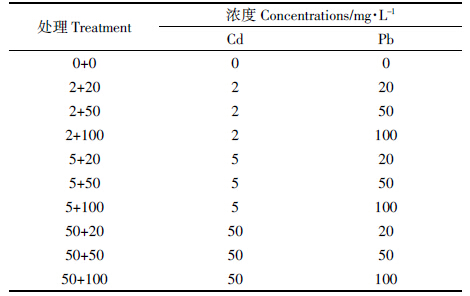
由图 1 可看出,随处理溶液中 Cd(或 Pb)水平的升高,湿地匍灯藓体内Cd(或 Pb)吸收整体呈上升趋势。但同一 Cd 处理水平下,藓体 Cd累积量却随 Pb 胁迫浓度的增加而显著降低。与低 Pb 水平(20 mg·L-1)相比(对照无检出值),在低 Cd(2 mg·L-1)处理时,50、100 mg·L-1的 Pb 处理分别使藓体内 Cd 累积量降低了30.1%和 78.4%;中 Cd(5 mg·L-1)水平处理下,则分别降低了 27.4%和 83.2%;高 Cd(50 mg·L-1)水平处理时,其降幅分别达到了 35.0%和 86.9%。相反,随Cd 处理浓度增加,藓体 Pb 的累积量无显著变化。对二者互作关系作图分析结果表明,Cd胁迫浓度与藓体内 Cd 含量和 Pb 胁迫浓度与藓体内 Pb 含量均呈现剂量效应关系(图 2A、图 2C),其中 Pb 胁迫浓度与藓体 Cd 含量呈现明显的负相关关系,并随着 Pb 胁迫浓度的提升反比斜率增大(图 2B),与之相反,Cd 胁迫浓度与藓体 Pb含量几乎不相关(图 2D)。
 |
| 图 1 Cd、Pb 复合胁迫下湿地匍灯藓对两种重金属的积累 Figure 1 Accumulation of Cd and Pb in Plagiomnium acutum under combined Cd and Pb stresses |
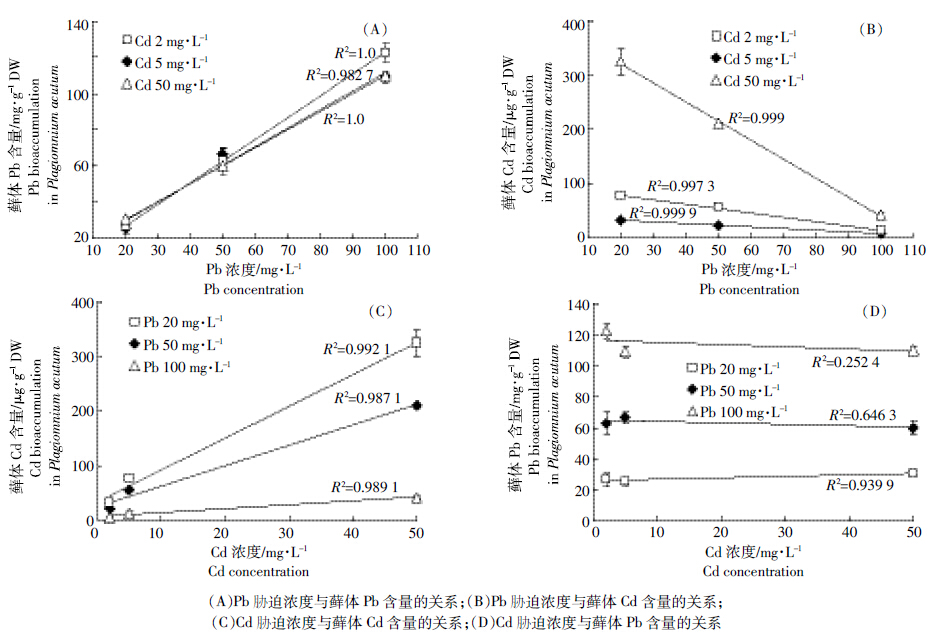 |
| 图 2 Cd、Pb复合胁迫下湿地匍灯藓对两种重金属吸收富集的相互关系 Figure 2 Interrelationship between cadmium and lead accumulation in Plagiomnium acutum under combined Cd and Pb stresses |
图 3显示,Cd、Pb 复合胁迫引起湿地匍灯藓体内游离脯氨酸极显著积累。在同一Cd水平下,随Pb 浓度增加游离脯氨酸含量持续上升。与对照相比,随 Pb 浓度增加,2 mg·L-1 Cd处理下,湿地匍灯藓的游离脯氨酸含量分别增加了1174%、1250%和1825%;5 mg·L-1 Cd处理下,分别增加了903%、1123%和1500%;50 mg·L-1 Cd处理下则分别增加了 1086%、1268%和2049%。 对游离脯氨酸含量与两种重金属之间的互作关系作图分析表明,脯氨酸的积累与Pb胁迫浓度呈现明显的正相关关系(图 4A),而与 Cd胁迫浓度相关性不大(图 4B)。
 |
| 图 3 Cd、Pb 复合胁迫下湿地匍灯藓游离脯氨酸含量的变化 Figure 3 Changes of free proline concentrations in Plagiomnium acutum under combined Cd and Pb stresses |
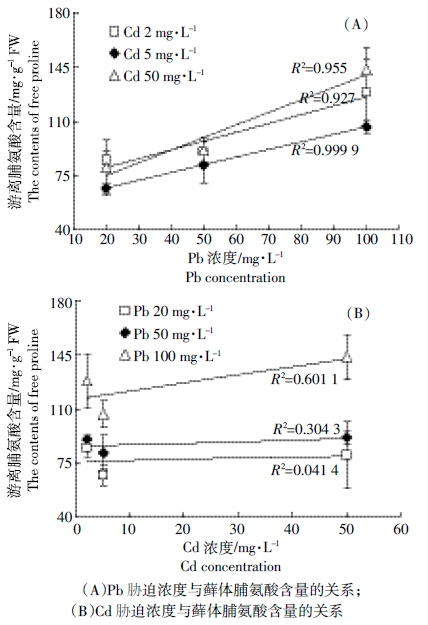 |
| 图 4 Cd、Pb 复合胁迫下湿地匍灯藓游离脯氨酸积累与两种重金属胁迫的相互关系 Figure 4 Interrelationship between proline accumulation in Plagiomniumacutum and Cd and Pb under combined Cd and Pb stresses |
由图 5可知,Cd、Pb 复合胁迫引起湿地匍灯藓体内的 MDA显著累积,并随复合胁迫浓度的增加而显著升高。与对照相比,随 Pb 浓度增加,在低Cd(2 mg·L-1)水平下,MDA含量分别增加了1785%、1623%、2100%;中Cd(5 mg·L-1)水平下,分别增加了2912%、1550%、3462%;高Cd(50 mg·L-1)水平下,分别增加了 4885%、3392%、7162%。这表明Cd、Pb 复合胁迫所致细胞脂质过氧化程度非常严重。对MDA含量与两种金属互作关系分析表明,Cd胁迫浓度与藓体MDA积累有明显的正相关关系(图 6B),而Pb胁迫浓度与MDA积累的相关性则非常低(图 6A)。
 |
| 图 5 Cd、Pb 复合胁迫下湿地匍灯藓体丙二醛含量的变化 Figure 5 Changes of malondialdehyde(MDA)content in Plagiomnium acutum under combined Cd and Pb stresses |
 |
| 图 6 Cd、Pb 复合胁迫下湿地匍灯藓体丙二醛含量与 两种重金属胁迫的相互关系 Figure 6 Interrelationship between MDA accumulation in Plagiomnium acutum and Cd and Pb |
由图 7A可看出,随Cd、Pb复合胁迫浓度加大,湿地匍灯藓的SOD活性逐渐增加。与对照相比,2 mg·L-1 Cd处理下,随 Pb 浓度的增加,SOD活性分别增加了-11.7%、13.7% 和 30.8%;5 mg·L-1 Cd处理下分别增加了39.9%、54.7% 和 52.4%;50 mg·L-1 Cd处理下则分别增加了-11.8%、55.6% 和237.4%。当Cd和Pb处于中、低浓度时,二者对SOD活性的作用表现为相互拮抗,在高浓度复合胁迫时却呈现为协同作用(图 8A、图 8B)。比较而言,当Cd浓度处于2 mg·L-1时,Pb是诱导藓体内SOD活性提升的主要原因(图 8A)。与之相反,如图 7B所示,湿地匍灯藓POD活性在相对对照的整体高水平上随复合处理浓度增加呈现出明显的下降趋势。当溶液Pb浓度为20 mg·L-1水平时,藓体POD活性显著高于对照,分别增加了106%、63%和55%,但随溶液中Cd浓度的增加持续降低;50 mg·L-1 Pb水平下POD活性随Cd浓度增加分别增加了67%、57%和-17%;当Pb浓度达到100 mg·L-1水平时,藓体POD活性已低于对照值,并随Cd浓度的增加分别降低了24%、21%和54%。相关性分析表明,POD活性与Pb处理浓度呈负相关(P<0.05,图 8C、图 8D)。与POD活性变化类似,图 7C所示的湿地匍灯藓CAT活性在低浓度复合胁迫下即表现为持续下降趋势,而这种下降趋势与Cd具有明显的相关性(P<0.05,图 8E、图 8F)。与对照相比,随Cd处理浓度增加,在20 mg·L-1 Pb处理水平,藓体的CAT活性分别降低了15%、51%和78%;50 mg·L-1 Pb处理水平下分别降低了28%、46%和60%;100 mg·L-1 Pb处理水平下,其降幅分别达到了39%、52%和68%。
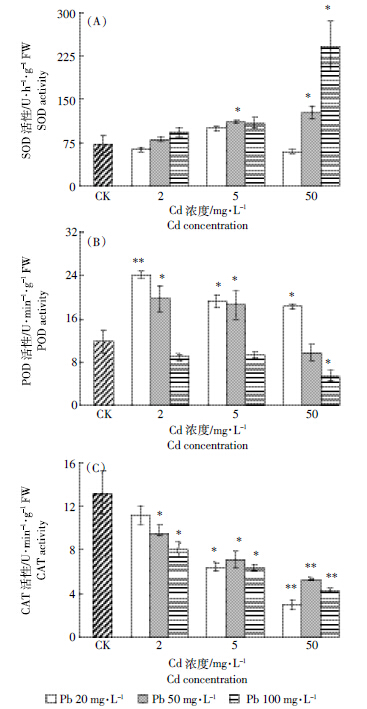 |
| 图 7 Cd、Pb 复合胁迫下湿地匍灯藓SOD(A)、POD(B)和 CAT(C)活性的变化 Figure 7 Changes of SOD(A),POD(B)and CAT(C)activities in Plagiomnium acutum under combined Cd and Pb stresses |
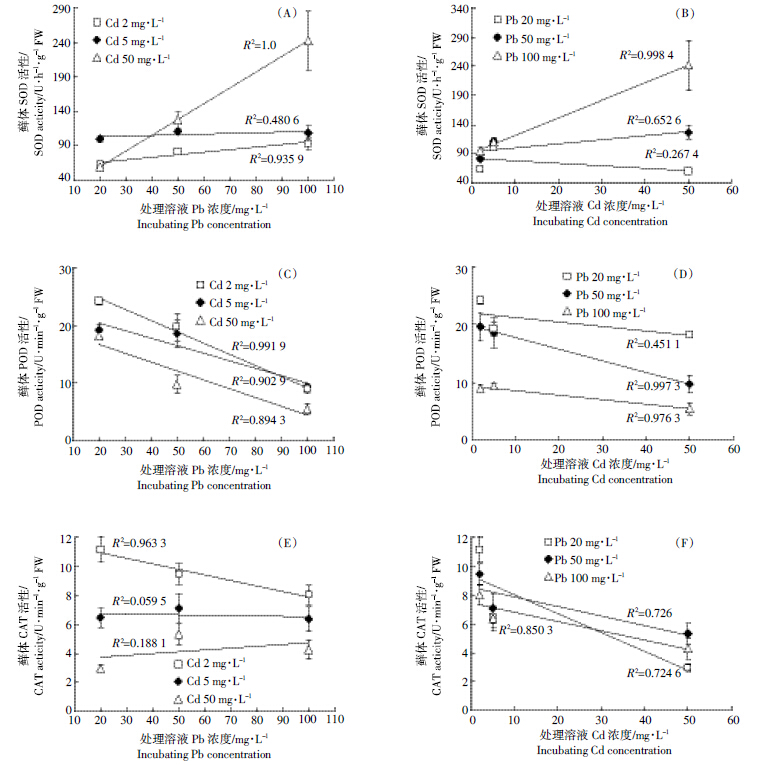 |
| 图 8 Cd、Pb 复合胁迫下湿地匍灯藓抗氧化酶活性与两种重金属胁迫的相互关系 Figure 8 Interrelationship between antioxidant enzyme activities in Plagiomnium acutum and Cd and Pb under combined Cd and Pb stresses |
藓类植物是重金属的富集者,能够吸收不同种类的重金属元素,但其对不同重金属离子的吸附是不一致的。如Maevskay等[14]把1 g走灯藓(Plagiomnium undulatum)浸入到100 mL硝酸铅溶液 1 h后,藓体内Pb的含量已经达到2 mg,相当于溶液中的总Pb;其原位显色分析表明,Pb比Cd更容易被藓体所吸收,基于此他们认为可能是因Pb竞争苔藓表面的离子交换位点而占用了细胞膜上的离子交换通道所致[3]。此外,前期研究结果表明,单一Cd、Pb胁迫下,湿地匍灯藓体内两种重金属的含量均呈浓度效应关系上升[11, 12]。本研究结果显示在Pb存在的条件下,湿地匍灯藓对Cd未能体现出强富集特性,随溶液中Pb浓度的增加,其对Cd的吸收量显著下降,Pb浓度越高,这种抑制作用越明显。只要Pb存在,即使是在高Cd浓度处理下,Cd的累积量也非常低。这种现象在低等植物田头菇[15]以及维管植物玉米[16]中都存在,后者也认为是Pb竞争土壤中的吸附位点所致。相反,Pb的吸收几乎不受Cd的影响,无论Cd怎样变化,藓体内的Pb含量总是与溶液总Pb含量相差无几。这些结果证实了上述观点,即当环境中Pb、Cd同时存在时,藓类植物可能通过优先吸收毒性较弱的Pb,将藓体表面的离子交换位点占据,从而减少或屏蔽毒性大的Cd对藓体的伤害,也许是藓类植物避害的策略之一。
脯氨酸含量的提升是植物应对重金属胁迫的一种普遍反应,大量研究表明,重金属胁迫均使植物体内脯氨酸积累[17]。一方面脯氨酸通过渗透调节来降低重金属的毒害,另一方面脯氨酸可直接清除重金属胁迫引起的活性氧自由基以及使胞质维持较高还原性状态,即提高谷胱甘肽(GSH)的水平来减轻重金属对植物的毒害[18, 19]。宋松泉等[20] 研究脯氨酸代谢在交叉耐性中的作用中也发现脯氨酸的积累水平对复合/交叉胁迫耐性的提升有明显的提升作用。藓类植物在Cd、Pb复合胁迫下的脯氨酸积累则并非十分清晰。本研究的结果证明Cd、Pb复合胁迫使湿地匍灯藓体内的脯氨酸显著积累,这种累积又与Pb浓度呈现正相关性,与Cd浓度效应关系不大,在以往我们的单因子实验结果也显示,随Pb胁迫浓度的增加,藓体的脯氨酸含量显著上升,Cd虽然也使藓体内脯氨酸含量显著增加,却呈现出随Cd浓度增加而持续下降的趋势[11, 12]。这些结论均明确支持了本研究中湿地匍灯藓体内脯氨酸的积累主要由Pb引起的结果。同样,Sun等[21]对采自上海五个不同污染程度的毛尖青藓(Brachythecium piligerum Chad)进行分析后发现,采自样点ZSP的毛尖青藓重金属Pb、Cd含量最高,污染程度最重;其次为样点HHP和MHZ。三个样点中,Pb含量从高到低分别为ZSP>HHP>MHZ,Cd含量高低顺序为ZSP>MHZ>HHP,三个样点藓体内的脯氨酸含量高低顺序为ZSP>HHP>MHZ,与Pb的浓度表现出一定的正相关性,而与Cd浓度关系不大。这从自然生态的侧面也支持了本研究的观点,即 Pb能刺激藓体应激增加脯氨酸含量来防御重金属胁迫产生的活性氧毒害,也许是藓类植物在遭受Cd、Pb复合胁迫时优先选择吸收Pb的第一个重要原因。
与Pb导致脯氨酸的积累相对应,藓类植物细胞膜的损伤可能主要来自于Cd。孙天国等[17]研究与本研究结果相同,均发现Cd、Pb复合胁迫下,随复合胁迫浓度增加,藓类植物体内MDA含量持续增加。虽然作为膜脂过氧化终产物的MDA含量随复合处理浓度增加而显著增加,但从本研究结果的相关性分析来看,MDA含量与Cd存在明显的正相关性,而与Pb的相关性不强,表明复合胁迫下,湿地匍灯藓体内MDA的累积主要由Cd引起,其对细胞膜的伤害远远强于Pb。基于此,可以认为当藓类植物遭受到复合重金属胁迫时,尽量减轻活性氧对细胞膜的损伤,可能是其优先选择吸收Pb的第二个重要原因。
抗氧化酶系统在植物遭受逆境胁迫时发挥着关键作用。本研究结果显示,作为O2·清除剂的SOD活性在整个处理过程中,随复合胁迫浓度增加,呈现为持续增加趋势,而这种增加一定程度上归于Pb的刺激作用。同样的结果也在富集植物印度芥菜中得到,随着Cd、Pb复合胁迫浓度的增加,其体内的SOD活性上升,但与本结果不同的是,Cd、Pb对印度芥菜SOD活性具有协同作用,而在油菜体内只是Pb具有激活SOD活性的作用[22]。作为以H2O2为代表的过氧化物清除酶POD活性在本实验中表现为先升后降,CAT活性则呈现为持续降低趋势,相关分析表明其活性的抑制主要受Cd的影响,POD的活性降低则主要由Pb引起。这一结果同样与Cd、Pb复合胁迫下印度芥菜的结果相一致 [22],表明富集植物在应对重金属胁迫时,即存在类似的生理代谢如提高SOD酶活性,也有其特异性反应如对不同重金属离子的响应,以达到保护细胞膜结构等来减轻重金属对植物体的毒害。 4 结论
(1)当湿地匍灯藓遭受Cd、Pb复合胁迫时,Pb可能被其优先吸收。随Pb胁迫浓度增加,Cd的吸收量显著减少,Pb对Cd的吸收具有显著抑制作用。
(2)湿地匍灯藓在复合胁迫下,脯氨酸和SOD酶活性由Pb所诱导产生,而MDA的积累和过氧化物清除酶活性下降则与Cd毒性直接有关。
(3)CAT和POD酶活性的下降所致的过氧化物积累应该是造成湿地匐灯藓Cd、Pb复合胁迫下氧化损伤的根本原因。
| [1] | Brown D H, Brumelis G. A biomonitoring method using the cellular distribution of metals in moss[J]. Science of the Total Environment, 1996, 187(2):153-161. |
| [2] | Panda S K, Choudhhury S. Changes in nitrate reductase activity and oxidative stress response in the moss Polytrichum commune subjected to chromium, copper and zinc phytotoxicity[J]. Brazilian Journal of Plant Physiology, 2005, 17(2):191-197. |
| [3] | Sun S Q, He M, Cao T, et al. Response mechanisms of antioxidants in bryophyte(Hypnum plumaeforme) under the stress of single or combined Pb and/or Ni[J]. Environmental Monitoring and Assessment, 2009, 149(1-4):291-302. |
| [4] | Maksymiec W. Effect of copper on cellular processes in higher plants[J]. Photosynthetica, 1997, 34(3):321-342. |
| [5] | Cho U H, Seo N H. Oxidative stress in Arabidopsis thaliana exposed to cadmium is due to hydrogen peroxide accumulation[J]. Plant Science, 2005, 168(1):113-120. |
| [6] | Gamalero E, Lingua G, Berta G, et al. Beneficial role of plant growth promoting bacteria and arbuscular mycorrhizal fungi on plant responses to heavy metal stress[J]. Canadian Journal of Microbiology, 2009, 55(5):501-514. |
| [7] | 曹 莹, 赵艺欣, 刘 洋, 等. 铅镉复合胁迫对不同耐性玉米衰老特性的影响[J]. 玉米科学, 2011, 19(6):70-73. CAO Ying, ZHAO Yi-xin, LIU Yang, et al. Effect of the combined stress of Cadmium and lead on senescence characteristics of Maize with different tolerances[J]. Journal of Maize Sciences, 2011, 19(6):70-73. |
| [8] | 魏海英, 方炎明, 尹增芳. Pb、Cd单一及复合污染对弯叶灰藓某些生理特性的影响[J]. 广西植物, 2003, 23(1):69-72. WEI Hai-ying, FANG Yan-ming, YIN Zeng-fang. Effects of Pb, Cd single and joint pollution on some physiological characters of Hypnum revolutum[J]. Guihaia, 2003, 23(1):69-72. |
| [9] | 魏海英, 方炎明, 尹增芳. 铅和镉污染对大羽藓生理特性的影响[J]. 应用生态学报, 2005, 16(5):982-984. WEI Hai-ying, FANG Yan-ming, YIN Zeng-fang. Effects of Pb2+ and Cd2+ pollution on physiological characteristics of Thuidium cymbifolium[J]. Chinese Journal of Applied Ecology, 2005, 16(5):982-984. |
| [10] | Carginale V, Sorbo S, Capasso C, et al. Accumulation, localisation, and toxic effects of cadmium in the liverwort Lunularia cruciata[J]. Protoplasma, 2004, 223:53-61. |
| [11] | 李朝阳, 陈 玲, 马陶武, 等. 湿地匍灯藓(Plagiomnium acutum)对Pb胁迫的生物标志物响应[J]. 农业环境科学学报, 2012, 31(2):292-298. LI Zhao-yang, CHEN Ling, MA Tao-wu, et al. Biomarker responses of Plagiomnium acutum to lead stress[J]. Journal of Agro-Environment Science, 2012, 31(2):292-298. |
| [12] | 李朝阳, 陈 玲, 吴 昊, 等. 湿地匍灯藓(Plagiomnium acutum)的防御机制对镉胁迫的响应[J]. 农业环境科学学报, 2012, 31(9):1665-1671. LI Zhao-yang, CHEN Ling, WU Hao, et al. Response of defense mechanisms in Plagiomnium acutum under Cd stress[J]. Journal of A gro-Environment Science, 2012, 31(9):1665-1671. |
| [13] | 李朝阳, 吴 昊, 田向荣, 等. Cd、Pb胁迫下湿地匍灯藓(Plagiomnium acutum)叶绿素荧光特性研究[J], 农业环境科学学报, 2014, 33(1):49-56. LI Zhao-yang, WU Hao, TIAN Xiang-rong, et al. Fluorescent characteristics of chlorophylls in Plagiomnium acutum under Cd and Pb stress[J]. Journal of Agro-Environment Science, 2014, 33(1):49-56. |
| [14] | Maevskaya S M, Kardash A R, Demkiv O T. Absorption of cadmium and lead ions by gametophyte of the moss Plagiomnium undulatum[J]. Russian Journal of Plant Physiology, 2001, 48(6):820-824. |
| [15] | 安鑫龙, 周启星, 李 婷, 等. 田头菇菌丝体对镉、铅及其复合胁迫的生长与富集效应[J]. 中山大学学报(自然科学版), 2008, 47(5):93-97. AN Xin-long, ZHOU Qi-xing, LI Ting, et al. Growth and enrichment responses of Agrocybe praecox hyphae to single and combined stress of Cd and Pb[J]. Acta Scientiarum Naturalium Universitis Sunyatseni, 2008, 47(5):93-97. |
| [16] | 曹 莹, 黄瑞冬, 李建东, 等. 铅和镉复合胁迫下玉米对镉的吸收特性[J]. 生态学杂志, 2006, 25(11):1425-1427. CAO Ying, HUANG Rui-dong, LI Jian-dong, et al. Cadmium absorption characteristics of Zea mays under combined stress of lead and cadmium[J]. Chinese Journal of Ecology, 2006, 25(11):1425-1427. |
| [17] | 孙天国, 沙 伟, 刘 岩. 复合重金属胁迫对两种藓类植物生理特性的影响[J]. 生态学报, 2010, 30(9):2332-2339. SUN Tian-guo, SHA Wei, LIU Yan. The effects of compound heavy metal stress on some physiological characteristics of two moss species[J]. Acta Ecologica Sinica, 2010, 30(9):2332-2339. |
| [18] | 支立峰, 余 涛, 朱英国, 等. 过量表达脯氨酸的转基因烟草细胞对毒性重金属的抗性增强[J]. 湖北师范学院学报(自然科学版), 2006(2):14-19. ZHI Li-feng, YU Tao, ZHU Ying-guo, et al. Overexpression of △1-pyrroline-5-carboxylate synthetase enhanced tolerance to toxic heavy metals in transgenic tobacco cells[J]. Journal of Hubei Normal University(Natural Science), 2006(2):14-19. |
| [19] | Smimoff N. The role of active oxygen in the response of plants to water deficit and desiccation[J]. New Phytologist, 1993, 125(1):27-58. |
| [20] | Song S Q, Lei Y B, Tian X R. Proline metabolism and cross-tolerance in germination/growth of wheat seeds to salinity and heat stress[J]. Russian Journal of Plant Physiology, 2005, 52(6):793-800. |
| [21] | Sun S Q, He M, Wang G X, et al. Heavy metal-induced physiological alterations and oxidative stress in the moss Brachythecium piligerum Chad[J]. Environmental Toxicology, 2011, 26(5):453-458. DOI 10. 1002/tox. 20571. |
| [22] | 郭艳杰, 李博文, 杨 华, 等. Cd, Pb 复合污染对印度芥菜抗氧化酶活性的影响[J]. 水土保持学报, 2011, 25(1):214-218, 228. GUO Yan-jie, LI Bo-wen, YANG Hua, et al. Stress responses of Brassica juncea to Cd and Pb compound contamination in soil[J]. Journal of Soil and Water Conservation, 2011, 25(1):214-218, 228. |
 2015, Vol. 34
2015, Vol. 34