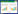文章信息
- 李定心, 樊霆, 唐子阳, 王振, 陈海燕, 鲁洪娟, 张国漪, 叶文玲, 张伟
- LI Ding-xin, FAN ting, TANG Zi-yang, WANG Zhen, CHEN Hai-yan, LU Hong-juan, ZHANG Guo-yi, YE Wen-ling, ZHANG Wei
- Cu(Ⅱ)胁迫下黑曲霉TL-F2谷胱甘肽系统的响应
- Responses of Glutathione System of Aspergillus niger TL-F2 to Cu(Ⅱ) Stress
- 农业环境科学学报, 2015, 34(5): 852-858
- Journal of Agro-Environment Science, 2015, 34(5): 852-858
- http://dx.doi.org/10.11654/jaes.2015.05.006
-
文章历史
- 收稿日期:2014-12-12
黑曲霉(Aspergillus niger)对重金属有较强的吸附作用,常被用于含镉、镍、砷、铅、锌、铜等重金属废水生物修复[13, 14, 15, 16]。有报道表明在ROS胁迫下,黑曲霉细胞内的CAT、SOD等抗氧化酶活性有不同程度的增加[17, 18],重金属胁迫引起黑曲霉脂质过氧化产物MDA的积累从而破坏细胞膜的完整性和有序性[19]。Canovas等[20]和Abhishek等[19]还发现在砷胁迫下,Aspergillus P37体内的GSH、 GR都会有不同程度的增减,与GSH/GPx系统的应激反应有关。综上所述,不同重金属氧化胁迫下黑曲霉抗性机制的研究已有很多,而对铜作用下黑曲霉GSH/GPx系统抗氧化机制的报道比较少。基于此,本实验探究在不同浓度铜及不同处理时间条件下黑曲霉细胞内膜脂过氧化程度,GSH/GPx系统中抗氧化物质及酶活的变化情况,以期探讨铜对黑曲霉的氧化胁迫作用和黑曲霉的抗铜氧化机制。 1 材料与方法 1.1 实验材料
实验所用黑曲霉(TL-F2)从铜陵某矿区污染土壤中筛选、纯化,由广州工业微生物检测中心鉴定,其对Cu(Ⅱ)的最大耐受浓度为800 mg·L-1。斜面和平板采用马铃薯固体培养基(PDA),自然pH值,28 ℃培养5 d后于4 ℃保藏。
液体培养基:葡萄糖20 g、蛋白胨 10 g、NaCl 0.2 g、CaCl2 0.1 g、KCl 0.1 g、K2HPO4 0.5 g、NaHCO3 0.05 g、MgSO4 0.25 g、FeSO4·7H2O 5 mg,蒸馏水1 L,自然 pH值。
Cu(Ⅱ)溶液采用分析纯Cu(NO3)2·3H2O配制。考马斯亮蓝可溶性蛋白、丙二醛(Malondialdehyde,MDA)、GR、GSH、GSSG和GPx试剂盒均购于南京建成生物工程研究所。
在无菌条件下,取新鲜菌体接入装有200 mL无菌水的500 mL锥形瓶中,于28 ℃、120 r·min-1条件下振荡2 h,用血球计数板计数,确定孢子液浓度,4 ℃冰箱中保存备用。 1.2 实验方法 1.2.1 实验浓度设置与培养条件
将1 mL孢子液接入到装有100 mL液体培养基的锥形瓶中,Cu(Ⅱ)的质量浓度范围分别为50、100、150、200、250、300 mg·L-1,于28 ℃、120 r·min-1条件下分别振荡培养2、4、6、8 d,测定不同重金属浓度及不同培养时间下菌体的生长量、可溶性蛋白、MDA、GSH、GSSG含量及GPx、GR活力。所有实验设3个平行。 1.2.2 粗酶液的提取
准确称取 0.5 g清洗干净的新鲜菌体,按质量(g)∶体积(mL)=1∶9的比例加入9倍体积的0.9%生理盐水4.5 mL,冰浴条件下机械匀浆(10 s·次-1),间隙30 s,连续3~5次,制成10%的组织匀浆。
分别于转速为 2500、5000、3500 r·min-1,温度为 4 ℃的条件下离心10 min,取上清液,制成粗酶液1、2、3,并于-20 ℃冷冻保存,用于测定可溶性蛋白、MDA、GSH、GR、GPx。
准确称取0.2 g清洗干净的新鲜菌体按重量体积比为1∶4加入GSSG试剂盒中的试剂四作为匀浆介质,冰浴匀浆,于转速 3500 r·min-1、温度 4 ℃的条件下离心10 min,制成粗酶液4用于测定GSSG。 1.2.3 菌株生长量测定
实验完成后,将经过滤的菌体用蒸馏水清洗干净放入60 ℃的烘箱中烘至恒重,测定菌株生长量。 1.2.4 可溶性蛋白、丙二醛(MDA)的测定
取粗酶液1分别用考马斯亮兰法蛋白试剂盒、MDA试剂盒处理后,用紫外分光光度计测定可溶性蛋白和MDA浓度。 1.2.5 谷胱甘肽系统内各物质和酶活的测定
GSH、GSSG含量和GPx、GR活力均取对应的粗酶液,用试剂盒处理后测定;GSH、GSSG含量表达分别为mgGSH·g-1prot·min-1和μmol·L-1;GPx和GR活力分别表示为U·mg-1和U·g-1prot。 1.3 数据统计分析
数据结果采用Origin8.5软件作图,实验数据采用Spass19.0进行one-way ANOVA分析。 2 结果与分析 2.1 Cu(Ⅱ)浓度对菌体生长量的影响
如图 1所示,空白组中菌体生长量随培养时间的增加呈上升趋势,实验处理组中随Cu(Ⅱ)浓度的升高,生长量逐渐降低。在Cu(Ⅱ)浓度分别为250、300 mg·L-1,培养时间为8 d时,菌体的生长量较空白组均下降了75%,下降率趋于稳定。由此说明,Cu(Ⅱ)对菌体的生长量产生了明显的抑制作用。
 |
| 图 1 Cu(Ⅱ)对菌体A.niger TL-F2 生长量的影响 Figure 1 Effect of Cu(Ⅱ)on growth of Aspergillus niger TL-F2 |
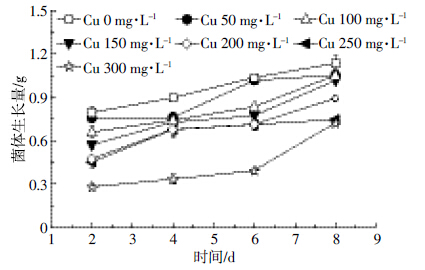
由图 2可知,当Cu(Ⅱ)浓度一定时,随着培养时间增加,A.niger TL-F2可溶性蛋白含量显著增加(P<0.01),但随Cu(Ⅱ)浓度的增加,蛋白含量显著下降(P<0.01)。当培养时间为2 d、Cu(Ⅱ)浓度为300 mg·L-1时,菌体的可溶性蛋白含量较空白组下降了96%。因此,高浓度Cu(Ⅱ)降低了可溶性蛋白含量。
 |
| 图 2 Cu(Ⅱ)对A.niger TL-F2 内可溶性蛋白含量的影响 Figure 2 Effects of different concentrations of Cu(Ⅱ)on soluble protein content in cells of Aspergillus niger TL-F2 |
如图 3所示,随着Cu(Ⅱ)浓度和培养时间的增加,MDA含量显著增加(P<0.01),当培养时间为8 d、Cu(Ⅱ)浓度为300 mg·L-1时,MDA含量最大可达293.88 nmol·mg-1prot。这说明Cu(Ⅱ)浓度越高,对A.niger TL-F2细胞膜的氧化损伤就越大,产生的脂质过氧化产物越多。
 |
| 图 3 Cu(Ⅱ)对A.niger TL-F2内MDA含量的影响 Figure 3 Effects of different concentrations of Cu(Ⅱ)on MDA content in cells of Aspergillus niger TL-F2 |
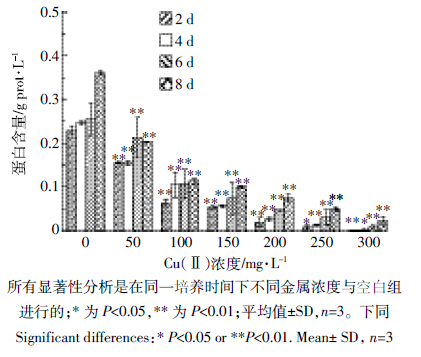
由图 4可知,随着Cu(Ⅱ)浓度和培养时间的增加,A.niger TL-F2内GSH含量显著增加(P<0.01),当培养时间为8 d、Cu(Ⅱ)浓度为300 mg·L-1时,GSH含量最高可达79.89 mgGSH·g-1prot·min-1。由此推断,高浓度的Cu(Ⅱ)可能激发了A.niger TL-F2体内氧化应激反应,从而合成较高浓度的GSH以抵制过量ROS产生的氧化损伤。
 |
| 图 4 Cu(Ⅱ)对A.niger TL-F2 内GSH含量的影响 Figure 4 Effects of different concentrations of Cu(Ⅱ)on glutathione content in cells of Aspergillus niger TL-F2 |
随着Cu(Ⅱ)浓度的增加,A.niger TL-F2菌体内GSSG含量呈先增加后降低的趋势(图 5)。在低浓度Cu(Ⅱ)处理时,GSSG含量随着Cu(Ⅱ)浓度的增加而显著增加(P<0.01)。当Cu(Ⅱ)浓度为150 mg·L-1、培养时间为8 d时,GSSG含量最高可达365.68 μmol·L-1。当Cu(Ⅱ)>150 mg·L-1时,GSSG含量显著下降(P<0.01)。
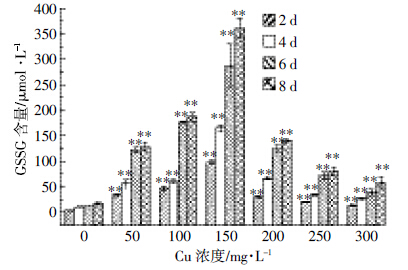 |
| 图 5 不同浓度Cu(Ⅱ)对A.niger TL-F2 内GSSG 含量的影响 Figure 5 Effects of different concentrations of Cu(Ⅱ)on glutathione content in cells of Aspergillus niger TL-F2 |
由表 1可知,随着Cu(Ⅱ)浓度和处理时间的增加,A.niger TL-F2菌体内的GSH/GSSG呈现下降趋势,与对照组相比差异显著或极显著(P<0.05或P<0.01)。
 |
由图 6可知,GPx活力随Cu(Ⅱ)浓度和培养时间的增加呈先升后降的趋势。在培养时间为2 d、Cu(Ⅱ)浓度为100 mg·L-1时,GPx活力升至最高值4 832.64 U·mg-1。当Cu(Ⅱ)>100 mg·L-1时,GPx活力显著下降(P<0.01),在8 d、Cu(Ⅱ)浓度为300 mg·L-1时,GPx活力降至最低值52.99 U·mg-1。
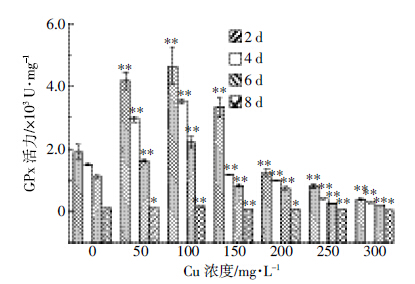 |
| 图 6 Cu(Ⅱ)对A.niger TL-F2内GPx 活力的影响 Figure 6 Effects of different concentrations of Cu(Ⅱ)on activities of GPx in cells of Aspergillus niger TL-F2 |
GR活力随Cu(Ⅱ)浓度的增加和菌体培养时间的延长呈先升后降的趋势(图 7),当菌体培养时间为2 d、Cu(Ⅱ)浓度为100 mg·L-1时,GR活力较对照组增加了89%。当Cu(Ⅱ)>100 mg·L-1时,GR活力显著下降(P<0.01)。
 |
| 图 7 Cu(Ⅱ)对A.niger TL-F2 内GR 活力的影响 Figure 7 Effects of different concentrations of Cu(Ⅱ) |
Guelfi等[21]研究表明,低浓度镉作用下菌体生长量稍有增长,随着镉浓度升高,生长量逐渐下降。这与本实验结果基本一致,不同的是Cu(Ⅱ)作用下黑曲霉的生长量呈持续下降趋势,可能是由于高浓度Cu(Ⅱ)超过了菌体生长所需,直接抑制了黑曲霉生长。
可溶性蛋白含量作为代谢过程的一个重要指标可用来反映细胞内蛋白质合成、变性、降解等多方面的信息[22]。Abhishek等[19]发现在较低浓度砷作用下,黑曲霉体内蛋白含量有一定程度的上升,从而增加菌体的抗性,但是随着金属浓度增加,蛋白合成受到抑制,最终出现下降趋势。本实验中A.niger TL-F2在Cu(Ⅱ)作用下可溶性蛋白含量随着培养时间的延长呈上升趋势,说明黑曲霉对Cu(Ⅱ)胁迫具有一定抗性。随着Cu(Ⅱ)浓度的增加又显著下降,可能是高浓度Cu(Ⅱ)进入A.niger TL-F2细胞后直接与蛋白结合使其变性,同时诱导蛋白质降解,从而抑制了蛋白合成。这与Li等[23]的研究一致,即在ROS引起的氧化应激反应中,可溶性蛋白含量是明显下降的。
MDA是脂质过氧化的重要产物,它在生物体内积累过量时会与脂类、核酸等发生交联,破坏膜的结构并最终导致细胞质膜受损伤。因此,MDA可作为反应脂质过氧化作用强弱的一个重要指标[24, 25, 26, 27]。Abhishek等[19]研究发现,在砷胁迫下黑曲霉细胞内脂质过氧化反应加剧,MDA含量明显增加,与本实验的结果相同,即Cu(Ⅱ)加剧A.niger TL-F2细胞内脂质过氧化反应,产生高浓度的MDA,使其破坏细胞结构。由此说明,在重金属毒害菌体过程中,脂质过氧化充当了重要角色。
GSH具备维持细胞内氧化还原水平的功能,在真菌抗氧化损伤中起着重要作用。研究表明在Cu(Ⅱ)等重金属胁迫下,GSH对机体的保护作用有两种途径:一种是直接与金属离子结合通过逆转重金属离子达到保护机体的目的[28];另一种是与重金属离子诱发产生的羟基自由基等发生氧化还原反应,降低其对细胞膜中含巯基的蛋白质和酶的氧化损失,从而使细胞免受损伤[29, 30, 31]。本实验结果显示,在不同浓度Cu(Ⅱ)作用下,菌体的GSH含量显著增加,对此则认为是高浓度重金属离子对菌体造成了一定的损伤:一方面使得菌体中的本底GSH与金属离子结合以缓解金属离子的毒性[32];另一方面,高浓度Cu(Ⅱ)激发菌体的应激反应,促进GSH的合成。在动态平衡之间,应激性所产生的GSH远大于所消耗的。这与Hegedüs等[33]的研究结果一致,表明重金属毒性一定程度上诱导菌体GSH合成,以此来缓解重金属对细胞的氧化损伤[34]。
本实验发现A.niger TL-F2在Cu(Ⅱ)作用下GSSG含量呈先增后降的趋势,可能在低浓度Cu(Ⅱ)(<150 mg·L-1)造成的轻微氧化逆境下,GPx催化GSH氧化成GSSG,使其含量显著上升以维持细胞正常代谢,与Jozefczak等[35]的研究一致。当Cu(Ⅱ)达到一定浓度时(>150 mg·L-1),GSSG积累达到峰值(含量>365.68 μmol·L-1时),菌体的应激性减弱,系统自动启动还原酶作用于GSSG将其还原为GSH,GSSG含量逐渐减少。这与金春英等[36]结果一致,即生物体内GSH和GSSG通常处于稳恒性动态平衡,当机体内GSSG积累较多时,GSH还原酶将作用底物GSSG还原成GSH。
GSH/GSSG比值已被大量研究用于综合评价生物组织中氧化胁迫水平,它能准确灵敏地反映动物体内抗氧化平衡状态[32, 37]。在正常生理状态下,细胞内GSH/GSSG稳定在一定范围内,在细胞受到过氧化损伤时会导致GSH/GSSG比值降低[38]。本实验结果显示在低浓度Cu(Ⅱ)作用下,诱导GSH的生物合成并通过GR酶快速将其还原为GSSG,随着Cu(Ⅱ)浓度和处理时间的增大,A.niger TL-F2菌体内的GSH/GSSG比值呈现明显下降趋势,与Abhay等[39]的研究一致。
GPx是生物体内重要的活性氧自由基清除剂之一,在反应过程中可促进过氧化物的分解,使连锁反应不能正常进行,以此减少过氧化物对机体造成的干扰和危害[40, 41, 42]。Shatarupa等[43]研究表明随Pb浓度的增加,黑曲霉体内GPx活性明显增加。本实验则显示在不同浓度Cu(Ⅱ)处理下,A.niger TL-F2体内GPx含量先增后降,原因可能是低浓度Cu(Ⅱ)处理时,GPx的合成途径被激活,其活力较对照组显著上升。随Cu(Ⅱ)浓度和处理时间的增加,菌体内的Cu(Ⅱ)不断积累,毒性随之增强,使大量Cu(Ⅱ)与GPx酶活性中心结合,导致GPx活性中心酶受到破坏甚至失活,新的GPx难以合成,使GPx活力显著下降。
生物体内GSH和GSSG通常处于稳恒性动态平衡,当机体内由于GSH的清除自由基作用导致积累较多GSSG时,GR将通过NADPH供氢作用底物GSSG还原成GSH,从而维持这一动态平衡[43, 44, 45, 46, 47]。本实验结果显示GR活力在低浓度Cu(Ⅱ)作用时,呈现增加趋势,与Abhishek等[19]的研究成果相符,但是随Cu(Ⅱ)浓度的增大和处理时间的延长被极显著抑制(P<0.01)而呈现下降趋势,与GPx含量的变化趋势一致。 4 结论
(1)Cu(Ⅱ)对A.niger TL-F2生长量、可溶性蛋白均产生抑制作用,金属浓度越高,抑制作用越大。
(2)高浓度Cu(Ⅱ)加剧A.niger TL-F2体内脂质过氧化反应,金属浓度越高MDA累积越多,菌体的氧化损伤越严重。
(3)Cu(Ⅱ)激发GSH/GPx系统氧化应激反应,促进GSH合成用于还原ROS引起的过氧化物从而降低菌体的氧化损伤。GSH在GPx催化下转化为GSSG从而导致其含量在初期的显著增加;随着菌体适应性增强氧应激反应减弱,GR作用GSSG还原为GSH,则GSSG含量下降;GPx和GR活力也是随Cu(Ⅱ)浓度的增加,先升后降。
(4)GSH/GSSG比值随Cu(Ⅱ)浓度的增大和处理时间的延长逐渐降低,可作为Cu(Ⅱ)单一胁迫下真菌敏感性指标。
| [1] | Chen J P, Wang X. Removing copper, zinc, and lead ion by granular activated carbon in pretreated fixed-bed columns[J]. Separation and Purification Technology, 2000, 19(3):157-167. |
| [2] | Freitas J D, Wintz H, Kim J H, et al. Yeast, a model organism for iron and copper metabolism studies[J]. Biometals, 2003, 16(1):185-197. |
| [3] | Gomes M P, Duarte D M, Carneior M M, et al. Zinc tolerance modulation in Myracrodruon urundeuva plants[J]. Plant Physiology and Biochemistry, 2013, 67:1-6. |
| [4] | Li X, Yang Y, Jia L, et al. Zinc-induced oxidative damage, antioxidant enzyme response and proline metabolism in roots and leaves of wheat plants[J]. Ecotoxicology and Environment Safety, 2013, 89:150-157. |
| [5] | Cristina D C, Pilar D V, Javier R U, et al. Antioxidant defence system during exponential and stationary growth phases of Phycomyces blakesleeanus:Response to oxidative stress by hydrogen peroxide[J]. Fungal Biology, 2013, 117(4):275-287. |
| [6] | Volesky B. Detoxification of metal-bearing effluents:Biosorption for the next century[J]. Hydrometallurgy, 2001, 59(23):203-216. |
| [7] | Belozerskaya T A, Gessler N N. Reactive oxygen species and the strategy of the antioxidant defense in fungi:A Review[J]. Prikladnaia Biohimiia I Mikrobiologiia, 2007, 43(5):565-575. |
| [8] | Gessler N N, Averyanov A A, Belozerskaya T A. Reactive oxygen species in regulation of fungal development[J]. Biochemistry(Moscow), 2007, 72(10):1091-1109. |
| [9] | Bai Z H, Harvey L M, Mcneil B. Oxidative stress in submerged cultures of fungi[J]. Critical Reviews in Biotechnology, 2003, 23(4):267-302. |
| [10] | Angelova M B, Pashova S B, Spasova B, et al. Oxidative stress response of filamentous fungi induced by hydrogen peroxide and paraquat[J]. Mycological Research, 2005, 109(2):150-158. |
| [11] | 方允中, 郑荣梁. 自由基生物学的理论与应用[M]. 北京:科学出版社, 2002:23-47. FANG Yun-zhong, ZHEN Rong-liang. Theory and application of free radical biology[M]. Beijing:Science Public, 2002:23-47. |
| [12] | Anjum N A, Ahamad I, Mohmood I, et al. Modulation of glutathione and its related enzymes in plants responses to toxic metals and metalloids:A review[J]. Environment and Experimental Botany, 2012, 75:307-324. |
| [13] | Wang J L, Chen C. Biosorbents for heavy metals removal and their future[J]. Biotechnology Advances, 2009, 27(2):195-226. |
| [14] | Sutherland J B, Heinze T M, Schnackenberg L K, et al. Biotransformation of quinazoline and phthalazine by Aspergillus niger[J]. Journal of Bioscience and Bioengineering, 2011, 111(3):333-335. |
| [15] | More T T, Yan S, Tyagi R D, et al. Potential use of filamentous fungi for wastewater sludge treatment[J]. Bioresource Technology, 2010, 101(20):7691-7700. |
| [16] | Amini M, Younesi H. Biosorption of Cd(II), Ni(II) and Pb(II) from aqueous solution by dried biomass of Aspergillus niger:Application of response surface methodology to the optimization of process parameters[J]. Clean-Soil, Air, Water, 2009, 37(10):776-786. |
| [17] | Fiedurek J. Production of Aspergillus niger catalase under various stress conditions[J]. Acta Microbial Pollute, 2000, 49(1):43-49. |
| [18] | Scandalios J G. The rise of ROS trends biochemistry[J]. Science, 2002, 27(9):483-486. |
| [19] | Abhishek M, Durba D, Sushil K M, et al. Tolerance of arsenate-induced stress in Aspergillus niger, a possible candidate for bioremediation[J]. Ecotoxicology and Environmental Safety, 2010, 73(2):172-182. |
| [20] | Canovas D, Vooijs R, Schat H, et al. The role of thiol species in the hyper tolerance of Aspergillus niger sp. P37 to arsenic[J]. Biology, Chemistry, 2004, 279:51234-51240. |
| [21] | Guelfi A, Azevedo R A, Lea P J, et al. Growth in hibition of the filamentous fungus Aspergillus nidulans by cadmium:An antioxidant enzyme approach[J]. Journal of General and Applied Microbiology, 2003, 49, 63-73. |
| [22] | Banergee B D, Seth V, Bahattacharya A, et al. Biochemical effects of some pesticides on lipid peroxidation and free-radical scavengers[J]. Toxicology Letters, 1999, 107(1-3):33-47. |
| [23] | Li Q, Brian M N, Linda M H. Adaptive response to oxidative stress in the filamentous fungus Aspergillus niger B1-D[J]. Free Radical Biology & Medicine, 2008, 44(3):394-402. |
| [24] | Sandalio L M, Dalurzo H C, Gomez M, et al.Cadmium-induced changes in the growth and oxidative metabolism of pea plants[J]. Journal of Experimental Botany, 2001, 52(364):2115-2126. |
| [25] | 江行玉, 赵可夫. 植物重金属伤害及其抗性机理[J]. 应用与环境生物学报, 2001, 7(1):92-99. JIANG Xing-yu, ZHAO Ke-fu. Mechanism of heavy metal injury and risistance of plants[J]. Chinese Journal Applied Environment Biology, 2001, 7(1):92-99. |
| [26] | Halliwell B, Gutteridg J M C.Free radicals in biology and medicine[D]. 2nded. Clarendon, Oxford, UK, 1989. |
| [27] | 王正秋, 江行玉, 王长海. 铅、镉和锌污染对芦苇幼苗氧化胁迫和抗氧化能力的影响[J]. 过程工程学报, 2002, 2(6):558-563. WANG Zheng-qiu, JIANG Xing-yu, WANG Chang-hai. Effects of Cd and Zn on oxidative stress and antioxidant capacity of Phragmites australis[J]. The Chinese Journal of Process Engineering, 2002, 2(6):558-563. |
| [28] | Limai A, Corticeior S C, Figuia E. Glutathione-mediated cadmium sequestration in Rhizobium leguminosarum[J]. Enzyme and Microbial Technology, 2006, 39(4):763-769. |
| [29] | 刘 萍, 林乐文, 郑嘉烈, 等. 用高效液相色谱法测定组织中谷胱甘肽[J]. 中国公共卫生, 1995, 10:473-474. LIU Ping, LIN Le-wen, ZHENG Jia-lie, et al. HPLC determination of glutathione in hair tissue[J]. Chinese Journal of Public Health, 1995, 10:473-474. |
| [30] | 卢永科, 川岛明, 堀井郁夫, 等. 顺铂对大鼠肝细胞毒性及谷胱甘肽的保护作用[J]. 中国公共卫生, 2004, 20(2):440-441. LU Yong-ke, KAWASHIMA Akira, HORII Ikuo, et al. Protective effects of glutathione on cisplatin-induced toxicity to rat hepatocytes[J]. Chinese Journal of Public Health, 2004, 20(2):440-441. |
| [31] | Pocsi L, Prade R A, Penninckx J. Glutathione altruistic metabolite in fungi[J]. Advances in Microbial Physiology, 2004, 49:1-76. |
| [32] | Schafer F Q, Buettner G R. Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple[J]. Free Radical Biology and Medicine, 2001, 30(11):1191-1212. |
| [33] | Hegedüs N, Emri T, Szilágyi J, et al. Effect of heavy metals on the glutathione status in different ectomycorrhizal Paxillus involutus strains[J]. World Journal of Microbiology & Biotechnology, 2007, 23(9):1339-1343 |
| [34] | Luna C M, Gonzalez C A, Tripp V S. Oxidative damage caused by on excels of copper in oat leaves[J]. Plant and Cell Physiology, 1994, 35(1):11-15. |
| [35] | Jozefczak M, Remans T, Vangronsveld J, et al. Glutathione is a key player in metal-induced oxidative stress defenses[J]. International Journal of Molecular Sciences, 2012, 13(3):3145-3175. |
| [36] | 金春英, 崔京兰, 崔胜云. 氧化型谷胱甘肽对还原型谷胱甘肽清除自由基的协同作用[J]. 分析化学研究简报, 2009, 37(9):1349-1353. JIN Chun-ying, CUI Jing-lan, CUI Sheng-yun. The cooperation of oxidized glutathione to reduced glutathione free radical scavenging synergetic[J]. Chinese Journal of Analytical, 2009, 37(9):1349-1353. |
| [37] | Droge W. Free radicals in the physiological control of cell function[J]. Physiological Reviews, 2002, 82(1):47-95. |
| [38] | Jones D P. Redox potential of GSH/GSSG couple:Assay and biological significance[J]. Methods in Enzymology, 2002, 348(11):93-112. |
| [39] | Kumar A, Prasad M N, Sytar O. Lead toxicity, defense strategies and associated indicative biomarkers in Talinum triangulare grown hydroponically[J]. Chemosphere, 2012, 89(9):1056-1065. |
| [40] | 宋增延, 姜 宁, 张爱忠, 等. 谷胱甘肽生物学功能的研究进展[J]. 饲料研究, 2008, 9:25-27. SONG Zeng-yan, JIANG Ning, ZHANG Ai-zhong, et al. Advances in the biological function of glutathione[J]. Email Alert, 2008, 9:25-27. |
| [41] | 高 层. 重金属Pb2+和Cu2+对太平洋牡蛎(Crassastrea gigas)毒性效应的比较研究[D]. 青岛:中国海洋大学, 2012. GAO Ceng. Toxic effects of heavy metal Pb2+ and Cu2+ to the Crassostrea gigas[D]. Qingdao:Ocean University of China, 2012. |
| [42] | Arthur J R. The glutathione peroxidases[J]. Cellular and Molecular Life Sciences, 2000, 57(13/14):1825-1835. |
| [43] | Shatarupa C B, Abhishek M J, Tapan K D. Biochemical characterization of a lead-tolerant strain of Aspergillus foetidus:An implication of bioremediation of lead from liquid media[J]. International Biodeterioration & Biodegradation, 2013, 84:134-142. |
| [44] | Foyer C H, Noctor G. Ascorbate and glutathione:The heart of the redox hub[J]. Plant Physiology, 2011, 155(1):2-18. |
| [45] | Seth C S, RemansT, Keunen E, et al. Phytoextraction of toxic metals:A central role for glutathione[J]. Plant, Cell and Environment, 2012, 35(2):334-346. |
| [46] | Fu R Y, Chen J, Li Y. The Function of glutathione glutathione peroxidase system in the oxidative stress resistance systems of microbial cells[J]. Chinese Journal of Biotechnology, 2007, 23(5):770-775. |
| [47] | Iannelli M A, Pietrini F, Fiore L, et al. Antioxidant response to cadmium in Phragmites australis plants[J]. Plant Physiology and Biochemistry, 2002, 40(11):977-982. |
 2015, Vol. 34
2015, Vol. 34