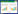文章信息
- 樊广萍, 仓龙, 刘德宏, 周东美
- FAN Guang-ping, CANG Long, LIU De-hong, ZHOU Dong-mei
- 电动强化过硫酸钠修复多氯联苯污染土壤的研究
- Electrokinetically Enhanced Persulfate Remediation of PCBs Polluted Soil
- 农业环境科学学报, 2015, 34(5): 859-865
- Journal of Agro-Environment Science, 2015, 34(5): 859-865
- http://dx.doi.org/10.11654/jaes.2015.05.007
-
文章历史
- 收稿日期:2015-02-06
2. 中国科学院土壤环境与污染修复重点实验室, 中国科学院南京土壤研究所, 南京 210008;
3. 保利协鑫控股有限公司(电力), 江苏 苏州 215028
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;
3. GCL-Poly Energy Holdings Limited(Power), Suzhou 215028, China
过硫酸钠(Na2S2O8)作为一种常用的氧化剂,具有较高的氧化还原电位(E0=2.0 V),还能被热、过渡金属、碱或者过氧化氢活化产生氧化性更强的硫酸根自由基(SO·4)(E0=2.6 V),包括PCBs在内的多种有机污染物都能被Na2S2O8氧化分解[ 2, 3 ]。ISCO技术实施的关键是保证氧化剂在土壤中有效迁移和与目标污染物充分接触,但对于一些低渗透性土壤,氧化剂在土壤中难以迁移,使这项技术的实施受到了限制。
电动修复技术是专门针对低渗透性土壤而提出的一项绿色的原位土壤修复技术。该技术通过在土壤两端施加电场,污染物可以通过电迁移、电渗流和电泳的方式迁移出土壤[ 4, 5 ]。但电动修复仅能使能离解的有机污染物迁移出土体,对于强疏水性的非极性有机污染物(如PCBs),单独的电动过程无法对其进行迁移降解处理。
电动修复技术与ISCO技术相结合,电场可以促进氧化剂在土壤中的迁移,使其与目标污染物充分接触。过硫酸根(S2O82-)作为阴离子,在电场中既可以通过电迁移从阴极向阳极移动,也可以通过电渗流从阳极向阴极移动。国外已经有少量电动与Na2S2O8联用修复人为添加污染土壤(如TCE、PCB44)的实验室研究[ 6, 7, 8, 9 ],但对PCBs实际污染土壤的修复研究鲜见报道。本课题组前期开展了电动与Na2S2O8联用修复铜-芘复合污染土壤的研究,取得了较好的效果[ 9 ]。
基于以上考虑,本文以PCBs实际污染土壤为研究对象,将电动技术与Na2S2O8氧化技术相结合,考察了两端投加、反转电场和碱活化Na2S2O8对土壤中PCBs降解的影响,系统研究了电动强化Na2S2O8修复PCBs实际污染土壤的修复效率和机制。
1 材料与方法 1.1 供试材料
PCBs混标(PCB-8,18,28,44,52,66,77,101,105,118,126,128,138,153,170,180,187,195,206,209)纯度均>99.4%,购于AccuStandard公司(美国)。Na2S2O8购自成都科龙化学试剂有限公司,纯度为99%。色谱纯的正己烷购自CNW公司(德国)。分析纯的正己烷和丙酮购自南京化学试剂有限公司。试验所用水均为超纯水(18 MΩ·cm-1),用Milli-Q系统(美国)制备。
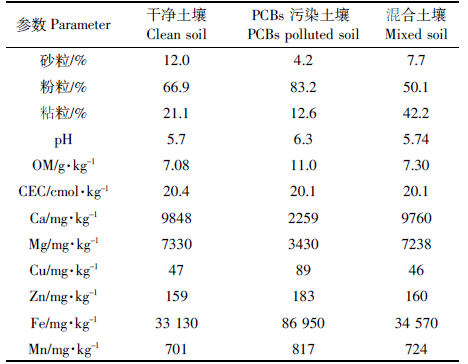
PCBs污染土壤采自浙江台州某电容器存放场,由于其污染物浓度过高,污染土量少,试验开始前用干净的黄棕壤(采自江苏南京紫金山脚下菜地旁边)对其进行稀释。这两种土壤的性质和混合土壤的性质如表 1所示。采集土壤风干后磨碎,过20目筛。大约300 g污染土壤与2700 g干净土壤充分搅拌混合后,放置通风橱一周,并不时搅拌以使其达到平衡。在试验开始前测定混合土壤的初始PCBs浓度(表 2)。
通过配制不同浓度的Na2S2O8研究其对土壤中PCBs的去除效率,获得最优的Na2S2O8浓度。Na2S2O8的浓度梯度为0%、5%、10%、20%、30%和40%,称取1 g污染土壤于40 mL玻璃瓶中,加入10 mL的氧化剂溶液(土水比为1∶10),25 ℃下振荡反应24 h(120 r·min-1),以4000 r·min-1离心10 min进行固液分离。上清液中的PCBs用正己烷(1∶1)提取,GC测定。土壤中的PCBs用丙酮∶正己烷(1∶1)超声提取三次,每次30 min,离心分离后合并提取液,用GC测定。通过加标回收的方法,计算出此种土壤提取方法的添加回收率可达78.6%~99.7%。为保证试验结果的重现性,每个样品做3个重复。
1.3 电动试验
电动修复装置同前期研究工作[10-11],包括直流电源、四通道的蠕动泵、圆柱形土柱(L=12 cm,d=6.6 cm)、阳极池、阴极池、钛网电极以及pH自动控制系统(图 1)。共设计四个处理,如表 3所示。试验中分别从阳极和阴极同时投加Na2S2O8,另外增加了反转电场的处理。反转电场可以使迁移进入土柱两端的离子重新向相反的方向移动,促进其与污染物的接触。碱活化Na2S2O8主要是指Na2S2O8在强碱性条件下(pH11~12)也有较高的活性,本研究用自制的pH自动控制系统通过添加0.1 mol·L-1的NaOH来控制阴阳极的pH为12.0。Na2S2O8的浓度根据浓度优化试验选取。电动试验开始之前先用0.01 mol·L-1 NaNO3溶液饱和土壤24 h,电压梯度设置为1 V·cm-1。在电动强化过程中测定电流、电渗流大小。试验周期为8 d,试验结束后,将土柱从阳极到阴极均匀切成5部分,分别标记为S1、S2、S3、S4和S5,测定土壤每部分的pH、电导率(EC)和PCBs浓度。
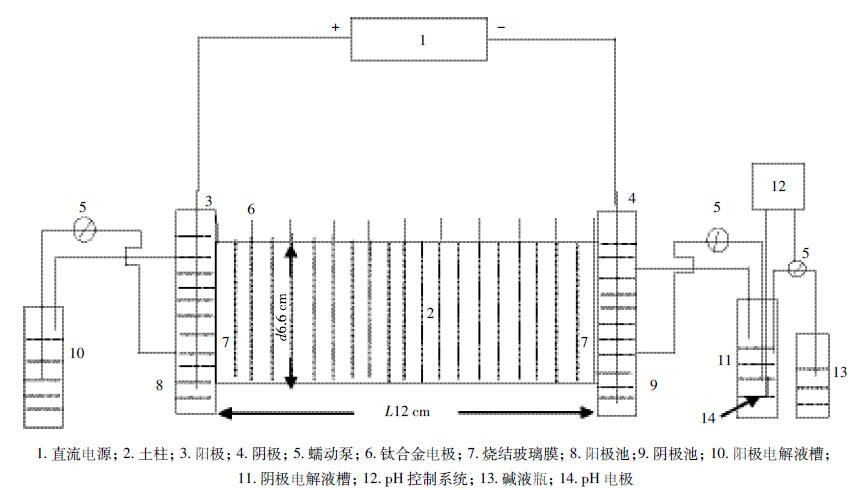 |
| 图 1 电动试验装置图 Figure 1 A schematic diagram of electrokinetic apparatus |
土壤基本理化性质的测定参考常规方法[12]。土壤pH和EC分别用pH计(上海雷磁,型号pHS-3B)和EC计(上海雷磁,型号DDS-11A)测定,土水比为1∶2.5。阳离子交换量用乙酸铵提取法;土壤有机碳(TOC)含量用K2CrO7外加热法测定,有机质(OM)含量由TOC乘以系数1.724计算得出;土壤粒径分布用美国库特尔公司生产的LS13320激光粒度仪测定;土壤重金属含量经HF-HClO4-HNO3消解后用ICP测定(Optima 8000,美国PerkinElme公司)。电动过程中电流的变化采用万用表进行测定,电渗流量由阴极电解液增加的体积计算得出。土壤样品风干后,磨碎过20目筛,超声提取后使用GC/μECD(Agilent 7890,美国)检测PCBs的浓度。测定条件:HP-5色谱柱(30.0 m × 0.25 mm × 0.25 μm),载气(高纯N2)流速为1 mL·min-1,尾吹气(高纯N2)流速为30 mL·min-1。进样口温度250 ℃,检测器温度300 ℃。柱升温程序:初始150 ℃,保持2 min,以5 ℃·min-1升至280 ℃,保持2 min。土壤中PCBs的去除率按照下列公式进行计算:去除率(%)=(1-五个截面PCBs浓度的平均值/土壤中PCBs初始值)×100。PCBs各组分的去除率也按照同样的方法进行计算。 2 结果和讨论 2.1 Na2S2O8浓度的优化
考察了不同浓度的Na2S2O8对土壤中PCBs降解的影响,结果如图 2所示。试验结果表明:土壤中PCBs的降解效率随着Na2S2O8浓度在一定范围内增加而增加,当Na2S2O8浓度为10%时,土壤中PCBs的降解率达到74.4%;当Na2S2O8浓度为20%时,土壤中PCBs的降解率最高,85.0%的PCBs被降解;而当Na2S2O8浓度上升到30%和40%时,PCBs的降解率反而有所降低。这是因为高浓度的Na2S2O8容易造成自由基的自我消耗[13]。电动试验中,考虑氧化剂分别从阴阳两极加入,出于实际应用的经济性,选用浓度为10%的Na2S2O8作为电动试验的氧化剂浓度。
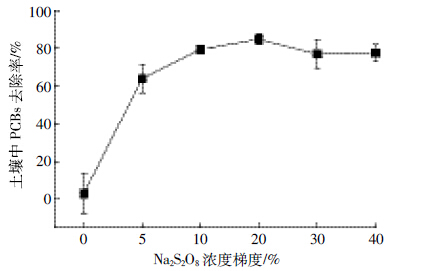 |
| 图 2 不同浓度梯度的Na2S2O8对土壤中PCBs降解的影响 Figure 2 Effect of Na2S2O8 dosage on PCBs degradation |
图 3显示的是电动过程中电流和电渗流量的变化。从图 3(a)可以看出,对照处理(Exp-01)中的电流较低,在7 mA以下,说明土壤溶液中的离子浓度较低。加入Na2S2O8的处理中电流均要高于对照处理。这与Na2S2O8较高的离子强度有关,同时Na2S2O8分解产生的H+进入土壤能降低土壤的pH,促进土壤中矿物的溶解[14-16]。从两端投加Na2S2O8时(Exp-02),电流在94 h时达到峰值74.6 mA,然后逐渐下降至25 mA左右。反转电场的处理(Exp-03)电流在70 h时达到峰值(79.3 mA)然后逐渐降低,第4 d调整电场正负极,电流迅速升高并再次达到峰值(118 mA)。碱活化的处理(Exp-04)电流强度最大,呈逐渐上升趋势,电流在174 h达到峰值230 mA,随后急剧下降。不断加入的NaOH导致该处理中土壤溶液始终保持较高的离子强度。
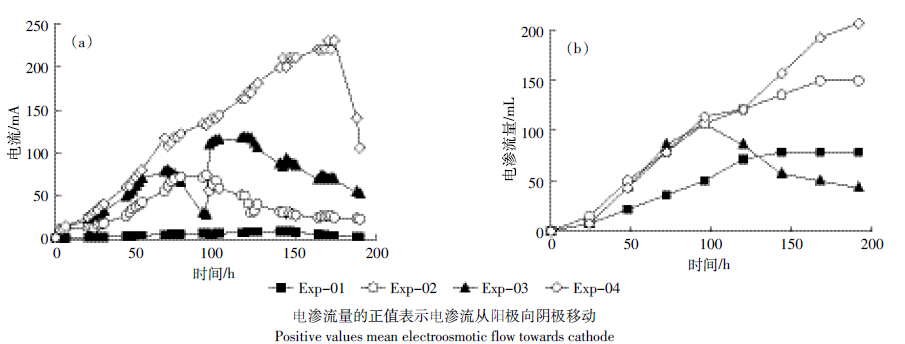 |
| 图 3 电动过程中电流(a)和电渗流量(b)的变化 Figure 3 Variation of electric current(a)and electroosmotic flow(b)in various treatments at different time |
图 3(b)显示的是电动过程中电渗流量的变化。对照处理(Exp-01)较低的电流导致其电渗流量也较低,仅有78.3 mL。Exp-02中的电渗流量高于对照处理,达到149 mL,加入Na2S2O8以后其较高的离子强度有利于电渗流的产生[8]。电渗流量的变化趋势表现为在试验初期电渗流速率较大,随着试验的进行,电渗流的速率逐渐减弱。这是由于阳极电解水产生的H+以及S2O2-8分解产生的H+和酸性副产物(如HSO-4)迁移进入土壤中,降低了土壤的pH,进而降低了土壤表面的zeta电位[17-18],zeta电位的降低会抑制电渗流的发生。反转电场的处理(Exp-03)使电渗流在第4 d发生了反向,有向阳极流动的趋势。各处理中,碱活化Na2S2O8处理(Exp-04)的电渗流量最大,达到206 mL,并呈逐渐上升的趋势。这跟其较高的pH有关,较高的pH有利于电渗流的发生[19]。 2.3 土壤pH和EC
图 4(a)是电动处理之后土壤各截面的pH分布。土壤的初始pH为5.7,对照处理(Exp-01)土壤pH在电解水的作用下呈现从阳极向阴极逐渐升高的趋势,范围在5.1~9.5之间。由于Na2S2O8分解会降低土壤的pH,当从阳极和阴极分别投加Na2S2O8时(Exp-02),随着Na2S2O8迁移进入土壤,土壤的pH也随之降低,土壤S1-S3部分pH从2.0升高到3.8。由于阴极电解水产生的OH-离子从阴极向阳极迁移进入土壤,试验结束时靠近阴极的S4和S5部分的pH在4.8左右。通常反转电场能改变土壤的pH分布,通过减弱土壤中的基本流动促进电动过程继续进行。试验结束时,Exp-03中pH的分布与Exp-02完全相反,呈现从阳极到阴极逐渐降低的趋势。Exp-04中由于控制阴阳极pH12.0,试验结束时,除了靠近阳极的S1部分pH较低外,土壤其余各截面pH都保持在12.0左右。
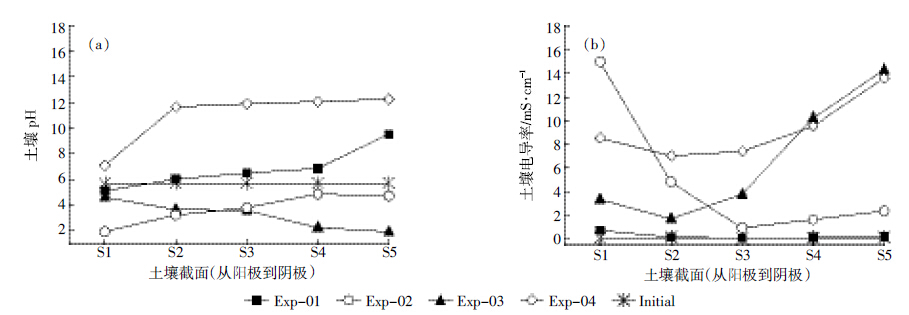 |
| 图 4 电动处理后土壤各截面pH(a)和EC(b)的分布 Figure 4 Distribution of pH(a)and electrical conductivity(b)in soils after electrokinetic treatments |
图 4(b)显示电动处理后土壤各截面EC的分布。土壤起始电导率为0.08 mS·cm-1,对照处理(Exp-01)的EC跟起始值相近,Na2S2O8的加入明显提高了土壤的EC。土壤EC的变化与pH变化一致,呈现pH越低EC越高的趋势。碱活化处理(Exp-04)由于大量NaOH的加入使土壤各截面EC的分布较均匀。 2.4 土壤中残留的PCBs
图 5显示电动试验结束后土壤各截面残留PCBs的分布。土壤PCBs的初始值为116 mg·kg-1,对照处理(Exp-01)PCBs的去除率比较低,只有9.7%的PCBs从土壤中去除。氧化剂的加入促进了土壤中PCBs的降解,当从两端都投加Na2S2O8时(Exp-02),土壤中PCBs的去除率达到19.6%。PCBs的分布从阳极向阴极(S1-S4)逐渐升高,靠近阳极部分的降解率高于靠近阴极部分,说明通过电渗流从阳极迁移进入土壤的S2O82-量要高于通过电迁移从阴极迁移进入土壤的S2O82-量。从降解率来看,作为Na2S2O8的运输载体,电渗流的作用要高于电迁移[20]。靠近阴极的S4部分的降解率低于其他部分,主要是因为S2O82-阴离子通过电迁移向阳极迁移的过程中,与流向阴极的电渗流方向相反,其流向阳极的电迁移会受到抑制[21]。另外,电动过程中,阴极产生的还原性氢气和富余电子也会消耗阴极的氧化剂,从而降低向土壤中迁移的氧化剂的量[7,22-24]。反转电场的处理中(Exp-03),土壤中PCBs的去除率与Exp-02相当,为19.2%。PCBs的降解主要集中在靠近阳极和阴极的部分并呈对称分布,土壤中部的PCBs降解不明显。其主要原因可能是第4 d反转电场使电渗流发生反向,抑制了原本随电渗流流向阴极的Na2S2O8的移动;而反转电场使原来阴极的去极化作用转移到了原来的阳极,消耗了阳极的氧化剂[20]。碱活化Na2S2O8的处理中(Exp-04),PCBs的去除率最高,达28.7%。土壤各部分较高的PCBs去除率与其较高的电渗流量有关(图 3b),因为较高的电渗流量促进了S2O82-及其活化产物向土壤中的迁移。另外,在碱活化Na2S2O8的过程中,SO·-4向OH·转化,OH·自由基占主导地位,其氧化能力比SO·-4更强[3, 25]。同时,在pH高于12的情况下,碱解作用也是导致土壤中PCBs降解的主要原因之一,因为在强碱性条件下,一些有机物能与OH-发生反应,造成有机物的分解或者部分降解[15, 26]。
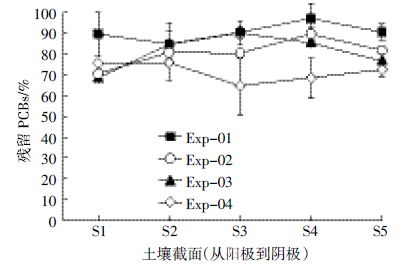 |
| 图 5 电动处理后土壤中残留的PCBs Figure 5 Residual PCBs in soils after electrokinetic treatments |
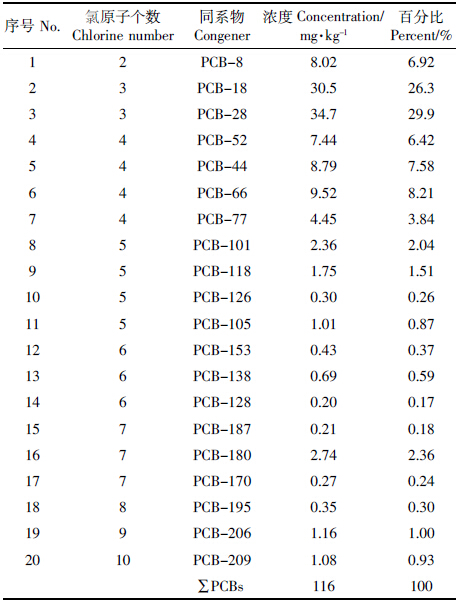
表 4为电动试验结束后各处理土壤PCBs各组分的去除率。因为土壤中PCBs大部分是以三氯的PCB-18和PCB-28存在(占PCBs总量的56.2%,表 2),所以各处理中PCB-18和PCB-28的降解率与PCBs总的去除率基本一致。从总去除率比较高的Exp-04中可以看出,总体上PCBs各同系物的去除率呈现随氯原子数的增多而下降的趋势,说明低氯的PCBs比高氯的PCBs更容易被降解。
从土壤中PCBs总的去除率来看,碱活化Na2S2O8(Exp-04)对土壤中PCBs的降解具有明显的促进作用,其去除率较对照处理(Exp-01)提高了2倍,但是总的去除率仍不高。这可能跟土壤的异质性和氧化剂的损失有关。Yukselen-Aksoy等比较了EK+Na2S2O8在热活化和碱活化条件下对高岭土和冰渍土中PCB44的降解。他们从阳极连续加入30%的Na2S2O8,经过7 d的处理,发现高岭土中PCB44的降解远高于冰渍土,降解率分别为77.9%和14.4%;他们认为冰渍土中较低的降解率跟冰渍土较高的缓冲能力、矿物含量的异质性和较高的有机质含量有关[8]。本试验中供试土壤为PCBs实际污染土壤,比添加PCBs土壤更难被降解。另外,由于Na2S2O8在迁移的过程中会逐渐分解,电动过程本身也会消耗部分氧化剂,使其在迁移进入土壤之前已被消耗分解[27]。在以后的研究中可以通过测定土壤中Na2S2O8的浓度进一步明确其在电场中的迁移行为,并通过选择合适的活化剂增强其在土壤中的活性,为电动和Na2S2O8氧化联用技术的实际应用提供基础数据和技术支持。 3 结论
(1)Na2S2O8的加入增强了电流和电渗流的强度,迁移进入土壤的Na2S2O8降低了土壤的pH。
(2)电场促进了Na2S2O8向土壤中的迁移及其对土壤中PCBs的降解,从降解率来看电渗流的作用要高于电迁移。
(3)由于去极化作用,反转电场没有促进土壤中PCBs的降解。
(4)电动过程中,碱活化Na2S2O8明显促进了土壤中PCBs的降解,28.7%的PCBs被去除。土壤的异质性和氧化剂的损失可能是导致PCBs降解效率较低的原因。
| [1] | Travis C C, Hester S T. Global chemical pollution[J]. Environmental Science & Technology, 1991, 25(5):814-819. |
| [2] | Liang C J, Bruell C J, Marley M C, et al. Persulfate oxidation for in situ remediation of TCE:I. Activated by ferrous ion with and without a persulfate-thiosulfate redox couple[J]. Chemosphere, 2004, 55(9):1213-1223. |
| [3] | Fang G D, Dionysiou D D, Zhou D M, et al. Transformation of polychlorinated biphenyls by persulfate at ambient temperature[J]. Chemosphere, 2013, 90(5):1573-1580. |
| [4] | Probstein R F, Hicks R E. Removal of contaminants from soils by electric fields[J]. Science, 1993, 260(5107):498-503. |
| [5] | Acar Y B, Alshawabkeh A N. Principles of electrokinetic remediation[J]. Environmental Science & Technology, 1993, 27(13):2638-2647. |
| [6] | Isosaari P, Piskonen R, Ojala P, et al. Integration of electrokinetics and chemical oxidation for the remediation of creosote-contaminated clay[J]. Journal of Hazardous Materials, 2007, 144(1):538-548. |
| [7] | Yang G C, Yeh C-F. Enhanced nano-Fe3O4/S2O82- oxidation of trichloro-ethylene in a clayey soil by electrokinetics[J]. Separation and Purification Technology, 2011, 79(2):264-271. |
| [8] | Yukselen-Aksoy Y, Reddy K R. Effect of soil composition on electrokinetically enhanced persulfate oxidation of polychlorobiphenyls[J]. Electrochimica Acta, 2012, 86:164-169. |
| [9] | Cang L, Fan G P, Zhou D M, et al. Enhanced-electrokinetic remediation of copper-pyrene co-contaminated soil with different oxidants and pH control[J]. Chemosphere, 2013, 90(8):2326-2331. |
| [10] | Zhou D M, Deng C F, Cang L. Electrokinetic remediation of a Cu contaminated red soil by conditioning catholyte pH with different enhancing chemical reagents[J]. Chemosphere, 2004, 56(3):265-273. |
| [11] | Zhou D M, Deng C F, Cang L, et al. Electrokinetic remediation of a Cu-Zn contaminated red soil by controlling the voltage and conditioning catholyte pH[J]. Chemosphere, 2005, 61(4):519-527. |
| [12] | 鲁如坤. 土壤农化分析[M]. 北京:中国农业科技出版社, 2000. LU Ru-kun. Analysis methods of soil agricultural chemistry[M]. Beijing:China Agricultural Science Press, 2000. |
| [13] | Ferrarese E, Andreottola G, Oprea I A. Remediation of PAH-contaminated sediments by chemical oxidation[J]. Journal of Hazardous Materials, 2008, 152(1):128-139. |
| [14] | Sperry K, Marley M, Bruell C, et al. Iron catalyzed persulfate oxidation of chlorinated solvents[C]//Proceedings of the Third International Conference on Remediation of Chlorinated and Recalcitrant Compounds, F. 2003. |
| [15] | Waisner S, Medina V F, Morrow A B, et al. Evaluation of chemical treatments for a mixed contaminant soil[J]. Journal of Environmental Engineering, 2008, 134(9):743-749. |
| [16] | Block P A, Brown R A, Robinson D. Novel activation technologies for sodium persulfate in situ chemical oxidation//Proceedings of the Proceedings of the Fourth International Conference on the remediation of chlorinated and recalcitrant compounds, F, 2004[C]. |
| [17] | 赵进英. 零价铁/过硫酸钠体系产生硫酸根自由基氧化降解氯酚的研究[D]. 大连理工大学, 2010. ZHAO Jin-ying. Sulfate radical-based oxidation of chlorophenols using zero-valent iron/sodium peroxydisulfate system[D]. Dalian University of Technology, 2010. |
| [18] | Liang C J, Lai M C. Trichloroethylene degradation by zero valent iron activated persulfate oxidation[J]. Environmental Engineering Science, 2008, 25(7):1071-1078. |
| [19] | Saichek R E, Reddy K R. Electrokinetically enhanced remediation of hydrophobic organic compounds in soils:A review[J]. Critical Reviews in Environmental Science and Technology, 2005, 35(2):115-192. |
| [20] | Fan G P, Cang L, Fang G D, et al. Electrokinetic delivery of persulfate to remediate PCBs polluted soils:Effect of injection spot[J]. Chemosphere, 2014, 117:410-418. |
| [21] | Roach N, Reddy K R. Electrokinetic delivery of permanganate into low-permeability soils[J]. International Journal of Environment and Waste Management, 2006, 1(1):4-19. |
| [22] | Rabaey K, Verstraete W. Microbial fuel cells:Novel biotechnology for energy generation[J]. Trends in Biotechnology, 2005, 23(6):291-298. |
| [23] | You S J, Zhao Q L, Zhang J Q, et al. A microbial fuel cell using permanganate as the cathodic electron acceptor[J]. Journal of Power Sources, 2006, 162(2):1409-1415. |
| [24] | Li J, Fu Q, Liao Q, et al. Persulfate:A self-activated cathodic electron acceptor for microbial fuel cells[J]. Journal of Power Sources, 2009, 194(1):269-274. |
| [25] | Liang C J, Lee P-H. Granular activated carbon/pyrite composites for environmental application:Synthesis and characterization[J]. Journal of Hazardous Materials, 2012, 231:120-126. |
| [26] | Jeffers P M, Ward L M, Woytowitch L M, et al. Homogeneous hydrolysis rate constants for selected chlorinated methanes, ethanes, ethenes, and propanes[J]. Environmental Science & Technology, 1989, 23(8):965-969. |
| [27] | Petri B G, Watts R J, Tsitonaki A, et al. Fundamentals of ISCO using persulfate[M]. In Situ Chemical Oxidation for Groundwater Remediation, Springer, 2011:147-191. |
 2015, Vol. 34
2015, Vol. 34