文章信息
- 陈艳芳, 李取生, 何宝燕, 梅秀芹, 雷永康, 徐智敏, 周丽珍
- CHEN Yan-fang, LI Qu-sheng, HE Bao-yan, MEI Xiu-qin, LEI Yong-kang, XU Zhi-min, ZHOU Li-zhen
- 高/低Cd累积苋菜品种金属累积特性与关键转运基因表达的关系
- Metal Accumulation and Expressions of Root Two Key Transporter Genes, HMA4 and IRT1, of High/Low Cd-Accumulating Amaranth Cultivars
- 农业环境科学学报, 2015, 34(6): 1041-1046
- Journal of Agro-Environment Science, 2015, 34(6): 1041-1046
- http://dx.doi.org/10.11654/jaes.2015.06.004
-
文章历史
- 收稿日期:2014-12-06
2. 水土环境毒害性污染物防治与生物修复广东省高校重点实验室, 广州 510632
2. Key Laboratory of Water/Soil Toxic Pollutants Control and Bioremediation, Department of Education of Guangdong Province, Guangzhou 510632, China
人口总量不断扩增,采矿、制造业等工业的迅猛发展,化肥、农药等的大量使用,持续的污水灌溉,导致土壤重金属污染问题日益突出。目前我国受Cd、Pb、Cr等重金属污染的耕地面积约2.0×106 hm2,占耕地面积近20%,致使农产品年产量下降1000万t [1].土壤中的重金属通过“土壤-植物-人体”或是通过“土壤-水体-人体”间接地被人类吸收[2].Cd具有极强的生物毒性,因其与许多金属离子具有相似性,在生物生命活动中可能会替代许多酶的活性中心或与蛋白质的巯基结合,扰乱细胞的生理生化过程,进而影响正常的生理代谢[3].因此,寻找具有重金属高累积特性的植物品种及筛选适合食用的蔬菜品种,对解决土壤污染问题及食品安全问题有重要意义。
研究表明,植物对金属的吸收并没有严格的选择性。植物对某些必需金属吸收的同时,其他非必需金属也随之被吸收,如Cd、Pb[4].植物对金属的吸收与许多转运蛋白有关,如HMA、ZIP、ABC等。P1b-ATPase属于金属阳离子输出蛋白,它通过水解ATP获得能量跨膜运送阳离子,因其除了能转运Zn、Cu等植物必需金属,同时也能转运Cd、Pb等重金属,故P1b-ATPase又被称为重金属转运ATP酶(Heavy Metal Transporting ATPase),即HMA[5, 6, 7, 8].拟南芥中存在8个HMA,其中HMA1-4是阳离子转运载体,它与Cu、Cd、Pb等阳离子的转运有关;HMA4在多种植物的根系都有表达,且在重金属的吸收、转运及分布方面起到关键作用。研究发现,AtHMA4主要在根茎叶的维管束组织中表达[9, 10, 11],并参与Zn和Cd在拟南芥中的长距离运输[12, 13].ZIP蛋白家族与必需金属吸收过程有关[14],在拟南芥、番茄、大豆、大麦和水稻等植物中都有发现。IRT1是该家族中主要的Fe载体,HvIRT1定位于细胞膜,并且能够运输Cd、Zn和Fe.此外,HvIRT1在大麦的根部表达起着吸收和转运Mn的作用[15].拟南芥生长在Fe缺乏的环境中时,作为胁迫响应机制之一,IRT1能大量表达在表皮细胞[16].将AhIRT1异位表达于西红柿,在Fe缺乏及Fe过量的情况下,Fe的吸收量都明显大大增加[17].在禾本科植物中OsIRT1也是根系吸收金属关键的转运体,直接参与根系对Fe的吸收[18].
目前植物吸收金属的机理尚不清楚,通过研究植物中金属相关转运蛋白基因的表达量与植物累积金属特性关系的研究尚较少。本研究选用南方地区广泛种植的蔬菜品种苋菜(Amaranthus mangostanus L.),研究不同苋菜对各金属的吸收累积特性,另外通过开展苋菜金属转运蛋白基因表达量与相关金属累积特性的研究,探讨苋菜累积金属的机理。对评价种植在重金属污染土壤中的健康风险及探究植物对重金属吸收机理有参考意义。 1 材料与方法 1.1 试验材料
植物:选用广州市场上常见的苋菜(Amaranth mangostanus L.)品种,白骨小圆叶油苋菜(BG)、正泰小圆叶苋菜(ZT)、台湾白苋菜(TB)、红柳叶苋菜(HLY).苋菜种子来自广州蔬菜研究基地及种子批发商。根据本研究结果选择重金属吸收特性差异更大的两个品种HLY及BG进行金属转运蛋白分析。
土壤:广州市郊区污染菜园土。其理化性质:pH为6.38,阳离子交换量为20.86 cmol·kg-1,总Cd、Pb、Zn、Ca、Fe、Mn含量分别为2.28 mg·kg-1、22.65 mg·kg-1、316.5 mg·kg-1、39.2 g·kg-1、31.4 g·kg-1、621.5 mg·kg-1,总有机碳含量为35.4 g·kg-1,速效磷含量为94.03 mg·kg-1,速效氮含量为128.87 mg·kg-1. 1.2 盆栽试验
试验用4个品种苋菜各设3个重复,每盆用鲜土3 kg,并控制每盆植株数5棵。盆栽试验于2014年5月下旬至8月上旬进行,生长天数为65 d.种子用多菌灵进行灭菌处理,种植于供试土壤中,期间进行常规管理,不施肥及使用农药,保证自然光照及充足水分,种植期间植物正常生长。完成种植后,收集苋菜的根和地上部。 1.3 样品处理 1.3.1 植物样品处理及金属含量测定
苋菜用去离子水清洗干净,按地上及地下部分剪开。取1 cm长根尖鲜样,液氮迅速冷冻后置于-70℃冰箱中保存,用于基因分析;地上部分植物包括茎和叶,60℃烘干至恒重后用于各金属指标的测定。
称取2 g根系鲜样,每品种设3个重复。用30 mL的10 mmol·L-1(NH4)2EDTA溶液浸泡并超声以提取根细胞质外体金属[19].经(NH4)2EDTA溶液提取的根系烘干至恒重后,用研钵磨成粉末状,混合10 mL浓硝酸,用微波消解仪(CEM corporation,MARS5)消解,消解条件:5 min升温至120℃保持恒温2 min,5 min升温至160℃恒温3 min,最后7 min升温至180℃恒温5 min.消解溶液用低速滤纸过滤至溶液澄清,定容至50 mL备用。
地上部分烘干恒重后称量总质量,以计算其含水率。将地上部分干样磨成粉末状,称取0.3 g干样,混合10 mL浓硝酸,用微波消解仪消解,每品种设3个重复。上述样品消解后皆采用原子吸收分光光度计(日本岛津公司,AA-7000)测定Cd、Pb的含量。采用电感耦合等离子体发射光谱仪(美国PE公司,OPTIMA 2000DV)测定Ca、Mn、Zn、Fe含量。采用植物标准样品(GSV-1国家标准参比物质)进行质量控制。 1.3.2 根系目的基因的测定
总RNA提取按照TRIZOL(康为世纪)试剂提供的方法。凝胶电泳检验RNA的完整性,仪器选用Bio-Rad(Universal Hood II)凝胶成像仪。cDNA反转录按照HiFi-MMLV cDNA 第一链合成试剂盒(康为世纪)提供的方法。半定量PCR引物:根据苋菜IRT1基因(NCBI GenBank:GU363501.2)设计为IRT1F(GGCATTGCTGCTGGAATTA)和IRT1R(TTTCCGCCAAGGATTATGAG).根据拟南芥、芥菜、Noccaea caerulescens等已知的HMA4基因全长序列,设计兼并引物HMA4F(GTTGTGTTAGTCAGTGCTTG)和HMA4R(GTGTCAAGATAATCAGCACT).上述引物均为5′~3′,皆用Oligo7评价。引物由上海生工生物工程有限公司合成。
半定量PCR采用上海生工的Taq PCR Master Mix.反应条件根据说明书步骤确定。以β-actin基因作为内参对照,每个样品PCR重复3次,凝胶电泳后选取1张对比图。 1.4 数据处理
数据处理采用Microsoft Excel 2010和IBM SPSS Statistics 21软件。种间差异性分析采用单因素LSD检验方差分析,相关性分析采用Pearson,双侧检验。植株内各金属浓度均换算成鲜重计。 2 结果与分析 2.1 苋菜地上部分金属累积品种差异
图 1为4个品种苋菜地上部分Cd含量,可以看出HLY地上部分的Cd含量最高,而BG品种地上部分含量最低。因此选择HLY和BG进行(与金属吸收有关)关键基因表达量的研究。

|
| 图 1 苋菜地上部分Cd含量 Figure 1 Cadmium content in aboveground biomass of amaranth |
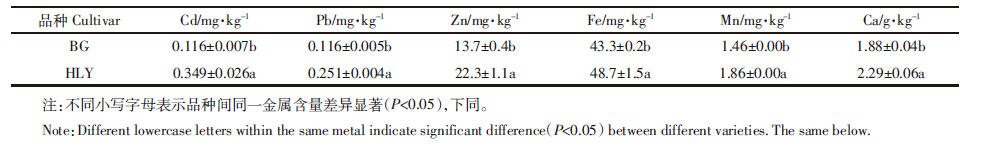
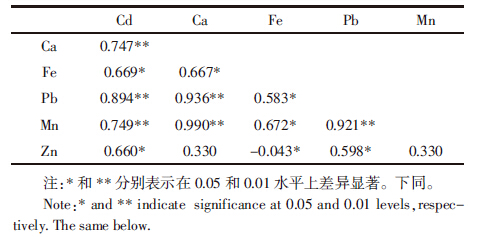
由表 1可知,对比两品种茎叶部分的金属含量,HLY品种地上部分的Cd、Pb、Zn、Fe、Mn和Ca均显着高于BG品种,表明HLY品种从根系转运金属的能力比BG品种强。金属之间的相互作用关系复杂,伴随着必需元素的吸收,非必需元素也同时进入植物体内,或是某一元素的大量存在抑制另一种元素的吸收。表 2为4个品种的地上部分金属相关性分析。苋菜地上部分Cd与Pb、Ca及Mn的吸收呈极显着正相关,与Zn和Fe的吸收呈显着正相关;Pb与Cd、Ca、Mn呈极显着正相关。
 |
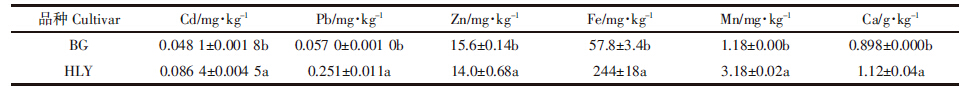
(NH4)2EDTA溶液提取的是根细胞质外体的金属,而余下的是根细胞原生质体内的金属。许多金属转运蛋白位于细胞膜并在金属的吸收转运过程起重要作用。从表 3可知,HLY品种根细胞原生质体的Cd、Pb、Mg、Fe、Mn、Ca等金属的含量皆高于BG,且Pb含量的差异表现最为突出,表明HLY根系吸收金属的能力比BG强。表 4的4个品种根系原生质体金属吸收相关性分析中,苋菜根系细胞原生质体金属Cd与Mn的吸收呈显着正相关,与Fe、Pb的吸收呈极显着相关;Fe、Mn与Pb的吸收也呈现极显着正相关。这表明在必需金属Fe、Ca等吸收的同时,其他非必需金属Cd、Pb等也随之进入根系。
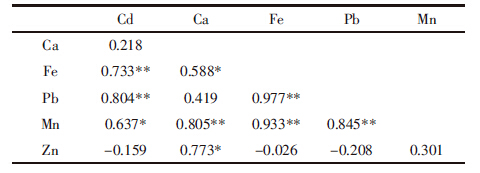 |
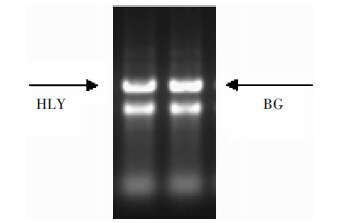
图 2为苋菜根系RNA提取电泳图,图中条带分别为HLY品种根系RNA(左)及BG品种根系RNA(右),两品种的3条荧光条带28s、18s及5s均清晰,表明提取的RNA完整性良好。
|
| 图 2 根组织RNA提取电泳结果 Figure 2 Electrophoretogram of RNA in amaranth roots |
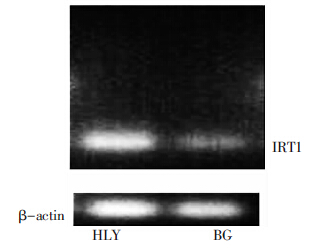
IRT1蛋白影响植物根系对土壤中Fe的吸收,而IRT1基因的表达量影响IRT1蛋白的合成。图 3显示,HLY品种的IRT1基因条带亮度大于BG品种,表明HLY品种根系IRT1基因的表达量大于BG品种。表 3中,HLY根系原生质体Fe吸收量大于BG品种,表明IRT1基因的较高表达可能有利于苋菜根系对Fe的吸收,与此同时也可能促进了根系对其他重金属(Cd、Pb、Ca、Mn等)的吸收。
|
| 图 3 苋菜根系IRT1基因表达 Figure 3 Expression of IRT1 in amaranth roots |
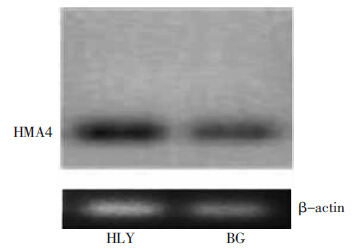
图 4显示,两品种HMA4基因条带亮度存在差异,HLY品种亮度高于BG品种,表明HLY根细胞HMA4基因表达量大于BG品种。由于HMA4在植物根系中起到将多种金属分配转运的作用,结合表 1所列HLY品种地上部分Cd、Ca等多种金属含量皆高于BG品种,表明HMA4基因的较高表达可能更有利于多种金属向地上部分转移。
|
| 图 4 苋菜根系HMA4基因表达 Figure 4 Expression of HMA4 in amaranth roots |
随着苋菜地上部分Cd的含量增加,地上部分的Zn、Ca、Pb等含量相应增加(表 2),表明苋菜Cd高累积品种对其他金属的累积能力较Cd低累积品种强。此外,随着地下部分原生质体Cd含量的增加,Fe、Pb、Mn的含量也增加,表明苋菜Cd高累积品种的根系对土壤中其他金属的吸收能力比低累积品种强。笔者推测,苋菜品种间的金属累积特性差异与某些通道蛋白有关。金属通道蛋白基因的表达量,能够在很大程度上影响该金属转运蛋白的量,从而影响植物对金属的吸收。因此,本文测定IRT1与HMA4两个金属转运蛋白的基因表达量,并研究其与苋菜金属吸收累积的关系。
IRT1是铁转运蛋白之一,主要在根系表皮细胞质膜中表达,其功能是将铁和其他金属从根外转运至表皮细胞内[20].本研究中,HLY根系原生质体Fe含量高于BG,同时IRT1基因表达量HLY苋菜高于BG苋菜,苋菜根系对Fe的吸收与根系的IRT1表达量呈正相关。此外,苋菜根系原生质体Cd、Pb与Fe的吸收呈极显着正相关(表 4).这一现象可能与苋菜IRT1有关。研究发现,拟南芥中,IRT1突变体不仅无法从土壤中摄取Fe,其他阳离子的累积也受到了影响[21],而当IRT1基因超表达时,将导致基础的IRT1蛋白增加,使多种金属过量吸收[22].Korshunova等[23]证明当IRT1在酵母菌中表达后,酵母菌能转运Mn,而且Cd、Fe和Zn皆能抑制Mn的转运,说明Cd等金属能够占用IRT1蛋白的通道。因此,苋菜IRT1可能并非是对Fe绝对专一的转运蛋白,它在影响根系Fe吸收的同时也影响了其他一些金属的吸收。IRT1基因在Cd高累积品种HLY中的较高表达,促进了HLY根系对Fe、Cd及Pb的吸收。
HMA4在多种植物中均有发现,并在根系大量表达。拟南芥的AtHMA4位于细胞质膜,并表达在根维管束组织,在AtHMA4超表达情况下,Cd和Zn从根转运到茎的量都有所增加[13];将AtHM44异位表达于西红柿中,使得西红柿叶子质外体的Zn过量[24].本实验结果表明,HLY地上部分的Zn和Cd比BG高,且HLY的HMA4基因表达量高于BG.这可能与苋菜HMA4有关。有研究发现,Zn/Cd超富集植物遏蓝菜能将大量重金属从根部转运至地上部分的叶表皮细胞中储存[25],其中TcHMA4起到从根部转运重金属及微量元素至木质部导管中的重要作用[7].因此笔者推测,在Zn和Cd从苋菜根系转运至茎叶的过程中,HMA4基因起到十分重要的作用。HMA4的长距离运输金属的功能,是植物通过转移金属的位置来降低局部区域金属浓度,以起到保护细胞生物活性作用的反应机制。本实验中,除了Cd的量在两品种中有显着差异外,Pb也呈现一致的趋势。有研究表明,HMA4存在多个金属结构域(Metal binding domain,MBD),它们起到与重金属结合的作用[8, 26].其中,AtHMA4中C端基团是Zn和Cd的高敏螯合剂,每个C端可以与10个Zn离子结合[27].HMA4基因蛋白除了转运Zn外,还涉及Cd、Pb、Co等金属。将遏蓝菜TcHMA4基因转至酵母中,其基因表达的菌株对Cd和Pb离子输出能力分别提高了70%和50%,说明HMA4赋予了植物对Cd与Pb的超富集特性[25, 28].笔者推测,苋菜HMA4转运Zn和Cd的同时也促进了一部分的Pb.这也许是Cd高累积品种HLY地上部分Pb累积量高于Cd低累积品种BG的原因之一。 4 结论
4个苋菜品种中,红柳叶苋菜地上部分Cd含量远高于地上部分Cd含量低的白骨小圆叶油苋菜。苋菜地上部分Cd与Pb、Ca、Mn的吸收呈极显着正相关,与Zn、Fe的吸收呈显着正相关。同时,红柳叶苋菜根系HMA4表达量高于白骨小圆叶油苋菜。苋菜地下部分Cd与Fe、Pb的吸收呈极显着正相关。红柳叶苋菜根系原生质体Cd含量高于白骨小圆叶油苋菜,而且红柳叶苋菜根系IRT1基因表达量也高于白骨小圆叶油苋菜。
| [1] | 程旺大, 姚海根, 吴伟, 等. 土壤-水稻体系中的重金属污染及其控制[J]. 中国农业科技导报, 2005, 7(4):51-54. CHENG Wang-da, YAO Hai-gen, WU Wei, et al. Heavy metal pollution and its countermeasures in soil-rice system[J]. Review of China Agricultural Science and Technology, 2005, 7(4):51-54. |
| [2] | Zhuang P, Zou B, Li N Y, et al. Heavy metal contamination in soils and food crops around Dabaoshan mine in Guangdong, China:Implication for human health[J]. Environmental Geochemistry and Health, 2009, 31(6):707-715. |
| [3] | Chen Y X, He Y F, Yang Y, et al. Effect of cadmium on nodulation and N2-fixation of soybean in contaminated soils[J]. Chemosphere, 2003, 50(6):781-787. |
| [4] | Prasad M N, Hagenmeyer J. Heavy metal stress in plants[M]. Berlin, Heidelberg, New York:Springer-Verlag, 1999. |
| [5] | 张玉秀, 柴团耀. 植物重金属调节基因的分离和功能[M]. 北京:中国农业出版社, 2006. ZHANG Yu-xiu, CHAI Tuan-yao. Isolation and function of heavy metal responsive gene in plant[M]. Beijing:China Agriculture Press, 2006. |
| [6] | Palmgren M G, Harper J F. Pumping with plant P-type ATPases[J]. Journal of Experimental Botany, 1999, 50(Suppl):883-893. |
| [7] | Axelsen K B, Palmgren M G. Inventory of the superfamily of P-type ion pumps in Arabidopsis[J]. Plant Physiol, 2001, 126(2):696-706. |
| [8] | Argüello J M, Eren E, González-Guerrero M. The structure and function of heavy metal transport P-1B-ATPases[J]. Biometals, 2007, 20(3/4):233-248. |
| [9] | Hussein D, Haydon M J, Wang Y, et al. P-type ATPase heavy metal transporters with roles in essential zinc homeostasis in Arabidopsis[J]. Plant Cell, 2004, 16(5):1327-1339. |
| [10] | Eren E, Kennedy D C, Maroney M J. A novel regulatory metal binding domain is present in the C terminus of Arabidopsis Zn2+-ATPase HMA2[J]. Journal of Biological Chemistry, 2006, 281(45):33881-33891. |
| [11] | Eren E, Argüello J M. Arabidopsis HMA2, a divalent heavy metal-transporting PIB-type ATPase, is involved in cytoplasmic Zn2+ homeostasis[J]. Plant Physiology, 2004, 136(3):3712-3723. |
| [12] | Hussain D, Haydon M J, Wang Y, et al. P-type ATPases heavy metal transporters with roles in essential zinc homeostasis in Arabidopsis[J]. Plant Cell, 2004, 16(5):1327-1339. |
| [13] | Verret F, Gravot A, Auroy P, et al. Over expression of AtHMA4 enhances root-to-shoot translocation of zinc and cadmium and plant metal tolerance[J]. Febs Letters, 2004, 576(3):306-312. |
| [14] | 金枫, 王翠, 林海建, 等. 植物重金属转运蛋白研究进展[J]. 应用生态学报, 2010, 21(7):1875-1882. JIN Feng, WANG Cui, LIN Hai-jian, et al. Heavy metal-transport proteins in plants:A review[J]. Chinese Journal of Applied Ecology, 2010, 21(7):1875-1882. |
| [15] | Pedas P, Ytting C K, Fuglsang A T, et al. Manganese efficiency in barley:Identification and characterization of the metal ion transporter HvIRT1[J]. Plant Physiol, 2008, 148(1):455-466. |
| [16] | Palmer C M, Guerinot M L. Facing the challenges of Cu, Fe and Zn homeostasis in plants[J]. Nature Chemical Biology, 2009, 5(5):333-340 |
| [17] | Xiong H C, Guo X T, Kobayashi, et al. Expression of peanut Iron Regulated Transporter 1 in tobacco and rice plants confers improved iron nutrition[J]. Plant Physiology and Biochemistry, 2014, 80:83-89. |
| [18] | Walker E, Connolly E. Time to pump iron:Iron-deficiency-signaling mechanisms of higher plants[J]. Current Opinion in Plant Biology, 2008, 11(5):530-535. |
| [19] | Feng M H, Shan X Q, Zhang S Z, et al. A comparison of the rhizosphere-based method with DTPA, ECTA, CaCl2, and NaNO3 extraction methods for prediction of bioavailability of metals in soil to barley[J]. Environmental Pollution, 2005, 137(2):231-240 |
| [20] | Vert G, Grotz N, Dedaldechamp F, et al. IRT1, an Arabidopsis transporter essential for iron uptake from the soil and for plant growth[J]. The Plant Cell, 2002, 14(6):1223-1233 |
| [21] | Barberon M, Dubeaux G, Kolb C, et al. Polarization of Iron-Regulated Transporter 1(IRT1) to the plant-soil interface plays crucial role in metal homeostasis[J]. Proceedings of the National A cademy of Sciences of the United States of America, 2014, 111(22):8293-8298. |
| [22] | Barberon M, Zelazny E, Robert S, et al. Monoubiquitin-dependent endocytosis of the Iron-Regulated Transporter 1(IRT1) transporter controls iron uptake in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(32):E450-E458. |
| [23] | Korshunova Y O, Edie D, Clark W G, et al. The IRT1 protein from Arabidopsis thaliana is a metal transporter with a broad substrate range[J]. Plant molecular biology, 1999, 40(1):37-44. |
| [24] | Siemianowski O, Barabasz A, Weremczuk A, et al. Development of Zn-related necrosis in tobacco is enhanced by expressing AtHMA4 and depends on the apoplastic Zn levels[J]. Plant Cell and Environment, 2013, 36(6):1093-1104. |
| [25] | Papoyan A, Kochian L V. Identification of Thlaspi caerulescen genes that may be involved in heavy metal hyperaccumulation and tolerance:Characterization of a novel heavy metal transporting ATPase[J]. Plant Physiology, 2004, 136(3):3814-3823. |
| [26] | Solioz M, Vulpe C. CPx-type ATPases:A class of P-type ATPases that pump heavy metals[J]. Trends in Biochemical Sciences, 1996, 21(7):237-241. |
| [27] | Baekgaard L, Mikkelsen M D, Sorensen D M, et al. A combined zinc/cadmium sensor and zinc/cadmium export regulator in a heavy metal pump[J]. Journal of Biological Chemistry, 2010, 285(41):32143-32152. |
| [28] | Hanikenne M, Talke I N, Haydon M J. Evolution of metal hyperaccumulation required cis-regulatory changes and triplication of HMA4[J]. Nature, 2008, 453(7193):391-396. |
 2015, Vol. 34
2015, Vol. 34