文章信息
- 刘遵奇, 孟军, 陈温福
- LIU Zun-qi, MENG Jun, CHEN Wen-fu
- 玉米秸秆生物炭对尿素分解的影响
- Effect of Corn Stalk Biochar on Urea Hydrolysis
- 农业环境科学学报, 2015, 34(6): 1142-1148
- Journal of Agro-Environment Science, 2015, 34(6): 1142-1148
- http://dx.doi.org/10.11654/jaes.2015.06.018
-
文章历史
- 收稿日期:2015-01-01
尿素是氮肥的主要形式之一,是目前农业生产中应用较为广泛的氮肥品种。使用尿素在提高作物产量的同时也带来一些问题,土壤中脲酶的存在导致尿素分解速度快,利用率一直不高[1, 2],而损失的氮素则成为潜在的污染源。例如氮以气态形式进入大气会加剧温室效应[3, 4]、通过雨水淋洗作用进入江河湖泊造成水体富营养化[5, 6, 7].因此,提高氮肥的利用效率一直是人们研究的热点问题。
近年来,生物炭作为一种新型功能材料为提高肥料利用率、改善土壤性质以及固碳减排等问题提供了解决的思路。生物炭是生物质在相对低温(<700 ℃)和限制氧气的条件下热解产生的富含碳素的固态物质[8].生物炭施入土壤后可以达到改善土壤性质[9]、提高土壤肥力[10]、减少养分损失的作用[11, 12, 13],以及降低温室气体(二氧化碳、氧化亚氮)排放[14, 15]的效果。目前一些研究认为生物炭对土壤氮素具有矿化作用[16],但对矿化的氮来源于土壤本身还是来自生物炭,仍存在一定争议[17, 18].另外也有研究发现生物炭可以影响土壤铵态氮和硝态氮的含量[13],既可能是生物炭对其产生的吸附作用[19, 20, 21, 22],也可能是生物炭促进微生物对其利用[23]所导致。生物炭还会影响土壤硝化与反硝化作用[24]进而影响氮素循环。由于以上研究多是以土壤中固有氮素为研究样本,生物炭对外源氮素的影响过程和机制尚未可知,而这正是将生物炭应用于减氮增效工作时亟待明确的问题。为此,本研究以两种温度热解产生的生物炭为试材,通过培养试验分析生物炭对尿素态氮分解及在土壤中转化的影响,以期为生物炭存在条件下氮肥(尿素)的合理投入、生物炭基肥料制备和应用提供参考。
1 材料与方法 1.1 供试土壤供试土壤为棕壤,取自沈阳农业大学水稻研究所试验田30 cm耕层,经风干、过2 mm筛、剔除肉眼可见植物组织与石块后备用。土壤基本性质:容重1.19 g·cm-3,全氮1.69 g·kg-1,全磷0.69 g·kg-1,全钾19.2 g·kg-1,有机碳10.60 g·kg-1,硝态氮4.65 mg·kg-1,铵态氮31.75 mg·kg-1,pH6.91。
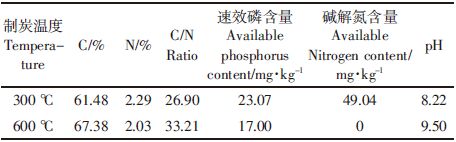
1.2 供试生物炭试验所用生物炭为玉米秸秆生物炭,首先将收获的玉米秸秆在烘箱中105 ℃烘干2 d左右,加工成1 cm长的小段,然后装入带盖坩埚,在马弗炉中于缺氧条件下由室温以5~10 ℃·min-1的升温速率分别加热至300 ℃和600 ℃,停留15 min获得。基本性质见表 1。
如表 2所示,生物炭以2%的添加量与土壤混合培养,以不添加生物炭土壤为对照处理,每个处理同时分为2部分,一部分灭菌,一部分不灭菌。共6个处理,每个处理重复3次。
操作方法:首先将风干棕壤土200 g分别与2种生物炭4 g混匀放入小花盆(底面积25 cm2,高8 cm)中,灭菌处理将生物炭-土壤混合放入灭菌锅中湿灭菌(120 ℃,20 min),取出冷却放入小花盆中。然后将各处理放入培养箱中,施加6 g·L-1尿素20 mL,加水至质量(风干土)含水率25%,在26 ℃、空气湿度为80%的条件下培养12 d。
在培养开始后的0.5、1、1.5、2、3、4、6、8 d取土壤样品,用Douglas & Bremner法[25]测定土壤中剩余尿素含量,以计算尿素分解速率;培养期间每天用密闭硼酸吸收法收集计算氨气排放;在1、3、5、7、9、11 d取土样,用2 mol·L-1氯化钙溶液浸提,流动注射分析仪(德国Seal-AA3)测定NH4+-N含量和NO3--N含量;在0、2、4、6、8 d取土样,靛酚蓝比色法测定脲酶活性;在-1、0、2、4、6、8 d电极法测定土壤pH值。在培养结束后用碱解扩散法测定碱解氮含量。
1.4 数据处理试验数据用SPSS统计分析软件中Duncan法进行差异显着性统计分析检验。使用Excel 2003软件进行图表的绘制。
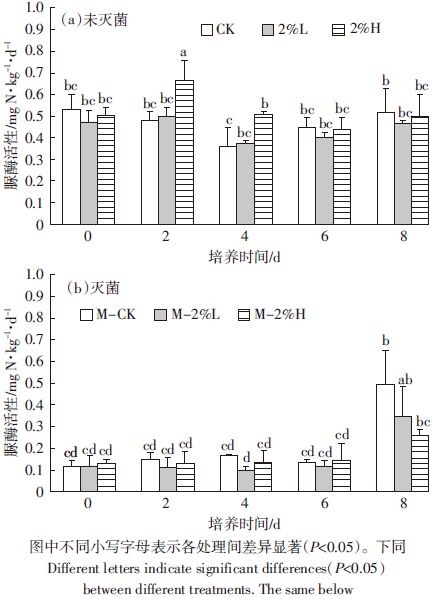
2 结果与分析 2.1 生物炭施入土壤对脲酶活性的影响脲酶是尿素水解的专一酶,其活性对尿素的分解速度有直接影响。在本实验中,土壤脲酶活性在培养后期受生物炭影响不大(图 1a).只有2%H处理土壤在培养前4 d对脲酶活性具有促进作用,之后与2%L处理和对照的活性水平基本一致。
|
| 图 1 生物炭对土壤脲酶活性影响 Figure 1 Effect of biochar on urease activity |
灭菌后的土壤(图 1b)脲酶活性在前6 d内保持在一个较低水平,由于土壤暴露在空气中,土壤的尿酶活性在培养第8 d后明显提高,同时2%H处理对其恢复过程有一定的抑制作用。
2.2 生物炭施入土壤对尿素分解的影响土壤中尿素转化受土壤pH值、温度和水分等条件影响,在水分适当时,土壤温度越高,转化越快。在大田条件下,土壤温度为10 ℃时,尿素完全转化成NH4+-N需7~10 d、20 ℃时需4~5 d,当30 ℃时只需2~3 d即可完全分解。本试验采用的培养温度为26 ℃,分解所需时间为2~3 d.
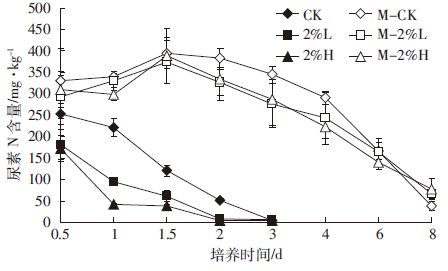
由土壤中尿素态氮的变化趋势(图 2)可以看出,对照处理土壤中尿素完全水解需要3 d左右,而生物炭施入后明显加快了尿素的分解,第2 d天结束时已基本检测不到,较对照处理提前1 d.同时生物炭促进尿素分解作用比较明显,在尿素加入0.5 d后,生物炭处理的尿素氮含量即开始低于对照,到培养至1 d结束时,生物炭处理尿素氮含量与对照相比差异达到最大,2%H、2%L、对照处理剩余尿素氮含量分别为:38.6、89.0、206.8 mg·kg-1.而初始添加的尿素氮含量为280.0 mg·kg-1,因此2%H、2%L处理分解的氮分别为241.4、191.0 mg·kg-1·d-1,分别是对照处理(73.2 mg·kg-1·d-1)的3.32倍和2.6倍。
|
| 图 2 土壤中残留尿素N浓度随培养时间变化 Figure 2 Concentrations of residual urea in soil over culture time |
在培养初期,灭菌土壤中的脲酶丧失活性,尿素无法分解,土壤尿素含量较高,而由于土壤暴露在空气中,脲酶活性会逐渐恢复,尿素开始分解,但分解速度缓慢。到培养后期仍能检测到少量尿素态氮存在,同时各处理间没有显示出差异。
2.3 生物炭施入土壤对无机氮含量的影响 2.3.1 对铵态氮的动态影响由土壤中NH4+-N变化趋势(图 3a)可以看出,未灭菌土壤中生物炭处理的NH4+-N含量在前5 d的培养过程中明显高于对照处理。其中以第1 d差异最大,分别为1450 mg·kg-1(2%H)和1380 mg·kg-1(2%L),是对照处理(744 mg·kg-1)的1.95倍和1.85倍。同时在此期间生物炭处理NH4+-N呈快速下降的趋势,说明生物炭处理土壤中NH4+-N不但积累快,转化为其他形态氮的速度也比较快。
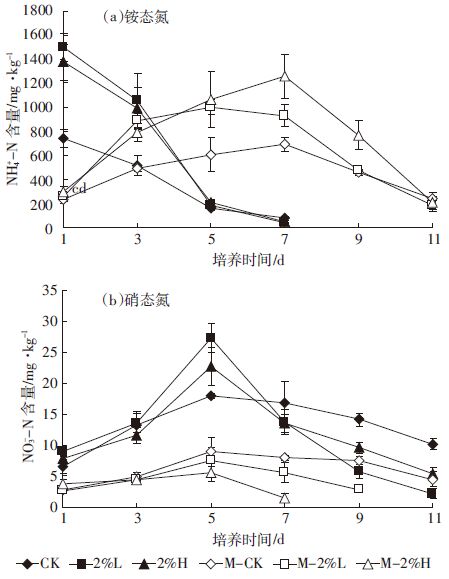
|
| 图 3 生物炭对土壤无机氮浓度的影响 Figure 3 Impact of biochar on soil inorganic nitrogen concentration |
在灭菌的土壤中,由于脲酶活性受到抑制(图 1),导致尿素分解较慢,初期NH4+-N浓度明显低于未灭菌处理,随着脲酶活性的恢复,NH4+-N积累量逐渐增加。与未灭菌处理现象一致的是生物炭处理NH4+-N含量在3~11 d内明显高于对照。另外,与未灭菌处理在开始培养时即呈现下降趋势不同,灭菌处理NH4+-N浓度先升高后下降,至第11 d后转化完毕。出现这种情况的主要原因可能是灭菌土壤中微生物活性较低,导致NH4+-N不能被固定或向NO3--N迅速转化,因而在土壤中有较长时间的积累。
2.3.2 对硝态氮的动态影响由本试验结果(图 3b)可以看出,虽然生物炭在很大程度上提高了土壤NH4+-N的含量,但NO3--N含量变化与之相比却十分微小。这表示大量的NH4+-N没有通过硝化作用转化为NO3--N,即生物炭没有提高土壤的硝化作用。而未灭菌生物炭处理的NO3--N含量在第3~7 d高于对照的原因可归结为底物(NH4+-N)增加。
培养至第5 d,生物炭处理NO3--N含量逐渐下降至低于对照处理,直到培养结束始终保持这种趋势。这可能是由于生物炭促进了微生物对NO3--N的利用,也可能是生物炭的吸附作用导致的。
在灭菌处理的土壤中,NO3--N含量一直处于较低水平。这可能是前期缺少硝化细菌的存在、后期硝化作用没有迅速恢复的原因,因而NH4+-N未能转化为NO3--N.在培养5 d后,对照处理NO3--N保持在相对稳定水平,生物炭处理中有明显下降趋势。
2.3.3 培养末期土壤碱解氮含量碱解氮含量能反映土壤近期内氮素供应情况,主要包括无机态氮(铵态氮、硝态氮)及易水解的有机态氮(氨基酸、酰铵和易水解蛋白质).
由图 4可以看出,在培养12 d后,所有生物炭处理的碱解氮含量均低于对照,未灭菌处理中2%L和2%H处理分别比对照处理降低40.1%和55.5%,降低效果明显。引起这种现象的原因可能是生物炭促进微生物数量与活性的提高,进而促进无机氮的固定[26].同时可以看出,虽然两组对照碱解氮含量没有明显差异,但M-2%L和M-2%H处理含量略高于未灭菌的两个处理,可能是由于灭菌后微生物活性降低而导致对无机氮固定减少。这也间接说明微生物对无机氮的固定是碱解氮降低的原因。
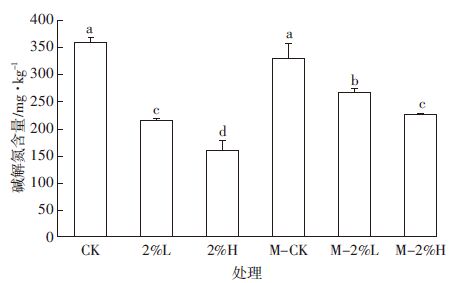
|
| 图 4 培养末期土壤碱解氮含量 Figure 4 Available nitrogen content in soil at end of incubation |
尿素施加到土壤中后,会通过脲酶的分解生成氨和二氧化碳,氨可以与水作用生成NH4+-N,或者直接以气态形式挥发到大气中。这一过程主要受土壤pH值、含水量、土壤脲酶活性及土壤微生物活动的影响。
从图 5可以看出,灭菌处理使脲酶失活导致尿素分解延后,进而导致灭菌与未灭菌两个处理间氨挥发的情况有很大差异,未灭菌的土壤各处理在第7 d氨气基本排放完毕,而灭菌处理氨气的挥发持续到第12 d.两种处理的氨气挥发高峰分别出现在第2~3 d和7~8 d,但共同的趋势是2%H>2%L>对照。生物炭施入土壤后对pH的提高是氨挥发增加的主要原因。

|
| 图 5 氨气挥发日变化 Figure 5 Daily variation of ammonia volatilization |
在未灭菌土壤当中,生物炭促进了氨气的单日挥发量,并且挥发高峰也早于对照处理1 d出现。施炭处理最高单日挥发量分别为1.56 mg N·kg-1·d-1(2%H)和1.16 mg N·kg-1·d-1(2%L),分别是对照处理(0.911 mg N·kg-1·d-1)的1.7倍和1.2倍。
2.4.2 各处理氨气排放总量的差异分析由图 6可以发现,灭菌土壤中的氨挥发量明显高于未灭菌土壤,其中M-2%H处理土壤最多(10.783 mg·kg-1),占外加尿素N的4%左右。
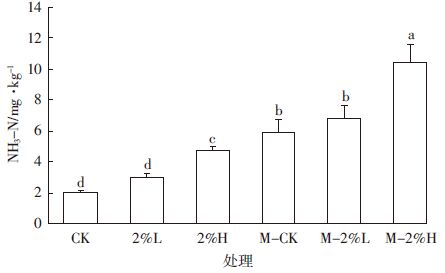
|
| 图 6 各处理氨气排放总量 Figure 6 Total ammonia emissions from each treatment |
在灭菌土壤中,由于缺少硝化细菌将NH4+-N转化为NO3--N,以及微生物对NH4+-N的固定,会有更多氨气挥发出去,挥发总量高于未灭菌土壤,差异达显着水平(P<0.05).在两种方式处理的土壤中,氨气的挥发总量同土壤的pH成正比,添加高温度生物炭处理(2%H和M-2%H)土壤pH值最高,其氨气挥发总量高于低温度生物炭处理(2%L和M-2%L).挥发量最小的是对照处理,CK和M-CK分别仅为2.39 mg·d-1和5.95 mg·d-1.
2.5 生物炭对土壤pH 的影响从图 7可以看出,在培养开始前,生物炭施入会明显提高土壤的pH 值:2%L处理的土壤pH值为7.51,较对照提高0.43;2%H处理的土壤pH值为7.88,较对照提高0.80.

|
| 图 7 土壤 pH 值随培养时间的变化 Figure 7 Changes of soil pH value over time |
培养开始后,尿素分解产生的铵会提高土壤pH 值。随着培养时间的推移,培养至第4 d后各处理的土壤pH开始逐渐下降,对照和施加低温生物炭土壤处理下降明显,高温度生物炭处理下降较为缓慢。培养至第8 d各处理均恢复到培养前水平。
灭菌处理土壤中由于尿素分解延迟,其pH提高也较为缓慢,变化趋势同未灭菌处理一致。
3 讨论本试验以两种温度的玉米秸秆生物炭为材料,以棕壤为试验土壤,研究了生物炭对尿素在棕壤中分解、无机氮积累的影响。结果表明:生物炭能够促进尿素在土壤中分解、提高土壤NH4+-N的积累和氨气的挥发以及土壤速效氮的固定作用。
试验中发现,两种温度制备的生物炭均不同程度加速尿素分解,以600 ℃生物炭效果尤为明显,可能源于在培养初期刺激脲酶活性的提高。而目前尚未有研究发现类似现象,因此其真实原因有待进一步探讨。
对于生物炭促进土壤NH4+-N积累的现象可解释为生物炭促进了土壤固有氮素的矿化。以第1 d 2%H处理为例,其总NH4+-N浓度为1400 mg·kg-1左右,扣除尿素所转化的243 mg·kg-1和土壤固有的(即灭菌土壤所含NH4+-N)302 mg·kg-1,矿化作用强度在850 mg·kg-1左右。同时,在培养3~9 d期间,灭菌处理间尿素氮残留量虽然没有差异,但灭菌生物炭处理的NH4+-N含量却显着高于灭菌对照处理。这也间接说明增加的NH4+-N来自土壤本身。已有研究发现生物炭对土壤氮具有矿化作用或者对土壤有机质有矿化作用[27, 16],Anderson等[24]进一步解释这种现象的原因是生物炭具有提高土壤微生物活性与数量的潜力,进而刺激其降解土壤有机质,导致土壤有机氮的正向激发作用。Nelissen等[28]同样以玉米秸秆生物炭为试验材料发现其在短期内(1周)加速了氮素的转化,将土壤氮从惰性库转化到活性库中,同时引起土壤自身有机的激发作用、提高了植物可利用氮含量。而生物炭对高pH土壤的激发作用较强[18],可能是高温度生物炭处理氮素矿化作用高于低温生物炭处理的原因。
本试验后期,生物炭处理中碱解氮含量明显低于对照。他人的一些培养试验也发现类似趋势,并且解释这种现象是由微生物固氮作用或非生物氮吸附作用引起的[13, 29, 30].本试验中灭菌后的生物炭处理碱解氮含量要高于未灭菌生物炭处理,也间接说明微生物对碱解氮的利用是其降低的主要原因。Deluca等[31]研究结果也表明,土壤氮素的固定是生物炭中活性有机碳组分(Labile carbon fraction)促进微生物对无机氮的需求导致的。
本实验结果显示,新鲜玉米秸秆生物炭短期内促进土壤氮素矿化作用和固定作用。这说明生物炭加速了土壤氮素的循环,增加了土壤中总矿化氮含量,因此能够提高短期内氮的植物可利用性[20].在植物存在的状态下,植物会与氮固定作用竞争矿化的氮从而降低氮损失的潜在风险。
试验发现,生物炭对氨挥发具有促进作用,这与杨帆等[32]的研究结果相同。由于土壤pH可影响氨在土壤中存在的形态(NH4+或NH3),在pH>7.2后,氨的形态向NH3转化,使氨挥发与土壤pH成正比。而两种炭处理的土壤pH(2%L为7.5,2%H为7.87)均高于对照处理(pH=7.09),因此生物炭提高土壤pH是其促进氨挥发的主要原因,Schomberg等[33]的研究结果也证实了这一点。同时可以看出,以氨气形式损失的N素只占外加N素的0.73%~3.73%,比例较小。
但也有一些培养试验[34, 35]发现生物炭对氨气具有良好的吸收效果,吸收量随制炭温度、生物炭pH和表面酸性官能团含量增加而增加,同时所吸收铵在pH值较低的炭处理中比较稳定。这说明生物炭是有能力吸收氨气的,但前提是所使用生物炭材料偏中性或酸性。本试验所用的生物炭碱性较强不利于减少氨气挥发,今后在大田生产中,与尿素同用时最好选择碱性偏弱的生物炭。
需要说明的是,本试验有许多局限之处。首先试验以玉米秸秆为制炭材料,与其他试验材料在各方面性质会有较大差异;其次,本试验为培养试验,是在未种植作物的条件下进行的,作物对氮素去向产生的影响未能考虑进来;最后,试验时间较短,对生物炭的长期效应来说还很难下定论。
4 结论(1)在本实验条件下,两种生物炭均会加快尿素在土壤中的分解速度,其中高温度生物炭作用效果比低温生物炭明显,并且能够短期内促进土壤中原有脲酶活性的发挥,但低温度生物炭没有这一效果。
(2)两种生物炭均会刺激土壤固有氮素的矿化,从而使NH4+-N的含量较对照提高85%左右。但对NO3--N影响不显着。
(3)低温和高温生物炭施入土壤后均明显提高了土壤pH值,导致氨挥发的增加。
(4)在灭菌土壤中,生物炭促进尿素分解和提高NH4+-N含量的效应会推迟5~7 d,与未灭菌土壤相比还会增加氨气的挥发量。
| [1] | 董燕, 王正银. 尿素在土壤中的转化与植物利用效率[J]. 磷肥与复肥, 2005, 20(2):76-78. DONG Yan, WANG Zheng-yin. Conversion of urea in soil and its plant use efficiency[J]. Phosphate & Compound Fertilizer, 2005, 20(2):76-78. |
| [2] | 彭少兵, 黄见良, 钟旭华, 等. 提高中国稻田氮肥利用率的研究策略[J]. 中国农业科学, 2002, 35(9):1095-1103. PENG Shao-bing, HUANG Jian-liang, ZHONG Xu-hua, et al. Research strategy in improving fertilizer nitrogen use efficiency of irrigated rice in China[J]. Scientia Agricultura Sinica, 2002, 35(9):1095-1103. |
| [3] | 董红敏, 李玉娥, 陶秀萍, 等. 中国农业源温室气体排放与减排技术对策[J]. 农业工程学报, 2008, 24(10):269-273. DONG Hong-min, LI Yu-e, TAO Xiu-ping, et al. China greenhouse gas emissions from agricultural activities and its mitigation strategy[J]. Transactions of the CSAE, 2008, 24(10):269-273. |
| [4] | Xing G X. N2O Emission from cropland in China[J]. Nutrient Cycling in Agroecosystems, 1998, 52(2-3):249-254. |
| [5] | 李世娟, 李建民. 氮肥损失研究进展[J]. 农业环境保护, 2001, 20(5):377-379. LI Shi-juan, LI Jian-min. Research progress on losses of fertilizer nitrogen[J]. Agro-Environmental Protection, 2001, 20(5):377-379. |
| [6] | 司友斌, 王慎强, 陈怀满. 农田氮、磷的流失与水体富营养化[J]. 土壤, 2000(4):188-193. SI You-bin, WANG Shen-qiang, CHEN Huai-man. Water eutrophication and losses of nitrogen phosphorus in farmland[J]. Soil, 2000(4):188-193. |
| [7] | 谌芸, 何丙辉, 赵秀兰, 等. 小江流域农地水土流失对水体富营养化的影响[J]. 水土保持学报, 2010, 24(4):31-34, 43. CHEN Yun, HE Bing-hui, ZHAO Xiu-lan, et al. Effect of soil erosion and water loss in farmland on water eutrophicationin Xiaojiang river basin[J]. Journal of Soil and Water Conservation, 2010, 24(4):31-34, 43. |
| [8] | Lehmann J, Joseph S. Biochar for environmental management[M]. Science and Technology Routledge, 2012. |
| [9] | 陈温福, 张伟明, 孟军. 农用生物炭研究进展与前景[J]. 中国农业科学, 2013, 46(16):3324-3333. CHEN Wen-fu, ZHANG Wei-ming, MENG Jun. Advances and prospects in research of biochar utilization in agriculture[J]. Scientia Agricultura Sinica, 2013, 46(16):3324-3333. |
| [10] | Gaskin J W, Steiner C, Harris K, et al. Effect of low-temperature pyrolysis conditions on biochar for agricultural use[J]. Trans ASABE, 2008, 51(6):2061-2069. |
| [11] | Laird D A. The charcoal vision:A win-win-win scenario for simultaneously producing bioenergy, permanently sequestering carbon, while improving soil and water quality[J]. Agronomy Journal, 2008, 100(1):178-181. |
| [12] | Laird D, Fleming P, Wang B Q, et al. Biochar impact on nutrient leaching from a midwestern agricultural soil[J]. Geoderma, 2010, 158(3-4):436-442. |
| [13] | Knowles O A, Robinson B H, Contangelo A, et al. Biochar for the mitigation of nitrate leaching from soil amended with biosolids[J]. Science of the Total Environment, 2011, 409(17):3206-3210. |
| [14] | 陈温福, 张伟明, 孟军, 等. 生物炭应用技术研究[J]. 中国工程科学, 2011, 13(2):83-89. CHEN Wen-fu, ZHANG Wei-ming, MENG Jun, et al. Researches on biochar application technology[J]. Engineering Sciences, 2011, 13(2):83-89. |
| [15] | Wang J Y, Pan X J, Liu Y L, et al. Effects of biochar amendment in two soils on greenhouse gas emissions and crop production[J]. Plant Soil, 2012, 360(1-2): 287-298. |
| [16] | Nelissen V, Rütting T, Huygens D, et al. Temporal evolution of biochar's impact on soil nitrogen processes-a 15N tracing study[J]. GCB Bioenergy, 2014. doi:10. 1111/gcbb.12156. |
| [17] | Smith J L, Collins H P, Bailey V L. The effect of young biochar on soil respiration[J]. Soil Biology and Biochemistry, 2010, 42(12):2345-2347. |
| [18] | Luo Y, Durenkamp M, De Nobili M, et al. Short term soil priming effects and the mineralisation of biochar following its incorporation to soils of different pH[J]. Soil Biology and Biochemistry, 2011, 43(11):2304-2314. |
| [19] | Novak J M, Busscher W J, Laird D L, et al. Impact of biochar amendment on fertility of a southeastern coastal plain soil[J]. Soil Science, 2009, 174:105-112. |
| [20] | Singh B P, Hatton B J, Singh B, et al. Influence of biochars on nitrous oxide emission and nitrogen leaching from two contrasting soils[J]. Journal of Environmental Quality, 2010, 39(4):1224-1235. |
| [21] | Yao Y, Gao B, Zhang M, et al. Effect of biochar amendment on sorption and leaching of nitrate, ammonium, and phosphate in a sandy soil[J]. Chemosphere, 2012, 89(11):1467-1471. |
| [22] | Zheng H, Wang Z Y, Deng X, et al. Impacts of adding biochar on nitrogen retention and bioavailability in agricultural soil[J]. Geoderma, 2013, 206:32-39. |
| [23] | Rondon M A,Lehmann J, Ramírez J, et al. Biological nitrogen fixation by common beans(Phaseolus vulgaris L.) increases with biochar additions[J]. Biology and Fertility of Soils, 2007, 43(6):699-708. |
| [24] | Anderson C R, Condron L M, Clough T J, et al. Biochar induced soil microbial community change:Implications for biogeochemical cycling of carbon, nitrogen and phosphorus[J]. Pedobiologia, 2011, 54(5-6):309-320. |
| [25] | 李世清, 李生秀, 贺海香. 土壤中尿素的浸提和比色测定:现代土壤科学研究[M]. 北京:中国农业科技出版社, 1994:316-320. LI Shi-qing, LI Sheng-xiu, HE Hai-xiang. The extraction and determination of urea in soil:Current research in soil science[M]. Beijing. China Agricultural Science and Technology Press, 1994:316-320. |
| [26] | Deluca T H, Mackenzie M D, Gundale M J. Biochar effects on soil nutrient transformations[M] //Biochar for environmental management. London: Earthscan, 2009:251-270. |
| [27] | Zimmerman A R, Gao B, Ahn M Y. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils[J]. Soil Biology and Biochemistry, 2011, 43(6):1169-1179. |
| [28] | Nelissen V, Rütting T, Huygens D, et al. Maize biochars accelerate short-term soil nitrogen dynamics in a loamy sand soil[J]. Soil Biology and Biochemistry, 2012, 55:20-27. |
| [29] | Bruun E W, Ambus P, Egsgaard H, et al, Effects of slow and fast pyrolysis biochar on soil C and N turnover dynamics[J]. Soil Biology and Biochemistry, 2012, 46:73-79. |
| [30] | Novak J M, Busscher W J, Watts D W, et al. Short-term CO2 mineralization after additions of biochar and switchgrass to a Typic kandiudult[J]. Geoderma, 2010, 154(3-4):281-288. |
| [31] | DeLuca T H, MacKenzie M D, Gundale M J, et al. Wildfire-produced charcoal directly influences nitrogen cycling in Ponderosa pine forests[J]. Soil Science Society of America Journal, 2006, 70(1):448-453. |
| [32] | 杨帆, 李飞跃, 赵玲, 等. 生物炭对土壤氨氮转化的影响研究[J]. 农业环境科学学报, 2013, 32(5):1016-1020. YANG Fan, LI Fei-yue, ZHAO Ling, et al. Influence of biochar on the transformation of ammonia nitrogen in soils[J]. Journal of Agro-Environment Science, 2013, 32(5):1016-1020. |
| [33] | Schomberg H H, Gaskin J W, Harris K, et al. Influence of biochar on nitrogen fractions in a coastal plain soil[J]. Journal of Environmental Quality, 2012, 41(4):1087-1095. |
| [34] | Asada T, Ishihara S, Yamane T, et al. Science of bamboo charcoal:Study on carbonizing temperature of bamboo charcoal and removal capability of harmful gases[J]. Journal of Health Science, 2002, 48(6):473-479. |
| [35] | Taghizadeh-Toosi A, Clough T J, Sherlock R R, et al. Biochar adsorbed ammonia is bioavailable[J]. Plant Soil, 2012, 350(1-2):57-69. |
 2015, Vol. 34
2015, Vol. 34