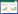文章信息
- 孙慧群, 周升恩, 吴怀胜, 李昆志, 李斌, 陈丽梅
- SUN Hui-qun, ZHOU Sheng-en, WU Huai-sheng, LI Kun-zhi, LI Bin, CHEN Li-mei
- 甲醛胁迫下蚕豆保卫细胞中过氧化氢的积累及其对气孔导度和开度的影响
- Impacts of Formaldehyde Stress on Hydrogen Peroxide Accumulation in Guard Cells and Stomatal Aperture and Conductance of Vicia Fabag
- 农业环境科学学报, 2015, 34(7): 1239-1246
- Journal of Agro-Environment Science, 2015, 34(7): 1239-1246
- http://dx.doi.org/10.11654/jaes.2015.07.003
-
文章历史
- 收稿日期:2015-02-02
2. 安庆师范学院资源环境系, 安徽 安庆 246011;
3. 昆明理工大学化学工程学院, 昆明 呈贡 650500
2. Department of Resource and Environment, Anqing Normal College, Anqing 246011, China;
3. Faculty of Chemistry and Engineering, Kunming University of Science and Technology, Chenggong 650500, China
相关调查表明,我国室内空气中甲醛(Formaldehyde,HCHO)浓度普遍高于室内空气质量标准(0.10 mg·m-3,GB/T 18883-2002),新装修房内HCHO浓度甚至高达3.86 mg·m-3,净化室内空气HCHO污染成为人们高度关注的课题[1, 2].近几年的研究主要集中在用植物净化室内HCHO污染,多为寻找能净化室内HCHO污染的植物,对其净化能力和效果进行比较[3, 4, 5, 6],一些学者利用14C和13C标记法对HCHO进入高等植物体内的代谢转化机制开展研究[7, 8, 9],但植物吸收HCHO的机制及其影响因素方面的研究未见报道。
气孔是植物进行水分交换和气体交换的门户,气孔开度和导度对外界非生物因素的刺激或变化敏感[10].已有研究证明,HCHO可导致多种植物的气孔开度或导度不同程度地下降[8, 11, 12, 13, 14],H2O2作为植物气孔运动信号转导过程的成员之一,是否参与调节气孔运动尚存在争议。外源H2O2可以诱导气孔的关闭[15, 16],但高湿环境下蚕豆叶片内产生的H2O2并未引起气孔关闭[17],说明H2O2对气孔开闭的调节受不同环境因素影响。李惠民等[18]研究显示HCHO可诱导拟南芥体内H2O2积累,但HCHO胁迫下植物体内H2O2的产生和积累是否影响气孔开度或导度,鲜见报道。为此,本研究以蚕豆(Vicia faba L.)为研究对象,对蚕豆进行模拟室内空气HCHO污染的处理,通过对蚕豆叶片H2O2含量及其H2O2亚细胞定位的检测,探讨HCHO胁迫下蚕豆保卫细胞H2O2的积累对气孔开度和导度的影响,为提高植物吸收HCHO能力的应用研究和植物气孔活动应答HCHO污染的机制研究提供理论依据。 1 材料与方法 1.1 实验材料和处理
用云南蚕豆8363(Yunnan Candou 8363)做供试材料,选择饱满种子沸水烫30 s以杀死蚕豆蟓,25 ℃黑暗下催芽萌发,待胚根长出2 cm转入花盆栽培,长到6片复叶时选择长势一致的健壮植株用于HCHO处理和测定。HCHO处理装置为一个三面由压缩板材(59 cm×40 cm×48 cm)构成、一面有玻璃门的家具柜,处理前用室内装修污染检测仪对柜内和柜外空气分别进行了0、24、48、72 h的检测,没有检测到苯、氨、甲苯和二甲苯,处理时用胶带密封柜的周沿。将XK-930-CH2O泵吸式甲醛测定仪固定在柜子玻璃门上,分别于 8:00、14:00、21:00三个时间点读取未放蚕豆植株的空柜内HCHO浓度,获得为期3 d的HCHO背景值,柜内HCHO浓度在早上8:00最低,中午14:00最高,日平均浓度在0.46~0.72 mg·m-3 之间;放入蚕豆植株后,72 h内柜内HCHO日平均浓度在0.44~0.64 mg·m-3之间,与未放入蚕豆植株差异不大,说明柜内板材持续释放HCHO.将长有蚕豆植株的花盆放入柜内后封闭柜门,同时在柜外(经测定HCHO浓度为0)放置长势一致的蚕豆植株作为对照(CK),控制柜内和柜外的温度和相对湿度等条件在相近的水平,柜内外光强均设定在450 lx·m-2,光照和黑暗处理时间设定为12 h/12 h.分别于0、24、48、72 h(每天的14:00)测定柜内和柜外蚕豆叶片的气孔开度和导度,并于相同时间取样用于叶片H2O2含量测定和H2O2的荧光显微定位检测。
抗坏血酸(Ascorbic acid,ASA)抑制实验按如下步骤进行:在蚕豆叶片下表皮均匀涂抹2 mmol·L-1的ASA,放入柜内,处理48 h后取样测定蚕豆叶片的气孔开度、导度和H2O2含量,以柜内0、48 h时未涂抹ASA的蚕豆叶片为对照。实验期间昼夜气温变化范围13~22 ℃,为避免土壤及其中的微生物吸收HCHO对实验结果造成影响,处理时将种植蚕豆的花盆从根基部到盆底用PVC膜封扎。 1.2 气孔开度和导度测定
处理后取柜外和柜内植株顶部往下第2片复叶上的叶片,用镊子轻轻撕取下表皮于载玻片上,滴上一滴生理盐水,盖上盖玻片,将制好的载玻片置于光学显微镜(Nikon Eclipse E200)下观察,中倍镜下用测微尺测量气孔开度,每个叶片测量40个气孔,取平均值。选取活体植株同部位的叶片,用CI-340便携式光合作用测量仪(美国)进行气孔导度的测定。 1.3 叶片H2O2含量和抗氧化酶活性测定
称取0.5 g叶片,加1 mL预冷的丙酮匀浆,4 ℃、12 000 r·min-1离心15 min,取l mL上清液,加3 mL萃取剂(体积比CCl4∶CHCl3=3∶1)混匀,再加5 mL ddH2O,混匀,4000 r·min-1离心1 min,上层水相为H2O2待测液,H2O2含量采用二甲酚橙法测定[19],以μmol·g-1 FW表示。称取0.5 g叶片,加2.5 mL预冷的磷酸缓冲液(50 mmol·L-1 pH 7.4)匀浆,4 ℃、12 000 r·min-1离心15 min,上清液为酶提取液。过氧化氢酶(Catalase,CAT)活性测定参照陈家长等[20]的方法,以OD240每分钟减少0.1的酶量为一个酶活力单位(U);超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化物酶(Peroxidase,POD)活性测定参照卫麦霞等[21]的方法,SOD活性以抑制NBT光化还原的50%为一个U;POD活性以OD460每分钟增加0.01为一个U;抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)活性测定参照沈文庵等[22]的方法,以每分钟氧化1 μmol ASA的酶量为一个U.酶活性单位均以U·min-1·g-1 FW表示。 1.4 保卫细胞中H2O2的荧光显微定位观察
参考张小莉等[23]的方法加以改进。剪取顶部往下第二片复叶上生长状态好的叶片,用dd H2O洗净,撕取下表皮,用毛笔轻轻刷去叶肉细胞,在 Tris 缓冲液(10 mmol·L-1 Tris,50 mmol·L-1 KCl,pH 6.1)中培养5 min.探针孵育时,从Tris 缓冲液中取出表皮条,放入装有1 mL 探针负载缓冲液(10 mmol·L-1 Tris,50 mmol·L-1 KCl,pH 7.2)的EP管中,再加入1 mL终浓度为50 μmol·L-1 的H2DCFDA(2′,7′-二氯氢化荧光素乙二脂),混匀,室温避光孵育20 min.将负载H2DCFDA 的表皮条用新鲜负载缓冲液漂洗2次,以洗去细胞表层多余的探针,将表皮条放在滴加一滴负载缓冲液的载玻片上,加上盖玻片,置于荧光显微镜(Olympus CFM-400E)下观察和拍摄保卫细胞内绿色荧光的分布,激发波长420~485 nm,软件为Tsview7. 1.5 数据统计分析
所有生理生化指标测定均重复3次,用SPSS19.0对所得数据进行统计学分析,显着性差异用多重比较(Duncan)法检验。 2 结果与分析 2.1 HCHO处理下蚕豆叶片气孔开度、导度和H2O2含量的变化
分别在0、24、48、72 h对柜内和柜外蚕豆叶片的气孔开度、导度和H2O2含量进行测定。结果显示(图 1),柜外蚕豆叶片的气孔开度和导度在0 h时分别为1.82 μm和38.89 mmol·m-2·s-1,24 h时分别降至1.65 μm和29.82 mmol·m-2·s-1(P<0.05),0 h和24 h形成的差异是蚕豆从温室移到室内短时间内适应温湿度等环境条件细微变化引起的,此后气孔开度和导度不再改变(P>0.05).与0 h时比较,HCHO处理72 h时,柜内蚕豆叶片的开度和导度分别显着下降46.3%和77.5%,24~72 h内柜内叶片的开度和导度均比相同时间柜外叶片的低。可见,柜内空气中的HCHO对蚕豆叶片的气孔开度和导度有较强的抑制作用,而且这种抑制作用随HCHO胁迫时间延长而增强。
|
| 图 1 不同时间HCHO 处理下蚕豆叶片气孔开度、导度和H2O2含量的测定结果 Figure 1 Stomatal aperture,stomatal conductance and H2O2 content of Vicia faba leaves under HCHO stresses for different time |
对不同时间柜内和柜外蚕豆叶片的H2O2含量进行测定,结果显示(图 1),柜外蚕豆叶片H2O2含量在24 h内没有显着性差异,48 h与24 h相比,从1.46 μmol·g-1 FW升至1.60 μmol·g-1 FW,此后未见明显变化,说明在未受HCHO胁迫的环境中蚕豆叶片中H2O2含量随时间的延长增加速度比较平缓。这与正常生理状态下叶片中抗氧化酶系统的清除功能有关。与0 h时比较,柜内蚕豆经HCHO处理24 h和72 h时叶片H2O2含量分别显着增加28.4%和45.2%(P<0.05);处理24~72 h期间,柜内叶片H2O2含量均显着高于柜外蚕豆叶片。可见HCHO胁迫对蚕豆叶片有明显的过氧化损伤作用,暴露于HCHO的时间越长,叶片产生的H2O2越多。 2.2 HCHO处理下蚕豆保卫细胞中H2O2的荧光显微定位分析
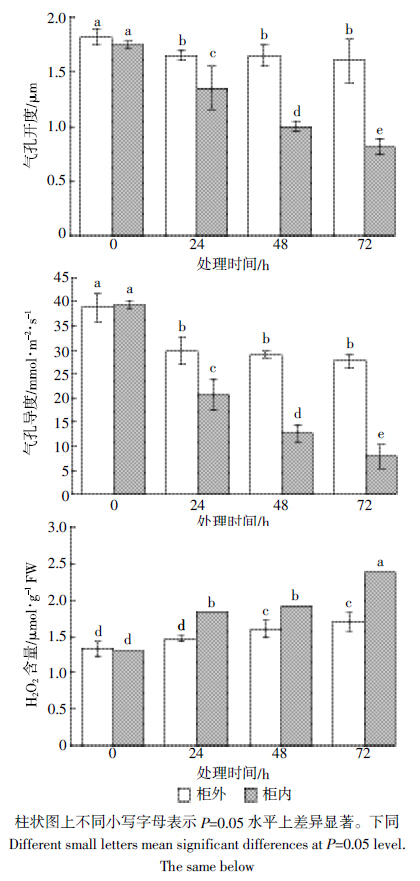
Cho等[24]、Lü等[25]和Tossi等[26]以H2DCFDA为荧光探针分别对拟南芥保卫细胞和水稻根中产生的H2O2进行原位显微分析,本研究通过H2DCFDA探针对蚕豆叶片H2O2进行显微定位检测。由图 2可见,蚕豆叶片的H2O2都定位于保卫细胞中(图 2a-图 2d、图 2i-图 2m);0 h时柜外和柜内叶片保卫细胞中的荧光很暗(图 2a、图 2i),说明正常生理状况下保卫细胞中积累的H2O2很少;24 h和48 h时柜内保卫细胞的胞质中荧光强度明显增强(图 2j、图 2k),说明HCHO处理初期H2O2累积于胞质中;72 h时柜外蚕豆保卫细胞中的荧光主要集中于胞质中(图 2d),柜内保卫细胞胞质和叶绿体中H2O2荧光强度都明显增强(图 2m),说明随着HCHO处理时间的延长,不仅保卫细胞胞质中积累的H2O2增多,积累H2O2的叶绿体数也显着增多。H2O2定位于保卫细胞揭示它对HCHO胁迫下蚕豆叶片的气孔运动可能具有一定的调节作用,柜内蚕豆叶片保卫细胞的荧光强度强于相同处理时间柜外的蚕豆叶片,说明柜内HCHO胁迫诱导蚕豆保卫细胞积累了更多的H2O2.
|
| 图 2 不同时间HCHO 处理下蚕豆保卫细胞H2O2荧光亚细胞定位检测 Figure 2 Fluorescence subcellular localization detection of H2O2 in Vicia faba guard cells under HCHO stresses for different times |
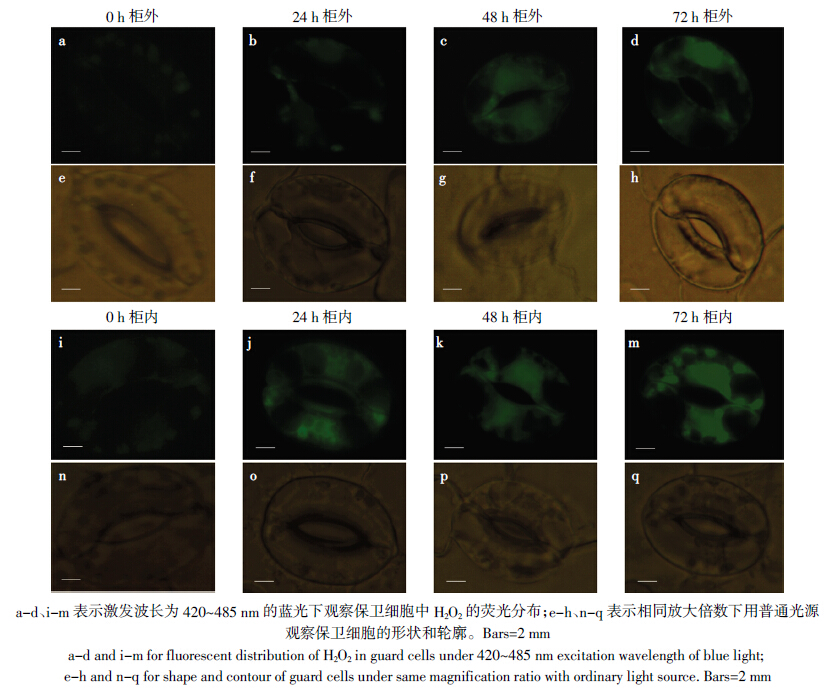
H2DCFDA探针对H2O2的特异性不强,图 2所显示的荧光可能与其他活性氧的产生和积累有关。为了进一步证实上述结果的正确性,在叶片上涂抹H2O2清除剂ASA,经HCHO处理后进行保卫细胞H2O2的荧光显微定位检测。ASA是植物体内重要的抗氧化化合物,涂抹的外源ASA可进入保卫细胞,在胞质APX催化下,ASA与H2O2反应,H2O2接受NADPH的电子得以还原成H2O,从而清除H2O2的毒性。由图 3可见,涂抹ASA叶片后保卫细胞胞质中荧光强度显着低于未涂抹ASA的叶片,证实HCHO胁迫导致蚕豆叶片保卫细胞中H2O2的积累。
|
| 图 3 涂抹ASA 对HCHO处理下蚕豆保卫细胞中H2O2的荧光亚细胞定位检测 Figure 3 Fluorescence subcellular localization detection of H2O2 in Vicia faba guard cells under HCHO stresses for different time by daubing ASA |
为了探讨HCHO胁迫下蚕豆叶片气孔开度和导度的下降是否与保卫细胞中H2O2的积累有关,对柜内不同处理时间蚕豆叶片H2O2含量和气孔开度与导度进行了相关性分析。通过相关系数r可知,不同时间HCHO处理下积累的H2O2与气孔开度的r值为-0.65~-0.63,呈中度负相关(P<0.05),与气孔导度的r值为-0.90~-0.79,呈高度负相关(P<0.01).这说明因HCHO胁迫引起的气孔开度和导度下降与H2O2积累有密切相关性。为了证实气体HCHO持续处理下保卫细胞中H2O2积累是影响蚕豆叶片气孔开度和导度的主要因子,对涂抹ASA后经HCHO处理的蚕豆叶片进行了气孔开度、导度和H2O2含量的测定。结果显示(图 4),涂抹了ASA的叶片与未涂抹ASA的叶片相比,H2O2含量从1.92 μmol·g-1 FW显着降至1.45 μmol·g-1 FW,气孔导度和开度则显着高于未涂抹ASA的叶片,分别上升21.7%和6%.对涂抹ASA后柜内蚕豆叶片H2O2含量与气孔开度和导度进行相关性分析,发现H2O2含量下降与开度的上升呈中度相关(r=-0.76,P<0.05),与导度的上升呈高度相关(r=-0.97,P<0.01),可见HCHO胁迫下引起的H2O2积累导致了气孔开度和导度的降低。
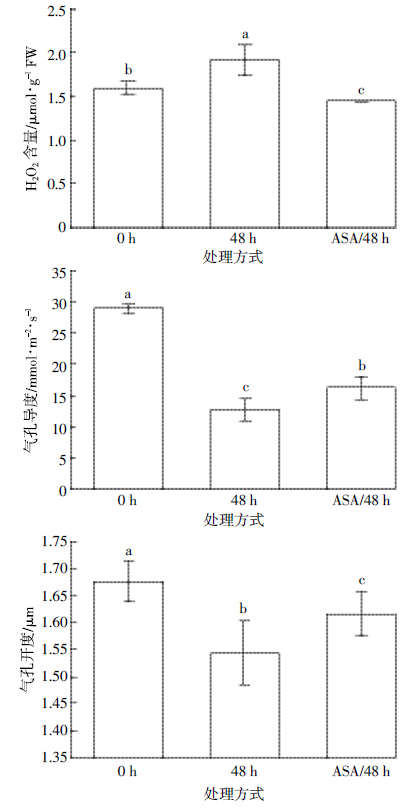
|
| 图 4 涂抹ASA 后HCHO 处理48 h 时蚕豆叶片H2O2含量和气孔开度、导度测定结果 Figure 4 H2O2 content,stomatal aperture and conductance of Vicia faba leaves under HCHO stresses for 48 h after daubing ASA |
为了探讨HCHO胁迫引起蚕豆叶片细胞内H2O2含量升高的原因,分别在0、24、48、72 h对柜内和柜外蚕豆叶片的CAT、SOD、POD和APX活性进行了测定。结果显示(图 5),与0 h的柜内蚕豆叶片相比,HCHO处理24 h时柜内叶片CAT、SOD、POD和APX的活性均显着升高,分别上升7.22%、3.20%、14.77%和6.72%,说明短时间的HCHO胁迫诱导蚕豆叶片抗氧化防御机制应激性加强;此后随着时间延长,柜内叶片 CAT和APX活性一直下降,从24 h到72 h分别降低22.66%和12.85%;POD活性先上升7.64%后又降低27.07%;SOD活性开始没有发生明显变化,72 h 时从284.52 U·min-1·g-1 FW显着升至291.44 U·min-1·g-1 FW.在HCHO处理24~72 h期间,将相同时间的柜内叶片和柜外比较,24 h和48 h时柜内叶片的四种酶活性均比柜外高,72 h 时SOD活性比柜外高,但CAT、POD和APX活性比柜外低。这说明HCHO处理72 h对蚕豆叶片的这三种酶活性起到了强烈抑制作用。由上述结果可知,HCHO胁迫诱导了SOD活性,对CAT、POD、APX活性是先诱导后抑制。
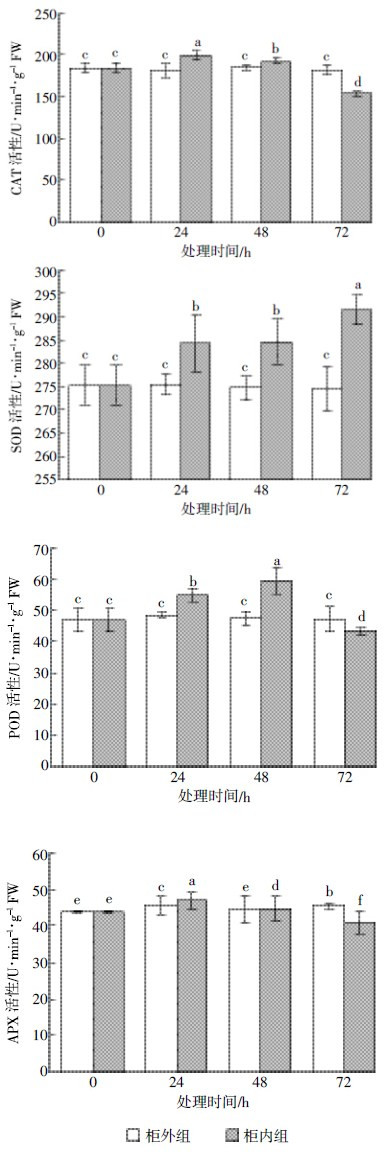
|
| 图 5 不同时间HCHO 处理下蚕豆叶片CAT、SOD、POD、APX 活性的测定结果 Figure 5 Activities of CAT, SOD, POD and APX in Vicia faba leaves under HCHO stresses for different time |
本研究结果显示,HCHO处理初期CAT、POD和APX活性上升,随着处理时间延长却呈下降趋势(图 5),可见蚕豆叶片在HCHO处理初期即表现出氧化损伤效应,这种效应在短时间内启动了蚕豆体内清除H2O2的抗氧化酶防御机制,但随着处理时间的延长,HCHO胁迫抑制了蚕豆体内CAT、POD和APX的活性,SOD活性却稳定上升。HCHO胁迫下四种酶活性的变化与前人的研究结果不同[27, 28],这种变化使得蚕豆叶片中H2O2不能及时转化,导致H2O2的积累。
对于不同时间HCHO处理下H2O2在保卫细胞中的定位,短时间(48 h内)的HCHO胁迫造成H2O2先在胞质中积累,与以下原因有关:胞质中分布有Cu/Zn-SOD,SOD活性的升高使胞质中活性氧转化成了H2O2;H2O2具有较高的跨膜通透性[29],由过氧化物酶体乙醇酸氧化、线粒体呼吸电子传递链、乙醛酸循环体脂肪酸β-氧化、叶绿体光化学反应等途径产生的H2O2可以穿膜而进入胞质[30];质膜上的氧化还原酶系统是产生H2O2的重要部位,位于质膜外侧的SOD、POD、NADPH氧化酶及多胺氧化酶、质膜上还原型的电子载体等途径产生的H2O2也都能进入胞质[16].HCHO处理72 h导致保卫细胞积累H2O2的叶绿体数量增多,主要是因为高等植物叶绿体PSⅠ假环式电子传递链的受体端存在NADPH氧化酶等,可通过位于类囊体膜上的铁氧还蛋白、黄素、喋啶和二酚等还原型组分将单电子传递给基态氧分子,从而形成超氧阴离子自由基(Superoxide anion free radical,O2·),O2·经SOD催化歧化生成H2O2[31, 32, 33],叶绿体中清除H2O2的关键酶是APX,但HCHO处理72 h后叶片中APX活性被显着抑制。
前人研究发现,盐胁迫可使植物体内H2O2含量增加[34],盐胁迫下蚕豆叶片中的H2O2积累伴随着气孔的关闭反应[35].韦立秀等[14]分别用2.85、5.49 mg·m-3的HCHO处理2种蚕豆24、48 h,发现2种蚕豆叶片的气孔开度均随HCHO浓度的增加和胁迫时间的延长而变小,但没有分析气孔开度的影响机制。该研究发现,0.46~0.72 mg·m-3的HCHO胁迫诱导的保卫细胞H2O2积累抑制了气孔的开度和导度,涂抹ASA的实验表明,由于ASA的清除作用使保卫细胞中H2O2含量减少,气孔开度和导度即随之回升,相关系数分析也显示H2O2含量积累和气孔开度与导度的下降具有高度相关性。这进一步证实空气中HCHO污染引起的蚕豆保卫细胞H2O2积累在气孔开放信号转导过程中对气孔开度和导度的调节起到关键作用。H2O2积累对气孔开度和导度的抑制使得植物吸收净化HCHO的能力减弱,应用植物净化室内空气HCHO污染应消除这种抑制作用。 4 结论
(1)HCHO持续胁迫显着增强了蚕豆叶片中SOD活性,CAT、POD、APX三种抗氧化酶活性先升高后下降,使得叶片中的H2O2不能迅速被清除,从而导致蚕豆叶片中H2O2的积累增加。
(2)在0.46~0.72 mg·m-3的HCHO处理下,短时间内蚕豆叶片细胞中产生的H2O2主要积累在保卫细胞的胞质中,处理时间延长到72 h,H2O2不仅分布于胞质,积累H2O2的叶绿体数量也增多。
(3)HCHO胁迫使蚕豆叶片保卫细胞中H2O2大量积累是导致蚕豆气孔导度和开度下降的主要原因。
| [1] | 王文超, 周仕学, 姜瑶瑶, 等. 室内甲醛污染治理技术的研究进展[J]. 环境科学与技术, 2006, 29(9):106-108. WANG Wen-chao, ZHOU Shi-xuan, JINAG Yao-yao, et al. Progress on indoor formaldehyde removal[J]. Environmental Science and Technology, 2006, 29(9):106-108. |
| [2] | 徐晓琴, 刘文君. 浅议室内环境空气污染现状及防治对策[J]. 甘肃科技, 2014, 30(7):48-49. XU Xiao-qin, LIU Wen-jun. Status and countermeasures of indoor environment air pollution[J]. Gansu Science and Technology, 2014, 30(7):48-49. |
| [3] | Xu Z, Wang L, Hou H. Formaldehyde removal by potted plant soil systems[J]. Journal of Hazardous Materials, 2011, 192(1):314-318. |
| [4] | Zhou J, Yue B, Chen S, et al. Response of marantaceae and pteridophytes potted plants for purification of formaldehyde polluted air[J]. African Journal of Agricultural, 2013, 8(47):6027-6033. |
| [5] | Van K P, Van N B, Hao N T B. Study on gaseous formaldehyde removal capability of some native plant species in Vietnam[J]. Pharmaceutical Research, 2013, 4(1):1-7. |
| [6] | Aydogan A, Montoya L D. Formaldehyde removal by common indoor plant species and various growing media[J]. Atmospheric Environment, 2011, 45(16):2675-2682. |
| [7] | Zhang W, Tang L, Sun H, et al. C1 metabolism plays an important role during formaldehyde metabolism and detoxification in Petunia under liquid HCHO stress[J]. Plant Physiology and Biochemistry, 2014, 83:327-336. |
| [8] | Zeng Z, Qi C J, Chen Q, et al. Absorption and metabolism of formaldehyde in solutions by detached banana leaves[J]. Journal of Bioscience and Bioengineering, 2014, 117(5):602-612. |
| [9] | Song Z B, Xiao S Q, You L, et al. C1 metabolism and the calvin cycle function simultaneously and independently during HCHO metabolism and detoxification in Arabidopsis thaliana treated with HCHO solutions plant[J]. Cell and Environment, 2013, 36(8):1490-1506. |
| [10] | 高春娟, 夏晓剑, 师 恺, 等. 植物气孔对全球环境变化的响应及其调控防御机制[J]. 植物生理学报, 2012, 48(1):19-28. GAO Chun-juan, XIA Xiao-jian, SHI Kai, et al. Response of stomata to global climate changes and the underlying regulation mechanism of stress responses[J]. Plant Physiology Journal, 2012, 48(1):19-28. |
| [11] | 郝辉芳, 冀瑞萍. 3种室内观赏植物对甲醛污染的响应[J]. 山西农业科学, 2010, 38(8):30-32. HAO Hui-fang, JI Rui-ping. Response of three indoor ornamentals to formaldehyde pollution[J]. Journal of Shanxi Agricultural Sciences, 2010, 38(8):30-32. |
| [12] | 肖素勤. 安装DAS/DAK甲醛光合同化途径转基因植物的甲醛代谢机理及生理特性研究[D]. 昆明:昆明理工大学, 2012:25-35. XIAO Su-qin. The effects of the installation of DAS/DAK photosynthetic formaldehyde-assimilation pathway on the metabolic mechanisms and physiological characteristics of transgenic plants[D]. Kunming: Kunming University of Science and Technology, 2012:25-35. |
| [13] | 轩秀霞, 肖素琴, 游 览, 等. 常春藤代谢气体甲醛中间产物及甲醛胁迫下叶片相关生理特性变化分析[J]. 生命科学研究, 2013, 17(2):125-135. XUAN Xiu-xia, XIAO Su-qin, YOU Lan, et al. The analysis of the intermediates for formaldehyde metabolism and physiological changes under gaseous formaldehyde stress in Hedera helix[J]. Life Science Research, 2013, 17(2):125-135. |
| [14] | 韦立秀, 朱 麟, 杨振德, 等. 蚕豆叶片气孔对甲醛污染的反应研究[J]. 安徽农业科学, 2008, 36(18):7570-7571. WEI Li-xiu, ZHU Lin, YANG Zhen-de, et al. Study on Vicia faba stomata reaction to indoor formaldehyde pollution[J]. Journal of Anhui Agricultural Sciences, 2008, 36(18):7570 -7571. |
| [15] | 程艳丽, 宋纯鹏. 植物细胞 H2O2 的信号转导途径[J]. 中国科学 C辑, 2005, 35(6):480-489. CHENG Yan-li, SONG Chun-peng. Signal transduction of H2O2 in plant cell[J]. China Science(C Life Science), 2005, 35(6):480-489. |
| [16] | 安国勇, 宋纯鹏, 张 骁, 等. 过氧化氢对蚕豆气孔运动和质膜 K+通道的影响[J]. 植物生理学报, 2000, 26(5):458-464. AN Guo-yong, SONG Chun-peng, ZHANG Xiao, et al. Effect of peroxide generation on stomatal movement and K+ channel on plasma membrane in Vicia faba guard cell[J]. Acta Phytophysiologica Sinica, 2000, 26(5):458-464. |
| [17] | Arve L E, Carvalho D R A, Olsen J E, et al. ABA induces H2O2 production in guard cells, but does not close the stomata on Vicia faba leaves developed at high air humidity[J]. Plant Signaling & Behavior, 2014, 9(7):e29192. |
| [18] | 李惠民, 张 莹, 贺军民. UV-B对拟南芥叶片不同来源H2O2的活化和气孔关闭的诱导[J]. 西北植物学报, 2013, 33(5):911-921. LI Hui-min, ZHANG Ying, HE Jun-min. UV-B activates different sources of H2O2 and induces stomatal closure in Arabidopsis thaliana leaves[J]. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(5):911-921. |
| [19] | Gay C A, Gebicki J M. Measurement of protein and lipid hydroperoxides in biological systems by the ferric-xylenol orange method[J]. Anal Biochem, 2003, 315(1):29-35. |
| [20] | 陈家长, 孟顺龙, 胡庚东, 等. 低浓度阿特拉津对鲫鱼过氧化氢酶(CAT)活性的影响[J]. 农业环境科学学报, 2008, 27(3):1151-1156. CHEN Jia-zhang, MENG Shun-long, HU Geng-dong, et al. Effects of low concentration of atrazine on catalase activity in Carassius auratus[J]. Journal of Agro-Environment Science, 2008, 27(3):1151-1156. |
| [21] | 卫麦霞, 龚道新, 黎定军, 等. 咪鲜胺及其制剂和主要代谢物对三叶浮萍 SOD 和 POD 活性的影响[J]. 农业环境科学学报, 2008, 27(3):1072-1076. WEI Mai-xia, GONG Dao-xin, LI Ding-jun, et al. Effect of prochloraz, its formulation and major metabolites on the activies of SOD and POD in Lemna paucicostata[J]. Journal of Agro-Environment Science, 2008, 27(3):1072-1076. |
| [22] | 沈文庵, 徐朗莱, 叶茂炳, 等. 抗坏血酸过氧化物酶活性测定的探讨[J]. 植物生理学通讯, 1996, 32(3):203-205. SHEN Wen-an, XU Lang-lai, YE Mao-bing, et al. Study on determination of ASP activity[J]. Plant Physiology Communications, 1996, 32(3):203-205. |
| [23] | 张小莉, 王鹏程, 宋纯鹏. 植物细胞过氧化氢的测定方法[J]. 植物学报, 2009, 44(1):103-106. ZHANG Xiao-li, WANG Peng-cheng, SONG Chun-peng. Methods of detecting hydrogen peroxide in plant cells[J]. Chinese Bulletin of Botany, 2009, 44(1):103-106. |
| [24] | Cho S C, Chao Y Y, Hong C Y, et al. The role of hydrogen peroxide in cadmium-inhibited root growth of rice seedlings[J]. Plant Growth Regulation, 2012, 6(1):27-35. |
| [25] | Lü D, Wang W, Miao C. ATHK1 acts downstream of hydrogen peroxide to mediate ABA signaling through regulation of calcium channel activity in Arabidopsis guard cells[J]. Chinese Science Bulletin, 2013, 58(3):336-343. |
| [26] | Tossi V E, Lamattina L, Jenkins G, et al. UV-B-induced stomatal xlosure in Arabidopsis is regulated by the UVR8 photoreceptor in an no-dependent mechanism[J]. Plant Physiology, 2014, 164(4):2220-2230. |
| [27] | 安 雪, 李 霞, 潘会堂, 等. 16种室内观赏植物对甲醛净化效果及生理生化变化[J]. 生态环境学报, 2010, 19(2):379-384. AN Xue, LI Xia, PAN Hui-tang, et al. The capacity of 16 ornamental plants on purifying indoor formaldehyde pollution and their physiological response to formaldehyde stress[J]. Ecology and Environmental Sciences, 2010, 19(2):379-384. |
| [28] | 韩晓弟. 气态甲醛染毒对吊兰生长的毒性作用[J]. 上海环境科学, 2010, 29(4):139-143. HAN Xiao-di. Toxicological effect of gaseous formaldehyde contamination on Chlorophytum comosum growth[J]. Shanghai Environmental Science, 2010, 29(4):139-143. |
| [29] | Hooijmaijers C, Rhee J Y, Kwak K J, et al. Hydrogen peroxide permeability of plasma membrane aquaporins of Arabidopsis thaliana[J]. Journal of Plant Research, 2012, 125(1):147-153. |
| [30] | Neill S J, Desikan R, Clarke A, et al. Hydrogen peroxide and nitric oxide as signalling molecules in plants[J]. Journal of Experimental Botany, 2002, 53(372):1237-1247. |
| [31] | Møller I M, Sweetlove L J. ROS signalling-specificity is required[J]. Trends in Plant Science, 2010, 15(7):370-374. |
| [32] | 孙骏威, 李素芳, 付贤树, 等. 低钾对水稻不同叶位叶片光合特性及抗氧化系统的影响[J]. 核农学报, 2007, 21(4):404-408. SUN Jun-wei, LI Su-fang, FU Xian-shu, et al. Effects of low potassium stress on photosynthetic characteristics and antioxidant systems in different position leaves of rice plants[J]. Journal of Nuclear Agricultural Sciences, 2007, 21(4):404-408. |
| [33] | 杜秀敏, 殷文璇, 赵彦修, 等. 植物中活性氧的产生及清除机制[J]. 生物工程学报, 2001, 17(2):121-125. DU Xiu-min, YIN Wen-xuan, ZHAO Yan-xiu, et al. The production and scavenging of reactive oxygen species in plants[J]. Chinese Journal of Biotechnology, 2001, 17(2):121-125. |
| [34] | Agarwal S, Pandey V. Antioxidant enzyme responses to NaCl stress in Cassia angustifolia[J]. Biologia Plantarum, 2004, 48(4):555-560. |
| [35] | 安国勇, 李保珠, 武桂丽, 等. H2O2作为根源信号介导盐胁迫诱导的蚕豆气孔关闭反应[J]. 植物生理学报, 2012, 48(3):265-271. AN Guo-yong, LI Bao-zhu, WU Gui-li, et al. H2O2 could act as root source signal to mediate stomatal closure induced by salt stress of Vicia faba L.[J]. Plant Physiology Journal, 2012, 48(3):265-271. |
 2015, Vol. 34
2015, Vol. 34