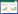文章信息
- 王志刚, 胡影, 徐伟慧, 莫继先, 李珊珊, 张志, 杨志宏
- WANG Zhi-gang, HU Ying, XU Wei-hui, MO Ji-xian, LI Shan-shan, ZHANG Zhi, YANG Zhi-hong
- 邻苯二甲酸二甲酯污染对黑土土壤呼吸和土壤酶活性的影响
- Impacts of Dimethyl Phthalate Contamination on Respiratory Rates and Enzyme Activities in Black Soil
- 农业环境科学学报, 2015, 34(7): 1311-1316
- Journal of Agro-Environment Science, 2015, 34(7): 1311-1316
- http://dx.doi.org/10.11654/jaes.2015.07.012
-
文章历史
- 收稿日期:2015-01-20
2. 哈尔滨工业大学市政环境工程学院, 哈尔滨 150001
2. Institute of Municipal Environment and Engineering, Harbin Industry University, Harbin 150001, China
邻苯二甲酸二甲酯(Dimethyl phthalate,DMP)是酞酸酯类污染物之一,主要用作塑料产品的成型剂,目前在全世界的工业领域大量使用[1],其与塑料是非共价键结合,很容易进入生态环境中[2],因此DMP已经成为遍及全世界的重要人为合成有机污染物质之一[3].DMP具有致突变、致畸和致癌的特点,美国环保署(USEPA)和我国环保部均把其列为优先控制污染物[4].DMP可以通过灌溉和农药与农膜的使用进入土壤环境中,已经成为在土壤中检出率较高的重要环境污染物[5, 6].
我国黑土(Mollisols)主要分布于东北部,是世界上仅有的三大黑土区之一[7].该区域农业发达,作物总产量占全国的14%,其中大豆产量占全国的40%,在保障我国粮食安全方面具有极其重要的作用[8],但是土壤退化也是该区域面临的最严重的环境问题之一,直接威胁着土壤生产力[9].最新的研究结果表明,部分黑土中的酞酸酯类污染物含量达4.90 mg·kg-1,而且DMP检出率高,含量远超过美国环保署设定的安全标准[10].
微生物和酶是土壤生物化学过程的最重要驱动者[11],对土壤环境的变化非常敏感,可以用来评价污染过程中土壤质量的变化[12, 13].本研究通过微宇宙实验设计,研究DMP污染过程中黑土中微生物呼吸和土壤酶活性的变化,阐释DMP污染对黑土质量的影响,以期为黑土保护和DMP生态毒理效应的揭示提供科学依据。 1 材料与方法 1.1 试验地点与实验土壤制备
本试验始于2013年10月20日,在东北农业大学园艺站(哈尔滨市)的温室中进行。实验土壤取自哈尔滨香坊农场(45°41′N,126°45′E)大豆田的表层土壤(0~20 cm),在土壤中未检测到DMP残留。土壤充分混均后过2 mm筛,去除植物残体和石块。土壤基本性质如表 1所示。
DMP(纯度>99.9%)购于中国标准物质标准样品信息中心,采用丙酮作为助溶剂,制备成1000 mg·L-1的DMP储备液,于4℃冰箱内避光保存备用。
每个土壤样品称取650 g置于 1 L(12.2 cm×12 cm)陶瓷花盆中,调整实验土壤湿度到田间最大持水量的80%,在25℃的黑暗培养箱中预培养7 d,以期活化并稳定土壤微生物活性,然后用DMP储备液在陶瓷盆中调整土壤DMP浓度,用丙酮调整各个处理投加的丙酮量保持一致,从而消除各个处理由于添加不同量储备液而引起的系统误差,然后在空气中放置3 h,目的是使助溶剂丙酮挥发,尽量减少丙酮对土壤的影响。试验共计5个处理,分别为对照(CK)0 mg·kg-1,DMP1处理5 mg·kg-1,DMP2处理10 mg·kg-1,DMP3处理20 mg·kg-1,DMP4处理40 mg·kg-1.对照处理(CK)添加了等量的丙酮。每个处理3次重复,置于培养箱内培养。在实验期间,用恒重法保持土壤含水量30%,温度为25± 2℃,培养箱内相对湿度为70%±5%.
土壤微生物量碳(MBC)采用氯仿熏蒸0.5 mol·L-1 K2SO4溶液浸提法测定[14],土壤微生物呼吸速率用每小时呼出的CO2量表示(mg CO2·kg-1·h-1)[15],代谢熵用每毫克微生物量碳的基础呼吸率表示(mg CO2·kg-1 MBC·d-1),土壤呼吸用碱液吸收滴定法测定[16].
脲酶活性测定采用苯酚-次氯酸钠比色法,以 37℃、24 h 后1 g 土壤生成的NH3-N 质量(μg)表征,单位为μg·g-1·h-1(以NH3-N 计)[17];土壤过氧化氢酶活性的测定采用KMnO4滴定法,结果以20 min后1 g土壤消耗 0.05 mol·L-1 KMnO4的毫升数来表示[17];多酚氧化酶采用邻苯三酚比色法[17];土壤转化酶采用3,5-二硝基水杨酸比色法测定[17];蛋白酶活性测定用酪蛋白酸钠分析方法,以 50℃、2 h,5 g 土壤生成的酪氨酸质量(μg)表征,单位为μg·g-1·h-1(以酪氨酸计)[18].为了消除土壤和试剂的误差,每一土样均设无基质和无土壤对照,3次重复。 1.3 数据处理
采用Sigma Plot 12.5进行方差分析并作图,采用Canoco for Windows 4.5进行典型对应性分析(CCA). 2 结果分析 2.1 DMP污染对黑土微生物呼吸的影响
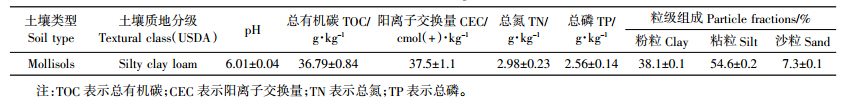
土壤呼吸是衡量土壤微生物活性或评价土壤肥力的重要指标,通过图 1a可知,5 mg·kg-1的DMP污染处理在培养的前7 d黑土土壤呼吸速率显着(P < 0.05)高于对照(CK),7 d后与对照的差异不显着;较高浓度的DMP处理(10、20、40 mg·kg-1),在10 d内显着(P < 0.05)抑制了黑土土壤呼吸速率,且抑制程度呈随污染浓度增加而增强的趋势。微生物代谢熵是微生物基础呼吸强度与微生物生物量碳的比值,DMP污染也改变了黑土微生物的代谢熵(图 1b),较低浓度(5 mg·kg-1)的DMP污染处理,在培养的前6 d黑土微生物代谢熵显着(P < 0.05)高于对照(CK),6 d后与对照之间的差异不显着;较高浓度的DMP处理(10、20、40 mg·kg-1),在10 d内显着(P < 0.05)抑制了黑土微生物代谢熵,但各浓度处理间的差异不显着。
|
| 图 1 DMP 污染对黑土微生物呼吸速率(a)和代谢熵(b)的影响 Figure 1 Effects of DMP contamination on soil respiratory rates (a)and microbial metabolic quotients (b) |
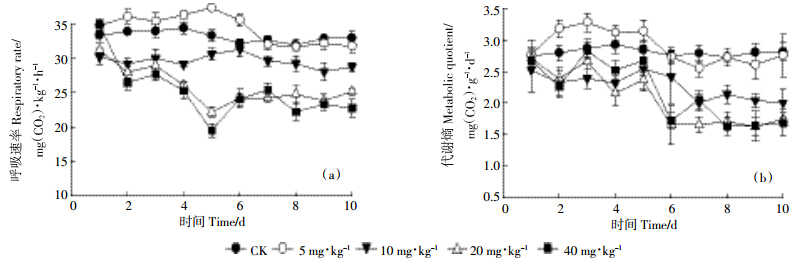
黑土酶活性在DMP污染过程中的动态变化见图 2.黑土过氧化氢酶受到DMP污染的显着(P < 0.05)抑制(图 2a),且抑制程度与DMP处理浓度显着相关(r2=0.85);在处理5 d时,低浓度DMP(5 mg·kg-1)对黑土多酚氧化酶有促进作用,且差异极其显着(P < 0.01),5 d后与对照无明显差异,较高浓度DMP处理(10、20、40 mg·kg-1)在培养5 d时均呈现抑制效应,10 d后多酚氧化酶活性呈现激活效应,且有与处理浓度正相关的趋势,但是差异不显着(图 2b);在DMP污染过程中黑土转化酶和脲酶均呈现相似的激活效应(图 2c和图 2e),随着培养时间的增加激活效应逐渐增强,但在15 d后激活效应逐渐下降,这两种酶的激活效应均与DMP浓度正相关(r2=0.77和r2=0.79);在处理5 d时,DMP(5 mg·kg-1)处理对黑土蛋白酶有促进作用(图 2d),且差异极显着(P < 0.01),但在处理15 d后低浓度DMP处理(5、10 mg·kg-1)黑土蛋白酶活性与对照无明显差异,而较高浓度DMP处理(20、40 mg·kg-1)中,黑土蛋白酶活性显着低于对照(P < 0.01).
|
| 图 2 DMP 污染对黑土酶活性的影响 Figure 2 Effects of DMP contamination on enzyme activities in black soil |
对应性分析(Correspondence analysis)又称R-Q分析,本试验设定DMP污染浓度、呼吸特征和微生物碳作为土壤样本的Q因子,各种黑土酶活性为土壤样本的R因子,分析各因子与污染处理后的土壤特征的对应关系。分析结果表明,主成分1(92.9%)和主成分2(4.0%)可以代表群体特征的96.9%(图 3).通过对应关系的解析图谱可以看出,DMP污染处理导致黑土特征发生了明显的改变,且随着处理浓度的提升在二维图谱中主成分1轴上距离越来越大,说明DMP污染导致黑土特征发生了显着改变;对土壤特征影响的作用大小排序为DMP>呼吸速率>MBC>代谢熵,说明DMP污染是黑土酶活性特征改变的主要原因之一。
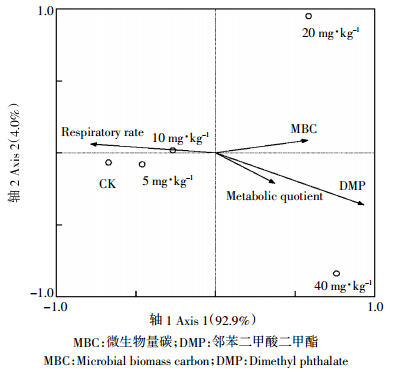
|
| 图 3 DMP 污染与黑土酶活特性的对应性分析 Figure 3 Canonical correspondence analysis of DMP contamination and enzyme activities in black soil |
由于土壤微生物特征和酶活性与土壤生态系统功能之间存在着较好的相关性[19, 20],土壤呼吸速率和酶活性等参数基本能反映土壤微生物活性的整体状况[21, 22],从而预测土壤生态系统功能变化趋势。土壤呼吸速率可作为土壤生物活性和土壤肥力乃至透气性的指标,并且指示着土壤生态系统演替的过程与方向[23].微生物熵可以充分反映土壤中活性有机碳所占的比例,由于土壤微生物量碳周转快,微生物熵值越大,土壤有机碳周转越快,并且将微生物生物量与微生物活性及功能联系起来[24],可以作为微生物胁迫指标之一。本试验中,DMP污染处理后黑土微生物呼吸速率和微生物代谢熵均表现为低浓度促进高浓度抑制,且抑制效应与DMP污染浓度正相关(图 1).这一研究结果与郭杨等在水稻土上的研究结果不一致[25],导致这种差异的原因可能与黑土中较高的有机质含量(>3.0%)有关。也有研究表明,DMP污染会导致土壤微生物群落改变[26],而且酞酸酯类有机物会在微生物细胞质膜上积累,降低质膜的流动性[27].因此,在DMP污染过程中,黑土微生物群落变化和质膜损伤是导致呼吸速率和代谢熵改变的重要原因。
土壤酶主要来源于土壤微生物[28],污染物进入土壤会引起土壤中各微生物种群活细胞数量及组成结构的变化,导致土壤中的微生物在生理代谢方面作出响应[29],最终影响到土壤酶活性。本研究发现,DMP污染对黑土过氧化氢酶具有抑制效应,对黑土转化酶和脲酶呈现为激活效应,且与污染浓度正相关;DMP污染对黑土多酚氧化酶和蛋白酶的影响呈现对时间波动的变化趋势,多酚氧化酶是先抑制后促进,蛋白表现为先促进后抑制(图 2).该结果与张建等在其他类型土壤上的研究结果不尽一致[30, 31],可能与土壤类型的不同有关,因为较高的有机质含量会赋予黑土许多特殊的性质[7, 9].土壤酶对土壤系统的物质转换和能量转换起着非常重要的作用,过氧化氢酶、多酚氧化酶和转换酶活性可以反映土壤有机碳素的转化速率,蛋白酶和脲酶可以反映土壤中有效氮素的代谢水平,均是衡量土壤肥力及土壤微生物总活性的重要指标[32, 33],且通过对应分析二维图谱(图 3)可以看出,DMP是影响黑土酶学性质改变的主要因素。因此,可以推断DMP污染有可能改变了黑土的碳素和氮素代谢功能。 4 结论
本研究发现黑土微生物呼吸速率和微生物代谢熵受低浓度DMP促进、高浓度DMP抑制,且抑制效应随DMP污染浓度增加而增大;DMP污染对黑土过氧化氢酶具有抑制效应,对黑土转化酶和脲酶呈现为激活效应,且与污染浓度正相关;DMP污染对黑土多酚氧化酶和蛋白酶的影响呈现对时间波动的变化趋势,且DMP是影响黑土酶学性质改变的主要因素。因此,DMP污染改变了黑土土壤呼吸和酶活性的代谢特征,影响了黑土的生态系统功能,进而有可能威胁到黑土肥力和粮食生产。
致谢:Kui Chen教授在论文写作过程中提供了宝贵意见,谨致谢忱。
| [1] | Boonnorat J, Chiemchaisri C, Chiemchaisri W, et al. Removals of phenolic compounds and phthalic acid esters in landfill leachate by microbial sludge of two-stage membrane bioreactor[J]. Journal of Hazardous Materials, 2014, 277(7):93-101. |
| [2] | Souza F L, Aquino J M, Irikura K, et al. Electrochemical degradation of the dimethyl phthalate ester on a fluoride-doped Ti/β-PbO2 anode[J]. Chemosphere, 2014, 109(8):187-194. |
| [3] | Latini G. Monitoring phthalate exposure in humans[J]. Clinica Chimica Acta, 2005, 361(1-2):20-29. |
| [4] | Jin D C, Kong X, Cui B J, et al. Biodegradation of di-n-butyl phthalate by a newly isolated Halotolerant Sphingobium sp.[J]. International Journal of Molecular Sciences, 2013, 14(12):24046-24054. |
| [5] | Bauer M J, Herrmann R. Estimation of the environmental contamination by phthalic acid esters leaching from household wastes[J]. Science of the Total Environment, 1997, 208(1-2):49-57. |
| [6] | Erythropel H C, Maric M, Cooper D G. Designing green plasticizers:Influence of molecular geometry on biodegradation and plasticization properties[J]. Chemosphere, 2012, 86(8):759-766. |
| [7] | Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of Northeast China[J]. Soil Biology & Biochemistry, 2014, 70(3):113-122. |
| [8] | Xu X Z, Xu Y, Chen S C, et al. Soil loss and conservation in the black soil region of Northeast China:A retrospective study[J]. Environmental Science & Policy, 2010, 13(8):793-800. |
| [9] | Tang W J, Liu H H, Liu B Y. Effects of gully erosion and gully filling on soil degradation in the black soil region of Northeast China[J]. Journal of Mountain Science, 2013, 10(5):913-922. |
| [10] | Zhang Y, Wang P J, Wang L, et al. The influence of facility agriculture production on phthalate esters distribution in black soils of northeast China[J]. Science of the Total Environment, 2015, 506-507(2):118-125. |
| [11] | Blagodatskaya E, Kuzyakov Y. Active microorganisms in soil:Critical review of estimation criteria and approaches[J]. Soil Biology & Biochemistry, 2013, 67(12):192-211. |
| [12] | Jusselme M D, Miambi E, Mora P, et al. Increased lead availability and enzyme activities in root-adhering soil of Lantana camara during phytoextraction in the presence of earthworms[J]. Science of the Total Environment, 2013, 445-446(2):101-109. |
| [13] | Yang W H, Zhang T X, Li S L, et al. Metal removal from and microbial property improvement of a multiple heavy metals contaminated soil by phytoextraction with a cadmium hyper accumulator Sedum alfredii H[J]. Journal of Soils and Sediments, 2014, 14(8):1385-1396. |
| [14] | Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology & Biochemistry, 1987, 19(6):703-707. |
| [15] | Hu S, Van Bruggen A H C. Microbial dynamics associated with multiphasic decomposition of 14C-Labeled cellulose in soil[J]. Microbial Ecology, 1997, 33(2):134-143. |
| [16] | Gil-Sotres F, Trasar-Cepeda C, Leirós M C, et al. Different approaches to evaluating soil quality using biochemical properties[J]. Soil Biology & Biochemistry, 2005, 37(5):877-887. |
| [17] | 关松荫. 土壤酶及其研究法[M]. 北京:农业出版社, 1986. GUAN Song-yin. Soil enzymes and research methods[M]. Beijing:Agriculture Press, 1986. |
| [18] | 周礼恺, 张志明. 土壤酶的测定方法[J]. 土壤通报, 1980, 11(5):37-38. ZHOU Li-kai, ZHANG Zhi-ming. Research methods of soil enzyme[J]. Chinese Journal of Soil Science, 1980, 11(5):37-38. |
| [19] | Allison S D. A trait-based approach for modeling microbial litter decomposition[J]. Ecology Letter, 2012, 15(9):1058-1070. |
| [20] | Graham E B, Wieder W R, Leff J W, et al. Do we need to understand microbial communities to predict ecosystem function? A comparison of statistical models of nitrogen cycling processes[J]. Soil Biology & Biochemistry, 2014, 68(1):279-282. |
| [21] | Hungria M, Franchini J C, Brand-Junior O, et al. Soil microbial activity and crop sustainability in a long-term experiment with three soil-tillage and two crop-rotation systems[J]. Applied Soil Ecology, 2009, 42(3):288-296. |
| [22] | Manna S, Singh N, Singh V P. Effect of elevated CO2 on degradation of azoxystrobin and soil microbial activity in rice soil[J]. Environmental Monitoring and Assessment, 2013, 185(4):1-10. |
| [23] | 赵 吉. 土壤健康的生物学监测与评价[J]. 土壤, 2006, 38(2):136-142. ZHAO Ji. Biological monitoring and assessment of soil health[J]. Soils, 2006, 38(2):136-142. |
| [24] | Dilly O, Winter K, Lang A, et al. Energetic eco-physiology of the soil microbiota in two landscapes of southern and northern Germany[J]. Journal of Plant Nutrition and Soil Science, 2001, 164(4):407-413. |
| [25] | 郭 杨, 韩 蕊, 杜文婷, 等. 邻苯二甲酸酯复合污染对土壤微生态的影响[J]. 环境科学研究, 2010, 23(11):1410-1414. GUO Yang, HAN Rui, DU Wen-ting, et al. Effects of combined phthalate acid ester contamination on soil micro-ecology[J]. Research of Environmental Science, 2010, 23(11):1410-1414. |
| [26] | 谢慧君, 石义静, 滕少香, 等. 邻苯二甲酸酯对土壤微生物群落多样性的影响[J]. 环境科学, 2009, 30(5):12786-1291. XIE Hui-jun, SHI Yi-jing, TENG Shao-xiang, et al. Impact of phthalic acid easters on diversity of microbial community in soil[J]. Environmental Science, 2009, 30(5):1286-1291. |
| [27] | Cartwright C D, Thompson I P, Burns R G. Degradation and impact of phthalate plasticizers on soil microbial communities[J]. Environmental Toxicology and Chemistry, 2000, 19(5):1253-1261. |
| [28] | Singh J S, Raghubanshi A S, Singh R S, et al. Microbial biomass acts as a source of plan nutrients in dry tropical forest and savanna[J]. Nature, 1989, 338(4):499-500. |
| [29] | 朱 凡, 洪湘琦, 闫文德, 等. PAHs污染土壤植物修复对酶活性的影响[J]. 生态学报, 2014, 34(3):581-588. ZHU Fan, HONG Xiang-qi, YAN Wen-de, et al. Enzymatic activity during phytoremediation of polycyclic aromatic hydrocarbon impacted soil[J]. Acta Ecologica Sinica, 2014, 34(3):581-588. |
| [30] | Gao J. Dynamic effects of PAEs on soil urease and phosphatase[J]. Agricultural Science and Technology, 2010, 11(2):189-192. |
| [31] | 张 建, 石义静, 崔 寅, 等. 土壤中邻苯二甲酸酯类物质的降解及其对土壤酶活性的影响[J]. 环境科学, 2010, 31(12):356-361. ZHANG Jian, SHI Yi-jing, CUI Yan, et al. Degradation of phthalate esters in soil and the effects on soil enzyme activities[J]. Environmental Science, 2010, 31(12):356-361. |
| [32] | Schloter M, Dilly O, Munch J C. Indicators for evaluating soil quality[J]. Agriculture Ecosystems & Environment, 2003, 98(1-3):255-262. |
| [33] | Kaplan H, Ratering S, Hanauer T, et al. Impact of trace metal contamination and in situ remediation on microbial diversity and respiratory activity of heavily polluted Kastanozems[J]. Biology and Fertility of Soils, 2014, 50(5):735-744. |
 2015, Vol. 34
2015, Vol. 34