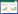文章信息
- 刘晓梅, 邹亚杰, 胡清秀, 杨小红, 沈德龙
- LIU Xiao-mei, ZOU Ya-jie, HU Qing-xiu, YANG Xiao-hong, SHEN De-long
- 菌渣纤维素降解菌的筛选与鉴定
- Screening and Identification of Cellulose-Degrading Bacteria from Spent Substrate of Edible Mushroom
- 农业环境科学学报, 2015, 34(7): 1384-1391
- Journal of Agro-Environment Science, 2015, 34(7): 1384-1391
- http://dx.doi.org/10.11654/jaes.2015.07.022
-
文章历史
- 收稿日期:2015-03-06
菌渣(Spent substrate)是食用菌栽培过程中收获产品剩下的培养基质废料[1],属于农业固体废弃物。然而如何对菌渣进行环保有效的处理,尚未得到很好的解决,大量的菌渣被随意堆放,造成环境污染和资源浪费[2],如何有效处理菌渣的问题已日益突出。菌渣中难以被利用的成分主要是粗纤维[3, 4, 5, 6],纤维素是制约菌渣降解的重要因素之一。目前对纤维素的处理方法主要有物理化学处理和生物降解两大类[7],物理化学方法,如酸处理、碱处理以及蒸汽加热等方法,存在反应条件剧烈、设备昂贵、成本高等问题[8],而利用添加纤维素高效降解菌的方法经济、有效[9, 10, 11],使其成为当前的研究热点。
近年来,国内外关于纤维素降解菌的报道很多,但大部分研究集中在对秸秆的降解上,对于菌渣降解的报道较少[2],特别是在利用有效微生物加快菌渣发酵腐熟方面的报道更少。本研究从微生物加快菌渣发酵腐化的角度出发,对不同地点堆放的杏鲍菇菌渣中的微生物进行分离培养,经过纤维素刚果红水解圈测定、滤纸条降解实验和纤维素酶活力测定,筛选出杏鲍菇菌渣中的高效降解纤维素菌株,并对菌株进行分类鉴定,以期为菌渣发酵腐熟提供优质菌种。
1 材料与方法 1.1 材料 1.1.1 菌渣样品①北京绿源永乐农业科技发展有限公司食用菌生产基地自然堆放3个月杏鲍菇菌渣(样品编号CB、CA);
②福建漳州用于栽培草菇的杏鲍菇菌渣,已建堆发酵5 d(样品编号FA、F);
③北京通州草场村用于栽培双孢菇的杏鲍菇菌渣,已建堆发酵10 d,堆料配方为:菌渣∶牛粪∶玉米芯=1∶1∶1(样品编号BC),发酵料温度为60 ℃。
1.1.2 培养基LB培养基:酵母提取物5 g,NaCl 10 g,蛋白胨10 g,水1000 mL,琼脂18 g,pH 7.0.
富集培养基[12]:蛋白胨10.0 g,K2HPO4 1.0 g,Na2CO3 5.0 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.015 g,MnSO4 0.05 g,酵母膏10 g,蒸馏水1000 mL,pH 6.0.
羧甲基纤维素钠培养基(CMC培养基)[13]:CMC-Na 15.0 g,NH4PO3 1.0 g,酵母膏 1.0 g,MgSO4·7H2O 0.5 g,K2HPO4 1.0 g,琼脂 18 g,蒸馏水1000 mL.
鉴别培养基:CMC-Na 20 g,(NH4)2SO4 2 g,MgSO4·7H2O 0.5 g,KH2PO4 1 g,NaCl 0.5 g,刚果红0.2 g,琼脂20 g,蒸馏水1000 mL,pH 7.2 .
滤纸条培养基:KH2PO4 2 g,(NH4)2SO4 1.4 g,MgSO4·7H2O 0.3 g,CaCl2 0.3 g,FeSO4·7H2O 5 mg,MnSO4 1.6 mg,ZnCl2 1.7 mg,CoCl2 1.7 mg,蒸馏水1000 mL,pH 7.2.向直径1.5 cm、长15 cm试管中加入该溶液5 mL,加1条滤纸(6 cm×1 cm)直立于试管中,加棉塞灭菌待用[14].
种子培养基[15]:葡萄糖 20 g,蛋白胨 1 g,Mandels营养盐浓缩液100 mL,Mandels微量元素浓缩液1.0 mL,1 mol·L-1柠檬酸缓冲液50 mL,蒸馏水1000 mL.其中,Mandels营养盐浓缩液有:(NH4)2SO4 14 g·L-1,(NH2)2CO 3 g·L-1,KH2PO4 20 g·L-1,CaCl2·2H2O 4 g·L-1,MgSO4·7H2O 0.2 g·L-1;Mandels微量元素浓缩液有:FeSO4·7H2O 5 g·L-1,MnSO4·H2O 1.6 g·L-1,ZnSO4·7H2O 1.4 g·L-1,CoCl2·6H2O 3.7 g·L-1;1 mol·L-1柠檬酸缓冲液:柠檬酸(C6H8O7·H2O)210 g,H2O 750 mL,加NaOH 78 g,冷却后测pH约为4.2,加水至1000 mL,pH约为4.5.
产酶培养基[15]:(NH4)2SO4 2.0 g,KH2PO4 3.0 g,CaCl2 0.5 g,MgSO4 0.5 g,CoCl2 3.0 mg,FeSO4·7H2O 7.5 mg,ZnSO4·7H2O 2.0 mg,MnSO4·H2O 2.5 mg,3%(W/V)菌渣粉,加水至1000 mL,自然pH.
1.2 方法 1.2.1 纤维素降解菌的富集与分离培养取10 g样品加入90 mL已灭菌的富集培养基中,在取样温度下,150 r·min-1摇床培养3 d,移取5 mL培养液至另一盛有新鲜培养基的三角瓶中继续培养3 d.取富集培养后的培养液,用无菌水稀释成10-4、10-5、10-6 3个梯度浓度。用移液枪吸取3种浓度的稀释液各100 μL涂布在CMC培养基平板上,每个梯度设置3个重复。在取样温度下培养24 h,从培养基上挑取单菌落于CMC培养基平板上划线分离、纯化培养。
1.2.2 纤维素降解菌的筛选根据文献[16]的方法,将筛选获得的菌株转接到鉴别培养基平板上,每个菌株3个重复,按上述相同温度培养4 d,根据鉴别培养基平板透明圈直径(D)和菌落直径(d)的大小,初步判断菌株降解纤维素能力的强弱。挑选D/d大的菌株进行下一步的筛选试验。
1.2.3 滤纸条降解试验移取1 mL菌悬液到滤纸条培养基中,并以不加菌液的滤纸条作为对照,与初筛温度相同条件培养10 d,观察滤纸条的溃烂情况,以“+”的多少表示滤纸崩溃程度,“+”越多说明该菌株纤维素降解能力越强[17].
1.2.4 纤维素降解酶高活性菌株筛选将滤纸条降解试验后获得的初筛菌株接种到种子培养基中,于37 ℃、120 r·min-1条件下培养18 h,获得种子液,然后按体积分数1%接种量接到产酶培养基中,于37 ℃、120 r·min-1培养4 d,进行纤维素酶活力测定,筛选纤维素降解酶高活性菌株。
获得的具有较高纤维素降解能力的菌株,接种到种子培养基中,按采样时温度培养1 d,随机组合等体积混合后,按体积分数1%转移至产酶培养基中于37 ℃、120 r·min-1培养4 d,进行纤维素酶活力测定,筛选纤维素酶活高的复合菌剂。
1.2.5 纤维素酶活力测定粗纤维素酶液的制备:将培养液于3000 r·min-1离心10 min,取上清液即为粗酶液。
羧甲基纤维素酶(CMC)酶活、滤纸酶(FPA)酶活、外切酶(C1)酶活分别参照标准QB 2583-2003[18]、刘洁等[19]、Bill等[20]和Ghose等[21],葡萄糖苷酶(β-Gase)酶活参照Christakopoulos等[22]的方法进行测定。
将纤维素酶每分钟催化底物水解生成1 μmol葡萄糖定义为一个酶活单位,用U表示。计算公式:

公式中5.56为1 mg葡萄糖的μmol数,即1000/180=5.56.
1.2.6 筛选菌株的鉴定酶活较高的菌株接种到LB培养基中,于37 ℃、120 r·min-1条件下培养18 h,进行16S rDNA序列分析。采用天根生化科技有限公司的细菌基因组DNA提取试剂盒进行菌株的基因组DNA提取,采用16S rDNA基因通用引物27F(5′-AGAGTTTGATCCTGGCTCA-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行扩增。PCR反应体系(50 μL):27F、1492R各1 μL,Taq酶(2 U·μL-1)0.5 μL,10×PCR buffer 5 μL,dNTP 4 μL,模板DNA 1 μL,ddH2O 38.5 μL.反应条件:94 ℃预变性4 min;94 ℃变性50 s;52 ℃退火1 min;72 ℃延伸1 min 30 s,共35个循环;然后72 ℃延伸14 min终止反应。反应结束后,用1%琼脂糖凝胶电泳检测PCR产物。PCR产物送华大科技有限公司测序,测序结果在NCBI数据库中进行Blast比对,选取序列相似性较高的菌株,采用MEGA 6.0软件构建系统进化树。
1.2.7 降解菌在菌渣发酵中的应用将筛选得到的酶活较高的菌株随机组合,构建多组复合菌剂。通过纤维素降解酶活测定,选择具有较高纤维素降解能力的纤维素复合菌剂进行菌渣堆肥试验。将纤维素复合菌剂(处理B)加入杏鲍菇菌渣堆肥中,同时与不加发酵菌剂(CK)和加入有机发酵菌曲(购于北京京圃园公司,处理A)两个处理进行堆肥效果比较,观察记录各处理堆肥温度。
1.3 数据处理纤维素降解菌筛选(1.2.2)和纤维素酶活测定(1.2.5)试验中,每个菌株获得的三组重复数据,利用SPSS软件在P=0.05条件下,分析差异显着性。
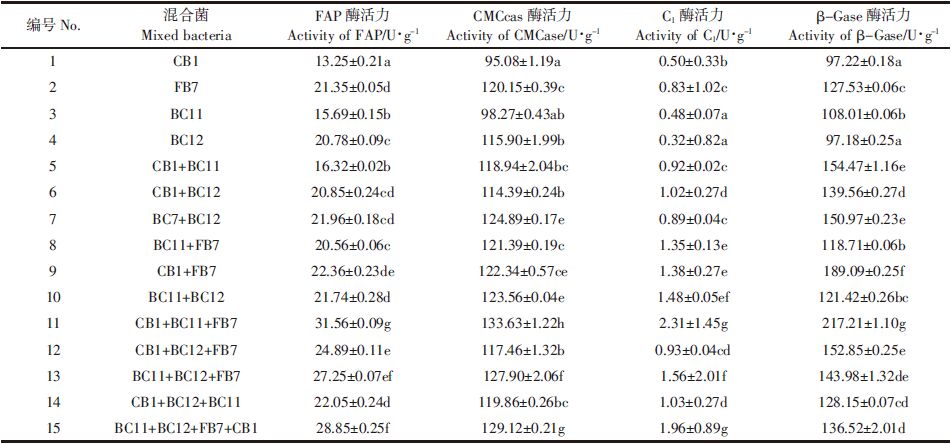
2 结果与分析 2.1 纤维素降解菌的分离与初筛3个不同地方采集的样品在富集培养液中培养3 d,经稀释后涂布到CMC培养基平板上,挑选出单菌落进行划线分离培养。将获得的菌株转接到纤维素刚果红培养基上,培养4 d后测量透明圈的直径和菌落直径大小。结果共有15株菌株产生较为清晰的透明圈,各菌株透明圈直径(D)与菌落直径(d)之比见表 1.选取(D/d)≥2的菌株(CB1、CB2、BC2、BC6、BC11、BC12、FB1、FB7、FA3)进行下一步筛选试验。
 |
将纤维素降解菌初筛过程中获得的9株菌株进行滤纸条降解试验,结果(表 2)表明:FB7菌株对滤纸条的降解效果最好,滤纸溃烂成糊状;BC11和BC12菌株处理的滤纸条接近糊状;CB1、CB2、CB4和BC2对滤纸条有崩解,但不成糊状;FB1、BC6两个菌株对滤纸条降解作用小,仅在滤纸边缘出现毛边。因此,选取FB7、BC11、BC12、CB1、CB2、CB4和BC2进行纤维素酶活测定。
通过对滤纸条降解效果好的7个菌株进行三角瓶发酵培养,对其粗酶液进行纤维素酶活力测定,结果见表 3.7株纤维素降解菌中,FB7菌株的CMC、C1、β-Gase酶活显着高于其他6株菌株,而FPA活力也稍高于其他菌株;其次为BC11、BC12、CB1菌株,四种酶活中的某一种活性比较高。由酶活结果可以看出,与滤纸条试验结果有较好的相关性,降解滤纸能力强的菌株产纤维素酶活性高。
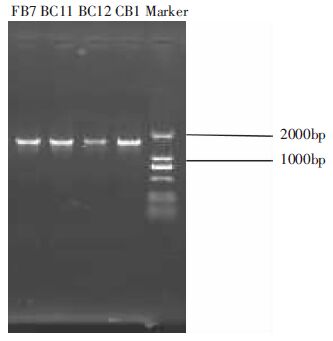
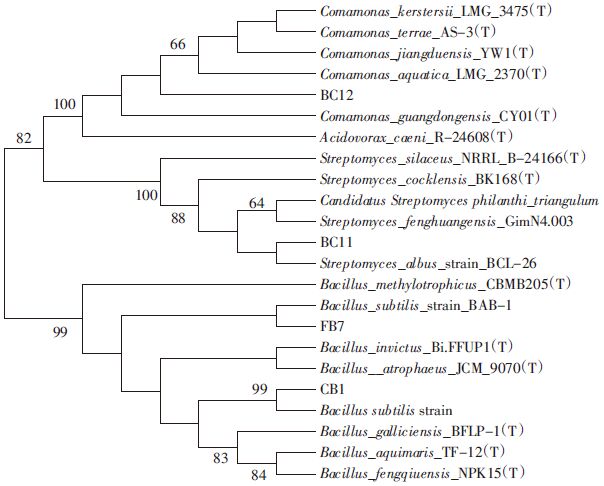
以酶活较高的FB7、BC12、BC11、CB1的基因组DNA为模板,利用细菌通用引物27F/1492R扩增,得到4株菌株的16S rDNA序列。用1%琼脂糖凝胶电泳检测PCR产物,结果如图 1.扩增片段长度约1.4 kb,符合常规的16S rDNA序列长度。将4株菌株的16S rDNA测序结果在Genbank数据库中进行Blast比对,选取同源性较高的模式菌株16S rDNA序列,利用MEGA 6.0软件的Neighbor-joining法[23]构建系统进化树(图 2).
|
| 图 1 16S rDNA 琼脂糖凝胶电泳 Figure 1 Agarose-gel electrophoresis picture of 16S rDNA |
|
| 图 2 菌株FB7、BC12、BC11、CB1基于16S rDNA 序列同源性构建的系统发育树 Figure 2 Phylogenetic tree of strains FB7、BC12、BC11 and CB1 based on 16S rDNA sequence homology |
序列比对结果表明:FB7、CB1与枯草芽孢杆菌的16S rDNA 序列相似度为100%,鉴定为枯草芽孢杆菌;BC12与丛毛单胞菌属中的Comamonas_ jiangduensis_YW1的16S rDNA 序列相似度达到99%,可判断BC12为丛毛单胞菌属的Comamonas_ jiangduensis;BC11的16S rDNA 序列与链霉菌属Streptomyces albus的16S序列相似度为98%.
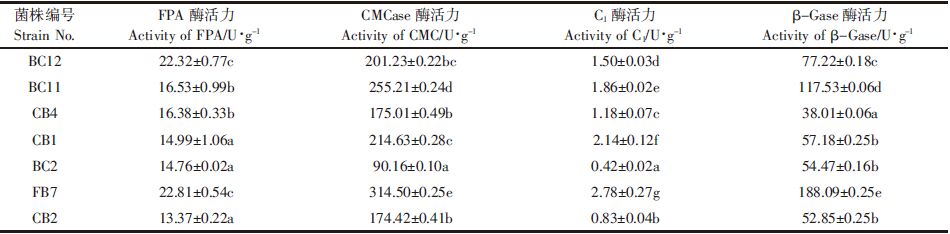
2.5 复合菌纤维素酶活测定将FB7、BC12、BC11、CB1共4菌株分别培养1 d后,按随机组合方式,等体积混合后再培养1 d,构建了11个复合菌剂。复合菌剂按体积分数1%转移至产酶培养基中于37 ℃、120 r·min-1培养4 d,测定复合菌剂与单菌的纤维素酶活结果如表 4.该结果表明复合培养后纤维素酶活相对单菌培养有所提高,其中,复合菌剂CB1+BC11+FB7的FAP、CMCase、C1、β-Gase酶活性最高,与单菌中酶活最高的FB7相比分别提高了47.8%、11.2%、178%、70.3%,且与其他组合之间存在显着差异。
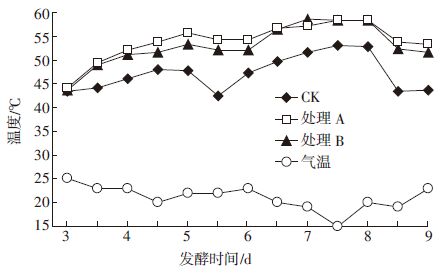
堆料中纤维素等大分子物质的分解需要微生物参与,大分子物质降解和微生物活动的同时伴随热量的产生,从而使堆体的温度上升。因此,堆温变化可以反映微生物活动强弱和物质氧化分解速度,也是堆肥腐熟程度的重要参数。测定杏鲍菇菌渣栽培双孢蘑菇前发酵过程中温度变化(图 3)可以看出,复合菌CB1+BC11+FB7(处理B)和有机发酵菌剂(处理A)加入菌渣堆肥中均可促进堆体温度快速上升,且整个发酵过程中堆料温度高于未加发酵菌剂的处理(CK),且处理A、B温度变化差异小。这表明本研究获得的复合菌剂应用于堆肥,其效果与目前商品菌剂相当。
|
| 图 3 菌渣堆肥过程中温度变化 Figure 3 Changes of temperature during composting of spent substrate |
从自然界中筛选纤维素降解菌是构建高效纤维素降解菌系的基础性工作。微生物对纤维素的降解主要依靠微生物自身产生的纤维素酶起作用,筛选高效纤维素降解菌以羧甲基纤维素酶(CMC)、滤纸酶(FPA)、葡萄糖苷酶(β-Gase)、外切酶(C1)等酶活性高低作为判断菌株降解纤维素能力强弱的依据。近年来,为了提高堆肥质量,研究人员在秸秆分解菌、纤维素分解菌、木质素分解菌等微生物菌株的筛选方面做了大量工作,获得了大量的优良的菌种,其中芽孢杆菌属、链霉菌属等微生物是纤维素降解菌中常见的细菌[24, 25, 26, 27].
郭豪等[28]用复合菌剂(由地衣芽孢杆菌、链霉菌、米根霉和木霉组成)以油菜秸秆粉为原料进行发酵,与对照相比纤维素、半纤维素降解率分别提高了24.5%和15.6%.Amir Jala[29] 等发现一株嗜温枯草芽孢杆菌R5能够产生多种酶,包括木聚糖酶、蛋白酶、淀粉酶、脂肪酶及纤维素酶。周淑霞[30]通过测定麦稻的失重、纤维含量及纤维素酶活来初步研究娄彻氏链霉菌腐熟剂的应用效果,同时与市场上购买的13种腐熟剂进行对比,结果表明娄彻氏链霉菌腐熟剂对麦稻降解能力强,具有开发成优质腐熟剂的潜能。王元明[31]将筛选得到的2株链霉菌属菌株1∶1混合接种到秸秆中进行腐熟试验,结果发现接种复合菌剂对秸秆有较好催腐熟效果,明显缩短发酵时间。丛毛单胞菌属在1985年由De Vos[32]等建立,目前对此类细菌在酚类、喹啉等污染物降解、环境治理等方面的研究较多,在纤维素降解方面的报道很少。
食用菌菌渣中主要成分是纤维素,尽管以农业废弃物(棉籽壳、木屑、甘蔗渣、玉米芯等)组成的食用菌栽培基质,在食用菌生长发育过程中,食用菌菌丝体分泌的纤维素酶已对基质中纤维素、木质素等成分进行部分分解利用,但菌渣中仍然存在大量纤维素、木质素。1979年Rajarathnam对Pleurotus flabellatus降解稻草做了详细研究,表明在菌丝和子实体生长阶段,木质素分别降解了4%和1.5%[33].2004年王海磊研究了Flammulina velutipes降解木质素的能力及相应酶活,表明F. velutipes J89-6对木质素有一定的降解能力,降解率高达46%[34].厦门大学的黄克服教授研究了Lentinus edodes对蔗渣的降解情况,表明L. edodes对蔗渣木质素降解率可达70%[35].1981年platt等表明Pleurotus sp.产生的木质素酶能降解棉秸或麦秸中65%的木质素[36].2014年本实验室分析了杏鲍菇栽培过程中碳素(C)转化效率,结果表明农业废弃物生产杏鲍菇产品,C利用率为9.91%,菌渣中残留C 71.68%,呼吸作用等引起C流失18.41%,菌渣中残留C主要以纤维素、木质素的形式存在。
当前,食用菌菌渣主要用作农作物基肥,在自然条件下,食用菌菌渣腐解速度慢(一般需要2到3年),影响到植物的生根和成活,还造成生产管理上的不便;而且,在自然风化和雨水的冲洗下,沥滤下来的高浓度的矿物质容易污染地表水甚至地下水,造成二次污染,破坏人类自身的生存环境。对食用菌菌渣进行发酵处理,通过微生物的作用可显着提高菌渣堆肥质量[37].另一方面,杏鲍菇菌渣堆制发酵后作为草菇、双孢蘑菇栽培原料已成为近年来一些食用菌生产基地的重要手段,但发酵技术尚不成熟。菌渣发酵过程也是主要微生物作用的过程,菌渣堆肥过程中高效降解微生物的应用有利于提高发酵速度和效果,提高草菇和双孢蘑菇产量,进而促进农业废弃物多级循环利用。
| [1] | 黄秀声, 翁伯琦, 黄勤楼, 等. 食用菌菌渣循环利用对农田生态环境的影响与评价指标[J]. 现代农业科技, 2010, 22:268-271. HUANG Xiu-sheng, WENG Bo-qi, HUANG Qin-lou, et al. Effects and assessment index of recycling use of edible fungus dregs on farmland ecological environment[J]. Modern Agricultural Science and Technology, 2010, 22:268-271. |
| [2] | 罗 萍, 陈永辉, 贺军军, 等. 菠萝渣纤维素降解菌的筛选及鉴定[J]. 微生物学杂志, 2011, 31(2):59-63. LUO Ping, CHEN Yong-hui, HE Jun-jun, et al. Screening and identification of cellulose degrading bacteria from fermented pineapple residue[J]. Journal of Microbiology, 2011, 31(2):59-63. |
| [3] | 李永芳. 食用菌菌渣的再利用[J]. 生物学通报, 2001, 3(36):44-45. LI Yong-fang. Utilization of edible fungi residues[J]. Bulletin of Biology, 2001, 3(36):44-45. |
| [4] | 李学梅. 食用菌菌渣的开发利用[J]. 河南农业科学, 2003(5):40-42. LI Xue-mei. Utilization of edible fungi residues[J]. Journal of Henan Agricultural Sciences, 2003(5):40-42. |
| [5] | 杭树群, 周宗俊, 武艳霞. 菌糠渣营养成分和消化率研究[J]. 食用菌, 1992(2):41-42. HANG Shu-qun, ZHOU Zong-jun, WU Yan-xia. Study on nutritive ingredients and digestibility of mushroom residues[J]. Edible Fungi, 1992(2):41-42. |
| [6] | 孙建华, 袁 玲, 张 翼. 利用食用菌菌渣生产有机肥料的研究[J]. 中国土壤与肥料, 2008(1):52-55. SUN Jian-hua, YUAN Ling, ZHANG Yi. Production of organic fertilizers by edible mushroom residue[J]. Soil and Fertilizer Sciences in China, 2008(1):52-55. |
| [7] | 文少白, 李勤奋, 侯宪文, 等. 微生物降解纤维素的研究概况[J]. 微生物学通报, 2010, 26(1):231-236. WEN Shao-bai, LI Qin-fen, HOU Xian-wen, et al. Recent advances in microbial degradation of cellulose[J]. Chinese Agricultural Science Bulletin, 2010, 26(1):231-236. |
| [8] | 陈洪章. 纤维素生物技术[M]. 北京:化学工业出版社, 2005:70-71. CHEN Hong-zhang. Biotechnology of lignocellulose[M]. Beijing:Chemical Industry Press, 2005:70-71. |
| [9] | 钱 林, 郑巧利, 付 瑾, 等. 一株高效纤维素降解菌株的分离鉴定及其酶学性质[J]. 微生物学通报, 2010, 37(4):524-528. QIAN Lin, ZHENG Qiao-li, FU Jin, et al. Isolation and cellulose degrading bacterium and its cellulose characterization[J]. Microbiology China, 2010, 37(4):524-528. |
| [10] | Adsul M, Bastawde K, Varma A, et al. Strain improvement of Penicillium janthinellum NCIM 1171 for increased cellulose production[J]. Bioresource Technol, 2007, 98(7):1467-1473. |
| [11] | Baldrian P, Valof P. Degradation of cellulose by basidiomycetous fungi[J]. FEMS Microbiology Reviews, 2008, 32(3):501-502. |
| [12] | 甄 静, 王继雯, 谢宝恩, 等. 一株纤维素降解真菌的筛选、鉴定及酶学性质分析[J]. 微生物学通报, 2011, 38(5):709-714. ZHEN Jing, WANG Ji-wen, XIE Bao-en, et al. Isolation, identification of a cellulose-producing strain and characterization of its cellulose-producing capability[J]. Chinese Agricultural Science Bulletin, 2011, 38(5):709-714. |
| [13] | Jeong J, Young K. Degradation of crystalline cellulose by the brown-rot basidiomycete fomitopsispalustris[J]. Journal of Microbiology, 2005, 43(6):487-492. |
| [14] | 冯健玲, 姚晓华, 韦秉兴, 等. 稻草秸秆纤维素分解菌的分离筛选[J]. 基因组学与应用生物学, 2009, 28(3):477-480. FENG Jian-ling, YAO Xiao-hua, WEI Bing-xing, et al. Isolation and screening of straw cellulose-decomposing microbes[J]. Genomics and Applied Biology, 2009, 28(3):477-480. |
| [15] | 杜先林, 李 辉, 王义强, 等. 里氏木霉Rut-30产纤维素酶发酵条件的优化[J]. 中南林业科技大学学报, 2010, 30(9):112-119. DU Xian-lin, LI Hui, WANG Yi-qiang, et al. Optimization of fermentation conditions for cellulose production by Trichodermareesei Rut C-30[J]. Journal of Central South University of Forestry and Technology, 2010, 30(9):112-119. |
| [16] | 张 超, 李艳宾, 张 磊, 等. 纤维素-刚果红培养基鉴定产纤维素酶真菌的机理研究[J]. 纤维素科学与技术, 2007, 15(2):9-44. ZHANG Chao, LI Yan-bin, ZHANG Lei, et al. Research on mechanism of cellulase-producing fungi by cellulose-Congo-red medium[J]. Journal of Cellulose Science and Technology, 2007, 15(2):9-44. |
| [17] | 李日强, 辛小芸. 天然秸秆纤维素分解菌的分离选育[J]. 上海环境科学, 2002, 21(1):8-11. LI Ri-qiang, XIN Xiao-yun. Isolation and screening on straw cellulose-decompoding microorganisms[J]. Shanghai Environmental Sciences, 2002, 21(1):8-11. |
| [18] | 国家发展和改革委员会. QB 2583—2003纤维素酶制剂[S]. 北京:中国轻工业出版社, 2004. National Development and Reform Commission. QB 2583—2003 Cellulases[S]. Beijing:China Light Industry Press, 2004. |
| [19] | 刘 洁, 李宪臻, 高培基. 纤维素酶测定方法评述[J]. 工业微生物, 1994, 24(4):27-32. LIU Jie, LI Xian-zhen, GAO Pei-ji. Review on method for determination of cellulose activity[J]. Industrial Microbiology, 1994, 24(4):27-32. |
| [20] | Bill A, John B. Measurement of cellulose activities[M]. America:National Renewable Energy Laboratory, 2008:1-11. |
| [21] | Ghose T. Measurement of cellulose activities[J]. Pure and Applied Chemistry, 1987, 59(2):257-268. |
| [22] | Christakopoulos P, Bhat M, Kekos D, et al. Enzymatic synthesis of trisaccharides and alkyl-β-D-glucosides by the transglycosylation reaction of β-glucosidase from Fusarium oxysporum[J]. International Journal of Biological Macromolecules, 1994, 16(6):331-334. |
| [23] | Eickmeyer K, Huggins P, Pachter L, et al. On the optimality of the neighbor-joining algorithm[J/OL].[2015-01-12]. http://www. biomedcentral. com/content/pdf/1748-7188-3-5. pdf. |
| [24] | 罗 辉, 仇天雷, 马诗淳, 等. 一株中温厌氧纤维素降解细菌的分离、鉴定及其系统发育分析[J]. 中国沼气, 2008, 2(3):3-7. LUO Hui, QIU Tian-lei, MA Shi-chun et al. Isolation, characterization and phylogenetic analysis of a mesophilic, cellulytic, anaerobic bacterium[J]. China Biogas, 2008, 2(3):3-7. |
| [25] | 陈晓萍, 孙付保, 陈晓旭, 等. 响应面法优化康宁木霉产纤维素酶固态发酵培养基[J]. 食品与生物技术学报, 2011, 30(1):106-115. CHEN Xiao-ping, SUN Fu-bao, CHEN Xiao-xu, et al. Optimization of Trichoderma konigii cellulose production on solid-state fermentation medium by response surface analysis[J]. Journal of Food Science and Biotechnology, 2011, 30(1):106-115. |
| [26] | Tuomela M, Vikman M, Hatakka A, et al. Biodegration of ligninina compost environment[J]. Bioresource Technology, 2000, 72(2):169-183. |
| [27] | 骆耐香, 陈森洲, 袁桂峰, 等. 广西沿海地区红树林根系土壤中放线菌的分离与鉴定[J]. 基因组学与应用生物学, 2010, 29(2):310-313. LUO Nai-xiang, CHEN Sen-zhou, YUAN Gui-feng, et al. Isolation and identification of actinobacteria from the soil of root system of mangrove forest in Guangxi coastal area[J]. Genomics and Applied Biology, 2010, 29(2):310-313. |
| [28] | 郭 豪, 祁金城, 石娜娜, 等. 油菜秸秆纤维素降解菌的筛选及复合菌剂的降解特性[J]. 湖北农业科学, 2013, 52(10):2264-2267. GUO Hao, QI Jin-cheng, SHI Na-na et al. Screening of rape straw-degradation microorganisms and the degrading features[J]. Hubei Agricultural Sciences, 2013, 52(10):2264-2267. |
| [29] | Amir J, Naeem R, Nouman R, et al. Gene cloning and characterization of a xylanase from a newly isolated Baeillus subtilis strain R5[J]. Journal of Bioscience and Bioengineering, 2009, 107(4):360-365. |
| [30] | 周淑霞. 一种含链霉菌的腐熟菌剂在麦秸还田中的初步应用研究[D]. 南京:南京师范大学, 2013:33-44. ZHOU Shu-xia. Application about organic matter-decomposing inoculants Streptomyces on the spread of straw returning[D]. Nanjing:Nanjing Normal University, 2013:33-44. |
| [31] | 王元明. 高温纤维素降解菌的筛选及其复合菌剂对秸秆降解效果的研究[D]. 南京:南京农业大学, 2013:29-42. WANG Yuan-ming. Screening for high-temperature cellulose-degrading strains and effect of the compositive microbial inoculants on crop straw degradation[D]. Nanjing:Nanjing Agricultural University, 2013:29-42. |
| [32] | Devos P, Kersters K, Falsen E, et al. Comamonas Davis and Park 1962 gen. nov., nom. rev. emend., and Comamonas terrigena Hugh 1962 sp. nov., nom. rev.[J]. International Journal of Systematic Bacteriology, 1985, 35(4):443-453. |
| [33] | Rajarathnam S, Wankhede D, Patwardham M. Some chemical and biochemical changes in straw constituents during growth of Pleurotus flabellatus(Berk & Br) Sacc[J]. European Journal Applied Microbiol and Biothechnology, 1979, 8(1):125-134. |
| [34] | 王海磊, 郭伟云, 于广丽, 等. 金针菇降解木质素的能力及相关酶活的研究[J]. 河南师范大学学报(自然科学版), 2004, 32(4):96-99. WANG Hai-lei, GUO Wei-yun, YU Guang-li, et al. Study on lignin degradation and enzyme activity of Flamulina velutipes[J]. Journal of Henan Normal University(Natural Science), 2004, 32(4):96-99. |
| [35] | 黄克服, 刘月英, 郑忠辉, 等. 香菇栽培过程甘蔗培养基主要组分的降解和有关酶活的变化[J]. 厦门大学学报(自然科学版), 1985(3):29-32. HUANG Ke-fu, LIU Yue-ying, ZHENG Zhong-hui, et al. Degradation of medium constituents and changes in allied enzyme activities during growth-of Lentinus edodes on sugarcane bagasse[J]. Journal of Xiamen University(Natural Science), 1985(3):29-32. |
| [36] | Platt M, Chet I, Henis Y. Ligno cellulose degradation during growth of the mushroom Pleurotus sp. ‘florida’ on cotton straw[J]. European Journal Applied Microbiol and Biotechnology, 1981, 13(3):194-195. |
| [37] | 竹江良, 刘晓琳, 李少明, 等. 两种微生物菌剂对烟草废弃物高温堆肥腐熟进程的影响[J]. 农业环境科学学报, 2010, 29(1):194-199. ZHU Jiang-liang, LIU Xiao-lin, LI Shao-ming, et al. Effect of two microbial agents on tobacco fine waste high-temperature compost maturity[J]. Journal of Agro-Environment Science, 2010, 29(1):194-199. |
 2015, Vol. 34
2015, Vol. 34