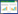文章信息
- 陈娴, 王晓蓉, 季荣
- CHEN Xian, WANG Xiao-rong, JI Rong
- 蚯蚓(Eisenia foetida)对水稻土中Cd的富集及其氧化应激
- Bioaccumulation and Oxidative Stresses of Cadmium in Earthworm Eisenia Foetida in a Paddy Soil
- 农业环境科学学报, 2015, 34(8): 1464-1469
- Journal of Agro-Environment Science, 2015, 34(8): 1464-1469
- http://dx.doi.org/10.11654/jaes.2015.08.005
-
文章历史
- 收稿日期:2015-04-11
2. 污染控制与资源化研究国家重点实验室, 南京大学环境学院, 南京 210023
2. State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023, China
2014年发布的全国土壤污染状况调查公报显示,7%的调查点位Cd超标[1],Cd已成为导致我国土壤污染的主要污染物。除了污染范围广外,Cd还是最有害的重金属之一,对人体的肾脏、骨骼、肺等都有伤害,并被列为第一类致癌物质[2]。另外,Cd易迁移和生物富集,可通过食物链对动物和人体健康造成危害。鉴于我国土壤Cd污染的严峻性,开展土壤Cd污染的生态风险评价和早期诊断具有重要意义。
当蚯蚓暴露于Cd污染土壤中时,土壤中的Cd被蚯蚓吸收和富集,引起蚯蚓体内生理生化响应,甚至造成伤害。在毒理学研究中,经常以环境中金属总浓度作为生物暴露浓度,但金属的有效性才是决定其在生物体内的吸收和毒性的关键因素[3]。土壤理化性质,如有机质[4]和pH[5]等都会影响金属的有效性。在各种金属有效态分析方法中,梯度扩散薄膜技术(DGT)作为一种原位“仿生”技术,其所测得的有效态金属含量与其毒性具有良好的剂量-效应关系[6]。因此,可选择DGT有效态Cd含量作为生物暴露剂量来衡量其毒性效应。
传统的生态毒理学方法,如急性毒性和繁殖试验,虽然能反映土壤整体毒性效应,但其响应不够灵敏,缺乏早期预警功能。近年来,分子生物标志物因其具有特异性、预警性和广泛性等特点,在水和土壤环境生态风险评价中的应用日益广泛[7]。在污染物胁迫下产生的氧化应激,包括活性氧(ROS)的产生、抗氧化防御系统和氧化损伤等因响应灵敏、检测方法成熟而被广泛用作生物标志物[8, 9]。蚯蚓是常用的表征土壤污染的指示生物[10],OECD和ISO都选择赤子爱胜蚓(Eisenia foetida)作为标准毒理实验的典型生物[11, 12]。蚯蚓的分子生物标志物有望成为土壤污染风险评估和早期预警系统的重要指标。
本文研究了E. foetida暴露于Cd污染水稻土后体内Cd等金属的富集,以及Cd胁迫下产生的氧化应激效应,并采用 DGT技术测定土壤中的有效态Cd,探讨土壤Cd的有效性与Cd在蚯蚓体内的富集及毒性效应之间的关系,为土壤Cd污染的早期诊断提供基础。 1 材料与方法 1.1 供试土壤和染毒
供试土壤为水稻土,采自常州武进农田表层(0~20 cm),位于31°39′46.4″N,119°54′20.2″E。土壤风干后过2 mm筛,于室温保存备用。其基本理化性质为:pH 6.91(0.01 mol·L-1 CaCl2∶土=5∶1),CEC 21.4 cmol(+)·kg-1,有机质1.04%,壤质粘土(黏粒、粉沙粒和沙粒含量分别为34.7%、36.1%和29.2%),土壤中Cd、Cr、Ni、Cu、Zn、As、Pb的含量分别为0.07、28.60、19.19、15.97、35.20、5.35、12.79 mg·kg-1,达到我国土壤一级标准。
在风干土中滴加Cd(NO3)2水溶液,使外源Cd的浓度分别为0、0.1、0.3、0.5、1、5、10 mg·kg-1(干土),并添加超纯水使土壤水分保持在最大持水量(MWHC)的40%,充分混匀,避光老化30 d。 1.2 蚯蚓驯养和暴露
赤子爱胜蚓购自南京江浦蚯蚓养殖厂,暴露前先于未染毒的土壤中驯养14 d。驯养结束后,选择质量为0.40~0.50 g的成年(有环带)蚯蚓,清洗后置于铺有湿润滤纸的培养皿中在暗处清肠24 h。
将不同污染浓度的老化土分装至塑料盆中,每个浓度设3 盆,每盆500 g(干重),在每盆土中放入10条清肠后的蚯蚓,盆口用尼龙纱网包裹。蚯蚓驯养和暴露实验均在人工气候培养箱中进行,温度(20±1) ℃,湿度75%±2%,400~800 lx 16 h光照和8 h黑暗循环,定期添加牛粪和超纯水,保持土壤湿度稳定。暴露14 d后,取出蚯蚓并进行清肠。 1.3 分析测定方法 1.3.1 土壤分析
测定土壤中的金属总量时,土样经冷冻干燥后,研磨过0.15 mm 筛,采用USEPA 3050B方法消解[13],用电感耦合等离子体质谱仪(ICP-MS,NexION 300X,美国PerkinElmer)测定。以NIST SRM 2711a 蒙大拿州土壤为标准参考物质,测定结果在保证值范围内。
采用DGT技术分析土壤有效态Cd,实验用DGT装置由南京大学罗军实验室提供,DGT有效态Cd的测定方法参考Luo等[14]。基本过程:调节土样含水率至MWHC的60%,放置2 d,然后提高至MWHC的100%稳定24 h;在20 ℃环境下,将DGT装置轻压入土壤表层,24 h后取出DGT装置中的吸附膜,用1 mL 1 mol·L-1 HNO3提取24 h,ICP-MS测定。 1.3.2 蚯蚓体内金属总量的测定和生物富集模型
将蚯蚓冷冻干燥,在玛瑙研钵中研磨,过0.15 mm筛,测定方法同土壤。蚯蚓对土壤中金属的富集能力用BSAF(生物-土壤富集系数)表示,即蚯蚓体内金属浓度与土壤中金属浓度的比值。
参考Borgmann等[15] 的饱和模型并稍作修改,对土壤中DGT-Cd和蚯蚓体内Cd的数据进行拟合,公式如下:
CTB=maxCDGT-Cd/[(K+CDGT-Cd)(1-loss×dep)]+CBk
式中:CTB是体内金属总量;max是金属的最大富集量;CDGT-Cd是土壤DGT-Cd浓度;K是半饱和常数,即CTB为最大富集量一半时的CDGT-Cd值;CBk是体内金属背景浓度(一般为0,可忽略); dep为虚拟变量,设为0(不清肠)或1(清肠);loss表示因清肠损失的体内金属比例。 1.3.3 蚯蚓体内ROS的测定
ROS的捕获与测定参考文献[16]。蚯蚓用预冷生理盐水洗净吸干后,迅速剪碎。称0.1 g加入1 mL以DMSO为溶剂的50 mmol·L-1 PBN溶液,于冰浴中充分匀浆,静置后取上清液注入毛细管中,放于液氮中保存。整个过程在氮气保护下进行。采用电子顺磁共振仪(EPR,EMX 10/12,德国Bruker)测定活性氧自由基强度。 1.3.4 蚯蚓生理生化指标的测定
称取适量剪碎的蚯蚓,按照1∶4(W/V)的比例加入预冷的Tris-HCl缓冲液(50 mmol·L-1Tris,1 mmol·L-1 DTT,1 mmol·L-1 Na2EDTA,250 mmol·L-1蔗糖,pH 7.6),迅速匀浆。匀浆液于4 ℃、9000×g离心30 min,取上清液于-80 ℃保存。
蛋白质测定采用考马斯亮蓝法[17],超氧化物歧化酶(SOD)采用氮蓝四唑法测定[18],过氧化氢酶(CAT)的测定参照徐镜波等[19]的方法,谷胱甘肽硫转移酶(GST)采用Habig等[20]方法测定,蛋白质氧化损伤的测定参照 Levin等[21]和 Nemat等[22]的方法,以蛋白羰基(PCO)的含量表示。 1.4 数据处理
实验结果表示为平均数±标准偏差(Mean±SD)。使用SPSS 19.0统计软件,用单因素方差分析法(One-way ANOVA)进行组间显著性差异分析,P<0.05表明差异显著,P<0.01表明差异极显著。 2 结果与讨论 2.1 蚯蚓对土壤中Cd等金属的吸收富集
表 1列出了投加不同浓度Cd的水稻土中总Cd和DGT有效态Cd的含量以及蚯蚓体内富集的Cd等金属的含量。根据表中BSAF值可见,在未染毒土壤中,蚯蚓对不同金属的吸收富集能力依次为Cd>As>Zn>Cu>Ni>Cr> Pb,其对Cd、Zn、As有明显的富集作用(BSAF>1)。Owsianiak等[23]认为蚯蚓富集金属的限速步骤是金属迁移至细胞膜的速率,而Cd比Pb、Hg等许多金属的迁移性大,因此更易被蚯蚓利用[24]。随着Cd投加量的增加,蚯蚓体内Ni、Cu、Zn含量呈下降趋势,表明Cd会抑制蚯蚓对这3种金属的吸收富集,但对Cr、As、Pb无显著影响。当暴露于0~10 mg·kg-1 外源Cd土壤中时,蚯蚓体内Cd的浓度范围为1.07~46.04 mg·kg-1,对Cd的富集系数在4.69~14.68之间,土壤Cd浓度越高,蚯蚓体内Cd富集量越大,但BSAF值越低。
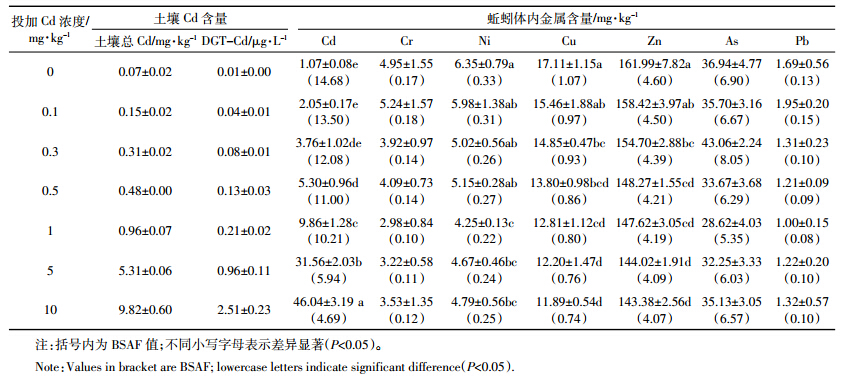
生物配体模型(BLM)认为生物体配位基结合的金属量是有限的,能达到饱和,因此配位基上结合的金属量遵循饱和动力学[15]。很多研究表明水生生物对金属的富集在低浓度暴露时线性增加,在高浓度时逐渐达到饱和,符合生物富集饱和模型[15, 25],但该模型在土壤生物上的应用鲜见报道。本研究发现蚯蚓对土壤中Cd的富集也呈现这一趋势,因此采用该模型对土壤中DGT有效态Cd与蚯蚓体内Cd含量进行拟合,结果如图 1所示。拟合的r2值为0.99,效果很好,可见饱和模型适用于蚯蚓对土壤Cd的富集。蚯蚓体内Cd的最大富集量 max可达70.24 mg·kg-1,半饱和常数K为1.21 μg·L-1。
|
| 图 1 土壤 DGT-Cd 与蚯蚓体内 Cd 含量的拟合曲线 Figure 1 Fitting curve between soil DGT-Cd and earthworm Cd content |
如图 2所示,自由基的EPR谱图具有3组双重超精细分裂峰,以第二组分裂峰的第一个小峰的峰高和峰谷差值的绝对值作为ROS的相对强度。经计算,超精细分裂常数αN=13.88 G,αH=2.35 G,与Liu等[26]结果一致,可初步认定蚯蚓体内的自由基为·OH。以对照组和10 mg·kg-1 Cd暴露组作示例,暴露组信号强度明显高于对照组,是对照组的2倍,表明Cd能诱导蚯蚓体内产生ROS。从图 3可以看出,当外源Cd浓度达到0.5 mg·kg-1时,蚯蚓体内ROS即被显著诱导产生,而10 mg·kg-1时则达到极显著水平。

|
| 图 2 10 mg·kg-1Cd 暴露组和对照组蚯蚓体内自由基 EPR 谱图 Figure 2 EPR spectra of free radicals in earthworms induced by Cd exposure |
图 4显示不同Cd浓度胁迫下,蚯蚓体内的3 种抗氧化系统酶(SOD、CAT和GST)以及蛋白氧化损伤(PCO)的响应变化。由图 4可见,随投加Cd浓度的增加,3 种酶活均表现出先抑后扬的趋势,SOD、CAT和GST最大抑制率分别达17%、39%和20%,其中CAT的这一趋势最为明显,在外源Cd为0.1 mg·kg-1时即极显著降低,虽然之后酶活逐渐增大,但在实验浓度范围内未达到显著性增加,总体呈现“U”型剂量效应。类似结论虽有所报道[27, 28],但很多文献指出污染胁迫会造成生物体内ROS的累积,进而促进SOD和CAT生成用于清除O2-·和H2O2,也会产生更多的GST进行解毒[8, 9, 29]。
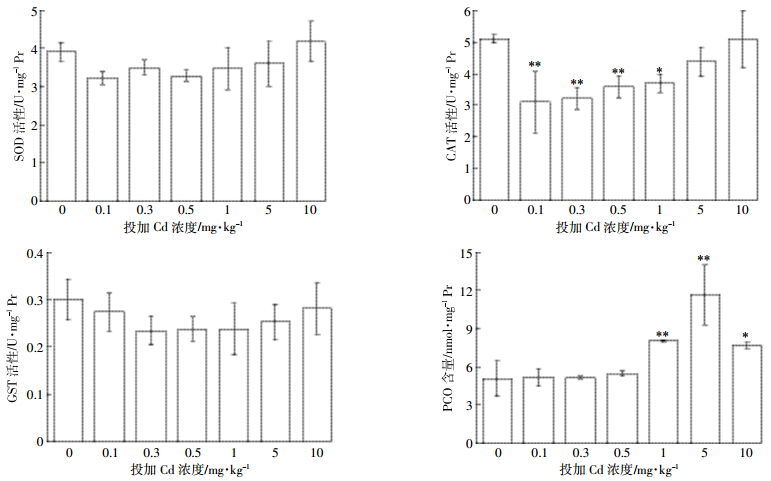
|
| 图 4 蚯蚓体内 SOD、 CAT、 GST 和 PCO 对不同浓度 Cd 胁迫的响应 Figure 4 Levels of SOD,CAT,GST and PCO in earthworms under exposure of different Cd concentrations |
为探讨上述两种结论不一致的原因,将本实验土壤——水稻土的DGT有效态Cd与刘智敏等[8]研究用的黑土进行了比较。以GST为例,暴露于外源Cd为5 mg·kg-1(DGT-Cd为12.7 μg·L-1)黑土中的蚯蚓GST活性显著增加,而水稻土中Cd的最大投加浓度为10 mg·kg-1,此时DGT-Cd仅为2.5 μg·L-1。由此推测,水稻土中Cd的低有效性是造成抗氧化酶未被显著诱导的原因,若继续增大水稻土中外源Cd浓度将会进一步促进抗氧化酶的生成。而低剂量(相对有效态而言)Cd对酶活的抑制作用可能是Hormesis效应的体现。Hormesis效应是一种普遍存在的剂量-效应关系[30],但很多毒理研究中由于剂量设置高于该效应发生所需的低剂量以及终点的选择而忽略了该现象[31]。后续实验拟扩大Cd 浓度范围来验证该效应的存在。
抗氧化系统酶活性的降低也加剧了ROS的累积,从而造成对蚯蚓的氧化损伤,蛋白质羰基含量(PCO)可作为蛋白质氧化损伤的指标。由图 4可见,当外源Cd浓度为1 mg·kg-1时,PCO极显著增加,5 mg·kg-1时达到最大,是对照组的2.3倍,超过该浓度时PCO降低,但仍显著高于对照组。
综合上述结果,各生理生化指标的敏感性不同,其中ROS最先响应,PCO其次,SOD、CAT和GST在实验浓度范围内均未被显著性诱导。因此,可选择ROS和PCO作为Cd污染土壤早期诊断的敏感生物标志物。ROS和PCO的响应阈值分别为0.5、1 mg·kg-1 外源Cd,根据其所对应的DGT-Cd含量,初步界定土壤Cd对蚯蚓产生早期伤害的阈值范围为0.13~0.21 μg·L-1 DGT-Cd。今后还需要室内试验和野外试验相结合,以提高阈值的精确度。由此可见,筛选合适的生物标志物至关重要,需要综合考察多种指标,若以不敏感指标为生物标志物,所得的阈值会偏大,从而影响土壤生态安全。 3 结论
(1)蚯蚓对水稻土(未染毒)中Cd的吸收富集明显高于其他金属,BSAF可达14.68,但外源Cd浓度的增加使得蚯蚓体内Cd 浓度增大和BSAF降低,并减少了蚯蚓对Ni、Cu、Zn的富集。蚯蚓对土壤中Cd的富集符合饱和模型。
(2)土壤Cd胁迫能诱导蚯蚓体内ROS的产生和累积,造成PCO极显著增加。但SOD、CAT和GST等3种抗氧化酶被抑制,呈现类似“U”型Hormesis效应。
(3)综合多种生化指标,ROS和PCO的氧化应激响应灵敏,可作为诊断和评价土壤Cd污染的生物标志物,获得水稻土中Cd对蚯蚓的致毒阈值范围为0.13~0.21 μg·L-1 DGT-Cd。
| [1] | 环境保护部,国土资源部.全国土壤污染状况调查公报[R].北京:中华人民共和国国土资源部,2014-04-17.Ministry of Environmental Protection of PRC,Ministry of Land and Resources of PRC.The nationwide survey communique of soil pollution[R].Beijing:Ministry of Environmental Protection of PRC,Ministry of Land and Resources of PRC,2014-04-17. |
| [2] | Lassen C,Hansen E.Cadmium review[M].Copenhagen:Nordic Council of Ministers,2003:15. |
| [3] | Ardestani M M,van Straalen N M,van Gestel C A M.The relationship between metal toxicity and biotic ligand binding affinities in aquatic and soil organisms:A review[J].Environmental Pollution,2014,195:133-147. |
| [4] | Irizar A,Rodríguez M P,Izquierdo A,et al.Effects of soil organic matter content on cadmium toxicity in Eisenia fetida:Implications for the use of biomarkers and standard toxicity tests[J].Archives of Environmental Contamination and Toxicology,2015,68(1):181-192. |
| [5] | Ardestani M M,van Gestel C A M.Using a toxicokinetics approach to explain the effect of soil pH on cadmium bioavailability to Folsomia candida[J].Environmental Pollution,2013,180:122-130. |
| [6] | Simpson S L,Yverneau H,Cremazy A,et al.DGT-induced copper flux predicts bioaccumulation and toxicity to bivalves in sediments with varying properties[J].Environmental Science&Technology,2012,46(16):9038-9046. |
| [7] | 王晓蓉,罗义,施华宏,等.分子生物标志物在污染环境早期诊断和生态风险评价中的应用[J].环境化学,2006,25(3):320-325.WANG Xiao-rong,LUO Yi,SHI Hua-hong,et al.Application of molecular biomarkers in early diagnosis and ecological risk assessment for water and soil[J].Environmental Chemistry,2006,25(3):320-325. |
| [8] | 刘智敏,顾雪元,王晓蓉,等.化学提取法预测土壤中镉对蚯蚓的毒性效应[J].农业环境科学学报,2013,32(10):1971-1978.LIU Zhi-min,GU Xue-yuan,WANG Xiao-rong,et al.The relationship between chemical extractable cadmium levels in soils and toxic responses of earthworms[J].Journal of Agro-Environment Science,2013,32(10):1971-1978. |
| [9] | Xue Y G,Gu X Y,Wang X R,et al.The hydroxyl radical generation and oxidative stress for the earthworm Eisenia fetida exposed to tetrabromobisphenol A[J].Ecotoxicology,2009,18(6):693-699. |
| [10] | Lanno R,Wells J,Conder J,et al.The bioavailability of chemicals in soil for earthworms[J].Ecotoxicology and Environmental Safety,2004,57(1):39-47. |
| [11] | Organization for Economic Co-operation and Development (OECD).OECD 222 Guideline for the testing of chemicals:Earthworm reproduction test (Eisenia fetida/Eisenia andrei)[S].Paris,OECD,2004. |
| [12] | International Organization for Standardization (ISO).ISO 11268-1-1993 Soil quality-effects of pollutants on earthworms (Eisenia fetida)-Part 1:Determination of acute toxicity using artificial soil substrate[S].Switzerland,ISO,1993. |
| [13] | United States Environmental Protection Agency (USEPA).USEPA 3050B Acid digestion of sediment,sludges,and soils[S].Washington D C,USPEA,1996. |
| [14] | Luo J,Cheng H,Ren J H,et al.Mechanistic insights from DGT and soil solution measurements on the uptake of Ni and Cd by radish[J].Environmental Science&Technology,2014,48(13):7305-7313. |
| [15] | Borgmann U,Norwood W P,Dixon D G.Re-evaluation of metal bioaccumulation and chronic toxicity in Hyalella azteca using saturation curves and the biotic ligand model[J].Environmental Pollution,2004,131(3):469-484. |
| [16] | Shi H H,Wang X R,Luo Y,et al.Electron paramagnetic resonance evidence of hydroxyl radical generation and oxidative damage induced by tetrabromobisphenol A in Carassius auratus[J].Aquatic Toxicology,2005,74(4):365-371. |
| [17] | Bradford M M.Rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254. |
| [18] | Beauchamp C,Fridovich I.Superoxide dismutase:Improved assays and an assay applicable to acrylamide gels[J].Analytical Biochemistry,1971,44(1):276-287. |
| [19] | 徐镜波,袁晓凡,郎佩珍.过氧化氢酶活性及活性抑制的紫外分光光度测定[J].环境化学,1997,16(1):73-76.XU Jing-bo,YUAN Xiao-fan,LANG Pei-zhen.The determination of enzymic activity and its inhibition on catalase by ultraviolet spectrophotometry[J].Environmental Chemistry,1997,16(1):73-76. |
| [20] | Habig W H,Pabst M J,Jakoby W B.Glutathione S-transferases:The first enzymatic step in mercapturic acid formation[J].Journal of Biological Chemistry,1974,249(22):7130-7139. |
| [21] | Levine R L,Williams J A,Stadtman E R,et al.Carbonyl assays for determination of oxidatively modified proteins[J].Method in Enzymology,1994,233:346-357. |
| [22] | Nemat Alla M M,Hassan N M.Changes of antioxidants levels in two maize lines following atrazine treatments[J].Plant Physiology and Biochemistry,2006,44(4):202-210. |
| [23] | Owsianiak M,Veltman K,Hauschild M Z,et al.Elucidating differences in metal absorption efficiencies between terrestrial soft-bodied and aquatic species[J].Chemosphere,2014,112:487-495. |
| [24] | Ernst G,Zimmermann S,Christie P,et al.Mercury,cadmium and lead concentrations in different ecophysiological groups of earthworms in forest soils[J].Environmental Pollution,2008,156(3):1304-1313. |
| [25] | Croteau M,Luoma S N.Characterizing dissolved Cu and Cd uptake in terms of the biotic ligand and biodynamics using enriched stable isotopes[J].Environmental Science&Technology,2007,41(9):3140-3145. |
| [26] | Liu K,Chen L,Zhang W,et al.EPR detection of hydroxyl radical generation and oxidative perturbations in lead-exposed earthworms (Eisenia fetida) in the presence of decabromodiphenyl ether[J].Ecotoxicology,2015,24(2):301-308. |
| [27] | Zhang Y,Shen G Q,Yu Y S,et al.The hormetic effect of cadmium on the activity of antioxidant enzymes in the earthworm Eisenia fetida[J].Environmental Pollution,2009,157(11):3064-3068. |
| [28] | 丁龙,李冬冬,汪承润,等.土壤镉诱导赤子爱胜蚓的氧化损伤、防御反应及其致毒阈值[J].环境化学,2014,33(7):1115-1122.DING Long,LI Dong-dong,WANG Cheng-run,et al.Oxidative damage,defense response and toxicity threshold in Eisenia foetida exposed to cadmium-polluted soils[J].Environmental Chemistry,2014,33(7):1115-1122. |
| [29] | Han Y N,Zhu L S,Wang J H,et al.Integrated assessment of oxidative stress and DNA damage in earthworms (Eisenia fetida) exposed to azoxystrobin[J].Ecotoxicology and Environmental Safety,2014,107:214-219. |
| [30] | Calabrese E J,Baldwin L A.Toxicology rethinks its central belief-Hormesis demands a reappraisal of the way risks are assessed[J].Nature,2003,421(6924):691-692. |
| [31] | Calabrese E J,Baldwin L A,Holland C D.Hormesis:A highly generalizable and reproducible phenomenon with important implications for risk assessment[J].Risk Analysis,1999,19(2):261-281. |
 2015, Vol. 34
2015, Vol. 34